Casos clínicos
Empleo de la resonancia magnética en el estudio de masas intratorácicas fetales
M. López-Valverde1
L. Oleaga2
J. R. Mancisidor3
J. K. Arrate4
1 Universidad del País Vasco. Servicio de Obstetricia y Ginecología
2 Servicio Radiodiagnóstico
3 Servicio Anestesiología
4 Servicio Neonatología
Hospital de Basurto. Bilbao
Servicio de Obstetricia y Ginecología
Avda. Montevideo, 18
48013 Bilbao
Correspondencia:
Miguel López-Valverde
Avda. Sabino Arana, 37-11.º
48013 Bilbao
Use of magnetic resonance imaging in the study of fetal intrathoracic masses
López-Valverde M, Oleaga L, Mancisidor JR, Arrate JK. Empleo de la resonancia magnética en el estudio de masas intratorácicas fetales. Prog Obstet Ginecol 1999;42:238-241.
Fecha de recepción: 2/6/98
Aceptado para publicación 18/9/98
INTRODUCCION
A la ecografía se la considera el primer método de imagen utilizado para el estudio de la cavidad torácica fetal. Después del nacimiento, la ecografía sigue siendo fundamental para demostrar anomalías congénitas, como las cardíacas y aquellas que pueden afectar a la cavidad torácica o al mediastino(1).
La Resonancia Magnética (RM), está siendo utilizada para el estudio de las malformaciones torácicas, fundamentalmente para las anomalías vasculares. Igualmente es útil para la valoración de malformaciones pulmonares. Aunque existen limitaciones, ya que tiene dificultades para la demostración de la arquitectura del parénquima pulmonar así como para la visualización de los vasos intrapulmonares, pero a pesar de ello, la RM puede ser de utilidad para el diagnóstico en determinados casos(2).
El desarrollo del pulmón fetal comienza a los 28 días post-fecundación, formándose los bronquios principales, como tubos sólidos que crecen hasta la semana 16 en el denominado estadio glandular. Posteriormente comienzan a canalizarse hasta alrededor de la 24 y es conocido como el estadio canalicular. Al concluir el mismo se desarrollan los conductos alveolares y más tarde, en torno a la semana 30, lo hacen los alveolos con sus capilares, es el denominado estadio alveolar que continuará hasta el final del embarazo(3,4).
El descubrimiento prenatal de masas hiperecogénicas a nivel torácico es poco frecuente, viéndose ecográficamente como una densidad homogénea que a veces tiene imágenes quísticas más o menos grandes en su interior. Ante estos hallazgos es prioritario comprobar la integridad del diafragma para descartar una posible hernia que permitiría el paso de órganos desde el abdomen al tórax. Muchas de estas imágenes descritas asientan a nivel pulmonar y su descubrimiento suele producirse en el segundo trimestre de la gestación(5), lo que sugiere que el mecanismo de aparición esté relacionado con el estadio canalicular del desarrollo. En estas imágenes ecográficas hiperecogénicas podemos ver modificaciones de su tamaño, a lo largo del embarazo, bien experimentando un aumento progresivo, en otras ocasiones se mantiene estacionado(6) o bien puede ir reduciéndose(7) hasta incluso llegar a dejarse de ver(5,8), aunque naturalmente esto no signifique su desaparición anatómica y con ello el cese del riesgo potencial para el niño(5,9).
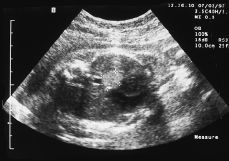
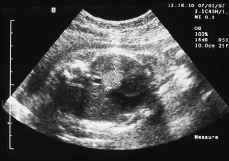
Figura 1. Ecografía fetal: masa hiperecogénica intratorácica.
CASO CLINICO
Primigesta de 22 años con antecedente de síndrome de Wolff-Parkinson-White, ablación con radiofrecuencia en 1996. Con evolución normal del embarazo hasta que en la semana 21, en un control ecográfico se visualiza una masa hiperecogénica, homogénea, de 12 mm en hemitórax izquierdo, en situación retrocardíaca, anterior a la aorta y supradiafragmática, el resto de la anatomía fetal era normal. Placenta normoinserta tipo I y líquido amniótico normal. A continuación se le practica una amniocentesis para estudio de cariotipo fetal con el resultado de 46 XY y los valores de la AFP eran normales.
En la semana 24, previo consentimiento informado de la paciente, se realiza un estudio de RM bajo anestesia superficial, con el propósito de conseguir la inmovilidad del feto y así evitar que el movimiento de éste pudiera interferir en la adquisición de las imágenes. Para dicho fin contamos con la colaboración de un médico anestesiólogo, mediante el empleo de Tiopental 5 mg/kg, Atracurio 30 mg, Isofluorano 1,5-0,5%, en una mezcla de oxígeno-oxido nitroso del 33-66%(10,11).
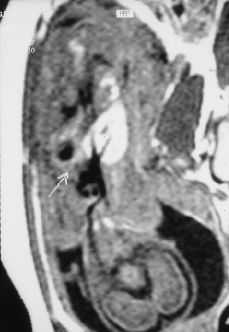
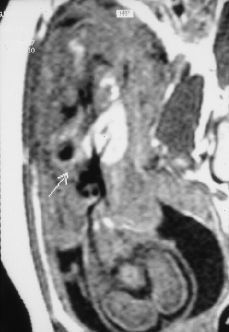
Figura 2.Resonancia magnética intraútero, T1 coronal: masa hipointensa en base pulmonar izquierda (flecha).
La exploración de RM se efectuó mediante un imán 1 Tesla (Siemens), utilizando la bobina principal de cuerpo como transmisora y receptora. Las series empleadas fueron axial y coronal SE potenciada en T1 TR/TE 600/15 ms, Axial TSE potenciada en Densidad Protónica y T2 TR/TE 4000/19/93 ms y una serie axial con técnica de inversión recuperación TIR TR/TE 2.300/19 ms TI = 140 ms. FOV = 350 mm, matriz = 192 x 256, grosor de corte = 5 mm.
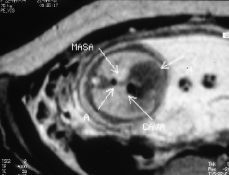
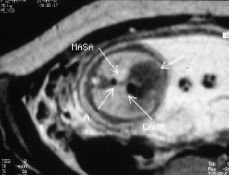
Este estudio de RM, confirmó la presencia de una masa localizada supradiafragmáticamente en la base del hemitórax izquierdo, situada anterior a la aorta y a la izquierda de la cava. Se trataba de una masa hipointensa en las series potenciadas en T1 e hiperintensa en la serie TSE potenciada en T2 y en la serie TIR, con una intensidad de señal intermedia en Densidad Protónica. No se objetivaron en el seno de la masa o en relación a ella imágenes de vacío de señal que sugirieran la presencia de estructuras vasculares y tampoco se objetivó alteración en la integridad del diafragma ni anomalías cardíacas, pulmonares o abdominales asociadas.
Figura 3.Resonancia magnética intraútero, T2 axial: masa hiperintensa en base pulmonar izquierda.
En el control ecográfico de la semana 29, se observa que el tamaño y la consistencia de la masa no ha experimentado modificación. Con el estudio Doppler pulsado no se encontraron flujos a este nivel. Se continuó controlando la evolución del embarazo que fue completamente normal y la imagen ecográfica fue disminuyendo de tamaño hasta dejarse de ver en la semana 37. La gestación concluyó en la semana 40,2 con un parto espontáneo, naciendo un varón de 3,505 gr, con Apgar 8/9, sin signos de distress.
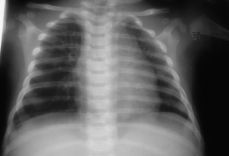
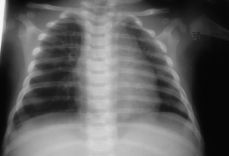
El control inmediato del neonato reveló una analítica normal, ecografía y radiología de tórax sin hallazgos patológicos y ecocardiograma normal. Los controles posteriores, hasta el sexto mes, han sido completamente normales, estando programado continuar con revisiones periódicas.
Figura 4.RX tórax recién nacido: sin hallazgos patológicos.
DISCUSION
En nuestro caso clínico, las imágenes ecográficas y los hallazgos de la Resonancia Magnética indicaban que se trataba de una masa dentro del propio parénquima pulmonar. Se descartó la existencia de hernia diafragmática pues se pudo observar la integridad del mismo y tampoco se encontraron anomalías intraabdominales. La posibilidad de que se tratase de una masa mediastínica posterior con contenido graso, si bien por el estudio podría ser compatible, pero la RM descartó que la masa tuviera contenido graso por las características de señal y tampoco se trataba de una masa quística pues no seguía las características de señal de líquido, se trataba por lo tanto de una masa sólida(12,13).
El diagnóstico diferencial de una masa sólida a nivel pulmonar, se centraría en dos malformaciones de su parénquima como son el Secuestro Pulmonar y la Malformación Adenoidea Quística.
El Secuestro Pulmonar, es una anomalía rara y consiste en una masa de tejido pulmonar embrionario no funcionante que no suele comunicarse con la vía aérea y que recibe su aporte sanguíneo de la circulación sistémica(1,14). Dentro de ellos, tenemos por un lado los Secuestros Extralobares, suelen tener su propia pleura separada y se localizan más frecuentemente en el lado izquierdo afectando tres o cuatro veces más a los varones, y ecográficamente aparecen como masas sólidas intratorácicas con morfología triangular, pudiendo verse un vaso anómalo que nace en la aorta y que se dirige al seno de la lesión, asociándose a veces con hernia diafragmática, hidrops, derrame pleural y polihidramnios(3,4,15). Por otra parte, los Secuestros Intralobares, se encuentran dentro de la pleura visceral normal, pero son sobre todo hallazgos postnatales(5).
La Malformación Adenoidea Quística (MAQ) es un hamartoma congénito del pulmón, debido, tal vez, a una agresión embrionaria antes del día 50 de la gestación, produciéndose una detención en la conexión entre las vías aéreas primitivas y el parénquima pulmonar, con un crecimiento aumentado de los bronquiolos terminales, existiendo unos subtipos: El tipo I, presenta grandes quistes, de más de 10 cm, con pared gruesa. El tipo II, se caracteriza por la presencia de muchos pequeños quistes de menos de 1 cm, y por último en el tipo III existen múltiples microquistes, apareciendo como una masa sólida que afecta a todo un lóbulo. Por ecografía las malformaciones tipo I y II aparecen como masas quísticas o mixtas con desplazamiento del mediastino, mientras que las de tipo III se muestran como masas sólidas(1,14,16).
Además de las posibilidades descritas, también deberíamos de tener en cuenta, una obstrucción baja del árbol resporatorio que originaría una hiperecogenicidad localizada(17). Obstrucción ésta, que en algún caso se ha descrito que podría deberse a un tapón de moco alojado en la luz, con retención de fluido en la parte distal de la obstrucción(5,18), mecanismo obstructivo que puede revertir al cabo del tiempo, con el crecimiento y la maduración pulmonar.
Finalmente señalaremos que tras los datos obtenidos con el estudio ecográfico, la RM y el Doppler, podemos dar como primer diagnóstico el de Malformación Adenoidea Quística tipo III, sin que puedan descartarse absolutamente otros, sobre todo el secuestro pulmonar, pues aunque no se hayan demostrado vasos aferentes anómalos, éstos a veces son difíciles de visualizar. En cuanto a que la imagen desaparezca al final del embarazo, aunque se tratase de una MAQ se podría explicar por la presencia a veces de canales anómalos de comunicación con las vías aéreas o digestivas(5,16,19).
En estos casos, en que desaparece la imagen ecográfica hiperecogénica a nivel pulmonar, el pronóstico neonatal es bueno, pero hay que tener en cuenta que aunque ya no se vea la masa a nivel pulmonar ello no significa que ha desaparecido el problema y por lo tanto en estos casos debe de seguirse una actitud expectante mantenida(5).
BIBLIOGRAFIA
1 May DA, Barth RA, Yeager S, Nussbaum-Blask A, Bulas DI. Perinatal and postnatal chest sonography. Radiol Clin North Am 1993;31:499-516.
2 Naidich DP, Rumancik WM, Ettenger NA, Feiner HD, Harnanz-Schulman M, Spatz EM, Toder ST, Geineser NB. Congenital anomalies of the lungs in aduls: MR diagnosis. AJR 1988;151:13-9.
3 Behrman RE, Vaughan VC, Nelson WE. Nelson tratado de Pediatría. Madrid. McGraw-Hill Interamericana; 1989. p. 923-53.
4 Tooley WH. El Pulmón en Rodolph AW. Tratado de Pediatría. Barcelona: Labor; 1985. p. 1459-73.
5 Montero JJ, De Miguel JR, Cavero A, Ballesteros G. Hiperecogenicidad pulmonar: desaparición antenatal. Progr Diagn Prenat 1997;9:570-5.
6 Sands R, Lilford R. Hiperechogenic areas detected in fetal chest al routine ultrasound examination. Three cases. Prenat Diagn 1992;12:79-82.
7 Budorick N, Pretorius D, Leopold G, Stamm E. Spontaneus improvement of intrathoracic masses diagnosed in utero. J Ultrasound Med 1992;11:653-62.
8 Meagher S, Fisk N, Harvey J, Watson G, Boogert A. Disappearing lung echogenicity in fetal bronchopulmonary malformation: a reassuring sign? Prenat Diagn 1993;13:495-501.
9 Mayden K, Tortora M, Chervenak F, Hobbins J. The antenatal sonographic detection of lung masses. Am J Obstet Gynecol 1984;148:349-51.
10 Murat I. Chirugie foetale: un nuovo defi pour les annees 90? Ann Fr Anesth Reanim 1992;11:232-4.
11 Revel MP, Pons JC, Lelaidier C, Fournet P, Vial M, Musset D, Labrune M, Frydman R. Magnetic resonance imaging of de fetus: a study of 20 cases performed without curarization. Prenat Diagn 1993;13:775-99.
12 Young G, L''Hereux PR, Krueckeberg ST, Swanson DA. Mediastinal brochogenic Cys: prenatal sonographic diagnosis. AJR 1989;152:125-7.
13 Dinsmore BJ, Grumbach K. Disorders of the fetal thorax and abdomen. Seminars in Roentgenology 1990;25:334-41.
14 Morin C, Filiatrault D, Russo P. Pulmonary sequestration with histologic changes of cystic adenomatoid malformatio. Pediatr Radiol 1989;19:130-2.
15 John P, Beasley S, Mayne V. Pulmonary sequestration and related congenital disorders. Pediatr Radiol 1989;20:4-9.
16 Mashiach R, Hod M, Schoenfeld A, Ovadia J, Merlob P. Antenalat ultrasound diagnosis of congenital cystic adenomatoid malformation of the lung: spontaneus resolution in utero. J Clin Ultrasound 1993;21:453-7.
17 McAlister W, Wright J, Crane J. Main-Stem bronquial atresia: intrauterina sonographic diagnosis. AM J Roentgenol 1987;148: 364-6.
18 Meizner Y, Rosenak D. The vanishing fetal intrathoracic mass: consider and obstructing mucous plug. Ultrasound Obstet Gynecol 1995;5:275-7.
19 Sepúlveda W, Fisk N. Resolving fetal hiperechogenic lung lesions: an unresolved issue. Ultrasound Obstet Gynecol 1995; 6:4-7.