Obstetricia
Evolución de los perímetros del iris y de la pupila fetal durante la gestación
Evolution of the perimeters of the iris and of the fetal pupil throughout gestation
C. López Ramón y Cajal
Unidad de Diagnóstico Prenatal
Servicio de Obstetricia
Complejo Hospitalario «Xeral-Cíes»
Vigo (Pontevedra)
Correspondencia:
Dr. Carlos López Ramón y Cajal
Unidad de Diagnóstico Prenatal
Servicio de Obstetricia
Complejo Hospitalario «Xeral-Cíes»
Calle Pizarro, 22. 36204 Vigo (Pontevedra)
e-mail: clopezr@meditex.es
Fecha de recepción: 25/11/99
Aceptado para publicación: 13/3/00
RESUMEN
Objetivo: La actividad pupilar depende del sistema nervioso autónomo y su regulación llega a alcanzar el córtex cerebral. En este artículo se estudia la evolución funcional del iris fetal en condiciones basales.
Sujetos y métodos: Se examinaron mediante ultrasonidos 192 pupilas de fetos humanos desde las semanas 15 hasta la 42. Las imágenes eran digitalizadas para la medición informática de los perímetros de la pupila y del iris.
Resultados: El perímetro del iris presenta un progreso lineal durante la gestación. El perímetro de la pupila muestra una evolución variable. A partir de la semana 23, el perímetro pupilar con relación al del iris es menor al 30 por 100. Esta relación, perímetro pupilar/iris, presenta una variación estadísticamente significativa a lo largo de la gestación (test de Kruskal-Wallis).
Conclusiones: La actividad pupilar manifiesta una integridad de determinadas vías neurológicas y puede permitir un nuevo control neurológico de los fetos humanos.
PALABRAS CLAVE
Pupila fetal; Iris fetal; Fisiología fetal; Embriología ocular; Neurología fetal.
ABSTRACT
Objective: Pupillary activity depends of autonomic nervous system and its regulation reaches the cerebral cortex. In this article we study the functional evolution of the fetal iris in basal conditions.
Material and methods: We examine through ultrasounds 192 pupils of human fetuses from 15th to 42nd. The images were digitized. After, the pupil and iris perimeters were measured in a computer.
Results: The fetal iris perimeter presents a lineal evolution throughout gestation. The fetal pupillary perimeter shows a variable progression. From 23rd weeks, the pupil/iris ratio is less than 30 por 100. The pupil/iris perimeter ratio shows a significant statistically variation throughout gestation (Kruskal-Wallis test).
Conclusions: Pupillary activity manifests integrity of neurological pathways related with the eye innervation and can let a new neurological control of the human fetuses.
KEY WORDS
Fetal pupil; Fetal iris; Fetal physiology; Eye embryology; Fetal neurology
López Ramón y Cajal C. Evolución de los perímetros del iris y de la pupila fetal durante la gestación. Prog Obstet Ginecol 2000;43:237-244.
INTRODUCCION
Los cambios en el tamaño de la pupila están en relación con la actividad del sistema nervioso autonómico. La pupila tiene dos funciones fundamentales: el reflejo a la luz y el reflejo de la acomodación. Sin embargo, también responde a otros estímulos que tienen un mecanismo neurológico independiente del estímulo luminoso y de la función visual. Existen respuestas pupilares acompañando a diferentes actividades mentales cuyas vías de control están relacionadas con el tálamo y el córtex cerebral(1,2).
Clásicamente, la maduración embriológica del iris se ha referido sobre el quinto mes de gestación(3). En este manuscrito se estudia la evolución de los perímetros del iris y de la pupila fetal, con la finalidad de conocer el tono neurológico de la pupila fetal.
MATERIAL Y MÉTODOS
Mediante ultrasonidos se estudiaron 192 pupilas de fetos humanos, no gemelares, desde las semanas 15 hasta la 42. Todos los casos fueron explorados por el autor en la Unidad de Diagnóstico Prenatal del Hospital Xeral de Vigo. El sistema de ultrasonidos utilizado fue un Acuson xp/4 adv (Acuson 128, Mountain View, CA) con una sonda abdominal C3. Todas las gestantes referían una fecha de la última regla conocida, ciclos previos regulares, no presentaban antecedentes médicos de interés y la evolución de su embarazo fue normal (analíticas maternas normales incluyendo test de diabetes). Nada más iniciar la exploración fetal se realizaba el estudio pupilar para conseguir una observación en condiciones basales. La madre debía de permanecer en silencio para evitar estímulos externos. Si se observaba una movilidad fetal espontánea excesiva, se esperaban unos minutos y así dar un tiempo a la relajación fetal. Una vez finalizado el registro iridopupilar se practicaba un examen fetal detallado. Para incluir un caso en el estudio, la exploración ecográfica fetal debía de confirmar un estudio estructural normal, una antropometría acorde con la edad gestacional y un examen Doppler de las arterias uterinas maternas, de las arterias umbilicales, de flujos cardíacos fetales y de retorno venoso dentro de los límites de la normalidad.
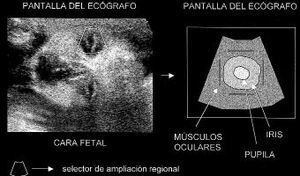
Para localizar la pupila se utilizaba el selector de ampliación regional («RES») del sistema de ultrasonidos. Mediante éste se expandía el área correspondiente a la cámara anterior ocular en una proyección frontal (Fig. 1). La imagen del iris se localizaba entre la inserción de los músculos oculares. Mediante un tenue movimiento de la sonda aparecía la imagen pupilar que se mostraba por las imágenes memorizadas en el ecógrafo (Figs. 2 y 3). El fotograma correcto era digitalizado a través de una tarjeta Targa plus (Truevision) para su archivo informático y ulterior análisis. En una fase posterior se realizaban las mediciones sobre las imágenes digitalizadas. El software de análisis de imagen utilizado fue el Image Tool for Windows v1.27 de Uthscsa (University of Texas Health Science Center in San Antonio)(4), calibrando el software en cada fotograma según la regla de graduación lateral de la imagen digitalizada del ecógrafo. Se midieron los perímetros de la pupila (PP) y del iris (PI). También se analizó la relación (PP/PI x 100) como verdadero índice del tamaño pupilar según la evolución del perímetro del iris. En el análisis estadístico se utilizó el software SPSS v6.0.1. El supuesto de normalidad se comprobó con el test de Shapiro-Wilks. Para el análisis estadístico de la relación (PP/PI x 100) se aplicó el test no paramétrico de Kruskal-Wallis, al no cumplirse el requisito de homogeneidad de varianzas.
Figura 1. Fotograma de la izquierda: colocación del selector de expansión regional sobre el ojo fetal, cámara anterior. En el esquema que aparece a la derecha se representa dónde se localiza el iris y la pupila: entre los músculos oculares y cámara anterior del ojo.
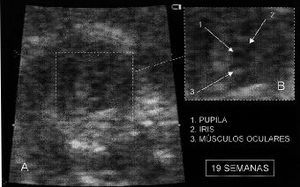
Figura 2. Fotograma A: Imagen en un feto en la semana 19. Fotograma B: Ampliación de la imagen señalando la pupila, iris y músculos oculares.
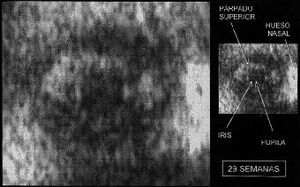
Figura 3. Imagen en un feto en la semana 29. A la derecha se representa el mismo fotograma donde se señalan el párpado superior, hueso nasal, iris y pupila.
Todos los estudios ultrasónicos del iris y pupila, su digitalización y mediciones de los perímetros fueron realizados por el mismo explorador (autor del artículo). En 15 fetos se realizaron tres digitalizaciones del iris y pupila de cada feto y se practicaron cinco mediciones de los perímetros de cada imagen para averiguar las variaciones intraobservador. Se cuantificó el coeficiente de variación (desviación estándar/media x 100) e índice de repetición (1,96 (check)2s2, donde s2 hace referencia a la varianza), es decir, valor por debajo del cual la diferencia entre las mediciones repetidas se encontrará con una probabilidad del 0,95. Los coeficientes de variación fueron del 5 por 100 y 3 por 100 para los perímetros de la pupila y del iris, respectivamente, y los índices de repetición fueron de 0,69 y de 1,51 para los datos de la pupila e iris, respectivamente.
RESULTADOS
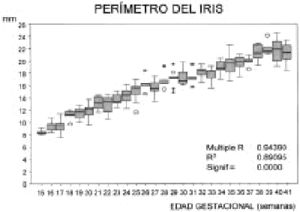
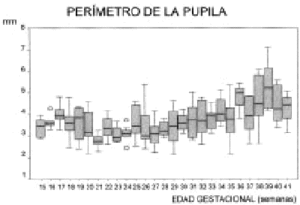
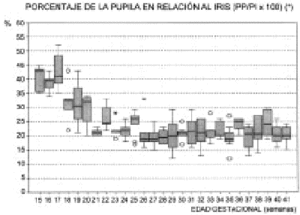
La evolución del PI experimenta un aumento lineal a lo largo del desarrollo fetal (Fig. 4). El PP presenta una gran variabilidad (Fig. 5). Los datos obtenidos y el número de casos por semana se representan en la tabla 1. El perímetro pupilar se encuentra por encima de 1 mm desde el principio de la gestación y puede llegar a superar los 6 mm en las semanas 37 y 38 (Fig. 5). La variabilidad en el perímetro pupilar es mayor en las semanas 26, 38 y 39 (con una desviación superior a 1 mm) y muy próximas a éstas, con una desviación superior a 0,90 mm, se encuentran las semanas 31, 35 y 37 (tabla 1). Sin embargo, la presencia de esta cierta distonía pupilar se corrige cuando la valoramos los datos pupilares junto al perímetro del iris. En esta relación, se observa una mayor variabilidad en las semanas 17, 19 y 29 (Fig. 6). El perímetro pupilar con relación al del iris es menor al 35 por 100 en las semanas 20, 21 y 22 (Fig. 6). A partir de la semana 23 es inferior al 30 por 100. La tendencia hacia un tono pupilar normal se inicia bruscamente en la semana 18. Esta relación, perímetro pupilar/iris, presenta una variación estadísticamente significativa a lo largo de la gestación (test de Kruskal-Wallis) (Fig. 6).
| Tabla 1 | |||||
| Pl (mm) | PP (mm) | ||||
| Semanas | n | Media | DE | Media | DE |
| 15 | 7 | 8,39 | 0,36 | 3,38 | 0,46 |
| 16 | 6 | 9,46 | 0,83 | 3,65 | 0,34 |
| 17 | 7 | 9,38 | 1,25 | 4,01 | 0,48 |
| 18 | 6 | 11,20 | 0,80 | 3,60 | 0,76 |
| 19 | 8 | 11,51 | 0,99 | 3,60 | 0,78 |
| 20 | 7 | 11,87 | 1,30 | 3,44 | 0,85 |
| 21 | 7 | 13,17 | 1,13 | 2,79 | 0,33 |
| 22 | 6 | 12,95 | 1,53 | 3,39 | 0,56 |
| 23 | 7 | 13,69 | 0,98 | 3,06 | 0,38 |
| 24 | 7 | 14,34 | 1,41 | 3,10 | 0,40 |
| 25 | 8 | 15,00 | 1,69 | 3,62 | 0,77 |
| 26 | 7 | 16,35 | 1,36 | 3,52 | 1,19 |
| 27 | 7 | 15,68 | 1,31 | 3,10 | 0,65 |
| 28 | 7 | 16,76 | 1,27 | 3,31 | 0,36 |
| 29 | 9 | 17,13 | 1,32 | 3,44 | 0,88 |
| 30 | 7 | 17,38 | 1,38 | 3,64 | 0,43 |
| 31 | 6 | 17,34 | 1,16 | 3,77 | 0,90 |
| 32 | 7 | 18,18 | 1,02 | 3,78 | 0,86 |
| 33 | 7 | 17,77 | 1,29 | 3,76 | 0,51 |
| 34 | 7 | 19,04 | 1,16 | 4,19 | 0,65 |
| 35 | 9 | 19,46 | 1,86 | 3,81 | 0,97 |
| 36 | 7 | 9,68 | 1,24 | 4,77 | 0,61 |
| 37 | 7 | 19,94 | 0,75 | 3,91 | 0,91 |
| 38 | 6 | 21,28 | 1,38 | 4,57 | 1,27 |
| 39 | 6 | 21,97 | 1,12 | 5,36 | 1,17 |
| 40 | 8 | 21,69 | 1,94 | 4,45 | 0,88 |
| 41 | 9 | 21,19 | 1,68 | 4,22 | 0,63 |
| 192 | |||||
Figura 4.
Figura 5.
* Test de Kruskal-Wallis significativo: 0,00.
Figura 6.
La media del perímetro pupilar se mantiene durante toda la vida fetal entre los 3 y 4 mm (tabla 1), por lo que durante la gestación el feto tiende a la miosis, ya que el perímetro del iris se incrementa de forma lineal. El tono pupilar a partir de la semana 23 es de miosis, con una relación pupila/iris inferior al 30 por 100.
DISCUSION
La pupila regula la cantidad de luz que excita la retina y ayuda a enfocar las imágenes sobre ella. El tamaño pupilar depende de la actividad de los músculos del iris: el esfínter (inervado por fibras parasimpáticas) y el músculo dilatador (inervado por fibras simpáticas). La actividad de ambos es antagonista, pero la actividad del esfínter predomina sobre la del dilatador(5). La dilatación pupilar no sólo se puede producir por la actividad del músculo dilatador, sino también por una relajación del músculo esfínter(5).
El músculo esfínter del iris se ha localizado alrededor la semana 17 de gestación, y las células para su formación ya se detectan desde las 13 semanas(6). La maduración del músculo dilatador se considera que tiene lugar sobre la semana 20(7).
Las funciones con que se relaciona la actividad de la pupila humana se esquematizan en la figura 7. Las respuestas pupilares del Grupo II son independientes de la luz y de la acomodación y su control nervioso está relacionado con estructuras nerviosas más superiores al mesencéfalo, naciendo incluso desde la corteza cerebral. Por esta razón, la actividad pupilar se utiliza como un indicador de atención cognitiva(1).
ACTIVIDAD DE LA PUPILA HUMANA | |
| Grupo I. | Funciones pupilares reflejas relacionadas con la fisiología ocular: * Reflejo pupilar a la luz. * Reflejo de acomodación. |
| Grupo II. | Funciones pupilares reflejas relacionadas con algunos «estados» del sistema nervioso, que incluyen al ojo como parte de una respuesta nerviosa: * Modificaciones en el agotamiento nervioso. * Cambios en la excitación emocional. * Dilatación pupilar que acompaña a diversas actividades mentales: -- Con la inspección de fotografías atractivas(8). -- Ejecutando tareas de discriminación auditiva(9). -- Ejecutando actos complejos con los dedos(10). -- Creando una imagen abstracta(11). -- Realizando cálculos mentales(12). * Dilataciones pupilares reflejas durante el desempeño de tareas cognitivas(2). * Respuestas al dolor y la estimulación del córtex. |
| Grupo lII. | Otras respuestas pupilares(5): * Variaciones de la presión intravascular.* Otros reflejos: orbicularis, oculosensorial, psicosensorial, reflejo vestibular pupilar, reflejo coclear pupilar y reflejo vagotónico pupilar. |
Figura 7. | |
Recientemente se ha descrito la evolución del área de la pupila fetal humana a lo largo de la gestación y su respuesta al estímulo doppler color(13). Después del estímulo doppler color a nivel del polígono de Willis la pupila responde con una midriasis. Sin embargo, antes de la semana 18, la respuesta es inversa: desde una midriasis basal a una miosis posterior al mismo estímulo.
La migración neuronal finaliza sobre el quinto mes(14,15). A partir del sexto mes se inicia la organización axonal (crecimiento axónico y dentrítico y formación de sinapsis) que termina varios años después del nacimiento(14,15). A partir de la semana 23 se estabiliza el tono pupilar (Fig. 6), iniciando en la semana 18 la pendiente hacia su tono normal (Fig. 6). En torno a esta fecha también cambia la respuesta de la pupila fetal al doppler color(13) y comienza a observarse la función fonadora de las cuerdas vocal fetales(16). Todo parece indicar el desarrollo de un nuevo control neurológico probablemente superior al troncoencéfalo, ya que la corteza cerebral está constituida y empiezan a establecerse las vías sinápticas.
La mayor variabilidad en el perímetro pupilar en las semanas 26, 38 y 39 coincide con las edades gestacionales en las que el feto puede estar en una situación de mayor alerta o inestabilidad neurológica, y que puede reflejar una susceptibilidad en el desencadenamiento del parto. Este dato tiene su importancia, ya que, durante la gestación, la media del perímetro pupilar oscila entre 3 y 4 mm, con un perímetro del iris que progresa de forma lineal, por lo que el feto adquiere un estado de miosis. Por esta razón, la medida del perímetro pupilar, en sí misma, puede tener valor funcional. El índice pupila/iris relaciona el estado pupilar (función neurológica) y crecimiento del iris (que no deja de ser una terminal evolutivamente adaptada del sistema nervioso al provenir de la cúpula óptica(3)), por lo que su interpretación es más exacta a nivel de evolución y desarrollo fetal que del estado neurológico fetal. En esta relación llama la atención la inestabilidad de la semana 29, siendo quizás una semana delicada en la relación crecimiento/función del desarrollo neurológico humano. Este hecho se ve reforzado por la circunstancia de que esta semana separa la valoración fetal en la supervivencia extrauterina: antes de la semana 29 la supervivencia está relacionada con la edad gestacional y, tras ésta, con el peso del recién nacido(17).
A partir de la semana 23 el tono pupilar basal presenta una tendencia hacia la pupiloconstricción intrauterina a diferencia de la dilatación pupilar del recién nacido prematuro(18,19). Este dato es muy interesante, ya que el estado basal fisiológico del sistema nervioso en desarrollo se relaciona con una miosis pupilar, por lo que la midriasis del prematuro podría reflejar un bloqueo en la interconexión de las vías iridopupilares, es decir, de las interconexiones de los diferentes estratos cerebrales. Probablemente, conseguir una miosis en un prematuro sería una señal sobre una evolución y estado neurológico favorable, ya que se consigue el estado normal que acompaña a su momento del desarrollo neurológico. La pupiloconstricción fetal, al ser relativamente precoz, sería consecuencia de la maduración de las vías autonómicas y liberación de neurotransmisores efectores. Por el contrario, la pupiloconstricción debida a la respuesta luminosa parece tener más relación con la maduración de la retina que con la de otras regiones o vías del sistema nervioso(20).
El estudio funcional intrauterino del sistema nervioso se basa en la investigación de su anatomía en desarrollo y en la descripción de modelos funcionales. La importancia de éstos es cada vez mayor por la necesidad de conseguir parámetros de función de este sistema que permitan avanzar en el conocimiento de las lesiones neurológicas de origen intrauterino. Hasta el momento, el análisis funcional del sistema nervioso con aplicación en la obstetricia clínica se intenta investigar a través del examen de la anatomía del sistema nervioso por ultrasonidos(21), del uso del perfil biofísico fetal(22) y de los estudios del comportamiento fetal(23). La descripción de nuevas funciones neurológicas fetales crea un nuevo camino que asienta las bases de la neurología fetal.
Hasta la fecha no se conoce la función intraútero del sistema nervioso. Por limitaciones técnicas y de orientación científica, los parámetros de control obstétrico no han logrado disminuir la incidencia de parálisis cerebral(24). La introducción de nuevas funciones neurológicas fetales, como el tono pupilar o la fonación fetal, y la aplicación de reflejos nerviosos fetales, como el reflejo pupilar, pueden permitir una valoración funcional del sistema nervioso intraútero. El objetivo fundamental de estas funciones es describir respuestas nerviosas de primera línea en la ontogenia nerviosa y que puedan ir construyendo la neurología funcional del desarrollo.
Una aplicación clínica del modelo funcional del tono pupilar se encuentra en la entidad clínica denominada como retardo en la maduración visual o RMV. Este concepto describe a recién nacidos que son aparentemente ciegos desde el nacimiento, con ojos y retina normales, y cuya función visual mejora a los 4-6 meses de edad consiguiendo una agudeza visual normal(25,26). Un grupo de RVM (tipo 1b) se relaciona con problemas perinatales(27). En el RMV han sido descritas respuestas pupilares retardadas(28). La relación de respuestas pupilares anormales con alteraciones perinatales refuerza la tesis entre el tono de la pupila fetal, sus posibles respuestas y el normal desarrollo neurológico intraútero.
BIBLIOGRAFIA
01 Iriki A, Tanaka M, Iwamura Y. Attention-induced neuronal activity in the monkey somatosensory cortex revealed by pupillometrics. Neurosci Res 1996;25:173-81.
02 Granholm E, Asarnow RF, Sarkin, AJ, Dykes KL. Pupillary responses index cognitive resource limitations. Psychophysiology 1996;33:457-61.
03 McDonnell JM. Ocular embriology and anatomy. En Retina. Volumen One. Basic Science and inherited retinal disease. Editado por Thomas E. Ogden, MD, PhD. Editor: Stephen J. Ryan. 2.ª ed. St Louis, Missouri: Mosby Year Book Inc; 1994. p. 5-17.
04 Image Tool for Windows v1.27 de Uthscsa (University of Texas Health Science Center in San Antonio). Available from: URL: http://ddsdx.uthscsa.edu/dig/itdesc.html.
05 Appenzeller O, Oribe E. The Autonomic Nervous System. An introduction to basic and clinical concepts. 5.ª ed. Amsterdam: Elsevier Science BV; 1997.
06 Uusitalo M, Kivela T. Development of cytoskeleton in neuroectodermally derived epithelial and muscle cells of the human eye. Invest Ophthalmol Vis Sci 1995;36:2584-91.
07 McDonnell JM. Ocular embryology and anatomy. En: Ryan SJ, Ogden TE, eds. Retina. Vol. 1. Basic Science and Inherited Retinal Disease, 2.ª ed. St. Louis, Missouri: Mosby Year Book; 1994. p. 5-17.
08 Hess EH, Polt JM. Pupil size as related to interest value of visual stimuli. Scienc 1960;132:349-50.
09 Kahneman D, Beatty J. Pupillary responses in a pitch-discrimination task. Percept Psychophys 1967;2:101-5.
10 Richer F, Beatty J. Pupillary dilations in movement preparation and execution. Psychophysiology 1985;22:204-7.
11 Paivio A, Simpson HM. The effect of word abstractness and pleasantness on pupil size during an imagery task. Psychonomn SCI 1966;5:55-6.
12 Hess EH, Polt JM. Pupil size as related to interest value of visual stimuli. Science 1964;132:349-50.
13 López Ramón y Cajal C. Response of the human fetal pupil to Color Doppler: a sign of cognitive function? Prenat and Neonat Med 1998;3:580-7.
14 Volpe. Neurology of the newborn. 3.ª ed. Philadelphia: WB Saunders Company; 1995.
15 Creutzfeldt OD. Cortex Cerebri. Performance, Structural and Functional Organization of the Cortex. Oxford. Oxford Science Publications; 1995.
16 López Ramón y Cajal C. Description of human fetal larynx functions: phonation. Early Hum Dev 1996;45:63-72.
17 Copper RL, Goldenberg RL, Creasy RK, DuBard MB, Davis RO, Entman SS, et al. A multicenter study of preterm birth weight and gestational age-specific neonatal mortality. Am J Obstet Gynecol 1993;168:78-84.
18 Isenberg SJ, Molarte A, Vazquez M. The fixed and dilated pupils of premature neonates. Am J Ophthalmol 1990;110:168-71.
19 Menkes JH. Textbook of child neurology. 5.ª ed. Baltimore, Maryland: Williams & Wilkins; 1995.
20 Radel JD, Das S, Lund RD. Development of light-activated pupilloconstriction in rats as mediated by normal and transplanted retinae. Eur J Neurosci 1992;4:603-15.
21 Monteagudo A, Timor-Tritsch IE. Development of fetal gyri, sulci and fissures: a transvaginal sonographic study. Ultrasound Obstet Gynecol 1997;9:222-8.
22 Manning FA, Bondaji N, Harman CR, Casiro O, Menticoglou S, Morrison I, et al. Fetal Assessment based on fetal biophysical profile scoring. VIII. The incidence of cerebral palsy in tested and untested perinates. Am J Obstet Gynecol 1998;178:696-706.
23 Nijhuis JG. Fetal Behaviuor. Development and Perinatal Aspects. Oxford. Oxford: Medical Publications; 1992.
24 Miller G. Cerebral palsies: an overview. En The cerebral palsies. Causes, consequences and management. Editado por Geoffrey Miller and Gary D. Clark. Boston: Butterworth-Heinemann; 1998.
25 Russell-Eggitt I, Harris CM, Kriss A. Delayed visual maturation: an update. Dev Med Child Neurol 1998;40:130-6.
26 Editorial. Delayed visual maturarion. Lancet 1991;337:950-2.
27 Tresidder J, Fielder AR, Nicholson J. Delayed visual maturation: Ophthalmic and neurodevelopmental aspects. Developmental Medicine and Child Neurology 1990;32:872-81.
28 Cocker KD, Moseley MJ, Stirling HF, Fielder AR. Delayed visual maturation: pupillary responses implicate subcortical and cortical visual systems. Developmental Medicine and Child Neurology 1998;40:160-2.