Casos clínicos
Gigantomastia puberal con hiperplasia estromal pseudoangiomatosa
Puberal gigantomastia with pseudoangiomatous stromal hyperplasia
I. Martínez-Montero1
O. Fernández-Tarrio1
F. Domínguez-Cunchillos2
L. Apesteguía3
M. J. Pelay4
H. Ayala4
1 Servicio de Obstetricia y Ginecología.
2 Servicio de Cirugía General.
3 Servicio de Radiodiagnóstico.
4 Servicio de Cirugía Plástica.
Hospital «Virgen del Camino». Pamplona.
Correspondencia:
Dra. Isabel Martínez Montero
Avda. Pío XII, 24, 5.° I.
31008 Pamplona
Fecha de recepción: 16/11/98
Aceptado para publicación: 19/4/99
INTRODUCCIÓN
Se denomina gigantomastia puberal, o hipertrofia virginal, al desarrollo excesivo de la glándula mamaria, uni o bilateral. Existe tendencia familiar y su desarrollo suele desencadenarse en la pubertad (media de edad, 16 años).
La aparición de gigantomastia en una niña o adolescente provoca alteraciones físicas y sobre todo psicológicas, que obligan a abordar su tratamiento etiológico tan precozmente como sea posible.
La presencia de hiperplasia estromal pseudoangiomatosa (PASH) en el ámbito de una macromastia puberal condiciona una mala respuesta al tratamiento hormonal y sucesivas recidivas después del quirúrgico.
Presentamos el caso clínico de una niña, en la cual a la macromastia bilateral se asoció PASH.
DESCRIPCIÓN DEL CASO
Paciente de 12 años de edad que acudió al Servicio de Ginecología por cuadro de dolor y sensación de distensión en ambas mamas, de 1,5 meses de evolución. Desde seis meses antes presentaba crecimiento mamario gradual, progresivo, que se había hecho excesivo coincidiendo con la mastalgia. No existían antecedentes de interés ni de administración de fármaco alguno.
Exploración física: normoconstituida, delgada (talla, 155 cm; peso, 39,9 kg). Genitales externos normales para su edad. Himen perforado. Tacto rectal: útero de nulípara; no se observa patología anexial. Citología vaginal simple: normal. Diagnóstico hormonal: hipoestrogénico. Ecografía ginecológica: útero en posición media, de tamaño y morfología normal; ambos ovarios miden 22 x 15 mm.
Exploración mamaria: hipertrofia mamaria bilateral (Fig. 1), más acusada en el lado izquierdo; enrojecimiento e intenso edema de la piel que le confiere aspecto de «piel de naranja», con exudado claro, transparente, a través de los poros cutáneos de los cuadrantes inferiores de ambas mamas. Areolas hipertróficas y pezones sin desarrollar. No nódulos ni masas palpables. Ecografía mamaria: mamas hipertróficas, con múltiples quistes bilaterales y desarrollo de tejido mamario, sin evidencia de masas.
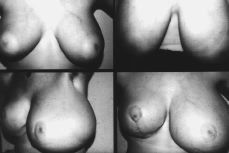
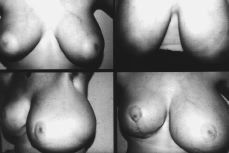
Figura 1. Fotocomposición en la que se observa: Ángulo superior izquierdo: desarrollo mamario, de la paciente en el momento de la primera consulta. Ángulo superior derecho, después de haber sido tratada con progesterona natural. Fotografías inferiores: recidiva de la gigantomastia, más llamativa en la mama izquierda, después de haber sido sometida la paciente a mamoplastia bilateral de reducción.
Estudio endocrinológico: analítica hormonal y resonancia magnética nuclear craneal, con estudio selectivo del eje hipotálamo-hipofisario, normal.
Se indicó tratamiento antiinflamatorio, mejorando la sintomatología de la paciente al cabo de un mes. Sin embargo, a los tres meses se evidenció notable aumento del tamaño de las mamas, comprobándose entonces que el dolor abdominal presentaba características cíclicas, y que era durante los días previos al dolor hipogástrico cuando se producía el mayor aumento de volumen mamario.
Se instauró tratamiento con antihistamínicos, diuréticos y progesterona natural para comprobar la respuesta al tratamiento hormonal y posponer en lo posible el tratamiento quirúrgico. Seis meses después de la primera consulta y ante la nula respuesta a la terapéutica hormonal (Fig. 1) y la importante afectación psicológica de la paciente, que le impedía incluso realizar actividades propias de su edad, se realizó mamoplastia bilateral de reducción (técnica de Strombeck de pedículo bilateral), extirpando sendas piezas quirúrgicas de 1.100 gr de la mama derecha y 2.100 gr de la izquierda.
Seis meses después de la intervención, precisó nueva mamoplastia de reducción de la mama derecha (1.000 gr).
A los cuatro meses de esta segunda intervención la paciente presentó nueva recidiva, bilateral, pero más acusada en la mama izquierda, con gigantomastia de gran tamaño (Fig. 2) y signos clínicos idénticos a los descritos en la primera exploración.
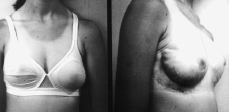
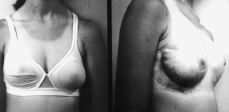
Figura 2. Estado actual de la enferma después de haber sido tratada mediante mastectomía subcutánea y colocación de sendas prótesis expansoras.
Se le reintervino, realizando mastectomía subcutánea bilateral (piezas quirúrgicas de 500 gr en mama derecha y de 2.400 gr en la izquierda.) y colocación de sendas prótesis expansoras biodimensionales, McGhan, de 230-250 cc, con objeto de alcanzar un desarrollo mamario armónico en cuanto a volumen con el desarrollo estatural y ponderal de la paciente (Fig. 3).
Las piezas quirúrgicas procedentes de las tres intervenciones presentaban un aspecto similar tanto macroscópica como histológicamente. Macroscópicamente todas las muestras tenían un aspecto fibroso, denso, patrón nodular, color rosado y sin tejido adiposo interpuesto. El examen histológico mostraba un tejido mamario sin desarrollo de unidades lobulillares terminales, con conductos grandes, dilatados, algunos con hiperplasia ductal papilar. Lo más llamativo era la hipertrofia estromal existente. El estroma era basófilo laxo en localización periductal y más colagenizado y con abundantes hendiduras comunicadas entre sí con patrón angiomatoso. Dichas hendiduras no eran verdaderos vasos, ya que las características inmunohistoquímicas de las células de revestimiento las identificaron como miofibroblastos (CD34, vimentina, actina y dermina, positivas) y no como células endoteliales (factor VIII y queratina, negativas).
El diagnóstico histológico fue de macromastia puberal con hiperplasia estromal pseudoangiomatosa.
DISCUSIÓN
El crecimiento y desarrollo de la mama de la mujer son procesos que dependen de las hormonas. Las mamas aumentan de volumen debido al crecimiento ductal, lobular y adiposo, siendo el elevado nivel de estradiol que se produce en la pubertad la causa principal del crecimiento mamario. Sin embargo, no es conocido el mecanismo por el cual dejan de crecer. Puesto que la mama no ejerce ningún control contrarregulador negativo conocido de la secreción hormonal, parece lógico pensar que el crecimiento final debe regularse por el propio tejido mamario. Quizás exista una regulación de la cantidad de receptores de hormona o de la acción del complejo hormona-receptor; o bien, una cierta cantidad de crecimiento epitelial ductal inhiba un ulterior crecimiento(1).
Se denomina macromastia puberal al desarrollo excesivo de la glándula mamaria durante la pubertad(2). Es necesario diferenciar las verdaderas macromastias, en las que se produce un aumento del tejido mamario, de las pseudohipertrofias mamarias, relacionadas con una excesiva cantidad de tejido graso y con la obesidad.
La etiología de la gigantomastia puede ser múltiple: procesos inflamatorios, causas tóxicas(3), causas endocrinas, procesos tumorales benignos y malignos primarios o metastásicos(4,5); pero, en todo caso, la aparición de un caso de gigantomastia bilateral o asimétrica en una niña o adolescente provoca alteraciones físicas y sobre todo repercusiones psicológicas graves, que obligan a poner en marcha todos los procedimientos necesarios para llegar a su diagnóstico etiológico diferencial(4,6), que permita realizar un adecuado tratamiento.
La PASH es un cambio del estroma mamario que se puede asociar tanto a lesiones benignas como malignas(7,8). A veces el cambio es tan llamativo que constituye el componente principal de la lesión. El cuadro será localizado o difuso dependiendo de la patología de base. Sin embargo, también puede presentarse como una lesión benigna, de probable etiología hormonal, que puede producir masas; esta última es su presentación más frecuente(9), y resulta fácil confundirla con un fibroadenoma. En estos casos, será la corebiopsia o la biopsia quirúrgica quienes den el diagnóstico de certeza(10). También, aunque con mucha menos frecuencia, se han descrito casos de afectación masiva asociados a gigantomastia, como es el caso presentado.
Su etiología sería progestagénica(11), o representaría un estado en la maduración del nuevo estroma mamario(12). Su incidencia mayor en mujeres premenopáusicas, y durante la gestación, hace sospechar la importancia del factor hormonal. Su patogenia es incierta, pero parece debida a una reactividad aberrante de los miofibroblastos a un estimulo hormonal tanto endógeno como exógeno(13), y se ha sugerido que podría ser el resultado de una manifestación exagerada de cambios fisiológicos descritos en el estroma mamario durante la fase lútea. Esto justificaría el hecho de tener un carácter cíclico, como en el caso presentado.
Histológicamente la macromastia puberal presenta un cuadro similar a una ginecomastia: conductos epiteliales con mayor o menor grado de hiperplasia ductal papilar. Cuando existe una PASH asociada el estroma presenta un complejo patrón de hendiduras anastomosadas que simulan canales vasculares. Las células que revisten estos canales son células del estroma mamario de naturaleza fibroblástica, presentan inmunorreactividad positiva para CD34, actina y vimentina y son negativas para marcadores endoteliales: factor VIII y queratina. Con estudios ultraestructurales también se ha demostrado el carácter no endotelial de dichas células. Suele presentar inmunorreactividad de las células del estroma con anticuerpos receptor de progesterona, y algo menos para los estrógenos, un patrón que contrasta con la ausencia de inmunorreactividad del estroma mamario normal (no gestacional) y en el componente estromal de la hiperplasia mamaria juvenil(11). Resulta esencial diferenciar el proceso de otros tumores vasculares, especialmente del angiosarcoma de bajo grado, con el que en ocasiones se ha confundido, y del que parece no ser precursor.
Mientras en las formas puras de hipertrofia virginal, el tratamiento con progesterona parece inhibir el crecimiento, aunque no es capaz de producir remisiones del volumen mamario(15,16), no ocurre así en las que asocian PASH.
En las hipertrofias virginales no existen niveles hormonales aumentados, por lo que el trastorno del desarrollo parece estar en los receptores hormonales de la mama(17), de tal forma que la progesterona bloquearía de alguna manera la acción de cantidades normales de estrógeno o prolactina. Del mismo modo, la PASH, podría ser el resultado de una manifestación exagerada a nivel de los receptores de progesterona de los cambios fisiológicos ocurridos en el estroma mamario durante la fase lútea(8). Por tanto, aunque el origen de ambos radicaría en una alteración a nivel de receptores, en la hipertrofia virginal pura sería en los receptores estrogénicos y en la hipertrofia que asocia PASH en los receptores de progesterona. Este hecho condiciona la respuesta al tratamiento de ambos procesos. Mientras en las macromastias virginales se aconseja realizar un tratamiento de prueba con progesterona, y si la mama deja de crecer, proceder a la reducción mamaria, continuando después el tratamiento hormonal durante seis meses más (o realizar mastectomía subcutánea con implante de silicona(15) si las mamas continúan creciendo con el tratamiento hormonal); cuando existe PASH asociada, el tratamiento con progesterona agravará el cuadro. Por este motivo, su tratamiento adecuado parece ser la extirpación completa(14,8), siendo frecuentes las recidivas después de excisiones incompletas. En sus formas difusas, para llegar al control local de la enfermedad puede ser necesaria la mastectomía(13).
Actualmente no existe información acerca de la utilidad del tratamiento con antiestrógenos o radioterapia ante la PASH.
BIBLIOGRAFIA
01 Topper YJ, Friedberg SH, Oka T. Development of insulin sensitivy by mouse mammary gland in vitro. New York: Academic. Runner MN; 1970. p. 101-13.
02 Fernández-Cid A. Patología infantojuvenil. Barcelona: Salvat; 1989.
03 De Pablo JL. Gigantismo mamario inducido por D-penicilamina. Descripción de un caso y revisión de la literatura. Rev Senología y Patol Mam 1993;6:91-6.
04 Fernández-Cid A, Ribas D. Patología mamaria. Barcelona: Salvat; 1982. p. 143-9.
05 Tanimura A, Konaka K. Acta Pathol Jpn 1980;30:157-60.
06 Boothroyd A, Carty H. Breast masses in childhood and adolescence. A presentation of 17 cases and review of the literature. Pediatr Radiol 1994;24:81-4.
07 Ibrahim RE, Sciotto CG, Weidnwe N. Cancer 1989;63:1154-60.
08 Rosen''s. Breast Pathology. Lippicott: Raven Publisher, 1997. p. 659-65.
09 Polger MR, Denison CM, Lester S, Meyer JE. Pseudoangiomatous stromal hyperplasia: mamographic and sonographic appearances. AJR Am J Roentgenol 1996;166:349-52.
10 Cohen MA, Morris EA, Rosen PP, Dershaw DD, Liberman L, Abramson AF. Pseudoangiomatous stromal hyperplasia: mammograpic, sonographic, and clinical patterns. Radiology 1996; 198:117-20.
11 Anderson C, Ricci A Jr, Pedersen CA, Cartun RW. Inmunocytochemical analysis of estrogen and progesterone receptors in benign stromal lesions of the breast. Evidence for hormonal etiology in pseudoangiomatous hyperplasia of mammary stroma. Am J Surg Pathol 1991;15:145-9.
12 Badve S, Sloane JP. Pseudoangiomatous hyperplasia of male breast. Histopathology 1995;26:463-6.
13 Powell CM, Cranor ML, Rosen PP. Pseudoangiomatous stromal hyperplasia (PASH). A mammary stromal tumor with myofibroblastic differentiation. Am J Surg Pathol 1995;19:270-7.
14 Vuitch MF, Rosen PP, Erlandson RA. Pseudoangiomatous hyperplasia of mammary stroma. Hum Pathol 1986;17:185-91.
15 Mayl N, Vasconez NO, Jurkiewicz MJ. Treatment of macromastia in the actively enlarging breast. Plast Reconstr Surg 1974;54:6-12.
16 Sperling RL, Gold JJ. Use of an anti-estrogen after a reduction mammaplasty to prevent recurrence of virginal hypertrophy of breasts: Case report. Plast Reconstr Surg 1973;52:439-42.
17 Sawin CT. Fisiología endocrina y fisiopatología de la mama. En Cirugía Plástica y de reconstrucción de la mama. Barcelona: Salvat; 1981. p. 77-95.