Ginecología
Anticoncepción hormonal oral y metabolismo lipídico
J. L. Dueñas Díez
Servicio de Ginecología
Hospital Universitario Virgen de la Macarena. Facultad de Medicina
Avda. Dr. Fedriani, 9
41009 Sevilla
Correspondencia:
Dr. José Luis Dueñas Díez
Servicio de Ginecología
Hospital Universitario Virgen de la Macarena
Avda. Dr. Fedriani, 9
41009 Sevilla
Oral contraceptives and lipid metabolism
Dueñas Díez JL. Anticoncepción hormonal oral y metabolismo lipídico. Prog Obstet Ginecol 1999;42:216-224.
Fecha de recepción: 16/9/98
Aceptado para publicación 16/11/98
RESUMEN
La obtención reciente de nuevas evidencias epidemiológicas que han relacionado la utilización de contraceptivos orales, especialmente los que contienen gestágenos de la tercera generación, con un incremento del riesgo de presentar enfermedad tromboembólica, la relación del metabolismo lipídico con el riesgo cardiovascular, los avances experimentados en el conocimiento de la fisiología de los lípidos y la necesidad de establecer unos criterios racionales en el control clínico de las usuarias de contraceptivos orales, constituyen el objetivo de esta revisión de conjunto.
PALABRAS CLAVE
Contraceptivos orales; Metabolismo lipídico.
ABSTRACT
The recent procurement of new epidemilogic evidences that have related the utilization of oral contraceptives, specially that contained gestagens of the third generation, with an increment of the risk of presenting tromboembolic disease, the relation of the lipid metabolism with the cardiovascular risk, the experienced advances in the knowledge of the lipid physiology and the need of establishing some rational criteria in the clinical control of the users of oral contraceptives, constitute the objective of this revision.
KEY WORDS
Oral contraceptives; Lipid metabolism.
METABOLISMO DE LOS LIPIDOS: BASES FISIOLOGICAS
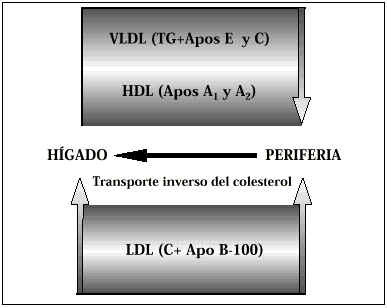
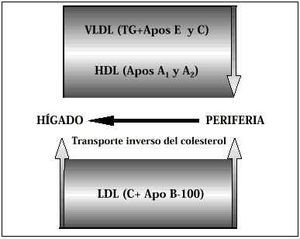
Los lípidos no son compuestos solubles en el plasma, de aquí que para ser transportados se precisen unos vehículos que se denominan lipoproteínas. Estos complejos trasladan los lípidos, fundamentalmente los triglicéridos y el colesterol, desde el hígado hacía las células de todo el organismo, donde son empleados para generar energía celular (triglicéridos) y para la síntesis de estructuras celulares y de hormonas esteroideas (colesterol). El exceso de lípidos sobrante de los tejidos periféricos es devuelto de nuevo al hígado «empaquetado» también en lipoproteínas en un sistema de transporte denominado «transporte inverso del colesterol». Ambos sistemas deben de estar muy bien sincronizados para un adecuado funcionamiento metabólico (Fig. 1).
Figura 1.Transporte de triglicéridos y de colesterol.
Todas las lipoproteínas tienen una estructura común. Su superficie está formada por fosfolípidos y colesterol libre asociados con componentes proteicos denominados Apoproteínas. El interior de estos complejos está lleno de triglicéridos y de esteres de colesterol. Las lipoproteínas se diferencian, entre otras cosas, por su diferente densidad cuando se realiza una ultracentrifugación secuencial del plasma, de aquí que atendiendo a este criterio se distingan básicamente tres tipos: lipoproteínas de muy baja densidad (VLDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL). Como veremos posteriormente existen, de algunas de ellas, subtipos y formas intermedias.
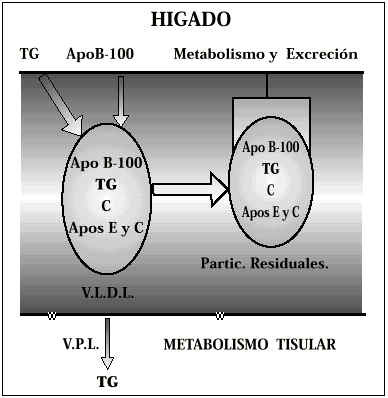
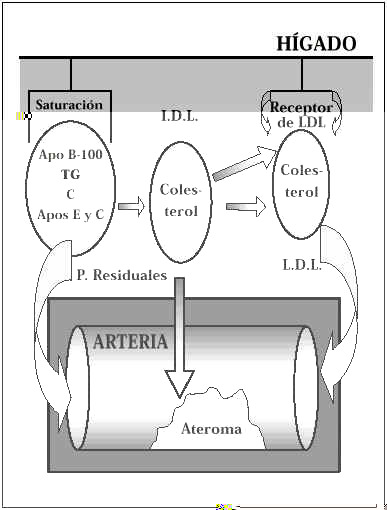
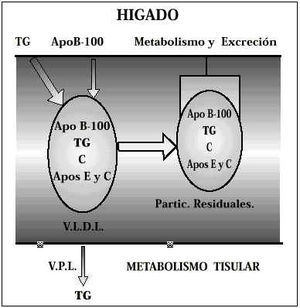
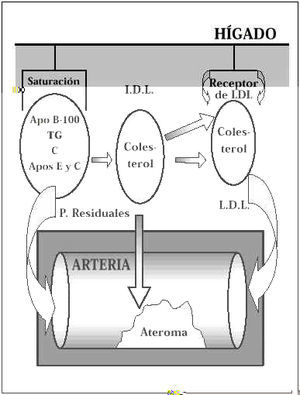
Los lípidos ingresan en el organismo a través de la dieta. Una vez atravesada la mucosa intestinal son vehiculados a través del sistema porta al hígado, donde son almacenados en forma de triglicéridos (TG). Cuando se precisa su envío hacia la periferia, el hígado lo hace empleando como vehículo de transporte las VLDL, uno de cuyos componentes fundamentales es una Apoproteína (Apo) sintetizada por el propio hígado, como componente integral de las VLDL, denominada Apo B-100. Las VLDL contienen además de Triglicéridos (TG), pequeñas cantidades de colesterol (C) y, un conjunto de pequeñas proteínas denominadas Apoproteínas E y C. Una vez en los tejidos, los TG pasan al interior de las células, donde son metabolizados por la acción de la lipoproteín-lipasa; y su vehículo, en ocasiones cargado en parte con triglicéridos reducidos y formas residuales, es devuelto de nuevo hacia el hígado para un reciclaje posterior o para su excreción (Fig. 2). En las sociedades occidentales, en las que predominan las dietas ricas en grasas, este sistema de transporte y aclaramiento se encuentra saturado en muchos individuos. En esta situación, algunas partículas residuales de VLDL cargadas de TG y, sobre todo, de colesterol permanecen en el plasma, son las denominadas lipoproteínas de densidad intermedia (IDL). Estas partículas son transformadas rápidamente en LDL que son las lipoproteínas más ricas en colesterol. En este proceso, la proteína estructural original la Apo B-100 permanece en forma de partículas de LDL(1) (Fig. 3).
Figura 2.Metabolismo de las VLDL.
Figura 3.Metabolismo de las partículas residuales.
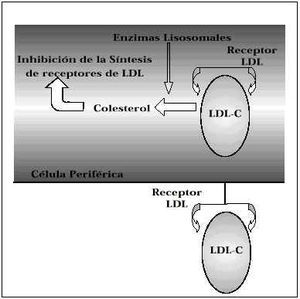
Las partículas de LDL se unen a receptores hepáticos específicos. Cuando el sistema está saturado el exceso de LDL e IDL y, quizá también, de VLDL son eliminadas más lentamente del plasma donde pueden experimentar modificaciones a través de mecanismos anormales. Se piensa que la oxidación predispone a la acumulación de estas partículas en los macrófagos de la pared arterial lo que daría lugar a interacciones con las plaquetas, con factores locales y a través de otros mecanismos trombóticos contribuiría a la formación y al crecimiento de las placas de ateroma(2). En condiciones normales la función de las lipoproteínas de baja densidad (LDL) consisten en liberar colesterol a las células por un mecanismo mediado por receptores específicos de LDL. Las propias células regulan la síntesis de este receptor en función de sus propias necesidades de colesterol con objeto de mantener su homeostasis (Fig. 4).
Figura 4.Metabolismo de las LDL.
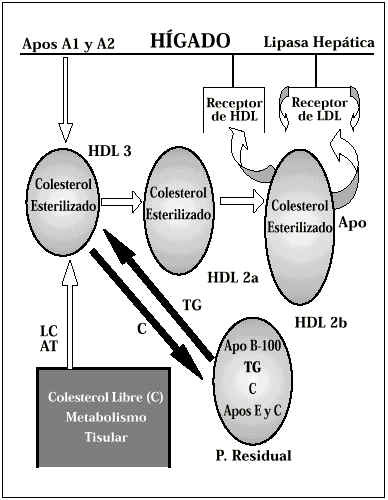
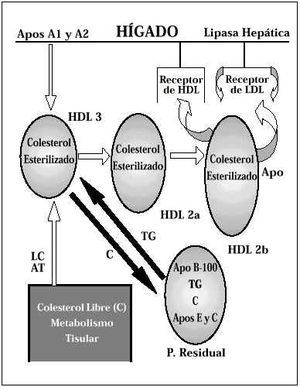
Las lipoproteínas de alta densidad (HDL) juegan un papel fundamental en el proceso denominado «transporte inverso del colesterol». Estas lipoproteínas están formadas por dos proteínas, las Apolipoproteínas A-1 y A-2, que son sintetizadas por el hígado y se combinan fácilmente con los lípidos liberados por otras lipoproteínas y por los tejidos, fundamentalmente con el colesterol. A medida que las Apo A-1 y A-2 se van cargando de colesterol desde la periferia, las moléculas de HDL van incrementando su tamaño denominándose respectivamente HDL3 , HDL2a y HDL2b. Entre estas tres partículas existe una gran heterogenicidad, siendo la HDL2b la de mayor capacidad de transporte de colesterol (Fig. 5). Las lipoproteínas de alta densidad pueden seguir tres caminos:
Figura 5.Metabolismo de las HDL.
Liberar el colesterol hacia las partículas residuales (las VLDL que habían cedido los Triglicéridos en los tejidos) que a través de su receptor pueden ser captadas por el hígado o, en el caso de estar este saturado, transformarse en IDL o LDL.
Las HDL2b pueden combinarse con una Apo E y unirse directamente con los receptores de LDL.
Ser captadas directamente por el hígado penetrando en el hepatocito a través de su receptor específico. Una vez en el interior, algunos de los componentes del HDL, especialmente las partículas de HDL2, son metabolizadas por la lipasa hepática para su posterior reciclaje. Es importante tener en cuenta que los niveles de Lipoproteín-lipasa pueden variar considerablemente, de unos individuos a otros, y verse influenciados por factores hormonales.
Los niveles plasmáticos de HDL2b son un excelente indicador, y muy fiable de un metabolismo lipídico eficaz y del «transporte inverso del colesterol». Si tenemos en cuenta que esta lipoproteína está constituida en buena parte por Apo A-1, los niveles plasmáticos de ésta también se consideran un buen marcador de este proceso.
PATOGÉNESIS DE LA HIPERLIPIDEMIA EN EL DESARROLLO DE LA ARTERIOESCLEROSIS
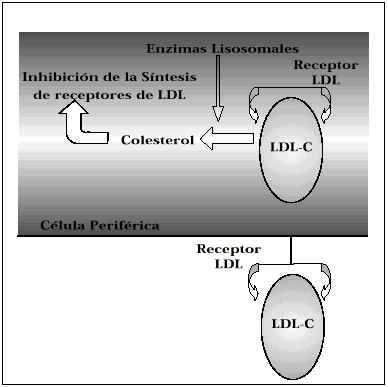
Las LDL se unen a su receptor en la membrana celular (presente en la mayor parte de las células del organismo) penetrando ambos en su interior. El complejo LDL-receptor queda inmediatamente expuesto a la acción de los enzimas lisosómicos que hidrolizan las partículas de LDL, liberando el colesterol que contienen en el citoplasma celular. Este colesterol libre ejerce tres efectos reguladores que sirven para mantener la homeostasis intracelular(2):
Suprime la actividad de la 3 hidroxi-3-metil glutaril Coenzima A reductasa que es la enzima limitante de la síntesis de colesterol.
Activa la colesterol acil transferasa que re-esterifica el exceso de colesterol para su almacenamiento como pequeñas gotitas lipídicas en el citoplasma.
Suprime la síntesis de receptores de LDL para evitar que nuevas partículas penetren y liberen colesterol.
Mediante estos mecanismos las células pueden regular (creando más o menos receptores de LDL) la captación de colesterol. Así, ante una gran oferta, por ejemplo a través de la dieta, se induciría una síntesis muy escasa de receptores de LDL, de tal forma que esta lipoproteína aumentaría en el plasma y el colesterol se acumularía.
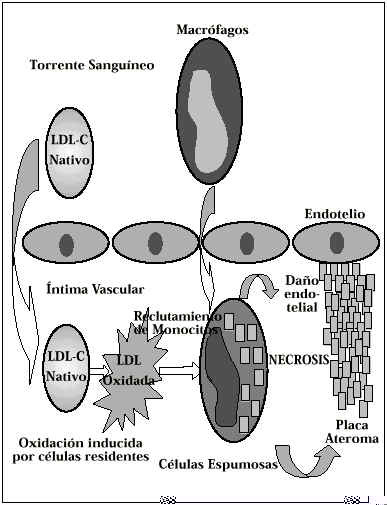
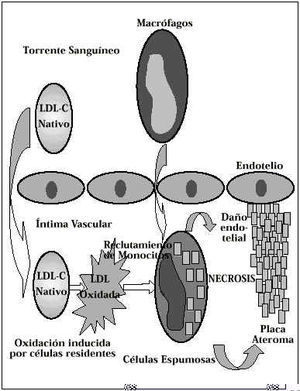
Actualmente, se admite la hipótesis de que unos niveles elevados de las LDL en el plasma, facilitarían el paso y la acumulación de esta lipoproteína en el espacio sub-endotelial de los vasos (Fig. 6). Una vez allí, muchas de estas moléculas experimentan un proceso de oxidación, inducida por células residentes en este espacio, como las células endoteliales y los macrófagos, dando lugar a una «LDL-modificada» que a su vez estimularía la producción, por las células vasculares locales, de una proteína quimiotáctica de los monocitos y de factores estimuladores de las colonias de granulocitos y de macrófagos que dan lugar al reclutamiento de monocitos y a la diferenciación de los macrófagos dentro de la pared arterial. El acúmulo de estas células estimularía la peroxidación de la LDL. El producto de esta reacción, hace que la Apoproteína B-100 adquiera una carga más negativa, lo que induce a los macrófagos a reconocer a este «LDL-modificado u oxidado» con sus «scavenger receptors» (receptores basureros) y a fagocitarlas, acumulándolas en su interior hasta transformarse en células espumosas(3). A diferencia de lo que ocurre habitualmente con el «LDL no oxidado», denominado también «nativo» que es reconocido por el receptor de LDL de los macrófagos y regulada su producción mediante los niveles de LDL, la LDL oxidada o modificada es reconocida por el «receptor basurero» (lo que se conoce bajo el término «scavenger receptor pathway») que no está sujeto a ningún feed-back negativo y cuyo resultado es el acúmulo masivo de colesterol en el interior de los macrófagos que se transforman en células espumosas.
Figura 6.Mecanismo de formación de la placa de ateroma.
Además de este mecanismo de acúmulo subendotelial de células espumosas, las LDL oxidadas ejercen un efecto quimiotáctico directo sobre los monocitos que son estimulados, primero a adherirse al endotelio, luego a cruzar la íntima y, posteriormente, a quedar atrapados en la capa subendotelial, sin posibilidad de retornar a la circulación. Finalmente, las LDL oxidadas tienen una acción citotóxica sobre las células vasculares, dando lugar a su destrucción y, como consecuencia de ello, a la liberación de colesterol y de enzimas lisosomales en el espacio extracelular de la íntima de los vasos, incrementando las lesiones arterioescleróticas(4).
En resumen, en la patogénesis de la arteriosclerosis juega un papel decisivo el incremento de los niveles plasmáticos de las LDL que, al encontrarse en exceso, se oxidan en la capa subendotelial de los vasos dando lugar a la formación y al desarrollo de las placas de ateroma, no olvidando que un exceso de oferta de lípidos induce el acúmulo de VLDL residual que al transformarse en IDL incrementa el «pool» de las LDL. De aquí, que cualquier agente que induzca la saturación de los mecanismos biológicos de transporte de partículas residuales hacia el hígado (incrementando las VLDL o las LDL) o reduzca la capacidad de «transporte inverso» del colesterol (reduciendo las HDL) contribuiría a la producción de arteriosclerosis.
HIPERLIPIDEMIA, ARTERIOSCLEROSIS Y ENFERMEDADES CARDIOVASCULARES: EVIDENCIAS EPIDEMIOLOGICAS
Varios importantes estudios epidemiológicos han relacionado algunas anormalidades del metabolismo lipídico con un incremento de las enfermedades cardiovasculares. Concretamente, una elevación de los niveles plasmáticos de las LDL o de la Apoproteína B-100 y una reducción de los niveles de las HDL o de las Apoproteínas A1 ó A2. Pero es la elevación de los niveles plasmáticos de colesterol, y su relación con el incremento de la incidencia de enfermedades cardiovasculares, la modificación lipídica mejor documentada desde el punto de vista epidemiológico, hasta el punto de que la reducción farmacológica de sus niveles plasmáticos, en pacientes hipercolesterinémicos, ha mostrado como resultado la reducción de la frecuencia de enfermedad cardiovascular al menos en el hombre(5,6).
La evidencia acumulada hasta el momento también sugiere que la hipertrigliceridemia es un importante factor de riesgo en la mujer. Los datos obtenidos del estudio Framingham(7) afirman que los triglicéridos elevados solo constituyen un factor de riesgo cardiovascular en las mujeres que tienen unos niveles plasmáticos muy bajos de HDL. Sin embargo, hay que tener en cuenta que existen otros muchos factores de riesgo cardiovasculares demostrados como son la obesidad, el tabaco, la hipertensión, el sedentarismo, la diabetes, las enfermedades que conducen a estados de hipercoagulabilidad y la arterioesclerosis y que cuando estos factores y/o enfermedades se asocian entre sí el riesgo se incrementa en proporción geométrica.
ACCIONES DE LOS CONTRACEPTIVOS ORALES SOBRE EL METABOLISMO LIPIDICO: EVIDENCIAS BIOLOGICAS Y EPIDEMIOLOGICAS
La historia cambiante de la contracepción hormonal oral hace que hoy en día distingamos varias generaciones de contraceptivos orales (CO), en función de la dosis y el tipo de los principios farmacológicos utilizados. Las evidencias obtenidas con los CO de la primera generación, hoy ya en desuso, de ninguna manera son traspolables a los preparados de la «tercera generación» que se emplean actualmente, con dosis de etinilestradiol (EE) seis veces menores y combinados con gestágenos radicalmente diferentes, entre otras cosas por tener mucha menor potencia androgénica que los utilizados en la primera etapa. Estas consideraciones deben de tenerse muy presentes a la hora de interpretar las evidencias y, en cualquier caso, especificado cuando se extraen conclusiones(8,9).
En general, las acciones de los esteroides sintéticos sobre el metabolismo lipídico son muy diferentes, según se trate de estrógenos y de gestágenos empleados aisladamente, o en combinación. El etinil estradiol (EE), el componente estrogénico más frecuente de los CO, actúa incrementando las HDL, especialmente la subfracción 2 (HDL2), reduciendo los niveles plasmáticos de las LDL, e incrementando los de las VLDL y, secundariamente, los TG. Los gestágenos en general, reducen los niveles plasmáticos de las fracciones VLDL y HDL y elevan los de LDL. No obstante, existen diferencias muy importantes entre los diferentes tipos de gestágenos. La acción aterogenizante más intensa la ejercen los derivados de la 19 nortestosterona (noretisterona y linestrenol). Por el contrario, el menor impacto lo presentan los derivados de la hidroxiprogesterona (acetato de ciproterona) y los gestágenos de la tercera generación (gestodeno y desogestrel). En consecuencia, el efecto global de los CO va a depender, teóricamente, de la dosis de EE y del tipo y la dosis del gestágeno combinados, de tal manera que la potencia relativa del estrógeno y del gestágeno determinarán el resultado neto(2,9).
Sobre el metabolismo de las HDL los estrógenos actúan al menos por dos mecanismos: la supresión de la actividad de la lipasa hepática, dando lugar a una reducción de la conversión del HDL2 en HDL3, e incrementando la síntesis de Apoproteína A. Los gestágenos androgénicos, por el contrario, estimulan la actividad de la lipasa hepática, produciendo el efecto contrario. Estos mecanismos explicarían porqué un incremento de las HDL, inducido por el EE, puede ser contrarrestado por el componente gestagénico. Los CO de bajas dosis empleados actualmente, combinados con los gestágenos de la «tercera generación», presentan un balance claramente positivo al no neutralizar éstos la acción beneficiosa del EE sobre el HDL (1,6.10,11,12,13,14).
Muchas de las combinaciones de los CO tienden a incrementar las concentraciones plasmáticas de las LDL. Esta elevación, es menor en los preparados «estrógeno-dominantes» que en los «gestágeno-dominantes»(15). El mecanismo a través del que los gestágenos androgénicos incrementan las LDL no ha sido aún clarificado. Teóricamente, la estimulación por estos gestágenos de la actividad de la lipasa hepática, podría facilitar la conversión de las VLDL a LDL. Este mecanismo, asociado con el estímulo de la producción de las VLDL inducida por el EE, podría dar como resultado el incremento de las LDL. Los CO, que contienen gestágenos de la «tercera generación», tienen un comportamiento muy diferente, ya que no modifican los niveles de las LDL lo que reduciría sustancialmente el riesgo aterogénico de los preparados con gestágenos androgénicos(10-17).
Uno de los aspectos del metabolismo lipídico más influidos por la acción de los CO es el de las lipoproteínas de muy baja densidad (VLDL) y el de los triglicéridos (TG). La mayor parte de los estudios detectan un incremento de los niveles plasmáticos de los TG y de las VLDL en los preparados eminentemente estrogénicos, como resultado del incremento de la producción de VLDL y una reducción de su aclaramiento inducidos por el EE. Una paliación de estos efectos puede observarse en los CO que contienen gestágenos 19-Norderivados, siendo en última instancia la potencia relativa del estrógeno y del gestágeno de cada preparado combinado, quien va a determinar el efecto neto sobre los niveles plasmáticos de las VLDL y de los TG. La elevación de estos últimos inducida por el EE es opuesta, con mayor eficiencia, por los gestágenos androgénicos como el levonorgestrel que por gestágenos no androgénicos como el desogestrel(18). Algunos artículos(19,20) comunicaron la asociación de hipertrigliceridemia en usuarias de CO asociada con pancreatitis masiva con compromiso vital. Estas situaciones son raras y, en principio, no justificarían, desde el punto de vista coste-beneficio, su screening generalizado a todas las potenciales usuarias de CO.
Artículos recientes(21,22) presentan evidencias de que los CO no inducen cambios significativos en los niveles plasmáticos de la Lipoproteína (a), factor claramente asociado, cuando está elevado, a enfermedades isquémicas.
Cuando se analizan, desde el punto de vista epidemiológico, las evidencias disponibles actualmente sobre el impacto de los CO sobre el metabolismo lipídico, y se evalúa con criterios objetivos su calidad, en base al tipo de diseño del estudio, el tamaño de las muestras y a las condiciones de rigurosidad científica se llega a la conclusión de que la calidad es de tipo «regular" (en una escala de «adecuada», «buena», «regular» y «pobre») y los datos proceden, en general, de estudios de duración de seguimiento cortos, generalmente de seis ciclos(23). Los estudios clínicos aleatorizados disponibles son de muestras pequeñas y no comparan riesgos entre usuarias y no usuarias de CO, sino entre usuarias de diferentes tipos de CO. El estudio con mayor nivel de evidencia científica (nivel I de calidad), desde el punto de vista de vista epidemiológico, es el metanálisis publicado por Lobo y cols.(14), aunque tan sólo hace referencia a un preparado que contiene 30 µgrs de EE y 150 µgrs de desogestrel. Con un nivel II de calidad científica se encuentra el estudio randomizado de Teichman y cols.(24), quienes evaluaron el impacto sobre el metabolismo lipídico de seis tipos de CO, todos ellos con 30-35 µgrs de EE o trifásicos conteniendo gestágenos de tercera generación en 460 mujeres. Los estudios de nivel de calidad III y IV son ya más numerosos(25-36) y se caracterizan por analizar muestras pequeñas con seguimientos durante cortos períodos de tiempo y, generalmente, sin grupo de control adecuado.
Del análisis e interpretación de los datos disponibles y con las reservas a las que obliga la calidad de la evidencia epidemiológica analizada, se puede concluir que los contraceptivos orales de baja dosis de EE, combinados con gestágenos de la tercera generación, ejercen un efecto balanceado sobre el metabolismo lipídico, ya que incrementan las HDL, las VLDL y los TG y no modifican significativamente las LDL y la Lp(a). Finalmente, y hasta el momento presente, no se han observado diferencias significativas entre los preparados de dosis bajas y ultrabajas (20 µg de EE)(3,7).
Hasta el momento presente, no hay ensayos que hayan sido diseñados para investigar la hipótesis de que los cambios lipídicos inducidos por los CO se asocien con un incremento o disminución de la incidencia de enfermedad cardiovascular (ensayos de intervención). Sin embargo, si se disponen de algunos datos obtenidos en la experimentación animal. Los estudios realizados en macacos(38) han demostrado que los CO que contienen norgestrel protegen al animal hembra del desarrollo de la arterioesclerosis cuando se comparan los resultados con los obtenidos en animales controles, incluso aunque en los primeros se hubieran producido cambios en los lípidos similares a los que ocurren en la especie humana. En el estudio, realizado durante 31 meses, todos los macacos recibieron una dieta aterogénica, mientras que un sub-grupo de hembras recibieron un CO con 50 µgrs de EE y 500 mgrs de Norgestrel. Una vez sacrificados los animales, las lesiones arterioscleróticas del grupo de hembras que habían sido tratadas con CO fue significativamente menor que en los machos o que en las hembras controles, incluso en aquellos casos en que en las tomadoras de CO el cociente colesterol/HDL (índice aterogénico) estaba desfavorablemente aumentado.
UTILIDAD DE LA DETERMINACIÓN DE LOS LIPIDOS Y DE LAS LIPOPROTEINAS EN USUARIAS POTENCIALES O ACTUALES DE CO
A la hora de establecer la necesidad, o no, de establecer controles lipídicos de la población usuaria de contraceptivos orales (CO) se han planteado en cuanto a sus objetivos tres posibilidades:
Realizar un control previo a la administración de los CO en las mujeres candidatas a su utilización, con objeto de determinar si este factor de riesgo cardiovascular está presente y, así, contraindicar su empleo, o establecer cual sería el preparado más adecuado.
Analizar la respuesta metabólica en mujeres que emplean CO una vez transcurrido un tiempo breve predeterminado.
Para detectar en las usuarias habituales de CO cualquier alteración del metabolismo lipídico que pudiera producirse en el tiempo, ligado o no a su empleo, con el fin evitar la progresión de la alteración.
En el caso de los lípidos y de las lipoproteínas hay escasa evidencia que soporte la necesidad de su determinación como una estrategia a utilizar sistemáticamente, tanto en primeras usuarias de CO como en las que ya están utilizándolos, cuando se trata de población sana. Por el contrario, es imprescindible su evaluación en mujeres con enfermedad cardiovascular establecida o con factores de riesgo múltiples (hipertensión, obesidad, fumadoras o con historia familiar de enfermedad cardiovascular prematura)(20). Finalmente, la determinación sistematizada en todas las mujeres, incluso sanas, de los lípidos como parte de un programa de screening precisaría previamente de una demostración, que no deje lugar a dudas, de la existencia de una asociación entre un determinado perfil lipídico inducido por los CO y la enfermedad cardiovascular, al menos de la misma entidad que se ha observado entre la mutación del factor V Leiden y la trombosis venosa(39).
CO EN MUJERES HIPERLIPÉMICAS
Uno de los aspectos que requieren un análisis particularizado es el de la conducta a seguir en cuanto a la prescripción de CO en mujeres con antecedentes personales de presentar diferentes tipos de hiperlipemia.
Las mujeres que presentan una hipercolesterimemia, casi sistemáticamente asociada a un incremento de las LDL, con una enfermedad cardíaca coronaria establecida presentan un riesgo elevado de trombosis que contraindica claramente el empleo de CO, incluso aunque su hipercolesterimemia esté controlada farmacológicamente. En el caso de mujeres con hipercolesterimemia asintomática en la que no se asocian otros factores de riesgo cardiovascular, aunque serían de primera elección otros contraceptivos no esteroideos, los CO no constituyen una contraindicación absoluta, si bien deben emplearse en su caso preparados de bajas dosis de EE.
Los niveles plasmáticos elevados de HDL protegen frente a la enfermedad cardíaca coronaria, especialmente en las mujeres(40), gracias a las propiedades antiaterogénicas de esta lipoproteína, ya que actúa como transportador de la paraoxonasa, enzima capaz de hidrolizar los peróxidos lipídicos y en consecuencia de reducir la oxidación responsable del daño de la pared arterial(41). Actualmente, la determinación de HDL en usuarias de CO no está justificada, ya que existe una duda razonable de que haya una relación directa entre unos niveles bajos de HDL y el desarrollo de enfermedad cardíaca coronaria en usuarias de CO. Por otra parte, existe una gran variación intraindividual y entre los diferentes laboratorios que dificulta la standardización y limita su uso para el screening(42).
Las escasas comunicaciones acerca de hipertrigliceridemias en usuarias de CO asociadas a una pancreatitis masiva(19,20), parecen ser debidas a una hipertrigliceridemia previa enmascarada de estas pacientes y, en todos los casos, fueron descritas en usuarias de CO de dosis muy elevadas de EE. El screening de los TG presenta los mismos problemas de detección que las HDL: dificultad de establecer los criterios de normalidad, enorme variación individual y grandes diferencias entre los laboratorios cuando analizan las mismas muestras(42). Estos hechos, junto con la excepcionalidad de los casos de hipertrigliceridemia asociada a pancreatitis no justifican su determinación indiscriminada en usuarias de CO. Sin embargo, los hallazgos que relacionan la hipertrigliceridemia con un incremento de los factores protrombóticos y con una disminución de la fibrinolisis(43), junto con los datos obtenidos recientemente, acerca del mayor incremento de los niveles plasmáticos de TG inducidos por los CO que tienen gestágenos de la tercera generación, respecto de los preparados con gestágenos más antiguos, desaconsejan su empleo como preparados de primera elección en pacientes con una hipertrigliceridemia demostrada, al menos hasta que se disponga de nuevas evidencias.
BIBLIOGRAFIA
1 Krauss RM. The metabolic impact of oral contraceptives. Am J Obstet Gynecol 1992;167:1177-84.
2 Tikkanen MJ. Role of plasma lipoproteins in the pathogenesis of atheroesclerotic disease with special reference to sex hormone effects. Am J Obstet Gynecol 1990;163:296-304.
3 Díaz MN. Antioxidants and Atherosclerotic hearth disease. N Engl J Med 1997;337:408-16.
4 Schwartz CJ. The pathogenesis of atherosclerosis: an overview. Clin Cardiol 1991;14:Supl I:110-6.
5 The Lipid Research Clinic Program. The lipid research coronary primary prevention trial results. I. Reduction in incidence of coronary hearth disease. JAMA 1984;252:351-64.
6 Samsioe G, Mattsson LA. Some aspects of the relationship between oral contraceptives, lipid anormalities and cardiovascular disease. Am J Obstet Gynecol 1990;163:354-8.
7 Castelli W.P. The trigliceride issue. A view from Framingham. Am Hearth J 1986;112:432-7.
8 Dueñas JL. Anticonceptivos hormonales y perfiles analíticos sanguíneos. Contracepción 1991;1:45-7.
9 Dueñas JL. Efectos cardiovasculares y lipídicos de los anticonceptivos hormonales. Prog Obst Gin 1997;40 Supl 1:S118-S25.
10 Gevers Leuven JA. Estrogenic effect of gestodene or desogestrel containing oral contraceptives on lipoprotein metabolism. Am J Obstet Gynecol 1990;163:358-62.
11 Kuhl H. Time dependent alterations in lipid metabolism during treatment with low dose oral contraceptives. Am J Obstet Gynecol 1990;163:363-9.
12 Moutos D. Lipoprotein alterations from a triphasic oral contraceptive containing ethinil estradiol and gestodene. J Reprod Med 1994;39:720-4.
13 Coata G. Effect of low dose oral triphasic contraceptives on blood viscosity, coagulation and lipid metabolism. Contraception 1995;52:151-7.
14 Lobo RA. Plasma lipids and desogestrel and ethinil estradiol: a meta-analysis. Fertil Steril 1996;65:1100-9.
15 Wahl P. Effects of estrogen/progestin potency on lipid/lipoprotein cholesterol N Engl J Med 1983;308:862-7.
16 Gevers Leuve JA. Effects of oral contraceptives on lipid metabolism. Am J Obstet Gynecol 1990;163:1410-3.
17 Kloosterboer HJ, Rekers H. Effects of three combined oral contraceptive preparations containing desogestrel plus ethinil estradiol on lipid metabolism in comparison with two levonorgestrel preparations. Am J Obstet Gynecol 1990;163:370-3.
18 März, W. A randomized crossover comparison of two low dose contraceptives: effect on serum lipids and lipoproteins. Am J Obstet Gynecol 1985;153:287-93.
19 Banks S. Hyperlipaemic pancreatitis and the pill. Postgrad. Med J 1970;46:576-8.
20 Davidoff F. Marked hyperlipidemia and pancreatitis associated with oral contraceptives N Engl J Med 1973;289:552-5.
21 Delplanque B. Lp(a) levels and antiestrogen antibodies in women with and without thrombosis in the course of oral contraception. Atheroesclerosis 1993;100:183-8.
22 Kuhl H. Effect on lipid metabolism of a biphasic desogestrel containing oral contraceptive: divergent changes in apoprotein B and E and transitory decrease Lp(a) levels. Contraception 1993;47:69-83.
23 Latorre P. Informe del grupo de Revisión Bibliográfica. Conferencia de Consenso sobre anticoncepción hormonal oral; 1997. p. 32-7.
24 Teichmann A. Metabolic profile of six oral contraceptives containing norgestimate, gestodeno and desogestrel. Int J Fertil 1995;40 Supl. 2:98-104.
25 Falsetti L. A new low dose estrogen oral contraceptive combination: effect on endocrine parameters and lipid status. Contraception 1988;38:316-20.
26 Garcés C. Modificaciones lipídicas inducidas por contraceptivos orales que contienen etinilestradiol más levonorgestrel o acetato de ciproterona. Prog Obstet Ginecol 1990;33:47-53.
27 Janaud. A comparison study of lipid and androgen metabolism with triphasic oral contraceptive formulations containing norgestimate or levonorgestrel. Acta Obstet Gynecol Scand 1992;71, supl 156:33-8.
28 Kakis G. A two year clinical study of the effects of two triphasic oral contraceptives on plasma lipids. Int J Fertil 1994;39:283-91.
29 Kruszon-Moran D. The interaction of alcohol consumption and oral contraceptive use on lipids and lipoproteins. Contraception 1988;37:39-51.
30 Kuhl H. Short and long-term effects on lipid metabolism of oral contraceptives containing 30 µgr ethinylestradiol and 150 µgr desogestrel or 3-keto-desogestrel. Horm Res 1995;44:121-5.
31 Moutos D. Lipoprotein alterations from a triphasic oral contraceptive containing ethinil estradiol and gestodene. J Reprod Med 1994;39:720-4.
32 Oyelola O. Fasting plasma lipids, lipoproteins and apolipoproteins in nigerian women using combined oral and progestin-only injectable contraceptives. Contraception 1993;47:445-54.
33 Pérez R. Alteraciones en el metabolismo de los lípidos y pruebas hepáticas inducidas por los contraceptivos orales. Toko-Gin Práct 1989;48:91-4.
34 Raitakari OT. Relations of life-style with lipids, blood pressure and insulin in adolescents and young adults. The cardiovascular risk in young Finns study. Atherosclerosis 1994;111:237-46.
35 Silván J, Dueñas JL, Navarro J. Relación entre el consumo de tabaco y los niveles séricos de los lípidos y lipoproteínas en usuarias de contraceptivos orales trifásicos. Clin Invest Gin Obst 1988;16:69-73.
36 Vaziri SM. The impact of female hormone usage on the lipid profile. The Framingham Offspring Study. Arch Intern Med 1993;153:2200-6.
37 Brill K. Investigation of the influence of two low dose monophasic contraceptives containing 20 µg de EE/75 g GTD and 30 µg EE/75 µg GTD on lipid metabolism, in a randomized trial. Contraception 1996;54:291-7.
38 Adams M.R. Contraceptive steroids and coronary artery artery artherosclerosis in cynomolgus macaques Fertil Steril 1987; 47:1010-8.
39 Vandenbroucke JP. Increased risk of venous thrombosis in oral contraceptive users who are carriers of the factor V Leiden mutation. Lancet 1994;344:1453-7.
40 Jacobs DR. HDL-C as a predictor of cardiovascular disease mortality in men and women: the follow-up study of the lipid research clinics prevalence study. Am J Epidemiol 1990;131:32-47.
41 Mackness MI. Paraoxonase prevents accumulation of lipoperoxides in LDL. FEBS Lett 1991;286:152-4.
42 Crook D. Role of screening for vasculae disease in pill users: lipids and lipoproteins. In: Evidence guided prescribing of the pill. Hannaford PC, Webb AMC. (Eds.) Carnforth, Lancs: Parthenon Publishing; 1996. p. 89-98.
43 Miller GJ. Hyperlipidemia and hypercoagulability. Prog Lipid Res 1993;32:61-9.