Ginecología
Carcinoma ductal in situ de la mama
P. J. Grases1
F. Tresserra1
R. Fábregas2
1 Servicio de Anatomía Patológica
2 Departamento de Obstetricia, Ginecología y Medicina de la Reproducción
Instituto Universitario Dexeus. Barcelona
Correspondencia:
Pedro J. Grases
Servicio de Anatomía Patológica
Instituto Universitario Dexeus
Paseo de la Bonanova, 67-69
08017 Barcelona
Ductal Carcinoma in situ of the breast
Fecha de recepción: 20/2/98
Aceptado para publicación 17/11/98
Grases PJ, Tresserra F, Fábregas R. Carcinoma ductal in situ de la mama. Prog Obstet Ginecol 1999;42:201-215.
RESUMEN
El carcinoma ductal in situ de la glándula mamaria ha adquirido un especial interés en años recientes debido a la posibilidad de su diagnóstico radiológico mediante la identificación de ciertos cambios estructurales, principalmente microcalcificaciones. Por otra parte, existen variedades histológicas que han permitido una clasificación con implicaciones en el tratamiento. La presente revisión de conjunto tiene como objetivo destacar los antecedentes históricos de la entidad, su frecuencia, la clínica y las exploraciones complementarias. Al mismo tiempo, establecer las bases para el diagnóstico anatomopatológico y enfatizar la necesidad de identificar diversos tipos histológicos. Se considera igualmente el diagnóstico diferencial con aquellos procesos que pueden prestarse a confusión. Se presenta la clasificación de Van Nuys como base para establecer las diversas modalidades de tratamiento.
PALABRAS CLAVE
Carcinoma in situ ductal; Mama; Microcalcificaciones.
ABSTRACT
Ductal carcinoma in situ of the breast has been recognized as a disease that can be identified radiographically not only by means of structural changes of the parenchyma but specially when microcalcifications are found. On the other hand, several histologic types have prompted a classification with implications in the treatment of the disease. This review has the purpose to bring out the historical background, the frequency, clinical findings an the explorations needed. At the same time reviews the basis for the pathological diagnosis, with emphasis in the identification of the diverse histological types. Those lesions that should be included in the differential diagnosis are also commented upon. Classification of Van Nuys is followed as the basis for the different forms of treatment.
KEY WORDS
Ductal carcinoma in situ; Breast; Microcalcifications.
INTRODUCCION
El carcinoma ductal in situ (CDIS) de la glándula mamaria constituye una modalidad de tumor maligno caracterizada por una proliferación de células epiteliales en el interior de los conductos galactóforos. Se trata de una lesión limitada por una membrana basal cuya arquitectura y características citológicas son variables(1-6). Su extensión (uni o multifocal), su distribución (continua o discontinua) y su tamaño, varían de una lesión a otra(7).
Así como la mayoría de los casos se encuentran en asociación con carcinoma ductal infiltrante, hay neoplasias puramente intraductales cuyo reconocimiento se ha visto facilitado por el diagnóstico cada vez más temprano de las lesiones proliferativas de la mama. Con el empleo de la mamografía como método de despistaje, el hallazgo de marcadores de lesión incipiente (principalmente microcalcificaciones), ha permitido escindirlas quirúrgicamente y ha puesto a disposición de los patólogos un espectro morfológico diferente al que se le ofrecía con anterioridad(8). Además de los problemas con el diagnóstico diferencial entre CDIS e hiperplasia ductal atípica, se han establecido aquellas variables que sirven de base para el tratamiento definitivo y orientan en su valoración pronóstica(4,9).
En nuestra experiencia de un total de 825 carcinomas ductales infiltrantes (en un período de siete años), 388 se asociaron a CDIS (47%). Otros 84 fueron diagnósticados como sólo CDIS lo cual representa un 9,1% del total de neoplasias ductales malignas. La incidencia aumenta desde un 3,2% en el año 1990 hasta el 15,7% en el momento actual. En un 79% de estos casos se constataron microcalcificaciones en el estudio histopatológico.
Hay que destacar que nuestro Centro es punto de referencia en patología mamaria y por lo tanto el porcentaje de CDIS esta sesgado por el cáncer avanzado que se recibe de otros sitios. Hemos constatado que durante los años 1996 y 1997 entre las pacientes de nuestra consulta sometidas a control mamario mediante mamografía bienal a partir de los 40 años y anual a partir de los 50 se encuentran un total de 67 cánceres nuevos siendo el porcentaje de CDIS del 20,8%, cifras comparables a la de otros autores(4).
ANTECEDENTES HISTORICOS
Es lógico suponer que el reconocimiento del CDIS como una entidad con peso propio está íntimamente vinculada al momento en que comenzaron a estudiarse sistemáticamente las piezas resecadas por los cirujanos (segundo cuarto del presente siglo y principalmente en los EE.UU.)(10). Hasta bien entrado el siglo XX los propios cirujanos eran los encargados de estudiar macroscópicamente la lesión mamaria durante el acto operatorio, decidir sobre su naturaleza (benigna o maligna) y proceder en consecuencia.
No fue hasta el inicio de la década de los 20 cuando se comenzó a reconocer la necesidad de fundamentar los diagnósticos de las lesiones mamarias peoperatoriamente mediante cortes congelados(11). De hecho, la disponibilidad de patólogos encargados de hacer los estudios puso en evidencia las limitaciones del diagnóstico hecho por el cirujano sin el recurso del estudio microscópico(12). Se tomó conciencia de los errores de interpretación (en más o en menos) y sus consecuencias para las pacientes.
Las primeras descripciones de CDIS datan de fines del siglo pasado y tienen un valor más bien anecdótico. En 1893 Bloodgood se refirió a un típico caso de comedocarcinoma mientras asistía a Halsted en el tratamiento de una lesión de apariencia maligna que dio salida a los comedones típicos de esta variedad de tumor(13).
El reconocimiento del CDIS como una entidad, se fundamentó en las descripciones de numerosos autores(14-17). Muir(18) fue el primero en emplear el término carcinoma intraductal, aunque unos años antes ya Broders(19) lo incluyó como un ejemplo de carcinoma in situ. Es necesario reconocer que fue la aparición de la primera edición del fascículo sobre tumores de la mama publicado por el Instituto de Patología de las Fuerzas Armadas en Washington lo que sirvió para divulgar el término CDIS(20). Su autor, junto a su colega Foote en el Memorial Hospital for Cancer and Allied Diseases en Nueva York, disponían de un material excepcional producto del prestigio de la Institución en donde prestaban sus servicios como patólogos(21). No hay que olvidar que fue allí, así como en la Mayo Clinic, en donde se recopilaron los primeros datos fiables sobre el seguimiento y evolución de los pacientes con cáncer de mama.
Como prueba de la falta de criterios claros en la materia, bastaría citar que un autor del prestigio de Ackerman, uno de los pioneros de la patología quirúrgica, durante la década de los 50, y aún en los 60, se mostraba escéptico sobre la malignidad de todas aquellas lesiones intraductales que no estuvieran enmarcadas dentro de los casos de comedocarcinoma y carcinoma papilar ilustrados en su libro(10,22). Haagensen en 1986(23) siguiendo la clasificación de Stout, aún consideraba como CDIS aquellos carcinomas con menos de un 50% de tumor infiltrante.
Una vez reconocido el CDIS como una entidad anatomopatológica se han publicado contribuciones sobre el diagnóstico diferencial con la hiperplasia atípica del revestimiento ductal, particularmente entre estas últimas y el tipo no-comedo de CDIS(24). Por otra parte se han llevado a cabo estudios para resaltar las dificultades que ofrece el tema cuando se compara el diagnóstico de una misma lesión en manos de diferentes observadores, todos ellos patólogos expertos en lesiones mamarias. En el estudio de Rosai(25), sus resultados fueron presentados con el título de lesiones epiteliales limítrofes («borderline») para destacar la falta de acuerdo en algunas de las lesiones: lo que para unos era hiperplasia no atípica del epitelio de revestimiento ductal, para otros si era atípica y viceversa. De igual forma, lo que algunos consideraron CDIS, otros llamaron hiperplasia atípica y viceversa. En otro estudio similar en el cual se facilitaron previamente los criterios diagnósticos establecidos por Page(26), se comprobó que es posible lograr un alto grado de concordancia mediante la aplicación estricta de estos criterios; después del análisis estadístico se concluyó que ningún patólogo resultó más maligno o benigno que los demás al no existir unificación en los patrones diagnósticos. Este no fue el caso del estudio de Rosai en el cual se encontraron discrepancias notables. Estas imprecisiones se han ido clarificando y en los años subsiguientes los patólogos han ido aprendiendo a reconocer las sutilezas de CDIS, sus variaciones y lo que significa para los otros especialistas encargados del estudio de la mama.
En los años 80 se reconoce una modalidad de asociación entre CDIS y carcinoma infiltrante capaz de explicar el mayor riesgo de recurrencia en los pacientes tratados con cirugía conservadora y radioterapia(27). El denominado carcinoma infiltrante con un componente intraductal extenso (CIE) que consiste o bien en la presencia de CDIS en más del 25% del tumor infiltrante con compromiso de conductos en la periferia o bien en una lesión predominantemente in situ, con focos microscópicos de infiltración. Aunque inicialmente se consideró como una indicación formal de mastectomía debido a un mayor riesgo de recidiva, hoy en día, si se cumplen ciertas premisas (margen adecuado), se tiende a tratar nuevamente con cirugía conservadora(28). El mayor riesgo de recidiva era atribuido a la existencia de focos de cáncer in situ más allá del borde de resección(29).
En la última década, el reconocimiento de la heterogenicidad de las lesiones individuales en el cáncer ductal in situ(30,31) ha llevado a la propuesta de nuevas clasificaciones(8) y a la integración de variables con valor pronóstico(9,32). Este nuevo enfoque, conocido como la clasificación de Van Nuys, en recuerdo de la localidad californiana en donde tuvo lugar la reunión de consenso, tomó en cuenta el tamaño del tumor, la distancia al margen y la clasificación anatomopatológica. Este enfoque ha servido de base para establecer la posibilidad del tratamiento quirúrgico conservador del CDIS. De cualquier manera se continúa a la espera de más estudios para validar con rigor estas propuestas(33).
FRECUENCIA
En el pasado, el carcinoma in situ de la glándula mamaria se consideraba una lesión poco frecuente (menos del 5% de todas las neoplasias malignas)(34). Resulta fácil entender que con el advenimiento de exploraciones complementarias capaces de detectar lesiones en etapas evolutivas más tempranas, aunado a la favorable acogida de las campañas de despistaje con participación de la población femenina en edades con mayor riesgo, se haya producido un incremento real del número de casos con CDIS.
La incidencia de CDIS de la mama ha aumentado considerablemente desde 1983(35). Tal como hemos mencionado, este incremento se correlaciona con la utilización de la mamografía. En los EE.UU. el número total estimado de pacientes con CDIS en el año 1992, resultó 200 veces superior al esperado si se hubiese calculado tomando en cuenta su frecuencia diez años antes. Así como este screening ha resultado beneficioso para el diagnóstico más temprano del carcinoma infiltrante, su efecto en la evolución del CDIS aún no se conoce. De momento se requieren ajustes en la terapia ya que se presume que en algunas áreas de los EE.UU. se utiliza la mastectomía como tratamiento de una forma indiscriminada.
Las mujeres menores de 35 años, en comparación con las premenopáusicas de mayor edad, tienen una tasa de incidencia más baja de CDIS, pero a la vez presentan carcinomas infiltrantes de mayor grado, en estadios más avanzados y con una sobrevida a los cinco años más pobre(36). Se concluye que las mujeres jóvenes tienen mayor riesgo de tener un cáncer mamario de mayor agresividad.
CLÍNICA Y EXPLORACIONES COMPLEMENTARIAS
El CDIS usualmente se presenta como una lesión no palpable que se reconoce por anormalidades mamográficas, o que se descubre incidentalmente en una biopsia mamaria realizada para precisar la naturaleza de una lesión palpable o por cambios radiológicos o ecográficos de naturaleza indefinida.
Deben reconocerse además modalidades que tienen que ver con su tamaño y localización. No es lo mismo una pequeña lesión no palpable de localización central, con secreción anormal a través del pezón, que una lesión multifocal comprometiendo numerosos conductos de diversos cuadrantes, o el caso de una lesión que se presenta como una masa palpable única y de límites relativamente bien definidos.
Hoy en día la mayoría de los casos de CDIS se detectan mamográficamente y la edad media es de 50 años, 15 años menos que la de pacientes con carcinoma ductal infiltrante sin CDIS(37).
En cuanto a las exploraciones complementarias debe tomarse en cuenta lo que ya hemos señalado: en la práctica, el CDIS se presenta de diversas maneras, lo que quiere decir que los pasos que hay que dar para obtener la biopsia y proceder al estudio histopatológico dependen de cada paciente. Las formas puras de CDIS constituyen un grupo minoritario. La mayoría de carcinomas intraductales se asocian con grados variables de atipia del epitelio de revestimiento o coexisten con un carcinoma infiltrante. Más rara aún es la asociación con carcinoma lobulillar in situ (CLIS). No olvidar que tanto la cancerización lobulillar de un CDIS como la extensión pagetoide a conductos galactóforos terminales, pueden ser causa de confusión.
Es por ello que convendría de momento referirnos a las exploraciones que permiten detectar lesiones mamarias incipientes, pequeñas y presumiblemente en etapas evolutivas iniciales de la enfermedad neoplásica de la mama. Sin duda la mamografía constituye hoy en día un notable avance. Ello ha permitido detectar un mayor número de casos de CDIS (del 15% al 20% de todos los cánceres mamarios)(4).
La anormalidad mamográfica más comúnmente asociada con CDIS está constituida por las microcalcificaciones en forma de cúmulos de densidad cálcica, en número, localización y apariencia variable(38). Pueden ser redondas o lineales, con o sin ramificaciones, pudiendo existir patrones combinados. La forma, sus contornos, el hecho de que se agrupen y de que sean menores de 1 mm, se consideran como microcalcificaciones sospechosas. En otros casos lo que se toma en cuenta es la aparición de cambios en un control, habiendo modificación de las características de las calcificaciones detectadas en estudios previos. No olvidar que así como en ciertos tipos de CDIS los límites de la lesión encontrada histopatológicamente suelen coincidir con lo que se observa radiológicamente, en otros la lesión casi siempre se extiende más allá de lo que indica la mamografía.
Con los avances logrados e inclusive con el empleo combinado de métodos distintos como es el caso de la ecografía(39) o de la resonancia magnética tridimensional(40), no puede emitirse un dictamen concluyente. Lo importante es que se dispone de una alteración que constituye un marcador de lesión sospechosa que obliga profundizar su estudio.
Con menor frecuencia el CDIS se presenta como una masa de partes blandas con o sin microcalficaciones dispersas(41). En muchos de estos casos no se sospechaba el diagnóstico de cáncer in situ. También hay pacientes en las cuales el CDIS se expresa radiológicamente como una zona desestructurada de muy difícil interpretación.
DIAGNÓSTICO
La obtención de muestras para el diagnóstico de carcinoma in situ requiere de una guía para asegurar que el espécimen sea representativo. Con excepción de los casos poco frecuentes de CDIS nodular con masa palpable o identificados mediante ecografía, el resto requiere de un marcaje radiológico. El estudio citológico del producto de una punción con aguja fina permite el diagnóstico de cáncer pero tiene algunas limitaciones. En primer lugar no siempre el material es suficiente, por otra parte se requiere de un personal bien entrenado y finalmente cuando se logran ver células tumorales malignas resulta muy difícil si no imposible discriminar entre CDIS o carcinoma infiltrante(42).
Exceptuando aquellos casos excepcionales de CDIS presentándose como una masa (palpable o no palpable) y en los cuales pueden obtenerse varios pequeños fragmentos cilíndricos mediante punción directa o dirigida (ecográficamente), se utiliza la biopsia estereotáxica(43-46). Está indicada para el diagnóstico de zonas desestructuradas de naturaleza incierta o cuando hay microcalcificaciones.
En el caso de microcalcificaciones es conveniente radiografiar los cilíndros obtenidos a fin de asegurarse de la existencia de las mismas(30). Este estudio lo completa e interpreta el propio radiólogo que ha efectuado la punción y al mismo tiempo debe tenerse presente que para encontrar microcalcificaciones en el estudio histopatológico a veces se requieren muchos cortes. En nuestra experiencia en un 45% de ocasiones éstas no se observan en las secciones histológicas habiendo sido previamente demostradas radiológicamente. También advertir que cuando las microcalcificaciones son de carbonato de calcio se identifican fácilmente en las preparaciones teñidas con hematoxilina y eosina. Por el contrario cuando son de oxalato de calcio deben buscarse haciendo uso de su refringencia o de la capacidad para variar el plano de la luz polarizada.
La biopsia escisional, requiere de marcaje radiológico mediante arpón metálico. En todo caso, después de la fijación, cuando se trata de microcalcificaiones, es conveniente radiografiar los fragmentos tisulares y seleccionar aquellos que las contengan. El marcaje con tinta china facilita la delimitación del margen de resección permitiendo establecer si la lesión llega hasta el mismo. En CDIS destacan el hallazgo de microcalcificaciones «amorfas» en asociación con CDIS poco diferenciado, en contraposición con microcalcificaciones laminadas y cristalinas en los tipos de CDIS bien diferenciados.
ANATOMÍA PATOLÓGICA
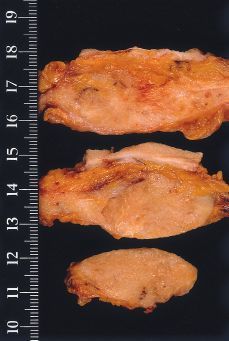
Alteraciones macroscópicas (Figs. 1 y 2). Hoy en día, con el empleo de la mamografía y la utilización de las microcalcificaciones como marcadores de lesión, la mayoría de los carcinomas intraductales no cursan con alteraciones macroscópicas significativas. En CDIS con necrosis y en los de configuración nodular, pueden observarse cambios detectables a simple vista. En el primero, se destacan conductos prominentes que dan salida a comedones de una forma espontánea o a la expresión manual; en los segundos, se aprecia una zona aumentada de consistencia cuyos contornos no son del todo precisos. No olvidar que estas alteraciones pueden ser multifocales y estar ubicadas en cuadrantes diferentes.
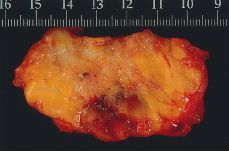
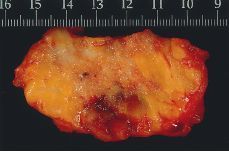
Figura 1.CDIS. Superficie de corte de apariencia irregularmente granular con evidencias de afectación del margen de resección.
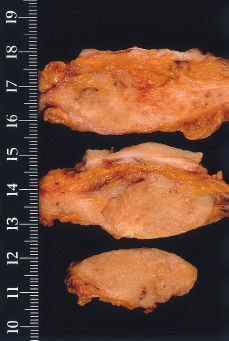
Figura 2.CDIS. Apariencia macroscópica de la superficie de corte de una lesión nodular relativamente bien circunscrita y parcialmente cubierta por piel indemne.
Alteraciones microscópicas. El diagnóstico de CDIS se fundamenta en el reconocimiento de alteraciones citológicas y arquitecturales de diverso tipo. En las lesiones incipientes, no siempre resulta fácil diferenciarlo de una hiperplasia ductal atípica. En cambio en las modalidades poco diferenciadas, con acentuado pleomorfismo celular y numerosas mitosis, para sólo citar el extremo opuesto, su reconocimiento no ofrece dificultades(3,5,8,47-49).
Variedades. Dependen de la forma como se disponen las células (patrón arquitectural) y de su grado de diferenciación. Se distinguen las siguientes:
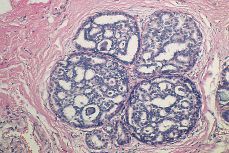
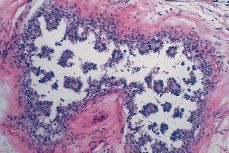
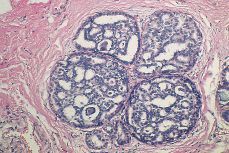
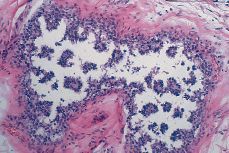
Cribiforme. La proliferación celular suele ser monomórfica, exhibiendo una buena polarización. Las células se disponen a modo de una criba (Fig. 3) y las luces secundarias son redondas u ovoides, limitadas por células cilíndricas o cúbicas con núcleos basales. Hay escasa actividad mitótica. Cuando se distingue una luz principal, ésta usualmente se encuentra desprovista de células necróticas. En algunos casos de CDIS cribiforme el grado de diferenciación es intermedio pudiéndose observar material necrótico intraluminal. Ello no justifica el diagnóstico de comedocarcinoma. De cualquier forma las mitosis son escasas y no se aprecia ni necrosis unicelular, ni autofagocitosis.
Figura 3.CDIS. Apariencia microscópica a menor aumento de una variedad cribiforme (de bajo grado sin necrosis). Nótese el contorno redondeado con indemnidad de la membrana basal.
Puede haber casos en los cuales se destaca una proliferación celular formando arcadas a manera de «puentes romanos» en cuyo caso la luz es más amplia. En contraste, hay otros en los cuales la proliferación llena la totalidad del conducto a modo de roseta.
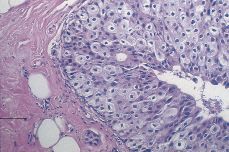
Variedad sólida. La proliferación de las células neoplásicas llena el conducto (Fig. 4) sin formación de luces secundarias, aunque comúnmente se presentan combinaciones con la variedad cribiforme y por tanto hay imágenes de transición. En general se trata de proliferaciones celulares de bajo grado.
Figura 4.CDIS. Variedad sólida de una lesión de bajo grado sin necrosis. Nótese la uniformidad en la configuración, tamaño y afinidad cromática de los núcleos.
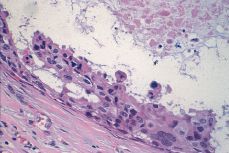
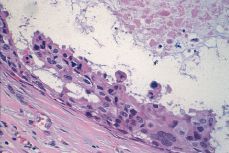
Comedocarcinoma. Se caracteriza por la presencia de necrosis, considerable atípia citológica y pérdida de la cohesión entre las células neoplásicas (Fig. 5). La necrosis no sólo está representada por el contenido de la luz y usualmente en íntima vinculación con microcalcificaciones, sino que en medio de la neoplasia, hay necrosis individual y autofagocitosis.
Figura 5.CDIS. Detalle de una parte del revestimiento ductal constituido por células neoplásicas con pérdida de la polaridad y marcado pleomorfismo. En la luz se aprecia necrosis. Los cambios son característicos de una lesión ductal in situ de alto grado con necrosis («comedocarcinoma»).
La atipia citológica consiste en un incremento del volumen celular. Los núcleos muestran considerable variación en su forma, tamaño y afinidad cromática. Su contorno es irregular y la cromatina es grumosa. Los nucléolos, únicos o múltiples, son prominentes y aparecen ubicados en la vecindad de la membrana nuclear.
Los conductos con comedocarcinoma pueden estar considerablemente aumentados de diámetro y su pared engrosada y fibrótica, rodeada por infiltrado linfocitario. Cuando hay cancerización lobulillar, es decir cuando las células de un CDIS que afecta el conducto terminal se extienden y sustituyen a las células del revestimiento alveolar del lobulillo, o en la enfermedad de Paget del pezón con tumor subyacente, el comedocarcinoma es la variedad que se encuentra con mayor frecuencia.
Variedad papilar. En el carcinoma papilar in situ se cumplen los criterios de lesión arborescente con un eje conjuntivo vascular en la mayoría de casos afectando a un sólo conducto galactóforo de gran tamaño. El patrón de la proliferación epitelial es variable: incremento de la estratificación, disposición cribiforme, formación de rosetas o micropapilas. Aunque suelen encontrarse un buen número de mitosis, las células neoplásicas tienden a ser de configuración y tamaño uniformes. Esa monotonía puede prestarse a confusión con una lesión no maligna y por lo tanto es útil comprobar la ausencia de células mioepiteliales para dar soporte al diagnóstico de malignidad.
Cuando no se tiene suficiente experiencia y en los casos de dictamen dudoso, el diagnóstico de este tipo de lesiones se enriquece con el empleo de marcadores inmunohistoquímicos. Tanto la actina como la proteína S-100 (especialmente de una manera combinada) sirven para identificar con mayor propiedad las células mioepiteliales. Debe tenerse presente que la actina sola, se expresa en las paredes de los vasos simulando inmunoreactividad en las células adyacentes y se presta a interpretaciones equívocas.
Es necesario considerar que el carcinoma papilar intraductal puede cursar con papilomatosis múltiple benigna o atípica. Quiere decir que en lesiones múltiples, deben valorarse individualmente cada una de las lesiones.
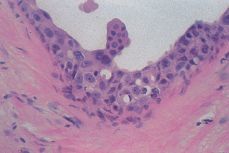
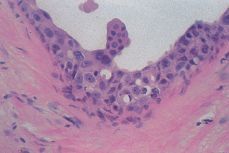
Variedad micropapilar. En esta modalidad de CDIS la proliferación de células epiteliales forma botones o papilas desprovistas de un eje conjuntivo vascular (Fig. 6). En la mayoría de los casos se trata de células bien diferenciadas que conservan la polaridad, hay escaso pleomorfismo y pocas mitosis. Debe sin embargo tenerse presente que puede haber lesiones con marcada atipia celular e inclusive desprendimiento de conglomerados que aparecen a la deriva, libres en el interior de la luz ductal. Como estos casos se apartan de la variedad convencional se conocen como variedad «pseudomicropapilar».
Figura 6.CDIS. Conducto galactóforo con engrosamiento de su pared y una proliferación de células neoplásicas que corresponde a un carcinoma micropapilar.
«Clinging». Este término propuesto por Azzopardi(50) no es aceptado por todos. La proliferación celular atípica se dispone en la pared de conductos que conservan una luz amplia y dan la sensación de haber quedado colgadas. No debe confundirse con hiperplasia ductal atípica. Cuando la lesión es poco diferenciada y hay marcada atipia, en otros planos de sección de la misma lesión, se encuentran alteraciones propias de un comedocarcinoma. La justificación para conservar el nombre de esta variante estriba en mantener la atención del patólogo y alertarle para que tenga en cuenta el diagnóstico de CDIS aún en presencia de una población celular más bien escasa pero de innegable estirpe tumoral, afectando conductos con una luz amplia y desprovista de contenido necrótico.
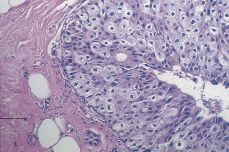
Variedades infrecuentes. Las variedades de CDIS apocrino (Fig. 7), de células claras, de células en anillo de sello y con diferenciación neuroendocrina son excepcionales. Su diagnóstico se fundamenta en atributos citoplasmáticos: citoplasma granular y eosinófilo (variedad apocrina), citoplasma claro (variante de células claras), vacuolización citoplasmática con aplanamiento y rechazo nuclear hacia la periferia de la célula (variante de células en anillo de sello). La mayoría de estos casos excepcionales tienen un patrón cribiforme, sólido o papilar.
Figura 7.CDIS. Detalle de la proliferación celular en un carcinoma in situ de la variedad apocrina. Nótese la eosinofilia citoplasmática.
Recientemente Tsang y cols.(51) han recopilado una serie de 34 pacientes con la variedad de carcinoma ductal in situ endocrino. Consiste en una proliferación intraductal predominantemente sólida y de bajo grado y las células neoplásicas expresan marcadores neuroendocrinos (cromogranina A, sinaptofisina y enolasa neuronal específica en combinaciones variables).
Esta terminología diagnóstica para calificar a las diversas modalidades de CDIS ha sido utilizada durante muchos años por la mayoría de los patólogos. Recientemente se han propuesto dos nuevas clasificaciones. La de Holland y cols(8) y la de Silverstein y cols.(32). En ambas se pretende establecer parámetros morfológicos con significación pronóstica.
La de Holland y cols.(8) (tabla 1) se fundamenta primariamente en la diferenciación citonuclear y secundariamente en la diferenciación arquitectural (polarización celular). Se distinguen tres categorías:
Tabla 1 Clasificación del carcinoma intraductal-Holland y cols. 1994(8) | |||
| Bien diferenciado | Moderadamente diferenciado | Pobremente diferenciado | |
| HALLAZGOS HISTOLOGICOS | |||
| PRINCIPALES | |||
| Núcleo | Monomorfismo | Pleomorfismo + | Pleomorfismo+++ |
| Cromatina | Uniforme y fina | Fina-grosera | Grosera |
| Nucléolo | Insignificante | Evidente | Prominente |
| Mitosis | Raras | Presentes ocasionalmente | Habituales |
| SECUNDARIOS | |||
| Diferenciación arquitectural (polaridad celular) | Marcada | Presente (es el principal punto de diferencia con el PD) | Ausente o mínima |
| HALLAZGOS ASOCIADOS | |||
| Necrosis central | Ausente o mínima (la presencia de necrosis no excluye esta categoría) | Variable | Habitualmente presente y prominente |
| Necrosis celular individual y autofagocitosis | Ausente | Variable | Habitualmente presente |
| Patrón de crecimiento | Cribiforme/micropapilar/ clinging/ raramente sólido | Cualquier patrón | Sólido/clinging/ pseudo-micropapilar/ pseudo- cribiforme |
| Calcificaciones | Laminadas/psamomatosas/ raramente amorfas | Amorfas o laminadas | Amorfas |
| Carcinoma asociado | Grado I | Grado II | Grado II ó III |
| La coexistencia de varios patrones en distintas áreas es poco frecuente aunque posible. Suele ser BD-MD ó MD-PD. La asociación BD-PD es infrecuente. En estos casos se diagnostica el peor diferenciado aunque no sea mayoritario. | |||
| Tipos especiales de CID no incluidos en la clasificación: Endocrino, apocrino, mucinoso, células en anillo de sello e hipersecretor. | |||
El CDIS poco diferenciado esta compuesto por células pleomórficas con núcleos irregularmente espaciados, abundante cromatina en grumos, nucléolos prominentes y numerosas mitosis. La diferenciación arquitectural es mínima o ausente y los patrones de crecimiento son sólidos, comedo, pseudocribiforme y micropapilar (sin polarización celular). Suele haber necrosis y cuando hay microcalcificaciones éstas son amorfas.
El CDIS bien diferenciado está formado por una población celular monomórfica, con núcleos regularmente espaciados, con cromatina finamente dispersa, nucléolos poco evidentes y escasas mitosis. Las células muestran polarización pronunciada con orientación de sus extremos apicales hacia la luz, usualmente resultando en patrón cribiforme, micropapilar y «clinging». La necrosis es infrecuente y cuando hay microcalcificaciones suelen ser de tipo psamomatoso.
La categoría con diferenciación intermedia muestra cambios que no cumplen los criterios previamente expuestos. La necrosis y las microcalcificaciones pueden ocurrir y estas últimas pueden ser amorfas o psamomatosas.
Este enfoque(52) se superpone en términos generales con la gradación propuesta y utilizada por Tavassoli(5) quien califica las tres categorías como alto grado, grado moderado y bajo grado en equivalencia a los tumores poco diferenciados, medianamente diferenciados y bien diferenciados respectivamente.
Llombart y cols.(53), proponen clasificar el CDIS en tipo comedón y tipo no comedón, subclasificando este último en bien diferenciado, moderadamente diferenciado y pobremente diferenciado.
La clasificación propuesta por Silverstein y cols.(32) combina grado nuclear con la necrosis de tipo comedo. A fin de predecir la recurrencia clínica, no se consideran relevantes los patrones arquitecturales anteriormente descritos. Clasifica las lesiones en alto y bajo grado nuclear y estos últimos los subclasifica en función de que tengan o no necrosis intraluminal, distinguiéndose así tres grupos: Grupo 1 CDIS de bajo grado sin necrosis; Grupo 2 CDIS de bajo grado con necrosis y Grupo 3 CDIS de alto grado.
Índice pronóstico de Van Nuys(9). Ante la evidencia de que el carcinoma ductal in situ muy probablemente incluye variedades con un riesgo de recurrencia local y significación pronóstica diferentes, el grupo de Silverstein en Van Nuys, California (EE.UU.), ha propuesto un índice pronóstico con intenciones terapéuticas. Se fundamenta en la premisa de que la mastectomía es una terapéutica excesiva para un grupo de pacientes y que el tratamiento conservador (con o sin radioterapia adyuvante) es insuficiente para evitar las recidivas locales. Se asigna un valor del 1 al 3 (tabla 2) a las siguientes variables: tamaño tumoral, distancia al margen y a dos parámetros morfológicos (grado nuclear y presencia o ausencia de necrosis).
Tabla 2 Clasificación de Van Nuys. Silverstein y cols. 1995(32) | ||||
| Puntuación | 1 | 2 | 3 | |
| Tamaño tumoral | Inferior o igual a 1,5 cm | 1,6-4 cm | Superior o igual a 4,1 cm | |
| Distancia al margen | Mayor o igual a 1 cm | 0,1-0,9 cm | Inferior a 0,1 cm | |
| Clasificación anatomopatológica | Bajo grado sin necrosis | Bajo grado con necrosis | Alto grado | |
| Puntuación 3 y 4 = sólo tratamiento local. Puntuación 5-7 = tratamiento local y radioterapia. Puntuación 8 y 9 = mastectomía. | ||||
GRADO NUCLEAR | ||||
| Núcleo | Grado 1 | Grado 2 | Grado 3 | |
| Tamaño | 1-1,5 veces un eritrocito | 1-2 veces un eritrocito | Superior a dos veces un eritrocito | |
| Cromatina | Difusa | Grosera | Vesicular | |
| Nucléolo | Inaparente | Infrecuente | Uno o más | |
| Grado nuclear 3: Alto grado; Grados nucleares 1 y 2: Bajo grado. | ||||
En las lesiones con valores bajos de 3 y 4 se comprobó una incidencia baja de recurrencias locales que no se modificó cuando se añadía radioterapia adyuvante. En el extremo opuesto, con valores de 8 y 9 se constató una alta incidencia de recurrencias con escasa variación al agregar radioterapia adyuvante. Los pacientes con valores intermedios de 5 a 7, tuvieron una evolución intermedia.
En concordancia con los resultados de Schnitt y cols.(33), el valor del Indice de Van Nuys debe ser probado en otros Centros y en especial debe esperarse un seguimiento más prolongado de las pacientes. No se trata de un verdadero índice y tiene limitaciones en la aplicación de los criterios morfológicos en manos de patólogos diferentes y a la vez problemas para establecer la distancia mínima de los márgenes, que por otra parte no son nuevos en carcinoma in situ. Existen también inconvenientes para establecer el tamaño. Cuando la lesión es pequeña y limitada a una preparación histológica, puede medirse con seguridad, pero cuando está presente en más de una preparación se requiere la evaluación de cortes múltiples y secuenciales.
En los casos de CDIS que vemos en nuestra práctica diaria, hemos decidido consignar en el informe anatomopatológico todas aquellas variables que permitan utilizar cualquiera de las clasificaciones. Mantenemos la terminología que se fundamenta en cambios arquitecturales (cribiforme, comedo, etc.) y consignamos el resto de los atributos citológicos (grado nuclear, índice mitótico), dimensiones, presencia o ausencia de necrosis, márgenes, lesiones asociadas, etc. tal como se ha consensuado recientemente(54).
DIAGNOSTICO DIFERENCIAL
Hay tres situaciones en las cuales se plantea el diagnóstico diferencial:
Hiperplasia atípica vs carcinoma in situ.
Carcinoma ductal in situ vs carcinoma lobulillar in situ.
Carcinoma ductal in situ vs carcinoma microinfiltrante.
En todas estas situaciones lo ideal es disponer de múltiples cortes histológicos y en casos de persistir la duda, debe preferirse la utilización de término más «benigno» o si se prefiere más «conservador».
Hiperplasia atípica vs carcinoma in situ. En la hiperplasia intraductal atípica se observan cambios citológicos y arquitecturales que la distinguen de la hiperplasia intraductal convencional(55,56). Las células que proliferan tienen tendencia a ser más uniformes, o redondeadas. Hay ligero incremento de la relación nucleocitoplasmática y los núcleos son redondeados. Con frecuencia se aprecian núcleos equidistantes dispuestos en rosetas. La arquitectura puede ser similar a lo descrito previamente en hiperplasia sin atipia o tener un patrón cribiforme o papilar de extensión variable.
Cuando se da el caso de que los cambios corresponden a los de un carcinoma ductal in situ, continuará aplicándose el término de hiperplasia intraductal atípica cuando el diámetro de un corte transversal del conducto (o la suma de varios conductos menores) no exceda 2 mm. Este límite arbitrario es utilizado por varios autores(1,56) después de haber concluido que en lesiones tan pequeñas no hay certeza para un dictamen concluyente de cáncer ductal in situ.
Carcinoma ductal in situ vs carcinoma lobulillar in situ. En las modalidades de CDIS con crecimiento sólido que se confunden con CLIS, la presencia de pequeñas luces secundarias, el mayor tamaño celular, la disposición en roseta de los núcleos con cierto grado de anisocariosis y la buena demarcación de los contornos celulares favorecen el origen ductal.
A favor del origen lobulillar se destaca el tamaño más pequeño de las células, la proliferación oclusiva con patrón sólido y la existencia de luces o glóbulos de secreción intracitoplasmática. Es necesario advertir que esta distinción no es siempre fácil y en la práctica, el dictamen depende de cada observador.
Carcinoma ductal in situ vs carcinoma microinfiltrante. Esta disyuntiva es particularmente significativa en los comedocarcinomas. La microinfiltración implica disrupción de la membrana basal y crecimiento de las células neoplásicas en el estroma mamario adyacente. Se considera como microinfiltrante cuando la profundidad de penetración es inferior a 0,1 cm(57). Debe distinguirse de la imagen que se obtiene cuando se examinan cortes tangenciales en el inicio de ramificaciones del árbol ductal. La cancerización lobulillar puede inducir en ocasiones a un falso diagnóstico de infiltración.
En la práctica la utilización de coloraciones especiales, histoquímicas (PAS, reticulina) o inmunohistoquímicas (Colágeno tipo IV, laminina) para detectar con mayor precisión la discontinuidad de la membrana basal no ha demostrado ser de utilidad.
TRATAMIENTO
El tratamiento del CDIS se basa fundamentalmente en la exéresis quirúrgica coadyuvada o no por la radioterapia. El planteamiento se basa principalmente en factores locales ya que comparativamente los tres métodos básicos, la exéresis con o sin radioterapia y la mastectomía poseen una supervivencia global semejante que es superior al 90% a los 10 años y por encima del 70% a los 20 años, mientras que la supervivencia libre de enfermedad a los 20 años es para la mastectomía del 74,5%, para la excisión con radioterapia del 63,3% y para la excisión sola del 46,8%(58).
Solamente biopsia escisional: hoy en día se dispone del seguimiento a largo plazo de varias series resultando evidente que se trata de un procedimiento insuficiente(59-63).
Tumorectomía sin tratamiento adyuvante: también ha resultado ser insuficiente (sobre todo en lesiones mayores de 2,5 cm) debido a los riesgos que se consignan en el siguiente apartado.
Tumorectomía seguida de radioterapia: esta alternativa se fundamenta en el trabajo publicado por Lagios y cols.(64). En un muestreo exhaustivo de piezas de mastectomía con CDIS menor de 2,5 cm, el riesgo de multicentricidad y de carcinoma infiltrante oculto resultó mucho menor en comparación con lesiones mayores de 2,5 cm. Estos hallazgos sirvieron de base para la terapia conservadora. Deben sin embargo excluirse los casos de CDIS micropapilar (sin necrosis) ya que tienen una mayor probabilidad de afectar varios cuadrantes(2,47).
Tumorectomía sin radioterapia: Para valorar en aquellos casos de CDIS de bajo grado.
Mastectomía (simple o con lifadenectomía axilar del primer nivel): tratamiento de elección en lesiones extensas y en CDIS micropapilar. La inclusión de los ganglios linfáticos del primer nivel es el resultado de su accesibilidad en el curso de la intervención quirúrgica y de esa manera cubrir la eventualidad de un pequeño foco inadvertido de cáncer infiltrante con metástasis. Los focos de microinfiltración se encuentran hasta en un 48% de casos en los que la lesión muestra un tamaño considerable(64) y las metástasis ganglionares pueden detectarse en un 1-2% de los casos(50).
En una revisión de la literatura comparando los resultados del tratamiento quirúrgico del CDIS con cirugía conservadora seguida o no de radioterapia vs mastectomía (controles a los 10 y 20 años), se concluye que la ligera disminución de la sobrevida utilizando tratamiento conservador, se compensa con el valor de la preservación de la mama(58). Se concluye por ello que el oncólogo está obligado a valorar las alternativas tomando en cuenta las preferencias de cada paciente.
En otro estudio comparativo que incluyó 300 pacientes con CDIS sin microinvasión, 167 mastectomizados y 133 tratados con tumorectomía y radioterapia, se apreciaron diferencias significativas en la sobrevida libre de enfermedad a los 10 años a favor de la mastectomía (98% vs 81%)(65). El análisis multivariante confirmó el grado nuclear como único factor predictivo de valor para la recurrencia local en pacientes tratadas conservadoramente. No se encontraron diferencias significativas en la sobrevida global entre ambos grupos. La recidiva de las lesiones de alto grado suele darse de forma más temprana a las de los otros tipos histológicos. Ello podría ser debido al mayor índice proliferativo de estas lesiones y al hecho de la mayor tendencia a producir depósitos de calcio lo cual hace que se detecten antes. Sin embargo parece ser que a larga data el índice de recidivas no varía en función del tipo histológico(66,67). Las recidivas locales aparecen principalmente cuando se emplean técnicas conservadoras, especialmente si no se realiza radioterapia adyuvante.
En una revisión de la literatura(62,67-96), cuando se emplea tratamiento escisional se encuentra un porcentaje promedio de recidivas del 18,63% (118 pacientes de 1.009); cuando se añade radioterapia la cifra de recidivas baja al 8,57% (87 pacientes de 1.015). En el caso de mastectomía, como es de esperar, el riesgo de recidiva es del 2,44% (35 pacientes de 1.432).
Es interesante observar que las recidivas que se producen son con frecuencia carcinomas invasores lo que evidentemente puede empeorar el pronóstico y obligar a cambiar la estrategia de tratamiento. Así en la revisión de la literatura observamos un 47,43% de carcinomas invasores entre las recidivas tras excisión sola, un 64,18% tras excisión y radioterapia y un 41,67% tras mastectomías. Estos sorprendentes resultados matizan la aplicación de la radioterapia en todos los casos de tratamiento conservador e inducen a pensar en una menor eficacia de la radioterapia en los CDIS frente a los invasores(75).
Por otra parte otros factores que pueden modificar el tratamiento dependen de las características tumorales como son la multicentricidad, y la presencia de características histológicas de comedocarcinoma. En el primer caso la imposibilidad de exéresis sin dejar tejido tumoral impide un tratamiento conservador y en el segundo la posibilidad de encontrar invasión es elevada sobre todo si es extenso 63% para Patchefsky(2), 19% para Silverstein(84) y 42% para Simpson(91).
Con la intención de objetivar criterios a veces sujetos a excesiva subjetividad se elaboró bajo la dirección de Silverstein un índice pronóstico denominado de Van Nuys y en el que se incluye el tamaño de la zona afectada, la distancia desde el tumor a los bordes de resección y el tipo histológico(32). La valoración obtenida tras evaluar los datos requeridos determinan el tipo de tratamiento que se debe realizar. En nuestro medio Zornoza y cols.(97) han aplicado estos criterios en una parte de su casuística.
EVOLUCIÓN Y PRONÓSTICO (SIGNIFICACIÓN BIOLÓGICA Y POTENCIAL MALIGNO)
La progresión del CDIS hacia carcinoma infiltrante es difícil de estudiar por varias razones:
Hasta hace pocos años la mayoría de las pacientes con CDIS eran mastectomizadas eliminándose la posibilidad de estudiar la historia natural de la enfermedad.
Cuando se toma como punto de partida aquellos casos en los cuales solamente se practicó una biopsia escisional, nos encontramos con una muestra muy reducida y en la mayoría de esos casos se desconoce realmente la extensión y a veces tampoco se precisan detalles del tipo y grado histológico.
Cuando se considera globalmente el CDIS como una entidad clinicopatológica, debe discriminarse cuidadosamente el tamaño, multifocalidad y variedad histológica, excluyendo con seguridad microinfiltración o posible asociación con un carcinoma infiltrante oculto.
Los criterios para el diagnóstico diferencial entre hiperplasia atípica del epitelio de revestimiento ductal y CDIS de bajo grado sin necrosis están sujetos a imprecisiones notables, aún en manos de patólogos expertos.
Todo ello dificulta considerablemente el diseño de un estudio prospectivo controlado ya que ante una lesión neoplásica, el desideratum consiste en ofrecer un tratamiento curativo. Por otra parte parece razonable poner en duda la afirmación de que el CDIS progresa inevitablemente hacia carcinoma infiltrante.
Durante la vida de un individuo normal, la transformación a un fenotipo invasivo no ocurre inexorablemente(61). Por otra parte, si la transformación tiene lugar, su expresión tarda años e incluso décadas.
Hay diferencias sustanciales en la frecuencia de aparición del proceso: alta en comedocarcinoma y baja para el resto de los tipos(84,98). Por lo tanto la transformación de CDIS en carcinoma infiltrante es directamente proporcional al grado citológico del tumor(99,100).
Hay evidencias de que el CDIS no es en todos los casos la lesión precursora del carcinoma infiltrante de la mama. Sin embargo hay estudios que demuestran la progresión a cáncer infiltrante en aquellos casos tratados únicamente con biopsia incisional en un 28-53% de casos con una media de seguimiento de entre seis y nueve años(61,62).
La utilización de marcadores biológicos para diferenciar casos de CDIS con mayor riesgo de progresión, tiene limitaciones(10). El empleo de índices de replicación y de anormalidades oncogénicas no ayudan demasiado cuando se necesita, es decir, para diferenciar hiperplasia atípica de CDIS, aunque con ello se pretenda implicar los hallazgos en una decisión terapéutica.
Los esfuerzos en ese campo continúan. En una contribución reciente(101) se determinó inmunohistoquímicamente la expresión de c-erbB-2, proteína p53, receptores estrogénicos y de progesterona, pS2, catepsina D, proteína CD44 y MLuC5 (receptor de laminina 67-kDa). No se encontró una correlación estadísticamente significativa entre la expresión de estos marcadores biológicos y la evolución, aunque una vez más, resultó evidente que en el subgrupo de pacientes con CDIS de alto grado con necrosis, el pronóstico fue menos favorable.
Recientemente Gupta y cols.(102) han demostrado que en la mayoría de los casos de CDIS bien diferenciado constituye el precursor del cáncer infiltrante de bajo grado con un pronóstico a largo plazo más favorable. Sugieren que muchas de las características genéticas y biológicas en cáncer de mama se encuentran ya establecidas en los clonos de células malignas de la etapa preinvasiva.
BIBLIOGRAFIA
1 Lennington WJ, Jensen RA, Dalton LW, Page DL. Ductal carcinoma in situ of the breast. Heterogeneity of individual lesions. Cancer 1994;73:118-24.
2 Patchefsky AS, Schwarts GF, Finkelstein SD, Prestinoino A, Sohn SE,Singer JS, Feig SA. Heterogeneity of intraductal carcinoma of the breast. Cancer 1989;63:731-41.
3 Rogers LW, Carcinoma in situ (CIS). En Page DL, Anderson TJ, eds. Diagnostic histopathology of the breast. Edinburgh: Churchill Livingstone, 1987; p. 157-92.
4 Schnitt SJ, Silen W, Sadowsky NL, Connolly JL, Harris JR. Ductal carcinoma in situ (intraductal carcinoma) of the breast. New Engl J Med 1988;318:898-903.
5 Tavassoli FA. Intraductal carcinoma. En Tavassoli FA, ed. Pathology of the breast. Norwalk: Appleton & Lange; 1992; p. 229-61.
6 Silverstein MJ. Ductal carcinoma in situ of the breast. Baltimore: Williams and Wilkins; 1997.
7 Faverly DR, Burgers L, Bult P, Holland R. Three dimensional imaging of mammary ductal carcinoma in situ: clinical implications. Semin Diagn Pathol 1994;11:193-8.
8 Holland R, Peterse JL, Millis RR, Eusebi V, Faverly D, Van de Vijver MJ, Zafrani B. Ductal carcinoma in situ: a proposal for a new classification. Semin Diagn Pathol 1994;11:167-80.
9 Silverstein MJ, Lagios MD, Craig PH, Waisman JR, Lewinsky BS, Colburn WJ, Poller DN. A prognostic index for ductal carcinoma in situ of the breast. Cancer 1996;77:2267-74.
10 Fechner RE. One century of mammary carcinoma in situ. What have we learned. Am J Clin Pathol 1993;100:654-61.
11 Wright JR. The development of frozen section technique, the evolution of surgical biopsy, and the origins of surgical pathology. Bull Hist Med 1985;59:295-326.
12 Bloodgood JC. When cancer becomes a microscopic disease, there must be tissue diagnosis in the operating room. JAMA 1927;88:1022-3.
13 Bloodgood JC. Comedo carcinoma (or comedo-adenoma) of the female breast. Am J Cancer 1934;22:842-53.
14 MacCarty WC. The histogenesis of cancer (carcinoma) of the breast and its clinical significance. Surg Gynecol Obstet 1913;17:441-59.
15 Ewing J. Neoplastic diseases. A textbook on tumors. Philadelphia: WB Saunders Co; 1919.
16 Cheatle GL, Cutler M. Tumours of the breast. Philadelphia: JB Lippincott Co; 1931.
17 Stout AP. Human cancer. Etiological factors: precancerous lesions growth, spread, symptoms, diagnosis, prognosis, principals of treatment. Philadelphia: Lea & Febiger; 1932.
18 Muir R. The pathogenesis of Paget''s disease of the nipple and associated lesions. Br J Surg 1935;22:728-37.
19 Broders AC. Carcinoma in situ contrasted with benign penetrating epithelium. JAMA 1932;99:1670-4.
20 Stewart FW. Tumors of the breast. Atlas of tumor pathology. Fascicle 34, Washington, DC: Armed Forces Institute of Pathology; 1950.
21 Foote FW Jr, Stewart FW. Comparative studies of cancerous versus noncancerous breasts. Ann Surg 1945;121:6-53.
22 Ackerman LV. Surgical pathology. St. Louis: CV Mosby Co; 1953.
23 Haagensen CD. Diseases of the breast. Philadelphia: W B Saunders; 1986.
24 Kraus FT, Newbecker RD. The differential diagnosis of papillary tumors of the breast. Cancer 1962;15:444-55.
25 Rosai J. Borderline epithelial lesions of the breast. Am J Surg Pathol 1991;15:209-21.
26 Schnitt SJ, Conolly JL, Tavassoli FA, Fechner RE, Kempson RL, Gekman R, Page DL. Interobserver reproducibility in the diagnosis of ductal proliferative breast lesions using standardized criteria. Am J Surg Pathol 1992;16:1133-43.
27 Schnitt SJ, Connolly JL, Kettry U, Mazoujian G, Brenner M, Silver B, Recht A, Beadle G, Harris JR. Pathologic findings on re-excision of the primary site in breast cancer patients considered for treatment by primary radiation therapy. Cancer 1987;59:675-81.
28 Schnitt SJ, Abner A, Gelman R, Connolly JL, Recht A, Duda RB, Eberlein TJ, Mayzel K, Silver B, Harris JR. The relationship between microscopic margins of resection and the risk of local recurrence in patients with breast cancer treated with breast-conserving surgery and radiation therapy. Cancer 1994;74:1746-51.
29 Holland R, Connolly J, Gelman R, Mravunac M, Hendriks JH, Verbeek AL, Schnitt SJ, Silver B, Boyages J, Harris JR. The presence of an extensive intraductal component following a limited excision correlates with prominent residual disease in the remainder of the breast. J Clin Oncol 1990;8:113-8.
30 Liberman L, Evans WP, Dershaw DD, Hann LE, Deutch BM, Abramson AF, Rosen PP. Radiography of microcalcifications in stereotaxic mammary core biopsy specimens. Radiology 1994;190:223-5.
31 Rosen PP, Oberman HA. Tumors of the mammary gland. Atlas of tumor pathology. Washington DC: Armed Forces Institute of Pathology; 1993.
32 Silverstein MJ, Poller DN, Waisman JR, Colburn WJ, Barth A, Gierson ED, Lewinsky B, Gamagami P, Slamon DJ. Prognostic classification of breast ductal carcinoma in situ. Lancet 1995;345:1154-7.
33 Schnitt SJ, Harris JR, Smith BL. Developing a prognostic index for ductal carcinoma in situ of the breast. Cancer 1996;77:2189-92.
34 Schnitt SJ. In situ carcinoma. En Harris JR, Hellman S, Craig Henderson I, Kinne DW eds. Breast diseases. Philadelphia: JB Lippinicott Co., 1991:229-44.
35 Ernster VL, Barclay J, Kerlikowske K, Grady D, Henderson C. Incidence of and treatment for ductal carcinoma in situ of the breast. JAMA 1996;275:913-8.
36 Winchester DP, Osteen RT, Menck HR. The National Cancer Data Base report on breast carcinoma characteristics and outcome in relation to age. Cancer 1996;78:1838-43.
37 Wazer DE, Gage y, Homer MJ, Krosnick SH, Schmid C. Age-related differences in patients with nonpalpable breast carcinomas. Cancer 1996;78:1432-7.
38 Vega A, Garijo F. Radiología del carcinoma in situ (intraductal) de mama. Estudio de correlación radiopatológica. Rev Senología Patol Mam 1995;8:160-7.
39 Rickard MT. Ultrasound of malignant breast microcalcifications: role in evaluation and guided prodedures. Australia-Radiol 1996;40:26-31.
40 Soderstrom CE, Harms SE, Copit DS, Evans WP, Savino DA, Krakos PA, Farrell RS Jr., Flamig DP. Three-dimensional RODEO breast MR imaging of lesions containing ductal carcinoma in situ. Radiology 1996;201:427-32.
41 Stomper PC, Connolly JL, Meyer JE, Harris JA. Clinically occult carcinoma in situ detected with mammography: analysis of 100 cases with radiologic-pathologic correlation. Radiology 1989;172:235-41.
42 National Cancer Institutte Breast Fine Needle Aspiration Conference, Betehesda. The uniform approach to breast fine needle aspiration biopsy. A synopsis. Acta Cytol 1996;40:1120-6.
43 Jackman RJ, Nowels KW, Shepard MJ, Finkelstein SI, Marzoni FA. Stereotaxic large-core needle biopsy of 450 nonpalpable breast lesions with surgical correlation in lesions with cancer or atypical hyperplasia. Radiology 1994;193:91-5.
44 Cross MJ, Evans WP, Peters GN, Cheek JH, Jones RC, Krakos P. Stereotactic breast biopsy as an alternative to open excisional biopsy. Ann Surg Oncol 1995;2:195-200.
45 Yeoman LJ, Humphreys MS, Thomas DM, Henderson S, Nunnerley HB. Radiographically guided fine needle aspiration cytology and core biopsy in the assesment of impalpable breast lesions. The Breast J 1996;5:41-7.
46 Burbank F. Stereotaxic breast biopsy: Its history, its present, its future. Am Surg 1996;62:128-150.
47 Bellamy COC, McDonald C, Salter DM, Chetty U, Anderson TJ. Non-invasive ductal carcinoma of the breast: the relevance of histologic categorization. Hum Pathol 1993;24:16-23.
48 Bobrow LG, Happerfield LC, Gregory WM, Springall RD, Millis RR. The classification of ductal carcinoma in situ and its association with biological markers. Semin Diagn Pathol 1994;11:199-207.
49 Lagios MD. Duct carcinoma in situ. Pathology and treatment. Surg Clin North Am 1990;70:853-71.
50 Azzopardi JG. Problems in breast pathology. London: WB Saunders Co.; 1979.
51 Tsang WYW, Chan JKC. Endocrine ductal carcinoma in situ (E-DCIS) of the breast. Am J Surg Pathol 1996;20:921-43.
52 Millis RR. Classification of ductal carcinoma in situ of the breast. Adv Anat Pathol 1996;3:114-29.
53 Llombart A, Ruiz A. Carcinoma in situ de mama: Tipos histológicos y propuesta de clasificación. Rev Senología Patol Mam 1995;8:149-59.
54 Consensus conference on the classification of ductal carcinoma in situ. Cancer 1997;80:1798-802.
55 Page DL, Dupond WD, Rogers LW, Rados MS. Atypical hyperplastic lesions of the female breast. A long term follow-up study. Cancer 1985;55:2698-708.
56 Tavassoli FA, Norris HJ. A comparison of the results of long-term follow-up for atypical intraductal hyperplasia and intraductal hyperplasia of the breast. Cancer 1990;65:518-29.
57 Sobin LH, Wittekind Ch. TNM classification of malignant tumours. New York: Wiley-Liss, 1997:123-30.
58 Hillner BE, Desch CE, Carlson RW, Smith TJ, Esserman L, Bear HD. Trade-offs between survival and breast preservation for three initial treatments of ductal carcinoma in situ of the breast. J Cin Oncol 1996;14:70-7.
59 Lewis D, Geschickter CF. Comedocarcinoma of the breast. Arch Surg 1938;36:225-44.
60 Betsill WL, Rosen PP, Lieberman PH, Robbins GF. Intraductal carcinoma. Long-term follow-up after treatment by biopsy alone. JAMA 1978;239:1863-7.
61 Rosen PP, Braun DW Jr, Kinne DE. The clinical significance of of pre-invasive breast carcinoma. Cancer 1980;46:919-25.
62 Page DL, Dupond WD, Rogers LW, Landenberger M. Intraductal carcinoma of the breast: Follow-up after biopsy only. Cancer 1982;49:751-8.
63 Carter D, Orr SL, Merino MJ. Intracystic papillary carcinoma of the breast. After mastectomy, radiotherapy or excisional biopsy alone. Cancer 1983;52:14-9.
64 Lagios MD, Westdahl PR, Margolin FR, Rose MR. Duct carcinoma in situ. Relationship of extent of noninvasive disease to the frequency of occult invasion, multicentricity, lymph node metastases, and short term treatment failures. Cancer 1982;50:1309-14.
65 Silverstein MJ, Barth A, Poller DN, Gierson DE, Colburn WJ, Waisman JR, Gamagami P. Ten-year results comparing mastectomy to excision and radiation therapy for ductal carcinoma in situ of the breast. Eur J Cancer 1995;31A:1425-7.
66 Lagios MD. Ductal carcinoma in situ: Controversies in diagnosis, biology and treatment. The Breast J 1995;1:68-78.
67 Solin LJ, Yeh I, Kurtz J, Fourquet A, Recht A, Kuske R, McCormick B, Cross MA, Schultz DJ, Amalric R, LiVolsi VA, Kowalyshyn MJ, Torhorst J, Jacquemier J, Westermann CD, Mazoijian G, Zafrani B, Rosen PP, Goodman RL, Fowble BL. Ductal carcinoma in situ (intraductal carcinoma) of the breast treated with breast-conserving surgery and definitive irradiation. Correlación of pathologic parameters with outcome of treatment. Cancer 1993;71: 2532-42.
68 Farrow JH. Current concepts in the detection and treatment of the earliest of the early breast cancers. Cancer 1970;25:468-77.
69 Ashikari R, Hajdu SI, Robbins GF. Intraductal carcinoma of the breast (1960-1969). Cancer 1971;28:1182-7.
70 Carter D, Smith RRL. Carcinoma in situ of the breast. Cancer 1977;40:1189-93.
71 Montague ED. Conservation surgery and radiation therapy in the treatment of operable breast cancer. Cancer 1984;53:700-4.
72 Sunshine JA, Moseley HS, Fletcher WS, Krippaehne WW. Breast carcinoma in situ: A retrospective review of 112 cases with a minimum 10 year follow-up. Am J Surg 1985;150:44-51.
73 Recht A, Danoff BS, Solin LJ, Schnitt SJ, Connolly J, Botnick L, Goldberg I, Goodman RL, Harris JR. Intraductal carcinoma of the breast: results of treatment with excisional biopsy and radiation. J Clin Oncol 1985;3:1139-43.
74 Temple WJ, Jenkins M, Alexander F, Hwang WS, Marx LH, Lees AW, Williams HT, Pambrun MG. Natural history of in situ breast cancer in a defined population. Ann Surg 1989;210:653-7.
75 Howard PW, Locker AP, Dowle CS, Ellis IO, Elston CW, Blamey RW. In situ carcinoma of the breast Eur J Surg Oncol 1989;15:328-32.
76 Kinne DW, Petrek JA, Osborne MP, Fracchia AA, DePalo AA, Rosen PP. Breast carcinoma in situ. Arch Surg 1989;124:33-6.
77 Carpenter R, Boulter PS, Cooke T, Gibbs NM. Management of screen detected ductal carcinoma in situ of the female breast. Br J Surg 1989;76:564-7.
78 Arnesson LG, Smeds S, Fagerberg G, Grontoft O. Follow-up of two tretment modalities for ductal cancer in situ of the breast. Br J Surg 1989;76:672-5.
79 Kurtz JM, Jacquamier J, Torhorst J, Spitalier JM, Hamalric R, Hunig R, Walther E, Harder F, Almendral A, Brandone H y cols. Conservation therapy for breast cancer other than infiltrating ductal carcinoma. Cancer 1989;63:1630-5.
80 Lagios MD, Margolin FR, Westdahl PR, Rose MR. Mammographically detected duct carcinoma in situ: frecuency of local recurrence following tylectomy and prognostic effect of nuclear grade in local recurrence. Cancer 1989;63:618-24.
81 Gallagher WJ, Koerner FC, Wood WC. Treatment of intraductal carcinoma with limited surgery: long term follow-up. J Clin Oncol 1989;7:376-80.
82 Baird RM, Worth A, Hislop G. Recurrence after lumpectomy for comedo-type intraductal carcinoma of the breast. Am J Surg 1990;159:479-81.
83 Price P, Sinnett HD, Gusterson B, Walsh G, A''Hern RP, McKinna JA. Duct carcinoma in situ: predictors of local recurrence and progression in patients treated by surgery alone. Br J Cancer 1990;61:869-72.
84 Silverstein MJ, Waisman JR, Gamagami P, Gierson DE, Colburn WJ, Rosser RJ, Gordon PS, Lewinsky BS, Fingerhut A. Intraductal carcinoma of the breast (208 cases). Clinical factors influencing treatment choice. Cancer 1990;66:102-8.
85 Stotter AT, McNeese M, Oswald MJ, Ames FC, Romsdahl MM. The role of limited surgery with irradiation in primary treatment of ductal in situ breast cancer. Int J Radiat Oncol Biol Phys 1990;18:283-7.
86 McCormick B, Rosen PP, Kinne D, Cox L, Yahalom J. Duct carcinoma in situ of the breast: an analysis of local control after conservation surgery and radiotherapy. Int J Radiat Oncol Phys 1991;21:289-92.
87 Bornstein BA, Rect A, Connolly JL, Schnitt SJ, Cady B, Koufman C, Love S, Osteen RT, Harris JR. Results of treating ductal cacinoma in situ of the breast with conservative surgery and radiation therapy. Cancer 1991;67:7-13.
88 Graham MD, Lakhani S, Gaze JC. Breast conserving surgery in the management of in situ reast carcinoma. Eur J Surg Oncol 1991;17:258-64.
89 Ringberg A, Andersson I, Aspegren K, Linell F. Breast carcinoma in situ in 167 women. Mode of presentation, therapy and follow-up. Eur J Surg Oncol 1991;17:466-76.
90 Cutuli B, Teissie E, Piat JM, Janser JC, Renaud R, Rodier JF, Jung GM. Radical surgery and conservative treatment of ductal carcinoma in situ of the breast. 10 to 20 year follow-up. Arch Surg 1992;127:468-72.
91 Simpson T, Thirlby RC, Dail DH. Surgical treatment of ductal carcinoma in situ of the breast. 10 to 20-year follow-up. Arch-Surg. 1992;127:468-72.
92 Schwartz GF, Finkel GC, García JC, Patchefsky AS. Subclinical ductal carcinoma in situ of the breast: treatment by local excision and survillance alone. Cancer 1992;70:2468-74.
93 Silverstein MJ, Cohlan BF, Gierson ED, Gierson ED, Furmanski M, Gamagami P, Colburn WJ, Lewinsky BS, Waisman JR. Duct carcinoma in situ: 227 cases without microinvasion. Eur J Cancer 1992;28:630-4.
94 Griffin A, Frazee RC. Treatment of intraductal breast cancer noncomedo type. Am Surg 1993;59:106-9.
95 Fisher B, Constantino J, Carol Redmond PH, Fisher E, Margolese R, Dimitrov N, Wolkmark N, Wickerham DL, Deuttsch M, Ore L y cols. Lumpectomy compared with lumpectomy and radiation therapy for the reatment of intraductal breast cancer. N Engl J Med 1993;328:1581-6.
96 Sneige N, McNeese M, Atkinson EN, Atkinson EN, Ames FC, Kemp B, Sahin A, Ayala AG. Ductal carcinoma in situ treated with lumpectomy and irradiation: histopathological analysis of 49 specimens with emphasis on risk factors and long term results. Hum Pathol 1995;26:642-9.
97 Zornoza G, Espi A, Regueira FM, Nwose E, Sierra A, Zornoza A. Carcinoma intraductal: valoración de factores para la elección del tratamiento. Rev Senología Patol Mam 1997;10:224-8.
98 Eusebi V, Foschini MP, Cook MG, Berrino F, Azzopardi JG. Long-term follow-up of in situ carcinoma of the breast with special emphasis on clinging carcinoma. Sem Diagn Pathol 1989;6:165-73.
99 Moriya T, Silverberg SG. Intraductal carcinoma (ductal carcinoma in situ) of the breast. A comparison of pure noninvasive tumors with those including different proportions of infiltrating carcinoma. Cancer 1994;74:2972-8.
100 Lampejo OT, Barnes DM, Smith P, Millis RR. Evaluation of infiltrating ductal carcinomas with a DCIS component: Correlation of the histologic type of the in situ component with grade of the infiltrating component. Semin Diagn Pathol 1994;11:215-22.
101 Perin T, Canzonieri V, Massarut S, Bidoli E, Rossi C, Roncadin M, Carbone A. Immunohistochemical evaluation of multiple biological markers in ductal carcinoma in situ of the breast. Eur J Cancer 1996;32A:1148-55.
102 Gupta SK, Douglas-Jones AG, Fenn N, Morgan JM, Mansel RE. The clinical behavior of breast carcinoma is probably determined at the preinvasive satge (ductal carcinoma in situ). Cancer 1997;80:1740-5.