Ginecología
Factor de crecimiento epidérmico y factor transformador del crecimiento-* en la enfermedad macroquística de mama
Epidermal growth factor and growth transforming factor-*in macrocystic breast disease
A. J. Herruzo
J. A. Castilla1
C. Marcos2
A. Ramírez3
S. Menjón
Departamento de Obstetricia y Ginecología
1 Servicio de Análisis Clínicos
2 Servicio de Anatomía Patológica
3 Servicio de Medicina Nuclear. Hospital Universitario Virgen de las Nieves, Granada
Correspondencia:
A. Herruzo Nalda
Departamento de Obstetricia y Ginecología
Hospital Universitario Virgen de las Nieves
18014 Granada
Fecha de recepción: 31/8/98
Aceptado para publicación: 27/1/99
RESUMEN
Objetivo: Analizar el papel del factor de crecimiento epidérmico (EGF) y factor transformador del crecimiento-* (TGF-*) en la fisiopatología de la mastopatía fibroquística.
Sujetos y métodos: Se determinaron los niveles de factor de crecimiento epidérmico (EGF) y del factor transformador del crecimiento-* (TGF-*) y de diversas hormonas esteroideas (estradiol, testosterona total, sulfato de dihidroepiandrosterona (DHEAS) y 17-OH-progesterona) en 29 líquidos de macroquistes mamarios con una relación K+/Na+ < 3 y 25 líquidos de macroquistes mamarios con una relación K+/Na+ > 3.
Resultados: Los niveles intraquísticos de EGF se mostraron significativamente más elevados en los quistes de relación K+/Na+ > 3. Por lo que se refiere al TGF-* no pudo detectarse en ningún líquido de macroquistes mamarios. El análisis de regresión lineal múltiple paso a paso, que explica la variabilidad de los niveles de EGF en líquido quístico, incluyó como significativos: al Estradiol y DHEAS, con coeficiente de regresión positivo.
Conclusiones: Estos resultados sugieren que el EGF puede ser un elemento clave en la relación existente entre esteroides y proliferación celular en la mastopatía fibroquística.
PALABRAS CLAVE:
Factores de crecimiento; Enfermedad fibroquística de la mama.
SUMMARY
Objetive: To study the role of epidermal growth factor (EGF) and transforming growth factor-* (TGF-*) in the physiopathology of fibrocystic breast disease.
Patients and methods: The concentration of EGF and TGF-* and steroid hormones (estradiol, testosterone, dehydroepiandrosterone sulfate and 17-hydroxyprogesterone) were studied in 29 breast cyst fluids with a K+/Na+ ratio above 3, and 25 breast cyst fluids with a K+/Na+ ratio below 3.
Results: EGF concentrations were higher in breast cyst fluids with a K+/Na+ ratio above 3 than in breast cyst fluids with a K+/Na+ ratio below 3. TGF-* levels were undetectable in all breast cyst fluids analyzed. Multiple linear regression analysis demonstrated that the concentration of EGF in breast cyst fluid was predicted statistically by the positive regression coefficients for estradiol and dehydroepiandrosterone sulfate.
Conclusions: These data suggest EGF plays an important role in the relationship between steroid and cellular proliferation in fibrocystic breast disease.
KEY WORDS:
Growth factor; Fibrocystic breast disease.
INTRODUCCION
Hoy día se diferencian dos tipos de macroquistes mamarios en la mastopatía fibroquística tanto en su fisiopatología como en su actividad metabólica intraquística. Estos macroquistes se diferencian en función de su composición electrolítica en quistes con una relación K+/Na+ > 3 y con una relación K+/Na+ < 3(1).
Resultados previos de nuestro grupo(2-6) coincidiendo con el de otros autores(7-11) han demostrado que en el ambiente hormonal intraquístico existe una importante actividad esteroidea que se caracteriza por hiperandrogenismo e hiperestronismo relativos y que éstos se hacen notoriamente significativos cuando la relación K+/Na+ es mayor de tres, asignándose un mayor riesgo de malignización a los macroquistes mamarios con una ratio K+/Na+ > 3, por parte de diferentes autores(12,13).
La acción de los elevados niveles de esteroides presentes en los macroquistes mamarios sobre la proliferación celular pueder ser directa o mediada por factores paracrinos o autocrinos(14). En la actualidad se han identificado muchos factores que intervienen en estos procesos, destacando entre ellos los denominados factores de crecimiento(15).
En este estudio nos propusimos analizar el papel de dos factores de crecimiento, con un claro papel en el cáncer de mama a nivel local(14), en la fisiopatología de la mastopatía fibroquística: factor de crecimiento epidérmico (EGF) y factor transformador del crecimiento-* (TGF-*), determinando sus niveles en líquido quístico y correlacionándolos con diferentes hormonas esteroideas.
MATERIAL Y MÉTODOS
Para realizar el estudio obtuvimos las muestras necesarias de pacientes procedentes de la Consulta de Patología Mamaria del Centro Materno-Infantil, del Hospital Universitario Virgen de las Nieves de Granada. Estas mujeres acudían para revisión periódica o por presentar nódulo mamario o mastalgia. Consentimiento informado fue obtenido en todas las pacientes incluidas en el estudio.
Las pacientes eran sometidas a exploración física mediante inspección y palpación de ambas mamas y axilas. A todas se les realizó mamografía y ecografía de ambas mamas, punción-aspiración con aguja fina (PAAF) del quiste, neumoquistografía de la mama afecta y análisis bioquímico y hormonal del líquido quístico.
Según el análisis de las características electrolíticas del líquido quístico, las mujeres diagnosticadas de mastopatía fibroquística, fueron incluidas en uno de los dos grupos en que se dividió el estudio: A) Un grupo de 29 mujeres, diagnosticadas tras mamografía, ecografía, PAAF y neumoquistografía, de padecer macroquistes de mama, no habitados, y en el que tras aspirar el quiste se obtuvieron al menos 3 ml de líquido quístico, presentando una relación K+/Na+ < 3. B) Otro grupo de 25 mujeres, de las mismas características, pero en las que la relación K+/Na+ del líquido quístico fue > 3.
Todas las mujeres incluidas en el estudio tenían un ciclo menstrual normal y no tomaban anticonceptivos hormonales ni medicación que pudiese afectar su estado hormonal. La edad media de las mujeres con enfermedad macroquística fue de 41,7 años, con una edad mínima de diecinueve años y máxima de cincuenta y tres años. En el grupo con relación K+/Na+ < 3 la edad media fue 40,8 años (diecinueve-cincuenta y uno), mientras que en aquellas con K+/Na+ > 3 era 42,6 años (treinta y uno-cincuenta y tres), no existiendo diferencias significativas.
La punción mamaria para las determinaciones analíticas se realizó en todos los casos entre los días 22 y 27 del ciclo menstrual, entre las 8 h. y las 10 h., y habiendo mantenido ayuno desde las 24 horas del día anterior. Una vez centrifugado el contenido quístico y decantado el líquido sobrenadante, realizamos divisiones alícuotas del mismo que se congelaron a 80ºC, hasta la realización de las mediciones pertinentes.
Para todas las determinaciones realizadas se pudo comprobar que diluciones seriadas con líquido quístico se comportaban de manera paralela a las curvas estándares respectivas.
Los niveles de K+ y Na+ se determinaron mediante potenciometría indirecta, usando kits comerciales (Beckman Instruments Inc, Brea, USA).
Los niveles de estradiol y testosterona total se estudiaron por RIA competitivo mediante kits comerciales (Sorin Biomédica, Vercelli, Italia). Las concentraciones de sulfato de dihidroepiandrosterona (DHEAS) y 17-OH-progesterona se investigaron por técnicas competitivas de RIA mediante kits comerciales (Immuchem, ICN Biomedicals, CA, USA). El método empleado para la determinación de DHEAS presentó una reacción cruzada con la 17-OH-PG menor del 0,1%. Los niveles de EGF y TGF-*, se determinaron mediante RIA competitivos (Biomedical Thecnologies Inc., Stoughton, USA)
Se utilizaron los siguientes paquetes estadísticos Statistica (Microsoft, Inc.) y BMDP (Biomedical Programs, Statistical Software, INC). Para cada variable se calculó en cada uno de los grupos de líquido quístico establecido (K+/Na+ < 3 y K+/Na+ > 3) los parámetros muestrales básicos: media y desviación típica. En la Figura 1 se presentan los datos mediante gráfico tipo «box and whisker», incluyendo mediana, rango intercuartílico y amplitud de la muestra. Para comprobar si las variables seguían una distribución normal se utilizó el test de Shapiro-Wilk, rechazándose la hipótesis nula de normalidad por debajo de un p < 0,001, sufriendo las siguientes transformaciones matemáticas las variables (logaritmo natural: estradiol, 17-OH-progesterona, DHEAS, testosterona; y raíz cuadrada: EGF) con el objeto de evitar problemas de no normalidad y hacer homogéneas las varianzas. Para la comparación de medias entre los diferentes tipos de líquido quístico se realizó el test de Levenne para comprobar la homogeneidad de las varianzas, al resultar dicho test significativo se realizó el test de Welch. Para el cálculo de correlaciones lineales simple y estudio de su significación se determinó el coeficiente de correlación lineal simple de Pearson. Se realizó el estudio de regresión múltiple paso a paso de los niveles de EGF frente al resto de variables analizadas (hormonas), con objeto de determinar el menor subconjunto de variables del líquido quístico que mejor explicasen la variabilidad de los niveles intraquísticos de EGF.
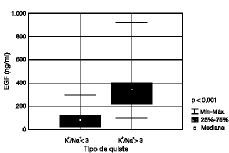
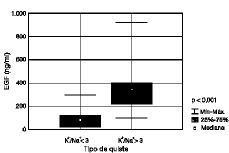
Figura 1. Niveles de factor de crecimiento epidérmico en líquido quístico.
.RESULTADOS
Los niveles intraquísticos de EGF se mostraron significativamente más elevados en los quistes de relación K+/Na+ > 3. Así, observamos una concentración de 359,5 ± 194,2 ng/ml en quistes con relación K+/Na+ > 3 frente a 86,4 ± 78 ng/ml en quistes con relación K+/Na+ < 3 (p < 0,001; Fig. 1). Por lo que se refiere al TGF-* no pudo detectarse en el análisis en ningún caso.
A nivel intraquístico se produjo una correlación positiva entre las concentraciones de EGF y las de todas las hormonas analizadas (Estradiol, DHEAS y Testosterona), salvo la 17-OH-Progesterona (Figs. 2 y 3).
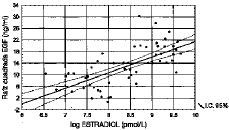
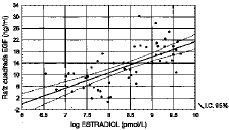
Figura 2. Correlación lineal simple entre estradiol y EGF (r = 0,65, p < 0,001).
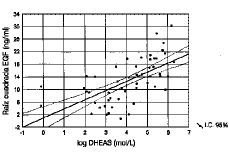
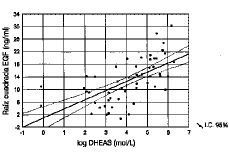
Figura 3. Correlación lineal simple entre DHEAS y EGF (r = 0,62; p < 0,001).
El análisis y el modelo de regresión lineal múltiple paso a paso, que explican la variabilidad de los niveles de EGF en líquido quístico, incluyó como significativos: al Estradiol, con coeficiente de regresión positivo (R2 = 0,43; Fexp = 39,79; g.l. = 1,52); y al DHEAS (R2 = 0,50; Fexp = 7,01: g.l. = 2,51), también con coeficiente de regresión positivo (tabla 1).
Tabla 1 Análisis de regresión lineal múltiple paso a paso de los niveles de factor de crecimiento epidérmico en líquido quístico frente a las hormonas analizadas | ||||||
| Paso | Variable | R | R2 | % Incr R2 | F exp | g.l. |
| 1 | Estradiol | 0,65 | 0,43 | 0,43 | 39,79 | 1,52 |
| 2 | DHEAS | 0,62 | 0,50 | 0,06 | 7,01 | 2,51 |
DISCUSION
El TGF-* es uno de los dos componentes activos del llamado factor de crecimiento del sarcoma, muy relacionado con el EGF por su habilidad para ligarse con su receptor (EGF-R), de forma que sus propiedades biológicas vienen determinadas por esta capacidad de activar el EGF-R, y se considera que posee actividades muy similares(16), aunque no siempre equivalentes. Desde el principio de su conocimiento se advirtió que las tasas de este factor eran inapreciables en muchos tejidos, aunque posteriormente se ha hallado en cantidades relativamente importantes en algunos tejidos epiteliales(17), fundamentalmente a nivel de la capa basal, a diferencia del EGF, participando de la proliferación celular(18). Dikson y Lippman(14) han sugerido que posiblemente la función del TGF-*, que se correlaciona con la sobreexpresión del protooncogén c-ras, dependa del tipo celular mamario que se investigue, así como de la tasa de EGFRs e, incluso, de la progresión tumoral.
Nosotros no hemos encontrado trazas de este factor en ninguno de los líquidos intraquísticos mamarios investigados, lo que podría deberse a una escasa proliferación celular existente en ellos. Tampoco Hess, et al.(19), encontraron TGF-* en su análisis de 100 muestras de líquido quístico mamario, lo que les hacía considerar que la expresión de este factor indicaría la existencia de células tumorales más que la posibilidad de que se desarrollase un tumor posteriormente. Manni, et al.(20), señalan a este respecto que la expresión de TGF-* parece ser debida a la acción directa de un oncogén más que a la consecuencia de un cambio celular durante el proceso de transformación. Travers, et al.(21), finalmente, ya señalaban que encontraban TGF-* en tejidos mamarios benignos o malignos, pero que sus tasas eran más abundantes en los casos en que los tumores malignos no eran estrógeno dependientes, sugiriendo que estos tumores tendrían un mecanismo autocrino de regulación.
En nuestro estudio hemos encontrado, como Torrisi, et al.(15) y otros autores(19,22), que las concentraciones de EGF son significativamente más altas en los quistes con relación K+/Na+ > 3. De igual modo hemos hallado que las concentraciones intraquísticas de EGF se encontraron muy elevadas, con respecto a los valores normalmente hallados en suero (< 2 ng/ml), en ambos tipos de quistes.
El EGF está muy relacionado funcionalmente, como hemos visto(16), con el TGF-*. Algunos autores(19,23) lo han encontrado en relación inversa con el TGF-ß, que nosotros no hemos estudiado ahora. Nosotros encontramos que existía una correlación positiva entre sus concentraciones y las de las hormonas esteroideas: estradiol, DHEAS y testosterona. En el análisis de regresión lineal múltiple paso a paso que realizamos se ha hallado que las variables que mejor expresaban los niveles de EGF intraquísticos son estradiol y DHEAS.
Lai, et al.(24) señalaron que la verificación de esta relación con el estradiol podía justificar que las mujeres con quistes mamarios con relación K+/Na+ > 3 pudieran tener mayor riesgo de desarrollar cáncer de mama. Es conocido que el EGF, en células de cáncer de mama, inhibe la síntesis y expresión de los receptores de estradiol y muy posiblemente también de los de progesterona(25-27), haciendo a la célula cada vez más indiferenciada y menos hormono-sensible. De la misma opinión son Torrisi, et al.(15) que han observado tasas crecientes de EGF en lesiones que representan los primeros pasos de la oncogénesis mamaria, como es la hiperplasia atípica, seguramente en dependencia de c-erbB2 y otros factores concurrentes, como corroboran Heffelfinger, et al.,(28) y Hafner, et al.(29), estos últimos buscando tratamientos antitumorales.
Numerosos estudios han correlacionado positivamente, como es nuestro caso, las concentraciones de EGF con esteroides, en tejidos benignos o malignos, in vitro e in vivo(15,19,23). Boccardo, et al., ya en 1988 (30), encontraron en líquido de quistes mamarios, una correlación positiva entre el EGF y el DHEAS, que posteriormente no ha hecho sino confirmarse por nosotros, y por otros autores previamente(14,24,31-33).
Puede por tanto señalarse que el EGF en la mastopatía fibroquística parece involucrado en la proliferación celular, de manera favorecedora, a través de su relación con los esteroides.
BIBLIOGRAFIA
01 Angeli A, Bradlow HL, Bodian CA, Chasalow FI, Dogliotti L, Haagensen DE Jr. Criteria for Classifying Breast Cyst Fluids. Ann N Y Acad Sci 1990;586:49-52.
02 Martínez L, Castilla JA, Mozas J, Díaz MA, Molina R, Herruzo A. Niveles enzimáticos en líquido quístico de macroquistes mamarios. Prog Obstet Ginecol 1994;37:107-12.
03 Martínez L, Castilla JA, Gil T, Molina J, Alarcón JL, Herruzo A. Niveles de PRL, FSH y LH en líquido de macroquistes mamarios. Clin Invest Gin Obst 1994b;21:402-4.
04 Martínez L, Castilla JA, Gil T, Molina J, Díaz MA, Mozas J, et al. Intracystic lipid profile in fibrocystic breast disease. Gynecol Endocrinol 1994;8:287-92.
05 Martínez L, Castilla JA, Gil T, Molina J, Alarcón JL, Marcos C, et al. Thyroid hormones in fibrocystic breast disease. Eur J Endocrinol 1995;132:331-4.
06 Martínez L, Castilla JA, Blanco N, Peran F, Herruzo A. CA-125, CA-15.3, CA-27-29, CEA, ß-hCG and *-fetoprotein levels in cyst fluid of breast macrocysts. Int J Gynecol Obstet 1995;48:187-92.
07 Dixon JM, Miller WR, Scott WN. pH of human breast cyst fluid. Clin Oncol 1984;10:721-4.
08 Molina R, Ballesta AM, Casals E, García ME, Marín JL, Herranz M, et al. Estudio bioquímico de los quistes mamarios: utilidad para su clasificación. Rev Diag Biol 1985;34:195-205.
09 Dogliotti L, Orlandi F, Caraci P, Puligheddu B, Torta M, Angeli A. Biochemistry of Breast Cyst Fluid. Ann N Y Acad Sci 1990;586:17-28.
10 Bradlow HL, Breed CN, Nisselbaum J, Fleisher M, Schwartz MK. PH as a marker of breast cyst fluid biochemical type. Eur J Surg Oncol 1987;13:331-4.
11 Haagensen Jr DE, Dilley WG, Mazoujian G, Wells SA. Review of GCDFP-15. An apocrine marker protein. Ann N Y Acad Sci 1990;586:161-73.
12 Bradlow HL, Fleisher M, Breed CN, Chasalow FI. Biochemical Classification of Patients With Gross Cystic Breast Disease. Ann N Y Acad Sci 1990;586:12-6.
13 Bruzzi P, Dogliotti L, Naldoni C, Bucchi L, Costantini M, Cicognani A, Torta M, Buzzi GF, Agnelli A. Cohort study of association of risk of breast cancer with cyst type in women with gross cystic disease of the breast. BMJ 1997;314:925-8.
14 Dickson RB and Lippman ME. Growth factors in breast cancer. Endocr Rev 1995;16:559-89.
15 Torrisi R, Zanardi S, Pensa F, Valenti G, de Franchis V Nicolo G, et al. Epidermal growth factor content of breast cyst fluids from women with breast cancer or proliferative disease of the breast. Breast Cancer Res Treat 1995;33:219-24.
16 Smith JM, Sporn MB, Roberts AB, Derynck R, Winkler ME, Gregory H. Human transforming growth factor-a causes precocious eyelid opening in new born mice. Nature 1985;315:515-6.
17 Derynck R, Roberts AB, Winkler ME, Chen EY, Goeddel D. Human transforming growth factor-a: precursor structure and expression in E.Coli. Cell 1984;38:287-97.
18 Snedeker SM, Brown CF, Di Augustine RP. Expression and functional properties of TGFa and EGF during mouse mammary gland ductal morphogenesis. Proc Natl Acad Sci 1991;88:276-80.
19 Hess JC, Sedghinasab M, Moe RE, Pearce LA, Tapper D. Growth factor profiles in breast ctst fluid identify women with increased breast cancer risk. Am J Surg 1994;167:523-30.
20 Manni A, Wright C, Badger B. Role of transforming growth factor or a-related peptides in the autocrine/paracrine control of experimental breast cancer growth in vitro by estradiol, prolactin and progesterone. Breast Cancer Res Treat 1990;15: 73-83.
21 Travers MT, Barett-Lee PJ, Berger U, Luqmani YA, Gazet JC, Powles TJ, et al. Growth factor expression in normal, benign, and malignant breast tissue. BMJ 1988;286:1621-4.
22. Ness JC, Sedghinasab M, Moe RE, Tapper D. Identification of multiple proliferative growth factors in breast cyst fluid. Am J Surg 1993;166:237-43.
23 Zanardi S, Pensa F, Torrisi R, de Franchis V, Barreca A, Minuto F, et al. Presence and distribution of growth factors in breast cyst fluid. Ann NY Acad Sci 1996;784:542-9.
24 Lai LC, Dunkley SA, Reed MJ, Ghilchik MW, Shaikh NA, James VH. Epidermal growth factor and oestradiol in human breast cyst fluid. Eur J Cancer 1990;26:481-4.
25. Leung BS. Roles of estrogen in mammary development, tumorigenesis and promotion of tumor growth. En: Leung BS; Hormonal regulation of mammary tumors. Lancaster: MTP; 1982. p. 30-72.
26 Jordan VC. Oestrogen and anti-oestrogen action: a hypothesis for the regulation of breast cancer cel replication. En Cavalli F; Endocrine therapy of breast cáncer. Berlin: Springer-Verlag; 1986. p. 27-35.
27 King RJ. Experimental strategies for studying the development of breast cancer with special reference to steroid hormones, growth factors and oncogenes. therapy of breast cáncer. En Cavalli F; Endocrine therapy of breast cáncer. Berlin: Springer-Verlag; 1986. p. 5-26.
28 Helffenfinger Sc, Lower EE, Miller MA, Fenoglio-Preiser CM. Plasma membrane phosphotyrosine, Her2-Neu, and epidermal growth factor receptor in human breast cancer. A comparative study. Am J Clin Oncol 1996;19:552-7.
29 Hafner F, Holler E, von Angerer E. Effect of growth factors on eestrogen receptor mediated gene expression. J Steroid Biochem Mol Biol 1996;58:385-93.
30 Boccardo F, Valenti G, Zanardi S, Cerruti G, Fassio T, Bruzzi P, et al. Epidermal growth factor in breast cyst fluid: relationship with intracystic cation and androgen conjugate content. Cancer Res 1988;48:5860-3.
31 Boccardo F, Torrisi R, Zanardi S, Valenti G, Pensa F, De Franchis V, et al. EGF in breast cyst fluid: relationships with intracystic androgens, estradiol and progesterone. Int J Cancer 1991;47:523-6.
32 Lai LC, Ghilchik MW, Shaikh NA, Reed MJ, James VH. Relationship between epidermal growth factor and dehydro-epiandrosterone and its sulphate in breast cyst fluid. Br J Cancer 1989;60:320-3.
33 Smith K, Miller WR, Fennelly JA, Matthews JN, Scott WN, Harris AL. Quantification of epidermal growt factor in human breast cyst fluids:correlation with dehydroepiandrosterone-sulphate and electrolyte concentrations. Int J Cancer 1989;44:229-32.