Ginecología
Linfadenectomía selectiva del ganglio centinela en el cáncer de mama
Selective dissection of the sentinel lymph node in breast cancer
A. Torné
D. Mateos
S. Vidal-Sicart1
J. Pahisa
G. Zanón
J. A. Lejarcegui
L. M. Puig-Tintoré
R. Herranz
X. Iglesias
1 Departamento de Obstetricia y Ginecología
Departamento de Medicina Nuclear
Hospital Clínic i Provincial. Universidad de Barcelona
IDIBAPS
Correspondencia:
Aureli Torné Bladé
Dpto. de Obstetricia y Ginecología
Hospital Clínic i Provincial
Villarroel, 170
08036 Barcelona
Fecha de recepción: 12/4/99
Aceptado para publicación: 12/7/99
RESUMEN
Objetivo: Conocer la eficacia de la linfografía intraoperatoria con colorante vital y la linfogammagrafía preoperatoria e intraoperatoria en la detección del ganglio centinela en pacientes con cáncer de mama. Valorar la concordancia entre la histología del ganglio centinela y el resto de la axila.
Sujetos y métodos: 45 pacientes con cáncer de mama tratadas primariamente mediante cirugía. Linfogammagrafía preoperatoria inyectando un nanocoloide marcado con tecnecio. Detección intraoperatoria del ganglio centinela mediante sonda detectora de rayos gamma y mediante inyección de azul de isosulfan peritumoral.
Resultados: La identificación global del ganglio centinela fue del 95%. El número medio de centinelas identificados fue 1,5 (rango 1-5), siendo positivos el 29%. Tres pacientes con ganglio centinela histológicamente negativo y afectación axilar presentaban rotura ganglionar (N1b3).
Conclusiones: La linfadenectomía selectiva del ganglio centinela utilizando radioisótopos o colorante vital es posible en la mayoría de pacientes. El factor determinante en su aplicabilidad clínica son los falsos negativos que pueden ser más frecuentes cuando existe rotura ganglionar.
PALABRAS CLAVE
Cáncer de mama; Ganglio centinela; Linfadenectomía selectiva.
ABSTRACT
Objectives: To know the efficacy of both lymphatic mapping with blue dye and preoperative and intraoperative lymphoscintigraphy in sentinel lymph node detection in patients with breast cancer. To assess the histological agreement between sentinel lymph node and complete axillary dissection.
Patients and Methods: 45 breast cancer patients who underwent primary surgical treatment. Preoperative lymphoscintigraphy with tecnetium radionuclide. Intraoperative detection of the sentinel lymph node by means of both a handled gammaprobe and patent blue peritumoral injection.
Results: Overall sentinel lymph node identification was 95%. Mean number of identified sentinel nodes was 1.5 (range 1-5), being positive 29% of them. Three patients with histologically negative lymph node and axillary infiltration showed extracapsular node involvement (N1b3).
Conclusions: Selective sentinel lymphadenectomy using radionuclides or blue dye is feasible in most of the patients. Clinical applicability depends on false negatives, which may be more frequent went extracapsular node involvement is present.
KEY WORDS
Breast neoplasm; Sentinel node; Selective lymphadenectomy.
INTRODUCCIÓN
Hace aproximadamente 100 años Halstead demostró el potencial curativo de la mastectomía radical en el cáncer de mama. Unos años más tarde Patey comprobó que la mastectomía radical modificada proporcionaba una supervivencia similar con una menor morbilidad. Recientemente la tumorectomía en el cáncer de mama ha hecho posible que un elevado porcentaje de mujeres se beneficien de una disminución considerable de la morbilidad física y psicológica asociada al tratamiento de dicha enfermedad(1). Sin embargo, a pesar de la progresiva evolución hacia un tratamiento menos agresivo del tumor primario, la linfadenectomía axilar sigue realizándose de manera sistemática aún cuando supone el procedimiento que conlleva mayor número de complicaciones en el tratamiento quirúrgico del cáncer de mama. Tal actitud se justifica por el importante factor pronóstico que supone el conocimiento del estado de los ganglios axilares. Los métodos de estudio preoperatorio de la axila como la exploración clínica o las técnicas no invasivas, se han mostrado ineficaces para la correcta estadificación axilar(2-6). Además, el abordaje quirúrgico menos invasivo como el muestreo ganglionar o la disección axilar parcial, han evidenciado un porcentaje de infraestadiaje del 10 al 45%(7,8).
Recientemente, la tendencia creciente a indicar tratamientos coadyuvantes incluso en estadios iniciales de la enfermedad ha suscitado una importante controversia sobre el papel de la linfadenectomía axilar.
En los tres últimos años se ha descrito la linfadenectomía selectiva del ganglio centinela como una nueva técnica capaz de informar con exactitud sobre el estado de la axila. El presente artículo expone nuestra experiencia inicial con la linfadenectomía del ganglio centinela en pacientes con cáncer de mama.
MATERIAL Y MÉTODOS
Este estudio incluye pacientes diagnosticadas de carcinoma de mama en la Sección de Ginecología Oncológica y Patología Mamaria del Hospital Clínic i Provincial de Barcelona, entre junio de 1997 y julio de 1998. Los criterios de inclusión en el estudio fueron: confirmación histológica de cáncer de mama, tratamiento primario con mastectomía radical modificada tipo Madden y pacientes diagnosticadas tras biopsia-exéresis de patrones mamográficos sospechosos y en las que dicha exéresis se haya considerado como parte del tratamiento conservador realizándose en un segundo tiempo la linfadenectomía axilar. Se excluyeron aquellos casos con cirugía o radioterapia axilar previa.
A todas las pacientes se les realizó una linfografía intraoperatoria con azul de isosulfan al 1%. Tras la inducción anestésica se inyectaron entre 3 y 8 ml. de azul a nivel peritumoral. En los casos en los que se había realizado previamente una tumorectomía el colorante se inyectó en el lecho quirúrgico. La rápida difusión del colorante a través de territorio linfático permitió obtener un mapa con los canalículos y los ganglios linfáticos teñidos de azul. Siguiendo el trayecto de los canalículos, la primera adenopatía teñida se identificó como el ganglio centinela, evidenciándose ocasionalmente más de uno. En las pacientes en las que se practicó una mastectomía radical modificada la mama se extirpó antes del abordaje axilar. En todos los casos tras la linfadenectomía selectiva del ganglio centinela se realizó una linfadenectomía axilar reglada con la inclusión sistemática de los niveles I y II y en algún caso del nivel III.
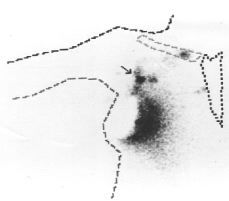
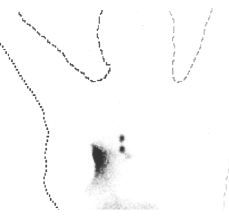
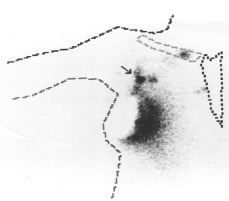
En un subgrupo de pacientes incluidas en la segunda fase del estudio se realizó, además de la linfografía con azul de isosulfan, una linfogammagrafía preoperatoria y localización intraoperatoria del ganglio centinela con una sonda detectora de rayos gamma. Para ello el día anterior a la intervención quirúrgica se inyectó peritumoralmente una sustancia coloidal (nanocoloide) marcada con tecnecio (99mTc) entre las 12 y 20 horas previas a la intervención. El estudio gammagráfico evidenció un área hipercaptante, correspondiente al lugar de la inyección y diversas acumulaciones del trazador correspondientes a los ganglios de drenaje de la axila o, en ciertos casos, de la mamaria interna (Figs. 1 y 2). Realizando dos proyecciones, una anterior y otra lateral, se determinó la localización aproximada del ganglio centinela, marcándose en la piel mediante tinta indeleble. Durante la intervención, concomitantemente con la utilización del azul de isosulfan, se llevó a cabo un rastreo intraoperatorio mediante una sonda detectora portátil. Se estimó que el número de cuentas necesarias para definir un ganglio como centinela debía ser 10 veces superior al número de cuentas del fondo correspondiente al resto del tejido axilar. Los ganglios identificados como centinelas se remitieron separadamente para su estudio histológico. Cada ganglio se estudió mediante dos secciones que se examinaron tras su tinción con hematoxilina-eosina. Las intervenciones quirúrgicas fueron practicadas por los diferentes miembros del Departamento de Obstetricia y Ginecología que habitualmente efectúan este tipo de cirugía. Por tanto, la mayor parte de los casos descritos forman parte del inicio de la curva de aprendizaje de dichos cirujanos. La inyección del radionúclido, y la gammagrafía preoperatoria y localización intraoperatoria mediante sonda detectora las realizó un mismo investigador correspondiente al Departamento de Medicina Nuclear del Hospital Clínic i Provincial.
Figura 1. Linfogammagrafía preoperatoria evidenciando área hipercaptante correspondiente al lugar de la inyección del radionúclido e hipercaptación axilar correspondiente a ganglio centinela situado en el nivel I.
Figura 2. Linfogammagrafía preoperatoria demostrativa de captación del trazador por los ganglios de la cadena linfática mamaria interna.
RESULTADOS
Este estudio incluye 45 pacientes con diagnóstico histológico de cáncer de mama. Cuatro pacientes fueron excluidas del estudio por incumplimiento de alguno de los requisitos antes enunciados en el material y métodos. La edad media de las 41 pacientes objeto de estudio fue de 60 años (rango 32-85). El 71% de ellas eran menopáusicas. El diagnóstico inicial se estableció mediante clínica, mamografía y citología positiva en el 59%, clínica y mamografía en el 20%, mamografía y citología positiva en el 7% y mamografía más exéresis previo marcaje lesional radiológico en el 15%. El tipo histológico predominante fue el ductal infiltrante en el 93%, siendo lobulillares el 7% restantes. La distribución según el grado histológico de diferenciación de Bloom-Richardson fue grado I, 17%; grado II, 44% y grado III, 39%. Respecto a la localización tumoral, predominaron los tumores de cuadrantes externos (54%), seguidos por los situados en la línea media (29%) y de cuadrantes internos (17%). La linfografía intraoperatoria con azul de isosulfan se realizó en las 41 pacientes mientras que la linfogammagrafía preoperatoria y detección intraoperatoria únicamente en 19 casos. La tasa de identificación del ganglio centinela con el procedimiento isotópico fue del 84%, consiguiendo identificar con el colorante vital el 95% de los casos. La tasa de identificación global del ganglio centinela fue del 95%. La clasificación según el tamaño tumoral valorado histológicamente fue: pTis: 5%, pT1: 46%, pT2: 42%, pT3: 5%, pT4: 2%. La presencia de metástasis ganglionar axilar se comprobó en el 39% de los casos, los cuales a su vez se subclasificaron en N1b1: 31%, N1b2: 5%, N1b3. 59%, N1b4: 5%. Como resultado de la linfadenectomía axilar completa se aislaron un total de 529 ganglios, media 13 (rango 5-19), de los cuales fueron positivos 130 (25%). El número total de ganglios centinelas identificados fue de 63 media 1,5 (rango 1-5), siendo positivos 18 (29%). La capacidad predictiva de la linfadenectomía selectiva del ganglio centinela mostró una sensibilidad del 80%, una especificidad y valor predictivo positivo del 100% y un valor predictivo negativo de 89%. La tasa de falsos negativos, teniendo en cuenta a las pacientes con axila positiva, fue del 20%.
DISCUSIÓN
Hace más de 20 años Cabanas propuso extirpar selectivamente el primer ganglio linfático receptor del drenaje tumoral, denominado ganglio centinela, para analizarlo y poder determinar en qué pacientes afectos de cáncer de pene debía realizarse una linfadenectomía más extensa(9). Morton, et al., en 1992, utilizaron un colorante vital para identificar el ganglio centinela en pacientes con melanoma(10). Un año más tarde, Alex y Krag demostraron que inyectando un radionúclido y mediante una gammacamara, era posible identificar el ganglio centinela de manera similar a la linfografía con colorante vital(11). En 1994 Giuliano describió la aplicación de dicho procedimiento en la estadificación axilar del cáncer de mama(12). En estos últimos cuatro años se han publicado numerosos estudios sobre las características técnicas de la linfadenectomía selectiva del ganglio centinela, a la vez que se ha suscitado un interesante debate sobre su aplicabilidad clínica y supuestas ventajas en el tratamiento de las pacientes con dicha neoplasia(13-15).
La creciente tendencia en disminuir la radicalidad del tratamiento quirúrgico del tumor primario en el cáncer de mama contrasta con la inamovible práctica de la linfadenectomía axilar que se indica de forma sistemática en toda paciente cuyo tratamiento primario sea quirúrgico, independientemente del estadio de la enfermedad. Los intentos de realizar una cirugía axilar limitada, tales como la disección exclusiva del nivel I, o el muestreo ganglionar, han demostrado una tasa inaceptable de infraestadiaje así como un elevado porcentaje de metástasis en niveles superiores (skip metástasis)(8,16,17). Por otro lado, últimamente se cuestiona la necesidad de realizar una linfadenectomía axilar, sobre todo en pacientes con estadios iniciales de dicha enfermedad, de los que un elevado porcentaje no obtendrá ningún beneficio y sí sufrirá una morbilidad considerable. Además, sólo entre el 10% y el 20% de todos los cánceres detectados mediante cribaje presentan afectación axilar o, lo que es lo mismo, sólo alrededor del 15% de los tumores T1a, T1b presentan una axila positiva(18). Otras críticas a la linfadenectomía axilar defienden que la supervivencia global en el cáncer de mama no depende de la disección axilar sino de las metástasis a distancia. Además, la afectación axilar microscópica puede ser curada mediante quimioterapia, con o sin radioterapia(19,20). Por tanto, si bien el estado histológico de los ganglios axilares representa el indicador pronóstico más importante, la tendencia a indicar tratamientos adyuvantes en estadios cada vez más precoces del cáncer de mama cuestiona, según muchos autores, las ventajas de este procedimiento.
La linfadenectomía selectiva del ganglio centinela tiene, pues, por objeto evitar la linfadenectomía sistemática en las pacientes sin afectación axilar. La consecución de este objetivo va a depender de una serie de factores. En primer lugar, de la tasa de detección del ganglio centinela. Los primeros estudios con azul de isosulfan mostraron tasas de detección del 66%, observándose una notable mejoría al aumentar la experiencia con dicho procedimiento(12,21). Actualmente, todos los estudios presentan tasas de detección superiores al 90%(14,22-25,27,28). Nuestra serie, a pesar de incluir múltiples cirujanos y representar la fase inicial de la curva de aprendizaje, evidencia una elevada tasa de detección global del 95%. Es discutible la existencia de un procedimiento de detección óptimo. El colorante vital permite ver los canalículos linfáticos y facilita la disección, sin embargo no permite conocer el lugar más apropiado para realizar la incisión cutánea o saber si existen otros ganglios centinela fuera de la axila, aspectos claramente evidenciados mediante linfogammagrafía. Posiblemente, el mejor método de detección se obtenga mediante la utilización combinada de ambas técnicas. Quedan por definir aspectos técnicos importantes como el tipo de coloide radioactivo más apropiado, el volumen de colorante o radionúclido que debe inyectarse, el lugar de la inyección (intratumoral, peritumoral, subdérmico, intradérmico), y el intervalo entre la inyección y el inicio de la cirugía(13).
El aspecto más controvertido, y a la vez limitante en la aplicación clínica de esta técnica es la existencia de falsos negativos. Todos los estudios evidencian una especificidad y un valor predictivo positivo del 100%, sin embargo la sensibilidad oscila entre el 88 y el 100%. Mientras para unos autores la tasa de falsos negativos es del 0%(11,22-25) para otros supera el 10%(12,14,26). El análisis de 11 series, sobre un total de 1.835 pacientes muestra un porcentaje de falsos negativos del 6,2%(13). El presente estudio halló una tasa de falsos negativos del 20%. Algunos trabajos publicados hacen referencia a los falsos negativos tomando como denominador el número total de pacientes y no el número de pacientes con axila positiva. Siempre que hablemos de falsos negativos deberíamos referirnos a esta última consideración. La existencia de falsos negativos es, sin duda, el factor más limitante a la hora de aceptar esta nueva técnica, ya que un infradiagnóstico, especialmente en pacientes con estadios iniciales de la enfermedad, puede conllevar un infratratamiento con el consiguiente menoscabo de la supervivencia. En próximos estudios deberá valorarse el papel de diferentes factores asociados a un aumento de los falsos negativos tales como edad de la paciente, tamaño tumoral, multicentricidad, técnica de identificación, experiencia del cirujano, tipo de procesamiento histológico, etc. Teniendo en cuenta el escaso número de pacientes de nuestro estudio, llama la atención que los tres casos falsamente negativos correspondían a un estadio de afectación ganglionar N1b3. Una posible explicación es que las metástasis con rotura ganglionar pueden condicionar la ausencia de circulación linfática en el ganglio afectado, quedando éste excluido de la tinción con colorante vital y/o del marcaje con radionúclido.
En conclusión, es posible realizar una linfadenectomía selectiva del ganglio centinela en la mayoría de pacientes con cáncer de mama. Aunque existe una elevada tasa de detección tanto con azul de isosulfan como con la linfogammagrafía, la utilización conjunta de ambos procedimientos es probablemente lo más aconsejable. Quedan por determinar múltiples detalles técnicos sobre el procedimiento, así como los factores asociados a la presencia de falsos negativos. Evitar la morbilidad de las linfadenectomías innecesarias constituye un importante objetivo. Sin embargo, actualmente la linfadenectomía selectiva del ganglio centinela sólo debería realizarse en el ámbito de la investigación clínica, en espera de demostrar que se trata de un adecuado procedimiento de estadiaje axilar sin detrimento de la supervivencia de las pacientes con cáncer de mama.
BIBLIOGRAFIA
01 Zanón G, Torné A. Tratamiento conservador del cáncer de mama. Cir Ibero Am 1994;3:4-9.
02 Danforth D, Findlay P, McDonald H, et al. Complete axillary lymph node dissection for stage I-II carcinoma of the breast. J Clin Oncol l986;4:655-62.
03 de Freitas R Jr, Costa MV, Schneider SV, et al. Accuracy of ultrasound and clinical examination in the diagnosis of axillary lymph node metastases to breast cancer. Eur J Surg Oncol 1991;17:240-4.
04 Nieweg OH, Kim EH, Wong WH, et al. Positron emission to-mograpby with fluorine 18-deoxyglucose in the detection and staging of breast cancer. Cancer 1993;71:3920-5.
05 Wahl RL, Cody RL, Hutchins GD, Mudgett EE. Primary and metastatic breast carcinoma: inicial clinical evaluation widh PET with the radiolabeled glucose analogue 2-[F-18] -fluoro-2-deoxy-D-glucose. Radiology 1991;179:765-70.
06 lsaacs RJ, Ford JM, Allan SG, et al. Role of computed tomography in the staging of primary breast cancer. Br J Surg 1993; 80:1137.
07 Christensen S, Jansson C. Axillary biopsy compared widh dissection in the staging of lymph nodes in operable breast cancer. Eur J Surg Oncol 1993;159:159-62.
08 Forrest A, Stewart H, Roberts, Steele R. Simple mastectomy and axillary node sampling in the management of primary breast cancer. Ann Surg 1982;196:371-8.
09 Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39:456-66.
10 Morton DL, Wen DR, Wong JH et al. Technical details of intraoperative Iymphatic mapping for early stage melanoma. Arch Surg 1992;127:392-9.
11 Alex JC, Krag DN. Gamma-probe guided localization of lymph nodes. Surg Oncol 1993;2:137-43.
12 Giuliano AE, Kirgan DM, Guenther JM, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer Ann Surg 1994;220:391-8.
13 Mc Masters, Giuliano EA, Ross MI, et al. Sentinel-lymph-node biopsy for breast cancer. Not yet the standard of care. N Eng J Med 1998;339:990-5.
14 Krag DN, Weaver DL, Alex JC, Fairbank JT. Surgical resection and radiolocalization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993:2:335-9.
15 Cox CE, Pendas S, Cox MJ. Guidelines for sentinel node biopsy and lymphatic mapping of patients with breast cancer. Ann Surg 1998;227:5:645-53.
16 Boova R, Bonnani R, Rosato M. Patterns of axillary nodal involvement in breast cancer: predictability of level one dissection. Ann Surg 1982:196:642.
17 Piggot J, Nochols R, Maddox W, Balch C. Metastases to the upper levels of axillry nodes in carcinoma of the breast and its implications for nodal sampling procedures. Surg Gynecol Obstet 1984;158:225-59.
18 Bundred NJ, Morgan DAL, Dixon JM. Management of regional nodes in breast cancer. Br Med J 1994;309:1222-5.
19 Cady B. Is axillary lymph node dissection necessary in routine management of breast cancer? No. Important Adv Oncol 1996: 251-65.
20 Haffty BG, Ward B, Pathare P. Reappraisal of the role of axillary lymph node dissection in conservative treatment of breast cancer. J Clin Oncol 1997;15:691700.
22 Albertini JJ, Lyman GH, Cox C, et al. Lymphatic mapping and sentinel node biopsy in the patient with breast cancer. JAMA 1996;276:1818-22.
23 Giuliano AF, Jones RC, Brennan M, Statman R. Sentinel lymphadenectomy in breast cancer. J Clin Oncol 1997;15:2345-50.
24 Borgstein PJ, Pijpers R, Comans EF, van Diest PJ, Boom RP, Meijer S. Sentinel lymph node biopsy in breast cancer: guidelines and pitfalls of lymphoscintigraphy and gamma probe detecction. J Am Coll Surg 1998;186:275-83.
24 Borgstein PJ, Meijer S, Pijpers R. Intradermal blue dye to identify sentinel lymph node in breast cancer. Lancet 1997;349: 1668-9.
25 Barnwell JM, Arredondo MA, Kollmorgen D, et al. Sentinel node biopsy in breast cancer. Ann Surg Oncol 1998;5:126-30.
26 Crossin JA, Jhonson AC, Stewart PB, Turner WW Jr. Gammaprobe guided resection of the sentinel lymph node in breast cancer. Am Surg 1998;64:666-8.
27 Veronesi U, Paganelli G, Galimberti V, et al. Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 1997;349:1864-7.
28 Krag D, Weaver D, Ashikaga T, et al. The sentinel node in breast cancer-a multicenter validation study. N Eng J Med 1998; 339:941-6