Obstetricia
Folatos y vitamina B12 en mujeres gestantes
Folates and vitamin B12 in pregnant women
G. Ballesteros1,2
P. Muñoz3
M. E. López3
J. R. de Miguel1,2
1 Departamento de Ciencias Médicas y Quirúrgicas Universidad de Cantabria
2 Servicio de Obstetricia y Ginecología Hospital Universitario «Marqués de Valdecilla»
3 Gerencia de Atención Primaria. Insalud. Cantabria
Correspondencia:
Gerardo Ballesteros Olmos
Servicio de Obstetricia y Ginecología
Hospital Universitario Marqués de Valdecilla
Cazoña, s/n
39011 Santander
Fecha de recepción: 11/3/99
Aceptado para publicación: 12/7/99
RESUMEN
Objetivo: Estudio observacional prospectivo de prevalencia seriada para determinar los niveles de folato eritrocitario y folato y vitamina B12 séricos.
Métodos: Muestra formada por 406 mujeres gestantes de Cantabria, estratificada por áreas y centros asistenciales de forma proporcional a los nacimientos de 1993 en cada uno de ellos. A todas se les realizó una determinación analítica al iniciar sus controles prenatales; al 94,5% se le realizó una segunda; y al 84,2% se le realizaron tres determinaciones. Para cada una de estas vitaminas se analizan los valores obtenidos, su distribución y correlación respecto a la edad gestacional, considerando la incidencia de suplementación farmacológica y el momento en que se produce.
Conclusiones: Los niveles de folatos y vitamina B12 de nuestras gestantes son comparables en su evolución a lo largo de la gestación a los publicados por otros estudios, y en general más altos. No obstante, sólo el 12% tendrían, en el primer trimestre, niveles de folatos óptimos para la prevención de DTN, mientras que los niveles del 68,9% de ellas comportarían riesgos de DTN mayores a los establecidos en otras poblaciones.
ABSTRACT
AIM: A prospective observational serial prevalence study to determine levels of red cell folate and serum levels of folate and vitamin B12.
Methods: A sample group was made up of 406 gestating women in Cantabria (Spain), distributed by areas and health care centers related to their number of births in 1993. All the women underwent an analytical determination upon beginning prenatal controls. Some 94.5% had a second and 84.2% a third such determination. For each of the vitamins we analyzed the values obtained, their distribution and correlation with respect to gestational age, considering the incidence of drug supplementation and the moment in which it took place.
Conclusions: Folate and vitamin B12 levels in our sample group are comparable in their evolution throughout the gestation period with figures published in other studies, and generally higher. However, in the first gestational trimester, only 12% could have optimum folate levels to prevent NTD, whereas levels in 68.2% of the women could involve risks of NTD greater than those in other population groups.
INTRODUCCIÓN
Numerosas publicaciones científicas advierten, desde los años 50 y 60, de la asociación de situaciones carenciales o alteraciones del metabolismo de los folatos con los defectos de cierre del tubo neural (DTN), con otras malformaciones, y con algunas patologías de la gestación.
Superando iniciales reservas metodológicas, ensayos como el del MCR(1) o el estudio húngaro de Czeizel y Dudás(2) establecen que hasta un 70% de los DTN pueden ser evitados con la toma periconcepcional de ácido fólico. Basándose en los datos objetivados en estos trabajos, los CDC de Atlanta(3) realizan, en 1991, su primera recomendación de suplementar periconcepcionalmente con 4 mg diarios de ácido fólico a las mujeres con antecedente de un hijo o feto afecto de DTN, a fin de evitar el alto riesgo de recurrencia del defecto. En 1992, avanzando datos del trabajo húngaro, que aún no había sido publicado, los CDC(4) lanzan su segunda recomendación dirigida a que todas las mujeres en edad reproductiva que puedan quedar embarazadas incrementen su ingesta de ácido fólico a 0,4 mg/día. Recomendaciones similares son realizadas por organismos sanitarios oficiales y por diferentes asociaciones profesionales en todo el mundo. También por el Ministerio de Sanidad y Consumo de nuestro país(5).
Ahora bien, las recomendaciones sobre la toma de ácido fólico se realizan sin que hayan sido precisados los mecanismos de acción por los que previenen los DTN, de los que a su vez, se sabe, que pueden ser de origen multifactorial, y que no todos son prevenibles con el ácido fólico.
Ou, et al.(6), consideran que del 40 al 50% de los DTN que se previenen incrementando la ingesta de ácido fólico, tienen como causa una mutación genética en la posición 677 del gen localizado en la banda 36,3 del brazo corto del cromosoma 1(7). Este gen codifica la síntesis del enzima metilén-tetrahidrofolato-reductasa, y la mutación descrita produce el cambio de una valina por una alanina, lo que disminuye su función. Aumentando el substrato, los folatos, se corrige la deficiencia funcional del enzima. Esta mutación tiene una prevalencia poblacional paralela a la de los factores de riesgo conocidos para los DTN (factores étnicos, geográficos y familiares básicamente).
Se establece así una interesante asociación, en la que un defecto genético ocasiona una alteración metabólica, que se manifiesta por un aumento moderado de la homocisteína, (a la que se le han demostrado efectos teratógenos), y que se corrige mediante la suplementación con un nutriente, el ácido fólico. Se trataría, al menos en estos casos, de una acción terapeutica de los folatos más que de una simple reposición fisiológica de sus niveles.
Dentro del proceso de remetilación de la homocisteína a metionina, la metil-cobalamina actúa a la vez que los folatos. Su déficit, puede ser causa de alteraciones funcionales importantes en el metabolismo de los folatos, como ocurre en la conocida hipótesis del atrapamiento de metilfolatos. Pero, además, también ocasiona un aumento moderado de homocisteína. Este incremento de la homocisteína debido al déficit de vitamina B12 también es corregido cuando suplementamos con ácido fólico. Kirke, et al.(8), establecen por primera vez grupos de riesgo relativo de DTN independientes para los niveles de folatos y para los niveles de vitamina B12, evaluados al inicio de la vigilancia prenatal.
Estos conocimientos constituyen las premisas de la hipótesis que implica a los folatos en la génesis de malformaciones tan dramáticas como la espina bífida, la anencefalia, y otros DTN más raros. La posibilidad de prevención primaria de estos defectos justifica y motiva este trabajo.
Consideramos a los folatos como elemento fundamental de nuestro estudio, por su utilidad probada en la prevención primaria de los DTN. Considerando, además, a la vitamina B12 como elemento íntimamente implicado en gran parte de las acciones metabólicas de los folatos, y con asociación independiente demostrada en el riesgo de aparición de DTN, nos propusimos realizar un estudio epidemiológico con los siguientes objetivos:
1. Conocer el estado nutricional de las mujeres gestantes de Cantabria en substancias como los folatos y la vitamina B12, determinando sus niveles hemáticos.
2. Conocer la actitud de los profesionales, que siguen la vigilancia prenatal de estas gestantes, respecto a la prescripción de suplementos de estas vitaminas, y al momento en el que se realizan.
MATERIAL Y MÉTODOS
Estudio observacional prospectivo. Dado que el objetivo principal pretende evaluar los niveles de algunas vitaminas a lo largo del embarazo, su diseño muestral es el de un estudio transversal o de prevalencia seriado.
El cálculo del tamaño muestral fue realizado considerando: una prevalencia del fenómeno a detectar entre el 5 y el 20%; una precisión de la estimación del 5%; y un nivel de confianza del 95%. Estas condiciones requieren un número muestral entre 73 y 246, según las tablas de Marks(9). No obstante, se decidió aumentar el número de casos, para mejorar la precisión y elevar la potencia estadística de las comparaciones.
Se realizó una estratificación poblacional de la muestra por áreas de salud y centros sanitarios públicos de la comunidad de Cantabria, proporcional al número de nacimientos habidos en el año 1993 en cada una de ellas. La captación de sujetos se realizó durante los primeros seis meses de 1995, finalizando la recogida de datos en julio de 1996. Se captaron, de forma consecutiva, un total de 415 gestantes al inicio de su vigilancia prenatal. Se excluyeron del estudio aquellas gestantes que ya habían iniciado los controles de vigilancia prenatal, y aquellas de las que no se pudo tener conocimiento del resultado final de la gestación. Finalmente fueron 406 los casos válidos para el estudio.
Nos propusimos realizar, a lo largo del embarazo, tres determinaciones de folato y vitamina B12 en suero, y de folato en hematíes a cada gestante incluida en el estudio. Las muestras fueron procesadas en el laboratorio de Medicina Nuclear del Hospital Universitario «Marqués de Valdecilla», capacitado para realizar técnicas de radioinmunoanálisis, con controles de calidad establecidos, y que cumple los criterios del Comité de Estándar de Laboratorios Clínicos.
La determinación de folato y vitamina B12 en suero se realizó, de forma cuantitativa y simultánea, mediante el «kit» de radioensayo SimulTRAC-SNB vitamina B12[57Co]/Folato[125I]. Este producto, fabricado por ICN Pharmaceuticals, tiene la particularidad de usar dos trazadores diferentes, para la vitamina B12 el [57Co], y para los folatos el [125I]. Los niveles de energía que producen pueden ser leídos por separado por los contadores comerciales de dos canales.
El folato intraeritrocitario se midió por el mismo «kit», pero lógicamente sobre una muestra de sangre hemolizada.
Con la prueba de Kolmogorov-Smirnov hemos analizado la distribución gausiana de las variables cuantitativas continuas, y mediante el test de Levene hemos cuantificado la homogeneidad de las varianzas. Constatado que se incumplían las condiciones mínimas para la aplicación de las pruebas paramétricas, hemos empleado, para el contraste de hipótesis de las variables medidas en escala de intervalo, el test de Kruskal-Wallis cuando se comparan más de dos categorías, y el test de Mann-Whitney cuando son sólo dos las categorías. Para comprobar el grado de correlación entre variables cuantitativas continuas empleamos el test de Spearman. Para realizar todo ello se ha utilizado el paquete estadístico SPSS v 6.1.2.
RESULTADOS
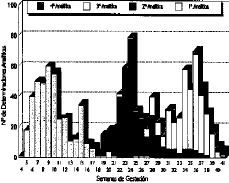
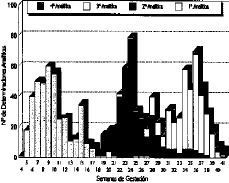
A las 406 gestantes incluidas en el estudio les fueron realizadas un total de 1.155 determinaciones analíticas para medir: folato en hematíes y folato y vitamina B12 en suero. Todas las gestantes tienen realizada una determinación al iniciar la vigilancia prenatal. El 94,5% tiene hecha una segunda determinación, el 84,2% tiene tres determinaciones, y a un 5,6% de la muestra, se les ha realizado un total de cuatro determinaciones analíticas a lo largo de la gestación. La Figura 1 recoge, en diagrama de barras acumuladas, la distribución de estas determinaciones a lo largo de la gestación.
Figura 1. Determinaciones analíticas en frecuencias absolutas realizadas a las gestantes del estudio.
La edad gestacional es tratada como variable de intervalo continua siguiendo las indicaciones de la FIGO, que considera «semana 0» los días 0 a 6 desde el inicio de la última menstruación. En 66 casos (16,2%) la edad gestacional fue calculada mediante la biometría ecográfica fetal realizada antes de la 20 semana: 11 mujeres desconocían la fecha de su última menstruación, y en los 55 casos restantes por discordancia, entre la edad gestacional referida por la gestante y la correspondiente a la biometría ecográfica, mayor a dos desviaciones típicas según las tablas de Campbell y Hadlok.
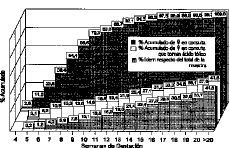
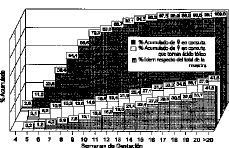
La edad de gestación en la que las gestantes del estudio se incorporan a las distintas unidades de vigilancia prenatal se muestra, en frecuencias acumuladas, en las columnas posteriores (oscuras) de la Figura 2. En ella reparamos que antes de la semana 7 de gestación sólo el 23,6% habían iniciado la vigilancia prenatal, el 68,4% antes de la 10 semana, y al completarse el primer trimestre ascendía al 92,1%. El interés de estos datos resulta evidente, ya que las posibles actuaciones preventivas lo serán en función de la sincronía con el desarrollo embrionario.
Figura 2. Porcentajes acumulados de mujeres que toman fármacos con folatos en relación al total de las captadas (columnas blancas), y al total de la muestra (columnas punteadas previas).
Una única gestaste recibió preparados farmacológicos con folatos en los meses previos al inicio de su embarazo. Durante la gestación el 41,6% de las gestantes recibieron aporte farmacológico de folatos, siendo el 2.º suplemento nutricional en frecuencia después del hierro (89,9%), y por delante de los preparados con calcio (12,5%).
Entre las 169 gestantes que recibieron preparados farmacológicos con folatos, la dosis y el tiempo de duración de la toma fueron muy variados. Las dosis diarias oscilaron entre 0,4 mg de ácido fólico y 15 mg de ácido folínico. La duración de la toma varió notablemente, de cortos períodos de 10 días en algunos casos, a tratamientos continuos durante toda la vigilancia prenatal. En los apartados donde valoramos la suplementación con estos preparados sólo constatamos el hecho y el inicio de la misma, pero no el tipo de preparado, ni la dosis, ni la duración del tratamiento.
De las gestantes del estudio que recibieron preparados farmacológicos con folatos en algún momento del embarazo: 77 (el 18% de la muestra, o el 21,9% de las sometidas a control en ese momento), los recibieron antes de finalizado el primer trimestre. Un 7,6% de las gestantes de la muestra los tomaron antes de la semana 10 de amenorrea. Sólo 5 mujeres (1,2% del total, y 5,1% de las controladas en ese momento), los tomaron antes de la semana 6 de gestación, momento en el cual ya se ha debido completar el cierre del tubo neural. La Figura 2 muestra en las dos primeras series del diagrama (barras blancas y punteado claro) los datos referidos.
Sólo 24 gestantes recibieron algún tipo de suplemento con vitamina B12, generalmente en forma de complejos multivitamínicos y de oligoelementos. La dosis más usual fue de 4 mg/día. En algunos casos no ha podido ser establecida la duración del tratamiento.
Niveles de folato sérico
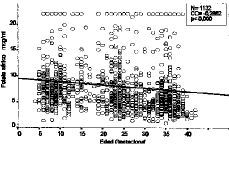
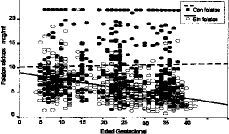
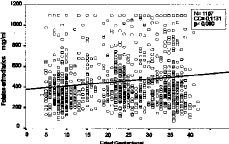
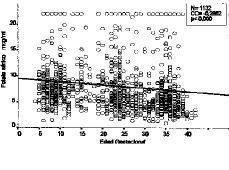
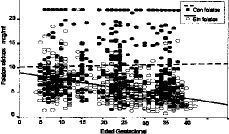
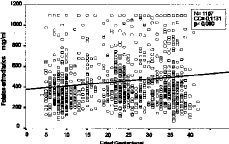
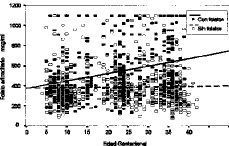
La totalidad de las determinaciones (1.132) de folato sérico realizadas se muestran en la tabla 1 divididas en dos categorías, dependiendo de que hayan recibido o no suplementos farmacológicos con folatos, y agrupadas por la edad gestacional. El análisis comparativo (tabla 2) constata que las evidentes diferencias presentan una alta significación desde el primer trimestre (p < 0,0005). Los niveles disminuyen conforme avanza la gestación. En la Figura 3 vemos que el coeficiente de correlación aplicado al conjunto de la muestra, presenta una significativa correlación negativa de --0,2662 (p < 0,0005). Si analizamos por separado las determinaciones suplementadas y no suplementadas con preparados farmacológicos con folatos, mientras que estas últimas presentan una manifiesta tendencia a disminuir (--0,4642, p < 0,0005), las suplementadas apenas si presentan una leve correlación (CC = --0,0273) sin significación estadística (Fig. 4).
Tabla 1 Niveles de folato en suero a lo largo de la gestación en el grupo de mujeres suplementadas farmacológicamente con folatos (cualquier dosis y cualquier duración), y en el grupo de las que no reciben folatos | ||||||||
| Supl. Folato | Semana de gestación | Media | Desviación típica | Mediana | ||||
| P5 | P25 | P50 | P75 | P95 | ||||
| Con suplemento de folato | ¾ 9 | 17,37 | 6,60 | 4,62 | 12,44 | 22,00 | 22,00 | |
| 10-13 | 14,88 | 8,24 | 6,90 | 7,33 | 15,31 | 22,00 | ||
| 14-18 | 10,12 | 5,03 | 3,62 | 5,66 | 10,02 | 12,83 | 22,00 | |
| 19-23 | 13,14 | 5,78 | 5,68 | 8,36 | 12,35 | 17,82 | 22,00 | |
| 24-27 | 12,37 | 6,73 | 3,57 | 6,73 | 11,06 | 22,00 | ||
| 28-31 | 15,07 | 7,26 | 5,12 | 7,34 | 16,99 | 22,00 | ||
| 32-35 | 9,74 | 6,21 | 2,79 | 4,90 | 7,26 | 14,59 | 22,00 | |
| >= 36 | 11,54 | 7,44 | 2,92 | 5,50 | 7,85 | 22,00 | ||
| Sin suplemento defolato | ¾ 9 | 8,13 | 4,18 | 3,43 | 5,64 | 7,25 | 9,17 | 20,47 |
| 10-13 | 8,55 | 3,88 | 3,61 | 6,11 | 7,77 | 9,89 | 17,96 | |
| 14-18 | 9,94 | 6,07 | 1,96 | 5,39 | 8,67 | 12,79 | 22,00 | |
| 19-23 | 6,57 | 3,05 | 2,77 | 4,57 | 5,72 | 8,26 | 13,34 | |
| 24-27 | 5,04 | 2,02 | 1,82 | 3,91 | 4,81 | 6,14 | 9,23 | |
| 28-31 | 5,07 | 2,33 | 1,83 | 3,61 | 4,15 | 6,60 | 10,20 | |
| 32-35 | 5,37 | 3,21 | 1,97 | 3,53 | 4,86 | 5,97 | 11,49 | |
| >= 36 | 4,50 | 2,11 | 2,08 | 3,08 | 4,09 | 5,67 | 8,02 | |
Tabla 2 Comparación de los niveles de folato en suero, en cada trimestre de la gestación, entre gestantes suplementadas farmacológicamente con folatos (cualquier dosis y cualquier duración) y las que no reciben folatos. | |||||
| Suplementación | Casos | Media | Desv. típica | IC 95% de la media | Significación estadística |
| Trimestre 1.° | Mann-Whitney | ||||
II. Con folatos | 13 | 16,60 | 6,89 | 12,43-20,77 | |
| II. Sin folatos | 317 | 8,25 | 4,03 | 7,80-8,70 | p < 0,0005 |
| Trimestre 2.° | |||||
| I. Con folatos | 104 | 12,10 | 5,97 | 10,94-13,26 | |
| II. Sin Folatos | 186 | 6,41 | 3,59 | 5,89-6,93 | p < 0,0000 |
| Trimestre 3.° | |||||
| I. Con folatos | 139 | 10,86 | 6,94 | 9,70-12,03 | |
| II. Sin folatos | 186 | 4,91 | 2,58 | 4,53-5,28 | p < 0,0000 |
Figura 3. Correlación de niveles de folato sérico con la edad gestacional (total de la muestra)
Figura 4. Correlación de niveles de folato sérico con la edad gestacional en función de la suplementación farmacológica con folatos.
Niveles de folato en hematíes
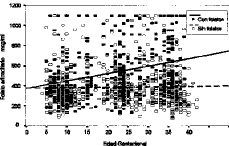
Analizamos un total de 1.107 determinaciones de folato intraeritrocitario. En su conjunto presentan un discreto coeficiente de correlación positiva de 0,1131 (p < 0,0005) a lo largo de la gestación (Fig. 5). Las suplementadas con preparados farmacológicos con folatos aumentan considerablemente la correlación positiva (CC = 0,2760), mientras que las no suplementadas presentan una leve tendencia a la disminución de los niveles de folato eritrocitario a medida que avanza la gestación (CC = --0,0120), como puede apreciarse en la Figura 6.
Figura 5. Correlación de niveles de folato eritrocitario con la edad gestacional (total de la muestra).
Figura 6. Correlación de niveles de folato eritrocitario con la edad gestacional en función de la suplementación farmacológica con folatos.
Los niveles de folato eritrocitario son mayores en las gestantes suplementadas con preparados farmacológicos de folatos como puede verse en la tabla 3. Las diferencias entre grupos persisten a lo largo del embarazo, y son estadísticamente significativas en el análisis comparativo para cada uno de los tres trimestres de la gestación, como puede apreciarse en la tabla 4.
Tabla 3 Niveles de folato en hematíes a lo largo de la gestación en el grupo de mujeres suplementadas farmacológicamente con folatos (cualquier dosis y cualquier duración), y en el grupo de las que no reciben folatos | ||||||||
| Supl. Folato | Semana de gestación | Media | Desvición | Mediana | ||||
| Típica | P5 | P25 | P50 | P75 | P95 | |||
| Con suplemento de folato | ¾ 9 | 516,1 | 240,9 | 326,0 | 358,5 | 510,0 | 657,5 | |
| 10-13 | 592,0 | 147,1 | 396,0 | 438,2 | 623,5 | 714,2 | ||
| 14-18 | 553,5 | 281,3 | 244,7 | 352,7 | 544,5 | 721,2 | 1.099,0 | |
| 19-23 | 647,4 | 258,2 | 271,0 | 456,0 | 618,0 | 814,0 | 1.099,0 | |
| 24-27 | 670,5 | 290,5 | 235,0 | 424,0 | 588,5 | 1.029,0 | 1.099,0 | |
| 28-31 | 608,0 | 246,0 | 400,0 | 422,2 | 475,5 | 864,0 | ||
| 32-35 | 620,5 | 299,4 | 275,7 | 378,2 | 501,0 | 884,7 | 1.099,0 | |
| >= 236 | 649,6 | 296,2 | 209,0 | 425,0 | 577,0 | 887,0 | 1.099,0 | |
| Sin suplemento de folato | ¾ 9 | 365,7 | 179,6 | 148,0 | 251,0 | 332,0 | 422,7 | 740,0 |
| 10-13 | 378,8 | 194,3 | 171,2 | 251,5 | 336,5 | 441,7 | 803,2 | |
| 14-18 | 459,3 | 197,1 | 185,8 | 327,7 | 413,0 | 598,0 | 925,3 | |
| 19-23 | 417,4 | 191,1 | 163,9 | 289,2 | 371,0 | 515,7 | 843,7 | |
| 24-27 | 402,6 | 215,5 | 203,9 | 280,0 | 350,0 | 427,0 | 1.051,8 | |
| 28-31 | 406,9 | 216,9 | 211,0 | 259,0 | 342,0 | 454,0 | 1.099,0 | |
| 32-35 | 402,6 | 180,8 | 187,0 | 256,0 | 371,0 | 501,0 | 804,0 | |
| >= 36 | 348,4 | 192,2 | 134,4 | 226,0 | 301,0 | 410,0 | 802,8 | |
| Tabla 4: Comparación de los niveles de folato en hematíes, en cada trimestre de la gestación, entre gestantes suplementadas farmacológicamente con folatos (cualquier dosis y cualquier duración) y las que no reciben folatos | |||||
| Suplementación | Casos | Media | Desv. típica | IC 95%de la media | Significación estadística |
| Trimestre 1.° | Mann-Whitney | ||||
| II. Con folatos | 13 | 567,1 | 210,7 | 439,7-694,5 | |
| II. Sin folatos | 313 | 370,2 | 185,5 | 349,6-390,9 | p < 0,0005 |
| Trimestre 2.° | |||||
| II. Con folatos | 107 | 627,5 | 275,5 | 574,7-680,4 | |
| II. Sin folatos | 195 | 418,7 | 201,4 | 390,3-447,2 | p < 0,0000 |
| Trimestre 3.° | |||||
| I. Con folatos | 139 | 633,0 | 293,7 | 583,7-682,2 | |
| II. Sin folatos | 181 | 378,7 | 195,1 | 350,1-407,3 | p < 0,0000 |
Niveles de vitamina B12 en suero
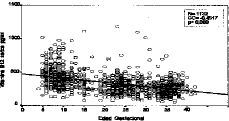
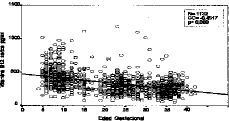
Se han analizado un total de 1.132 determinaciones de vitamina B12 sérica a las 406 gestantes incluidas en el estudio. La tendencia a disminuir conforme avanza la gestación se refleja en un coeficiente de correlación de Spearman negativo de --0,4517 (p < 0,0005), y que se muestra en la Figura 7. Esto es especialmente manifiesto en los dos primeros trimestres de la gestación con coeficientes de correlación de --0,1853 y --0,1739 con p < 0,05 en ambos. En el tercer trimestre la correlación se hace discretamente positiva (0,0781) y sin significación estadística (p = 0,160).
Figura 7. Correlación de los niveles de vitamina B12 séric con la edad gestacional (total de la muestra).
La tabla 5 muestra, dividida en dos grupos dependiendo de que las gestantes hubieran recibido o no vitamina B12, los valores medios y percentilados, agrupados por edad de gestación. Realizado el estudio comparativo, sólo las diferencias del 21 trimestre de la gestación alcanzan significación estadística (p<0,05), como se aprecia en la tabla 6. El escaso número de gestantes (tan sólo 24) que recibieron vitamina B12, limita el rigor de las comparaciones a la par que apenas si modifica la tendencia descendente del coeficiente de correlación (CC = --0,4548 para las no suplementadas y CC = --0,4209 para las suplementadas), como puede verse en la Figura 8.
Tabla 5 Niveles de vitamina B12 en suero a lo largo de la gestación en el grupo de mujeres suplementadas farmacológicamente con B12 (cualquier dosis y cualquier duración), y en el gnupo de las que no reciben B12 | ||||||||
| V. B12 Supl | Semana de gestación | Media | Desvición | Mediana | ||||
| Típica | P5 | P25 | P50 | P75 | P95 | |||
| Con suplemento de vitamina B12 | ¾ 9 | 422,6 | 127,1 | 246,0 | 280,5 | 451,5 | 544,5 | |
| 10-13 | 376,0 | 362,0 | 120,0 | 120,0 | 376,0 | |||
| 14-18 | 419,2 | 141,0 | 244,0 | 319,0 | 388,0 | 542,0 | ||
| 19-23 | 252,0 | 112,0 | 81,0 | 144,7 | 271,0 | 350,2 | ||
| 24-27 | 333,0 | 130,1 | 241,0 | 241,0 | 333,0 | |||
| 28-31 | 386,6 | 399,9 | 92,0 | 92,0 | 226,0 | |||
| 32-35 | 242,6 | 101,1 | 60,0 | 176,7 | 240,5 | 305,7 | ||
| >= 36 | 259,5 | 86,6 | 147,0 | 181,5 | 256,0 | 344,2 | ||
| Sin suplemento de vitamina B12 | ¾ 9 | 454,6 | 168,7 | 219,5 | 343,5 | 438,0 | 529,5 | 788,5 |
| 10-13 | 403,4 | 153,9 | 196,5 | 300,7 | 393,0 | 464,0 | 730,1 | |
| 14-18 | 337,2 | 156,6 | 151,5 | 244,5 | 327,0 | 403,0 | 559,7 | |
| 19-23 | 308,5 | 136,0 | 140,7 | 220,7 | 287,5 | 307,5 | 508,2 | |
| 24-27 | 281,5 | 98,3 | 142,7 | 208,2 | 272,0 | 356,5 | 455,2 | |
| 28-31 | 291,2 | 201,4 | 101,4 | 174,5 | 242,0 | 336,0 | 885,3 | |
| 32-35 | 274,2 | 180,5 | 111,0 | 188,0 | 251,0 | 308,0 | 441,0 | |
| >= 36 | 268,0 | 91,3 | 125,2 | 204,7 | 260,0 | 328,5 | 447,6 | |
Tabla 6 Comparación de los niveles de vitamina B12, en cada trimestre de ía gestaaón, entre gestantes suplementadas farmacológicamente con B12 (cualquier dosis y cualquier duración) y las que no recibieron B12 | ||||||
| Suplementación | Casos | Media | Desv. típica | IC 95%de la media | Significación estadística | |
| Trimestre 1.° | Mann-Whitney | |||||
| I. Con vitamina Bl2 | 10 | 413,3 | 165,8 | 294,6-531,9 | ||
| II. Sin vitaminaBl2 | 325 | 436,3 | 165,2 | 418,3-454,3 | p = 0,9974 | |
| Trimestre 2.° | ||||||
| II. Con vitamina Bl2 | 21 | 363,2 | 147,5 | 296,0-430,3 | ||
| II. Sin vitamina Bl2 | 292 | 304,2 | 129,3 | 289,3-319,1 | p < 0,05 | |
ITrimestre 3.° | ||||||
| I. Con vitamina B12 | 19 | 270,6 | 166,4 | 190,4-350,8 | ||
| II. Sin vitamina Bl2 | 306 | 273,8 | 149,6 | 257,0-290,6 | p = 0,6371 | |
Figura 8. Correlación de niveles de vitamina B12 con la edad gestacional en función de la suplementación farmacológica con vitamina B12.
La comparación de los niveles de vitamina B12, entre el grupo de las suplementadas con preparados farmacológicos con folatos y las no suplementadas, también se realizó por trimestres de gestación y no mostró diferencias significativas.
Los rangos de normalidad de vitamina B12 fijados por nuestro laboratorio son de 140-970 pg/ml. En base a ellos y a los criterios más frecuentemente utilizados en los estudios clínicos, hemos elaborado la tabla 7. En ella se muestran, en tres categorías, el estado en vitamina B12 de las gestantes de nuestro estudio. El 96% de nuestras gestantes inician su embarazo con unos niveles de cobalamina normales. Al finalizar la gestación la frecuencia de valores normales ha descendido al 73,5%.
Tabla 7 Frecuencias de distribución de los niveles de vitamina B12 sérica del estudio, por trimestres de gestación, según los rangos de normalidad más frecuentemente utilizados en la práctica clínica | |||||||
| Clasificación clínica | Grupos de niveles | l.er trimestre | 2.° trimestre | 3.er trimestre | |||
| Casos | (%) | Casos | (%) | Casos | (%) | ||
| A) Hipocobalaminemia | <140 pg/ml | 5 | (1,5) | 11 | (3,5) | 30 | (9,3) |
| B) Valores subóptimos | 140-200 | 8 | (2,4) | 41 | (13,1) | 56 | (17,2) |
| C) Valores normales | > 200 | 322 | (96,1) | 261 | (83,4) | 239 | (73,5) |
DISCUSIÓN
Cronología de inicio de los controles prenatales y de la suplementación con preparados farmacológicos con folatos
Es generalmente admitido que la formación del tubo neural se completa el 26 día postfecundación con el cierre del neuroporo posterior, lo que condiciona notoriamente la posibilidad de actuar preventivamente sobre los defectos malformativos de estas estructuras. En la Figura 2 se recogió la cronología respecto a la edad de gestación, en la que las gestantes inician sus controles prenatales y reciben los suplementos farmacológicos con folatos. Se evaluaron así las actuaciones preventivas realizadas, y la capacidad de actuación contra la inoportuna precocidad del desarrollo del tubo neural. Sólo el 23,6% de las gestantes del estudio consultaron por su gestación antes de la semana 7 en la que teóricamente ya se habría completado el cierre del tubo neural de su embrión. En esa misma edad de gestación, sólo el 1,2% de las gestantes del estudio, lo que equivale al 5,2% de las incluidas en los controles prenatales, han recibido algún tipo de suplemento con folato. Este último dato, aun tratándose del año 1995, es más desalentador, pues refleja la actitud de los profesionales que realizan la vigilancia prenatal.
Más del 92% (374 gestantes) del estudio fueron incluidas antes de la semana 14 de gestación. En ese momento 73 gestantes habían recibido algún suplemento farmacológico con folatos (el 18% de la muestra, y el 21,9% de las captadas), y pudieron beneficiarse de su posible efecto protector sobre malformaciones de otros órganos, como apuntan múltiples publicaciones(10-12). Valoramos positivamente la dinámica de acogida de gestantes en el dispositivo de vigilancia prenatal de nuestro sistema sanitario público, que es más temprana que la referida por otros autores(8,13,14), pero está lejos de ser el ideal para actuar en la prevención de los DTN. A tal respecto, es opinión generalizada que la consulta preconcepcional debe ser el marco ideal para disponer las medidas necesarias y lograr que la prevención primaria de los DTN sea realmente efectiva. En nuestro país, Carrera J.M. y Gallo M., avalan este criterio en un documento audiovisual editado por la SEGO en 1996, y dirigido a concienciar sobre este problema a los profesionales responsables de la vigilancia prenatal. Más recientemente, Fabre E.(15) realiza una detallada revisión de conjunto sobre los objetivos y contenidos de la consulta preconcepcional. Aunque la falta de información de las mujeres, la escasa planificación del embarazo y la lenta implantación de esta medida entre los profesionales de la salud, hacen que las medidas orientadas a la prescripción de suplementos se muestren escasamente satisfactorias en aquellos lugares donde ya fueron puestas en marcha(16-18). Tanto los CDC(17) estadounidenses, como autores europeos del prestigio del Dr. Wald(19), director del estudio MRC, o el grupo irlandés de Daly, et al.(20), abogan por medidas de intervención sobre la población general como la de fortificar con ácido fólico alimentos de consumo diario. Todos ellos consideran ideal, en sus respectivas poblaciones, la intervención sobre el grupo de alimentos derivados de los cereales.
Niveles de folato y vitamina B12 séricos y de folato en hematíes
La pregunta, ¿tiene interés conocer los niveles de folatos en las mujeres que planifican un embarazo?, encuentra respuesta en los estudios del grupo de trabajo irlandés que, primero demuestran la relación entre los DTN y los niveles de folato y vitamina B12 al inicio de la gestación(8), y después establecen los diferentes riesgos de aparición del defecto en función de los niveles de folatos(20). Estos trabajos establecen unos rangos de niveles de estas vitaminas, para diferentes riesgos relativo de padecer un DTN, que en absoluto se corresponden con los criterios de normalidad utilizados en la práctica clínica, generalmente relacionados con patologías hematológicas. Los citados estudios demuestran que por debajo de 7 ng/ml de folato sérico, o por debajo de 400 ng/ml de folato eritrocitario maternos, aparece un progresivo aumento de riesgo de afectación de su descendencia por esta malformación.
Nuestros resultados muestran que la diferencia de niveles de folato, tanto sérico como eritrocitario, en las suplementadas y en las no suplementadas, son gráfica y estadísticamente significativas. Esto concuerda con lo generalmente observado por otros autores(21-23), y no nos merece mayor valoración que la de corroborar la facilidad con la que se absorben los folatos a lo largo de todo el embarazo.
Con las determinaciones de las gestantes no suplementadas valoramos la evolución fisiológica de los folatos a lo largo del embarazo. Comprobamos que la tendencia, tanto de los niveles de folato en suero como en hematíes, es totalmente superponible a la descrita por Ek y Magnus(24). Los niveles de folato sérico inicialmente ascienden y, desde la semana 14-18 en nuestra población y la 10-13 en las gestantes noruegas, inician un descenso progresivo hasta el final de la gestación. El folato eritrocitario presenta un descenso significativo a partir de las 30-33 semanas en el grupo de Ek y Magnus, y a partir de las 32-35 semanas en nuestro estudio.
Conocidos los niveles de folato y vitamina B12 de las gestantes de nuestra comunidad, ¿cómo podemos valorarlos? A nivel nacional no existen datos publicados sobre los riesgos poblacionales para los DTN en función de los niveles de estas vitaminas. En el grupo de estudio no se han producido casos de DTN, por lo que nosotros tampoco podemos establecer criterios de riesgo. Este no era uno de los objetivos de nuestro trabajo que, dada la prevalencia de la enfermedad, requeriría o una muestra mayor u otro tipo de estudio. Así pues, valoraremos nuestros resultados con los riesgos para los DTN en función de los niveles de vitaminas establecidos en una población, la irlandesa(8,20), con una prevalencia de la enfermedad sensiblemente mayor que la nuestra. Aunque los riesgos poblacionales no sean extrapolables, creemos que los riesgos individuales sí serán diferentes en función de los niveles de sus vitaminas.
Los rangos de normalidad establecidos para evaluar la folatemia no mantiene criterios uniformes. La mayoría de las publicaciones consideran hipofolatemia sérica a valores inferiores a 3 ng/ml, pero las hay que marcan el límite en 1,5 ó 2 ng/ml. Frecuentemente se hace referencia a valores subóptimos cuyos límites también varían, siendo para algunos entre 2 y 4 ng/ml, y para otros entre 3 y 6 ng/ml. Con los valores intraeritrocitarios ocurre algo parecido, hay quien considera hipofolatemia a valores por debajo de 175 ng/ml, quien los inferiores a 150 ng/ml, y quien los menores de 140 ng/ml. Los valores subóptimos de los folatos en este compartimento son fijados en 160 ng/ml, o 200 ng/ml. Las tablas 8 y 9 reflejan las distintas frecuencias, para cada uno de los trimestres, en los rangos de valores con los que pretendemos contrastar nuestros resultados. En ellas se reflejan por separado los criterios clínico-hematológicos con los rangos marcados por nuestro laboratorio, y los criterios de riesgo relativo para los DTN establecidos por Daly, et al.(20).
Tabla 8 Frecuencias de distribución de los niveles de folato eritrocitario, por trimestres de gestación, según los rangos de normalidad y el riesgo relativo establecido para los defectos de cierre del tubo neural | |||||||
| Calificación y riesgos | Grupos de niveles | l.er trimestre | 2.° trimestre | 3.er trimestre | |||
| Casos | (%) | Casos | (%) | Casos | (%) | ||
| A) Hipofolatemia | <140 ng/ml | 9 | (2,7) | 2 | (0,7) | 5 | (1,6) |
| B) Valores subóptimos | 140-200 | 23 | (6,9) | 12 | (3,9) | 17 | (5,3) |
| C) Valores normales | > 200 | 299 | (90,3) | 288 | (95,3) | 298 | (93,1) |
| III) R.R. para DTN: 6,6 (*) | <150 ng/ml | 14 | (4,2) | 5 | (1,7) | 9 | (2,8) |
| III) R.R. para DTN: 3,2 | 150-199 | 18 | (5,4) | 9 | (3,0) | 13 | (4,1) |
| III) R.R. para DTN: 2,3 | 200-299 | 96 | (29,0) | 50 | (16,6) | 59 | (18,4) |
| IV) R.R. para DTN: 1,6 | 300-399 | 100 | (30,2) | 83 | (27,5) | 75 | (23,4) |
| IV) R.R. para DTN: 0,8 | >400 | 103 | (31,1) | 155 | (51,3) | 164 | (40,4) |
| (*) Riesgo relativo de descendencia con defecto del tubo neural según Daly, et al. | |||||||
Tabla 9 Frecuencia de distribución de los niveles de folato sérico por trimestres de gestación, según los rangos de normalidad y el riesgo relativo establecido por los defectos de cierre del tubo neural | |||||||
| Calificación y riesgos | Grupos de niveles | l.er trimestre | 2.° trimestre | 3.er trimestre | |||
| Casos | (%) | Casos | (%) | Casos | (%) | ||
| A) Hipofolatemia | < 3 ng/ml | 6 | (1,8) | 21 | (7,2) | 37 | (11,4) |
| B) Valores subóptimos | 3-6 | 88 | (26,3) | 104 | (35,9) | 147 | (45,2) |
| C) Valores normales | > 6 | 241 | (71,9) | 165 | (56,9 | 141 | (43,4) |
| III) R.R. para DTN: 3,7 (*) | <2 ng/ml | 3 | (0,9) | 6 | (2,1) | 8 | (2,5) |
| III) R.R. para DTN: 2,6 | 2-3 | 3 | (0,9) | 15 | (5,2) | 31 | (9,5) |
| III) R.R. para DTN: 1,9 | 3-5 | 49 | (14,6) | 58 | (20,0) | 107 | (32,9) |
| IV) R.R. para DTN: 1,5 | 5-7 | 80 | (23,9) | 73 | (25,2) | 74 | (22,8) |
| IV) R.R. para DTN: 0,9 | > 7 | 200 | (59,7) | 138 | (47,6) | 105 | (32,3 |
| (*) Riesgo relativo de descendencia con defecto del tubo neural según Daly, et al. | |||||||
Atendiendo a la medición del folato sérico, más de un 28% de nuestras gestantes se encuentran con valores subóptimos o bajos en el primer trimestre, mientras que sólo son el 9,6% las incluidas en estas categorías cuando nos referimos al folato eritrocitario. Similares, pero de mayor cuantía, son las diferencias que, para estas mismas categorías de rangos, y en el mismo trimestre de embarazo, publica Montoneri(23). Aunque las diferencias se acentúan al incluir los niveles subóptimos, es obvio que los términos de normalidad no son totalmente superponibles cuando nos referimos a los folatos en suero o a los intraeritrocitarios.
En el primer trimestre de gestación y según los niveles de folato en suero, el 1,8% de nuestras gestantes se encuentran con hipofolatemia y el 71,9% tienen valores «normales», pero sólo el 59,7% estaría en el grupo de riesgo no aumentado (RR < 1) de que su descendencia se afecte de un DTN según los rangos determinados por Daly, et al.(20).
Para el mismo período y según los niveles de folato en hematíes, el 2,7% de nuestras gestantes están hipofolatémicas y más del 90% tienen valores «normales», pero sólo el 31,1% estaría en el grupo de riesgo no aumentado respecto a los DTN.
Las gestantes sin riesgo aumentado son casi el doble dependiendo del compartimento sanguíneo donde midamos los valores de folato. Surge la cuestión, ¿a cual de los dos criterios hemos de dar crédito? El folato sérico experimenta notables variaciones. Sus valores son muy sensibles al aporte dietético reciente y a las interferencias con la ingesta simultánea de fármacos u otros nutrientes(25). Su utilidad clínica es relativa, pero constituye un marcador precoz del grado de cumplimiento del tratamiento en los ensayos clínicos. Hall(26), en 1976, dejó patente que el descenso de los niveles de folato sérico durante la gestación con la variable que mejor se asocia es con el aumento del volumen plasmático, lo que, sin duda alguna, explica el aumento de «hipofolatemias séricas» en el 2.º (7,2%) y 3.er trimestre (11,4%), que contrasta con la disminución de las «hipofolatemias eritrocitarias» y que no creemos que deban ser atribuidas exclusivamente al aumento de gasto de folatos durante la gestación. Los poliglutamatos eritrocitarios reflejan un índice nutricional más duradero (aproximadamente los cuatro meses previos a la determinación) y menos variable del estado de folatos que los niveles en suero, y tienen una gran correspondencia con la clínica(25). El propio trabajo de Daly, et al.(20), refleja una mayor capacidad de discriminación de riesgo relativo para los DTN con los niveles de folato eritrocitario.
No estando establecidos estos riesgos en nuestra población, creemos conveniente adoptar como límite inferior de folatemia normal, al referirnos al riesgo para los DTN, los niveles establecidos en el estudio irlandés: 400 ng/ml para el folato eritrocitario, y 7 ng/ml para el folato sérico. Las mujeres en edad reproductiva con valores inferiores presentarán un riesgo aumentado de que su descendencia pueda afectarse por un DTN, y sus niveles de folato no deben ser considerados como «normales».
Prolongando su análisis de riesgo, los mismos autores concluyen que continúan encontrando un efecto protector progresivo mientras los niveles de folato eritrocitario ascienden hasta 570 ng/ml, y que el beneficio no aumenta con niveles superiores. Los 570 ng/ml podrían ser considerados como los «niveles óptimos» de folato en hematíes al referirnos a los DTN. Sólo el 12% de las gestantes de nuestro estudio tienen niveles superiores a este umbral ideal en la determinación del primer trimestre.
Los niveles de vitamina B12 materno
Al inicio de la vigilancia prenatal, también fueron relacionados por Schorah, et al.(27), y Kirke, et al.(8) con el riesgo de padecer un DTN por su descendencia. Este último grupo establece una correlación negativa entre los niveles de folato y vitamina B12 en suero y la prevalencia de los DTN, que son independientes entre sí aunque se potencian. Hemos distribuido a las gestantes de nuestro estudio utilizando los rangos de valores usados por ellos para valorar su distribución en los diferentes grupos de riesgo.
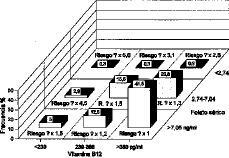
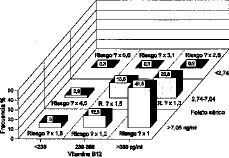
En base a los criterios citados, el 41,5% de nuestras gestantes estarían en el grupo de riesgo de mínima prevalencia, otro 53,8% estaría en riesgo de prevalencia 1,2 a 1,5 veces mayor, y el resto (4,5%) en los grupos de prevalencia más altas (2,6 a 5,6 veces mayores). El incremento de riesgo, siempre según los datos del estudio irlandés, sería de 5,6 veces mayor para las gestantes con niveles de vitamina B12 y folato sérico más bajos. La Figura 9 presenta junto a las frecuencias de distribución de las gestantes de nuestro estudio, los múltiplos de un desconocido riesgo basal que suponemos proporcional al de la población irlandesa.
Figura 9. Distribución de las gestantes del estudio en grupos de riesgo de prevalencia según los niveles de vitamina B12 y de folato sérico establecidos por Kirke, et al.
El número de deficiencias de vitamina B12, aumenta a lo largo de la gestación (tabla 7). Así mismo, cuando analizamos por trimestres la correlación de los niveles con la edad gestacional apreciamos que la tendencia descendente se invierte en el tercer trimestre. Esta peculiaridad también ha sido observada por Caretti, et al.(28), que refieren un descenso de los niveles de vitamina B12 hasta la semana 27 de la gestación, y un leve aumento a partir de ese momento y hasta el final de la misma.
Las gestantes suplementadas con vitamina B12 presentan niveles más altos de esta vitamina (tablas 5 y 6), y de folatos (datos no tabulados). Las diferencias son significativas para el folato sérico en 2.º y 3.er trimestre, y para la propia vitamina B12 en el 2.º También son mayores los niveles de vitamina B12 entre las suplementadas con preparados farmacológicos con folatos (diferencias no significativas y datos no tabulados). El número de gestantes suplementadas con esta vitamina es escaso, y todas ellas además recibieron folatos, por lo que no podemos emitir conclusiones. No obstante, sabemos que son muchas las interrelaciones entre folatos, piridoxina y cobalamina, y especialmente en los procesos de remetilación de la homocisteína, como dejaron patente Steegers-Theunissen, et al.(29).
La siguiente cuestión que nos planteamos es, ¿cómo son los niveles de folato y vitamina B12 de nuestras gestantes respecto a los de otras poblaciones?
A nivel nacional, Navarrete, et al.22) en 1990, encuentran que el 1,6% de las gestantes de Granada tienen menos de 2 ng/ml de folato sérico, determinado entre la 26 y 31 semanas de gestación. El 59,2% de ese mismo grupo, tiene valores inferiores a 6 ng/ml. En este mismo intervalo gestacional, el 9,0% de nuestras gestantes presentan niveles menores de 2 ng/ml, y el 60,0% tienen valores por debajo de 6 ng/ml (la distribución de estos valores no ha sido tabulada). Las diferencias con respeto a este grupo son notorias en cuanto a la frecuencia de niveles extremadamente bajos, mientras que en el nivel de los 6 ng/ml son prácticamente idénticos.
Con los niveles de folato y de vitamina B12 de los grupos de control (gestantes de fetos no afectados por DTN), de los estudios más citados en la bibliografía, hemos elaborado las tablas 10, 11 y 12, en las que comparamos los niveles obtenidos en nuestro estudio, utilizando el mismo período gestacional y el estadístico descrito en los trabajos de referencia. Como puede apreciarse en ellas, los niveles en folato sérico y eritrocitario, y en vitamina B12 de las gestantes de nuestro estudio son superiores en todos los casos a los de las gestantes incluidas en los diferentes estudios comparados, excepción hecha, de los niveles en vitamina B12 de las participantes en el estudio de Mills(30), y de los niveles de folato sérico de las mujeres del estudio de Economides(31).
Tabla 10 Contraste de valores de medias o medianas de vitamina B12 sérica en nuestro estudio vs los grupos control de otros estudios en similares momentos de la gestación | |||||
| Autores: (ref. bibliográfica) | Analizado en | Casos | Vitamina B12 (pg/ml) | Estadístico | |
| Mills, et al. (30) | 1.er trimestre | 178 | 520 | Media | |
| Nuestro estudio | 1.er trimestre | 313 | 308 | Media | |
| Wald, et al.(32) | 1.er trimestre | 75 | 240 | Mediana | |
| Molloy, et al.(14) | 1.er trimestre | 363 | 277 | Mediana | |
| Nuestro estudio | 1.er trimestre | 313 | 286 | Mediana | |
| Kirke, et al.(8) | Captación | 247 | 296 | Mediana | |
| Nuestro estudio | Captación | 406 | 402 | Mediana | |
| Economides, et al.(31) | 2° trimestre | 32 | 230 | Mediana | |
| Nuestro estudio | 2.º trimestre | 313 | 286 | Mediana | |
Tabla 11 Contraste de valores de medias o medianas de folato sérico en nuestro estudio vs los grupos control de otros estudios en similares momentos de la gestación | |||||
| Autores: (ref. bibliográfica) | Analizado en | Casos | Folato sérico (ng/ml) | Estadístico | |
| Smithells, et al.(33) | l.er trimestre | 953 | 6,3 | Media | |
| Mills, et al.(30) | l.er trimestre | 172 | 4,3 | Media | |
| Nuestro estudio | l.er trimestre | 335 | 8,6 | Media | |
| Wald, et al.(32) | l.er trimestre | 36 | 5,7 | Mediana | |
| Nuestro estudio | l.er trimestre | 335 | 7,6 | Mediana | |
| Hall MH(13) | Captación | 1.000 | 6,6 | Media | |
| Nuestro estudio | Captación | 406 | 8,7 | Media | |
| Kirke, et al.(8) | Captación | 247 | 4,6 | Mediana | |
| Molloy, et al.(14) | Captación | 384 | 3,4 | Mediana | |
| Nuestro estudio | Captación | 406 | 7,6 | Mediana | |
| Economides,et al.(31) | 2.º trimestre | 24 | 7,4 | Mediana | |
| Nuestro estudio | 2.º trimestre | 290 | 6,7 | Mediana | |
Tabla 12 Contraste de valores de medias o medianas de folato en hematíes en nuestro estudio vs los grupos control de otros estudios en similares momentos de la gestación | |||||
| Autores: (ref. bibliográfica) | Analizado en | Casos | Folato eritrocitario (ng/ml) | Estadístico | |
| Smithells, et al.(33) | l.er trimestre | 959 | 228 | Media | |
| Nuestro estudio | l.er trimestre | 331 | 378,2 | Media | |
| Wald, et al.(32) | l.er trimestre | 26 | 162 | Mediana | |
| Nuestro estudio | l.er trimestre | 331 | 339 | Mediana | |
| Kirke, et al.(8) | Captación | 247 | 338 | Mediana | |
| Nuestro estudio | Captación | 395 | 350 | Mediana | |
| Laurence, et al.(31) | 2.º trimestre | 47 | 281 | Media | |
| Nuestro estudio | 2.º trimestre | 302 | 492,7 | Media | |
| Economides, et al.(31) | 2.º trimestre | 24 | 400 | Mediana | |
| Nuestro estudio | 2.º trimestre | 302 | 406 | Mediana | |
Concluimos, a tenor de lo expuesto, que nuestros resultados sobre los niveles de folato y de vitamina B12 de las gestantes de Cantabria son comparables en su evolución a lo largo de la gestación con los publicados por otros autores y, en general, más altos que los de otros estudios. No obstante, sólo el 12% de nuestras gestantes tendrían, en el primer trimestre, niveles óptimos de folato protectores de los DTN. Hasta un 68,9% de ellas tendrían niveles con riesgo superior al establecido en otras poblaciones de tener descendencia afectada por un DTN.
BIBLIOGRAFIA
1 MRC Vitamin Study Research Group. Prevention of neural tube defects: Results of the Medical Research Council Vitamin Study. Lancet 1991;338:131-7.
2 Czeizel AE, Dudás I. Prevention of the first occurrence of neural tube defects by periconcepcional vitamin supplementation. New Engl J Med 1992;327:1832-5.
3 Centers for Disease Control. PHS. Use of folic acid for prevention of spina bifida and other neural tube defects: 1983-1991. MMWR 1991;40:513-6.
4 Centers for Disease Control. Recommendations for the use of folic acid to reduce the number of cases of spina bifida and other neural tube defects. MMWR 1992;41(RR-14):1-7. En JAMA 1993;269:1233-8.
5 Ministerio de Sanidad y Consumo. Dirección General de Farmacia y Productos Sanitarios. Circular n.º 1/92. Recomendaciones sobre el uso de ácido fólico como suplemento para prevenir daños en el tubo neural. Madrid, 8 enero 1992.
6 Ou CY, Stevenson RE, Brown BK, Schwartz CE, Allen WP, Khoury MJ, Rozen R, Oakley GP Jr, Adams MJ Jr. 5, 10-metilenetetrahydrofolate reductase genetic polimorphism as a risk factor for neural tube defects. Am J Med Genet 1996;63:610-4.
7 Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Mathews RG, Boers GH, Heijer M, Kluijtmans LA, van den Heuvel LP, Rozen R. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase: isolation of cDNA, mapping and mutation identification. Nat Genet 1995;10:111-3.
8 Kirke PN, Molloy AM, Daly LE, Burke H, Weir DG, Scott JM. Maternal plasma folate and vitamin B12 are independent risk factors for neural tube defects. Q J Med 1993;86:703-8.
9 Marks RG. Determining the proper sample size. En Marks RG, editor. Designing a Research Project. New York: Van Nostrand Reinhold Co; 1982. p. 129-71.
10 Czeizel AE. Limb-reduction defects and folic acid supplementation. Lancet 1995;345:932.
11 Shaw GM, Lammer EJ, Wasserman CR, O''Malley CD, Tolarova MM. Risks of orofacial clefts in children born to women using multivitamins containing folic acid periconceptionally. Lancet 1995;346:393-6.
12 Scanlon KS, Ferencz C, Loffredo CA, Wilson PD, Correa-Villaseñor A, Khoury MJ, Willett WC. Preconceptional folate intake and malformations of the cardiac outflow tract. Baltimore-Washington Infant Study Group. Epidemiology 1998;95-8.
13 Hall MH. Folates and the fetus. Lancet 1977;I:648-9.
14 Molloy A, Kirke PN, Hillary I, Weir DG, Scott JM. Maternal serum folate and vitamin B12 concentrations in pregnancies associated with neural tube defects. Arch Dis Chid 1985;60:660-5.
15 Fabre E. Consulta Preconcepcional. Prog Obstet Ginecol 1998; 41:5-28
16 Wild J, Sutcliffe M, Schorah CJ, Levene MI. Prevention of Neural-tube Defect. Lancet 1997;350:30-1.
17 From The Centers For Disease Control and Prevention. Knowledge and use of folic acid by women of childbearing age--United States, 1997. MMWR 1997;46:721-3. En JAMA 1997; 278:892-3.
18 Bower C, Blum L, O''Daly K, Higgins C, Loutsky F, Kosky C. Promotion Of Folate For The Prevention of neural tube defects: knowledge and use of periconceptional folic acid supplements in Western. Aust N Z J Public Health 1997;7:716-21.
19 Wald NJ. Folic acid and neural tube defects: the current evidence and implications for prevention. Ciba Found Symp 1994;181:192-208. Discussion 208-211.
20 Daly LE, Kirke PN, Molloy A, Weir DG, Scott JM. Folate levels and neural tube defects. Implications for prevention. JAMA 1995;274:1698-702.
21 Chanarin I, Rothmans D, Ward A, Perry J. Folate status and requeriment in pregnancy. BMJ 1968;2:390-4.
22 Navarrete L, Rodríguez E, Ros R, Rodríguez MT, Gilabert MT. Importancia del aporte de folatos y repercusión de los niveles de folatemia sobre madre y feto. Experiencia clínica. En Simposio Internacional «Hierro y Folatos. Repercusiones en la madre y el feto». Hospital Sta. Cristina. INSALUD. Madrid, 29 de Marzo de 1990. p. 63-84.
23 Montoneri C. Carencia de folatos durante la gestación. Tratamiento con ácido folínico. En Simposio Internacional «Hierro y Folatos. Repercusiones en la madre y el feto». Hospital Sta. Cristina. INSALUD. Madrid, 29 de Marzo de 1990. p. 53-62.
24 Ek J, Magnus EM. Plasma and red blood cell folate during normal pregnancies. Acta Obstet Gynecol Scand 1981;60:247-51.
25 Recommended Dietary Allowances. Subcommitee on the Tenth Edition of the RDAs. Food and Nutrition Board Commision on Life Sciences. 1.ª ed. Raciones Dietéticas Recomendadas. Vitaminas hidrosolubles: FOLATOS. Barcelona; Ediciones Consulta 1991. p. 144-53.
26 Hall MH, Pirani BBK, Campbell D. The cause of the fall in serum folate in normal pregnancy. Br J Obstet Gynecol 1976; 83:132-6.
27 Schorah CJ, Smithells RW, Scott J. Vitamin B12 and anencephaly. Lancet 1980;1:880.
28 Caretti N, Eremita GA, Porcelli B, et al. Pattenrs of vitamin B12 and folic acid during pregnancy. Gynecol Obstet Invest 1994; 38:78-81.
29 Steegers-Theunissen RP, Boers GH, Trijbels FJ, Finkelstein JD, Blom HJ, Thomas CM, Borm GF,Wouters MG, Eskes TK. Maternal hyperhomocysteinemia: a risk factor for neural-tube defects? Metabolism 1994;43:1475-80.
30 Mills JL, Tuomilethto J, Yu KF, Colman N, Blaner WS, Koskela P, Rundle WE, Forman M, Toivanen L, Rhoads GG. Maternal vitamin levels durig pregnancies producing infants with neural tube defects. J Pediatr 1992;120:863-71.
31 Economides DL; Ferguson J, Mackenzie IZ, Darley J, Ware II,Holmes-Siedle M. Folate and vitamin B12 concentrations in maternal and fetal blood, and amniotic fluid in second trimester pregnancies complicated by neural tube defects. Br J Obstet Gynaecol 1992;99:23-25.
32 Wald NJ, Hackshaw AD, Stone R, Sourial NA. Blood folic acid and vitamin B12 in relation to neural tube defects. Br J Obstet Gynaecol 1996;103:319-24.
33 Smithells RW, Shepard S, Schorah CJ. Vitamin deficiencies and neural tube defects. Arch Dis Child 1976;51:944-50.
34 Laurence KM, James N, Miller MH, Tennant GB, Campbell H. Double blind randomized controlled trial of folate treatament before conception to prevent recurrence of neural tube defects. BMJ 1981;282:1509-11.