Ginecología
Niveles plasmáticos de ß-endorfina en la dismenorrrea primaria
Plasma levels of ß-endorphin in primary dysmenorrhea
J. Martínez-Guisasola1
J. Ferrer2
F. Díaz3
F. Alonso4
M. Guerrero1
1 Servicio de Obstetricia y Ginecología Hospital «General Yagüe». Burgos
2 Cátedra de Obstetricia y Ginecología Hospital Central de Asturias Facultad de Medicina. Oviedo
3 Departamento de Biología Funcional. Área Fisiología Facultad de Medicina. Oviedo
4 Servicio de Análisis Clínicos. Hospital General Yagüe. Burgos
Correspondencia:
Dr. Javier Martínez-Guisasola Campa
Servicio de Obstetricia y Ginecología
Hospital «General Yagüe»
Avda. del Cid, 96
09005 Burgos
e-mail: jmg@sego.es
Fecha de recepción: 15/6/99
Aceptado para publicación: 16/7/99
RESUMEN
Objetivo: Determinar las concentraciones plasmáticas de ß-endorfina en período menstrual en mujeres con y sin dismenorrea primaria.
Metodología: Estudio descriptivo para determinar las concentraciones plasmáticas de ß-endorfina en 65 mujeres voluntarias con ciclos ovulatorios que se incorporan por muestreo consecutivo. Se administran dos escalas para cuantificar el dolor y establecer los grupos, dismenorreicas (n = 32) y no dismenorreicas (n = 33).
Resultados: Las concentraciones del opiáceo son inferiores en los tres días analizados en la dismenorreica, no presentando significación estadística. El día 1.° del ciclo, día de mayor intensidad dolorosa (escala visual analógica 7,28 vs 1,33 puntos), las concentraciones de ß-endorfina son inferiores (p = 0,09) en las mujeres con dismenorrea (71,84, DE: 28,78 pg/ml vs 86,02, DE: 37,87 pg/ml) difierencia no significativa, pero clínicamente importante. El resto de los días, la disminución de la intensidad dolorosa hace que las concentraciones de ß-endorfina tienda a igualarse entre sendos grupos. Se aprecia una débil correlación negativa entre las concentraciones del opioide y la intensidad dolorosa.
Conclusiones: Las concentraciones plamáticas de ß-endorfina son inferiores en la mujer con dismenorrea respecto a la mujer sin dismenorrea, ello podría explicar, en parte, la mayor sensación dolorosa. La confirmación de los resultados mediante otros estudios permitiría abrir líneas de investigación en cuanto al tratamiento de la dismenorrea primaria.
PALABRAS CLAVE
ß-endorfina; péptidos opioides; dismenorrea;ciclo menstrual.
ABSTRACT
Objective: To know the relationship between plasma ß-endorphin levels and menstrual pain.
Study desing: Prospective desitgn about plasma
ß-endorphin levels in the early follicular phase of 65 volunteer women. They are divided according to the Pain Estimation Tests into 2 groups; women without dysmenorrhea (n = 33) and primary dysmenorrhea group (n = 32).
Results: Upon comparing women with and without painful menstruation no statistical significance is noted in the ß-endorphin levels although on the first day of the cycle, the day of the greatest pain intensity, the difference in these levels is nearly significative (p < 0.1) and is clinically important.
Conclusion: ß-endorphin levels are lower in the women with primary dysmenorrhea than those found in the women without painful menstruation.
KEY WORDS
ß-endorphin; Opioid peptides; Dysmenorrhea; Menstrual cycle.
INTRODUCCIÓN
La dismenorrea primaria, entendiendo como tal el dolor menstrual recurrente en mujeres con ciclos ovulatorios y sin patología orgánica que lo justifique, acompañado o no de otros síntomas, preferentemente de tipo neurovegetativo, es responsable de estrés físico y psicosocial.
La ß-endorfina, péptido derivado de la proopiomelanocortina, es sintetizada en el lóbulo anterior de la hipófisis, en el hipotálamo y en el cerebro, entre otros lugares del organismo(1,2) mediante fragmentación proteolítica de su molécula precursora(1). La ß-endorfina realiza efectos analgésicos al unirse a los receptores mu, delta y probablemente epsilon(3,4). Además de la actividad analgésica interviene en el control neuroendocrino del eje hipotálamo-hipófisis-ovarios, en donde se ha identificado tanto este opiáceo como sus receptores(5-8).
Su implicación en la fisiología del eje reproductor se ha comprobado al apreciar modificaciones en sus concentraciones tanto intracelulares (células del núcleo arcuato del hipotálamo, células hipofisarias y ováricas) como plasmáticas (sangre del sistema porta hipotálamo-hipofisario y sangre periférica) durante el ciclo ovulatorio, la castatración, la menopausia y la terapia hormonal sustitutiva(6,9,10).
A nivel central la ß-endorfina inhibe los pulsos de secreción de GnRH y de LH(6,8,11) y en sangre periférica sus concentraciones plasmáticas durante el ciclo menstrual de la mujer fértil presentan una oleada preovulatoria(6,12-16) que no aparece en el ciclo anovulatorio(12).
La modulación neuroendocrina del estímulo doloroso de origen pélvico está lejos de conocerse y el conocimineto que sobre la modulación de la percepción dolorosa realizan la ß-endorfina y sus receptores es todavía parcial(17). Tanto el cerebro como la hipófisis liberan ß-endorfina en respuesta a los estímulos dolorosos(18) que además se relacionan con los incrementos plasmáticos no sólo del opiáceo sino tambien de la ACTH(19). Se conoce que este opiáceo es un modulador antiálgico(20) cuya acción antinociceptiva la realiza al activar diferentes rutas del sistema inhibidor descendente(21) y al pasar al LCR procedente del núcleo arcuato se distribuye por el SNC uniéndose a sus receptores en diferentes lugares(17).
En sangre periférica se ha apreciado que existe una buena correlación entre la intensidad dolorosa y las concentraciones de ß-endorfina(22) así en mujeres con endometriosis los niveles plasmáticos de opiáceo son inferiores cuando existe dolor que cuando no existe(23,24), dicha endorfina circulante puede proceder de la secreción hipofisaria estimulada por el dolor(25), así como de las células del sistema inmunológico que se acumulan en los órganos en los que se desarrolla el proceso inflamatorio, dichas células liberan ß-endorfina en respuesta a diferentes factores del proceso inflamatorio y activan localmente los receptores opioides de los nervios sensitivos periféricos para inhibir el dolor(26-28).
El presente estudio analiza las concentraciones de ß-endorfina plasmática en mujeres con ciclo ovulatorio durante la fase folicular precoz (menstruación), comparando dichas concentraciones entre mujeres con y sin dismenorrea primaria.
MATERIAL Y METODOS
Se estudian 65 mujeres jóvenes (17-33 años) no sometidas a tratamiento hormonal ni anticonceptivos orales durante al menos los seis meses previos al estudio. Todas presentan ciclos ovulatorios regulares (27,23 ± 6,3 días), comprobándose la ovulación de dos ciclos consecutivos mediante temperatura basal, seguimiento ecográfico de la foliculogénesis y determinación de la progesterona plasmática en la fase lútea media.
La ecografía pélvica permitió, además, descartar patología genital orgánica que pudiera estar relacionada con el dolor menstrual. No se permitió la toma de AINEs, sustancias opiáceas, ni de tranquilazantes que modificasen el componente ansioso del dolor.
Durante la fase folicular precoz (días 1 a 5) del ciclo estudiado se recogieron tres muestras de sangre correspondientes a los días 1, 2 y 4 ó 5 del ciclo, sangre recogida en tubos con anticoagulante edta-K. Inmediatamente se centrifugó dicha sangre para obtener plasma que fue congelado hasta la realización de las diferentes determinaciones hormonales.
La prolactina, LH y FSH, así como el 17ß-estradiol se cuantificaron con los reactivos habituales de nuestro hospital empleando ELISA, mientras que la ß-endorfina fue cuantificada mediante RIA empleando kits de la casa New England Nuclear, cuyos porcentajes de reacción cruzada con la ß-lipotropina fueron del 50% y menores del 0,01% para la *-endorfina, leuencefalina, met-encefalina y *-MSH. Los coeficientes de variación intra e interensayo fueron de 8,2 y 15,1% respectivamente.
Durante la fase menstrual estudiada se analizó la intensidad dolorosa de la menstruación empleando las escalas validadas Visual Analogue Scale-VAS(29) y la Verbal Multidimensional Scoring System-VMSs- (tabla 1), entre los dos sistemas existe correlación(30); ambas escalas nos permitieron clasificar las menstruaciones en dolorosas y no dolorosas.
| Tabla 1 Escala verbal multidimensional para valorar el grado de dismenorrea. Tomado de Andersch(30) | ||||
| Grado | Actividad laboral | Síntomas sistémicos | Analgésicos | |
| 0. | Menstruación no dolorosa, actividad diaria sin afectar | No afectada | Ninguno | No precisa |
| 1. | Menstruación dolorosa levemente que altera escasamente la actividad diaria. | Rara vezalterada | Ninguno | Rara vez precisa |
| 2. | Dolor moderado que afecta la actividad diaria Precisa analgésicos que alivian el dolor evitando la ausencia laboral | Afectada Moderadamente | Escasos | Precisa |
| 3. | Dolor severo asociado a síntomas vegetativos, que reduce la actividad diaria, precisa analgesia | Inhibida | Evidentes | Escaso efecto |
La aplicación de estos test de valoración del dolor a las 65 mujeres (grupo A) nos permitió subdvidirlas en mujeres sin dismenorrea (grupo B) y mujeres con dismenorrea (grupo C), estando formado el grupo B por todas aquellas mujeres cuya puntuación VAS fue menor o igual a 3 y el VMSs igual al grado 0.
El estudio estadístico se realizó con el programa SPSS en la Unidad de Investigación del Hospital, realizando test de Student para la comparación de medias independientes y cálculo de la significación en las variables cuantitativas. La *2 de Pearson se empleó para el análisis descriptivo de las variables cualitativas recogidas en el protocolo de estudio. Se analizó la posible asociación entre la intensidad dolorosa y las concentraciones de ß-endorfina mediante análisis de correlación valorando el coeficiente de correlación de Pearson y la R2, junto con su grado de significación.
RESULTADOS
Comprobado el carácter ovulatorio del ciclo menstrual estudiado y del anterior a éste, son incluidas en el estudio 65 fases foliculares precoces correspondientes a otras tantas voluntarias. En todas ellas las concentraciones plasmáticas de LH, FSH, PRL y 17ß-estradiol se encontraron dentro de los límites normales para la fase del ciclo analizada. Las concentraciones plasmáticas de ß-endorfina quedan representadas en la tabla 2.
Tabla 2 Concentraciones plasmáticas de ß-endorfina (pg/ml) durante el período menstrual en el total de la muestra (grupo A), en mujeres sin dismenorrea (grupo B ) y en mujeres con dismenorrea (grupo C) | |||
| Grupo | Día 1.° | Día 2.° | Días 4.°-5.° |
| A (n = 65) | 79,04 ± 34,20 | 70,66 ± 28,21 | 82,03 ± 35,07 |
| B (n = 33) | 86,02 ± 37,87 | 72,72 ± 30,67 | 83,15 ± 27,82 |
| C (n = 32) | 71,84 ± 28,78 | 68,54 ± 25,74 | 80,87 ± 41,68 |
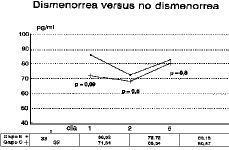
Durante la fase folicular precoz del grupo constituido por todas las voluntarias (grupo A) las concentraciones del opiáceo demuestran un descenso significativo entre el primer y segundo día del ciclo menstrual, seguido de un ascenso en el día 4 ó 5 respescto al 2.° día del ciclo (p < 0,005). Dichas concentraciones representa los niveles plasmáticos de ß-endorfina durante la menstruación (Fig. 1).
Figura 1. Concentraciones plasmáticas medias y su correspondiente desviación estándar en pg/ml de ß-endorfina durante la fase folicular precoz de la mujer. (n = 65).
El estudio comparativo de las mujeres con y sin dismenorrea primaria (grupos C y B) no demuestra diferencias generales entre ambos en cuanto a edad, edad de la menarquia, tipo de ciclo, nivel de estudios, consumo de tabaco, alcohol, dismenorrea familiar, etc. Diferencias que evidentemente sí aparecen al analizar la variable dismenorrea primaria.
En las mujeres con dismenorrea primaria, el 78% refirieron el dolor como tipo cólico, frente al 22% que indicaron el dolor como cólico y congestivo, el 84% localizaron el dolor en el hipogastrio y el resto (16%) abdominal, también un 84% indicó irradiación del dolor fuera de la pelvis y un 83% presentó sintomatología asociada al dolor pélvico (náuseas, vómitos, cefalea, etc).
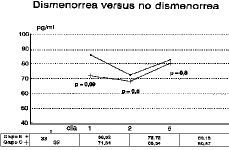
Las concentraciones de ß-endorfina durante la fase folicular precoz no demuestran diferencias estadísticamente significativas en ninguno de los días estudiados entre las mujeres con y sin dismenorrea primaria (grupos C y B) (Fig. 2) siendo inferiores en el grupo de voluntarias con dismenorrea (tabla 2), si bien en el primer día del ciclo, día de máxima intensidad dolorosa, las concentraciones de opiáceo son notablemente inferiores en las mujeres con dolor menstrual (p = 0,09).
Figura 2. Concentraciones plasmáticas de ß-endorfina durante la menstruación de mujeres sin dismenorrea (grupo B) y con dismenorrea (grupo C). La diferencia entre las medias de ambos grupos es de 14,18 pg/ml, lo cual aunque no es estadísticamente significativo (p = 0,09) sí es clínicamente importante, siendo los niveles entorno a un 20% superiores en las mujeres sin dolor menstrual.
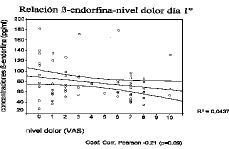
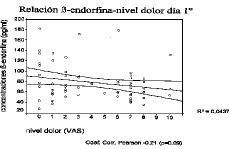
Con los resultados obtenidos el primer día del ciclo, se analiza la relación entre las concentraciones de ß-endorfina y el nivel de dolor (ausente, leve, moderado y severo) mediante análisis de la varianza, no obteniéndose resultados significativos (p = 0,04), cuando el estudio de correlación se realiza respecto a la variable cuantitativa dolor medida por la escala visual analógica se observa una débil asociación lineal negativa entre ambas variables (coef. correlación Pearson = 0,21; p = 0,09), la falta de significación estadística puede ser explicada por el reducido tamaño muestral así como por las amplias desviaciones estándar de las concentraciones de opiáceo (Fig. 3). Estos resultados sólo permiten indicar una débil asociación negativa entre el dolor y las concentraciones de ß-endorfina en el primer día de menstruación.
Figura 3. Representación gráfica de la correlación existente entre los niveles de dolor según la escala visual analógica y las concentraciones plasmáticas de ß-endorfina en el primer día menstrual.
DISCUSIÓN
En el conjunto de la muestra se aprecia que durante la fase folicular precoz del ciclo ovulatorio de la mujer las concentraciones de ß-endorfina disminuyen entre el primer y segundo día del ciclo, incrementándose posteriormente, al comenzar la fase folicular media, hasta igualarse a las observadas el primer día del ciclo. Ello coincide, en parte, con los resultados aportados por el grupo de Laatikainen(14), que indica un significativo descenso de las concentraciones de ß-endorfina entre los días 1.° y 2.° del ciclo, pero seguido en el día 5.° del ciclo por unas concentraciones aún menores.
Según estos resultados, durante el primer día del ciclo, día de inicio de la menstruación, las mayores concentraciones de opiáceo respecto a días posteriores podrían reflejar un mecanismo de adaptación del organismo al estrés físico que para el organismo de la mujer supone el inicio de la menstruación, descendiendo dicha reacción a medida que el organismo se adapta. El descenso de ß-endorfina se inicia ya en el día previo a la menstruación, que es cuando las concentraciones perimenstruales son máximas, y continua durante la fase folicular precoz(31), al finalizar esta fase el opiáceo plasmático se incrementa posiblemente estimulado por el progresivo incremento de 17-ß-estradiol en sangre secundario al desarrollo folicular y al descenso de las prostaglandinas circulantes(25).
Este patrón plasmático descendente de la ß-endorfina se aprecia tanto en presencia como en ausencia de dolor menstrual, presentando las mujeres con dismenorrea unas concentraciones inferiores respecto a las no dismenorreicas todos los días de la fase menstrual, igualándose los niveles de la ß-endorfina en ambos grupos al finalizar la menstruación, esto puede apoyar que durante la menstruación la producción de opioide es diferente según exista o no dolor.
Las concentraciones en tejido endometrial de prostaglandinas se mantienen constantes durante el ciclo ovulatorio, incrementándose en la fase lútea tardía y durante la menstruación(32). En la mujer con dismenorrea las concentraciones de prostaglandinas, tanto en fluido menstrual como en el propio endometrio, son aún superiores a las presentes en la mujer no dismenorreica(33,34) y se conoce que la prostaglandina E inhibe la secreción de ACTH y ß-endorfina por las células corticotropas de la hipófisis anterior(25), por ello sería explicable que las menores concentraciones plasmáticas de endorfina en la mujer dismenorreica sean debidas a una mayor producción endometrial de prostaglandina.
Además de este estado opioide general de la mujer durante la menstruación, se conoce que a nivel local el sistema inmune interviene en la modulación del dolor, así se ha demostrado que las células inmunes con alto contenido opiode se desplazan hacia los lugares en los que se desarrolla una reacción inflamatoria para liberar entonces ß-endorfina que inhiba el dolor mediante la activación de receptores opioides locales(28). En la dismenorrea primaria, en los días perimenstruales, la mayor concentración de ß-endorfina almacenada en el interior de los monocitos ocurre en el tercer día de ciclo y este acúmulo es superior en la mujer dismenorreica respecto la mujer sin dolor menstrual(28), el acúmulo de opiáceo dentro de los monocitos y su posterior liberación local puede explicar que las concentraciones plasmáticas de opioide se igualen entre los grupos a medida que se supera la situación de estrés y que la intensidad dolorosa de las mujeres con dismenorrea decrezca a partir de entonces.
En mujeres con dolor menstrual primario, el día de mayor intensidad dolorosa, apreciamos que las concentraciones de ß-endorfina son notablemente inferiores a las presentes en las mujeres sin dismenorrea primaria. En mujeres con endometriosis, las concentraciones plasmáticas de endorfina durante la fase lútea son inferiores respecto a las mujeres sin endometriois y al comparar dentro del grupo de mujeres con endometriosis, dichos niveles son inferiores en las mujeres que asocian dolor respecto a las que no lo asocian, estableciendo una posible relación entre dolor y concentraciones de endorfina(24), asociación no encontrada por otros autores(22) y que nosotros tampoco demostramos feacientemente en la dismenorrea primaria.
En las primeras 24-48 horas, en la mujer con dismenorrea los menores niveles circulantes de endorfina podrían explicar una mayor sensibilidad general al dolor, situación que debe ser asociada a las elevadas concentraciones de prostaglandinas a nivel uterino responsables del dolor local. Probablemente en el alivio de la sensación dolorosa señalado a partir de entonces sea debido, por un lado, al incremento de la endorfina circulante y, por otro, a la mayor actividad analgésica de los opiáceos a nivel local, procedentes de células inmunes que han alcanzado el foco inflamatotio. Todo ello sin olvidarse de la menor concentración local de prostaglandinas secundaria al menor contenido mucoso por la descamación previa, y se sospecha que este opiáceo también puede reducir los efectos que la Pg E ejerce sobre su propio receptor, además de que posiblemente la endorfina antagonice la síntesis de prostaglandina E(35,36).
Nuestro estudio apoya la hipótesis, aunque de manera no significativa, que el día de máxima intensidad dolorosa los niveles plasmáticos de ß-endorfina en mujeres con dismenorrea primaria son manifiestamente inferiores respecto a los observados en menstruaciones no dolorosas, ello según lo expuesto por Backon(36), implica una menor actividad analgésica mediada por los opiáceos y un menor bloqueo tanto de la síntesis de prostaglandina E y de sus receptores.
BIBLIOGRAFIA
01 Eipper BA, Mains RB. Structure and biosynthesis of proadrenocorticotropin/endorphin and related peptides. Endocr Rev 1980;1:1-27.
02 Emerson RB, Eipper BA. Characterization of pro-ACTH/endorphin derived peptides in rat hypothalamus. J Neurosci 1986;6:837-49.
03 Facchinetti F, Petraglia F, Genazzani AR. Localization and expression of the three opioid systems. Sem Reprod Endocrinol 1987;5:103-13.
04 Narita M, Tseng LF. Evidence for the existence of the ß-endorphin sensitivite «epsilon opioid receptor» in the brain: the mechanisms of epsilon mediated antinociception. Jpn J Pharmacol, 1998;76:233-53.
05 Watkins NB. Presence of adrenocorticotropin and ß-endorphin immunoreactivities in the magnocellular neurosecretory system of the rat hypothalamus. Cell Tissue Res 1980;207:65-80.
06 Kerdelhue B, Parnet P, Lenoir V, et al. Interaction between 17-ß-estradiol and the hypothalamo-pituitary ß-endorphin system in the regulation of the cyclic LH secretion. J Steroid Biochem 1988;30:161-8.
07 Aleem FA, Omar RA, Eltabbakh GH. Immunorreactive ß-endorphin in human ovaries. Fertil Steril 1986;45:507-11.
08 Ferin M, Van Vugt D, Wardlaw S. The hypothalamic control of the menstrual cycle and role of endogenous opioid peptides. Recent Prog Horm Res 1984,40:441-85.
09 Jirikowski GF, Merchentaler I, Rieger GE, Stumpf WE. Estradiol target sites immunorreactive for ß-endorphin in arcuate nucleus of rat and mouse hypothalamus. Neurosci 1986;65: 121-6.
10 Wardlaw SL, Wehrembreg WB, Ferin M, Antunes JL, Frantz AG. Effect of sex steroids on ß-endorphin in hypophyseal portal blood. J Clin Endocrinol Metab 1982;55:877-81.
11 Veldhius JD, Rogal AD, Sahson ML, Dufan ML. Endogenous opiates modulate the pulsatile secretion of biologically active luteinizing hormone in man. J. Clin Invest 1990;72:2031-6.
12 Petraglia F, Di Meo G, De Leo V, Nappi C, Facchinetti F, Genazzani AR. Plasma ß-endophin levels in anovulatory states: changes after treatment for the induction of ovulation. Fertil Steril 1986;45:185-90.
13 Tang LCH, Chan SYW, Tang GWK, Ma HK. Serum immunorreactive ß-endorphin in the human ovulatory cycle. Int J Fertil 1987;32:149-51.
14 Laatikainen T, Raisanen I, Tulenheimo A, Salminen K. Plasma ß-endorphin and the menstrual cycle. Fertil Steril 1985;44: 206-9.
15 Vrbicky KW, Baumstark JS, Wells IC, Hilgers TW, Kable WT, Elias CJ. Evidence for the involvement of ß-endorphin in the human menstrual cycle. Fertil Steril 1984,38:701-4.
16 Ferrer J, Martínez-Guisasola J, Díaz F, Alonso F, Guerrero M, Marin B. Plasma levels of ß-endorphin during the menstrual cycle. Gynecol. Endocrinol 1997;11:75-82.
17 Bach FW. ß-endorphin in the brain. Acta Anaesthesiol Scan 1997;41:133-40.
18 Zangen A, Herzberg U, Vogel Z, Yadid G. Nociceptive stimulus induces release of endogenous ß-endorphin in the rat brain. Neuroscience 1998;85:659-62.
19 Aloisi AM, Albonetti ME, Muscettola M, Facchinetti F, Tanganelli C, Carli G. Effects of formalin induced pain on ACTH, ß-endorphin, corticosterone and interleukin 6 plasma levels in rats. Neuroendocrinology 1995;62:13-8.
20 Monroe PJ, Hawranko AA, Smith DL, Smith DJ. Biochemical and pharmacological characterization of multiple ß-endorphinergic antinociceptive systems in the rat periaqqueductal gray. J Pharmacl Exp Ther 1996;276:65-73.
21 Suh HW, Song DK, Choi SR, Huh SO, Kim YH. Differential effects of omega-conotoxin GVIA, nimodipine, calmidazolium and KN-62 injected intrathecally on the antinociception induced by ß-endorphin, morphine and (D-Ala 2, N-MePhe4, Gly-o15) enkephalin administered intracerebroventriculary in the mouse. J Pharmacl Exp Ther 1997;282:9617-6.
22 Bernstein L, Garzone PD, Rudy T, Kramer B, Stiff D, Peitzman A. Pain perception and serum beta-endorphin in trauma patients. Psychosomatics 1995,36:2767-84.
23 Vercellini P. Endometriosis: What a pain it is. Semin Reprod Endocrinol 1997;15:251-61.
24 Yu CQ, Zhai MF, Yao RM. Effect of nei-yi recipe on plasma ß-endorphin levels during menstrual cycle in women with endometriosis. Chung Kuo Chung Hsi Chieh Ho Tsa Chic 1995; 15:6-8.
25 Troullos E, Hargreaves KM, Dionne RA. Ibuprofen elevates immunoreactive ß-endorphin levels in humans during surgical stress. Clin Pharmacol Ther 1997;62:74-81.
26 Machelska H, Cabot PJ, Mousa SA, Zhang Q, Stein C. Pain control in inflamation governed by selectins. Nat Med 1998;4: 1425-8.
27 Schafer M, Carter L, Stein C. Interleukin I beta and corticotropin releasing factor inhibit pain by releasing opioids from immune cells in inflamed tissue. Proc Nat Acad Sci USA 1994; 91:4219-23.
28 Marchini M, Manfredi B, Tozzi L, Sacerdote P, Panerai A, Fedele L. Mitigen induced linfocyte proliferation and peripheral blood mononuclear cell ß-endorphin concentrations in primary dysmenorrhoea. Human Reprod 1995;10:815-7.
29 Melzack R. The McGill pain questionnaire: a major properties and scoring methods. Pain 1975;1:277-99.
30 Andersch B, Milson A. An epidemiologic study of young women with dysmenorrhea. Am J Obstet Gynecol 1982;144:655-60.
31 Ferrer J, Martínez-Guisasola J, Díaz F, Ríos JM, Marín B. Concentraciones plasmáticas de ß-endorfina en el período perimenstrual. Prog Obst Gin 1994;37:563-8.
32 Downie J, Poyser NL, Wunderlich M. Levels of prostaglandins in human endometrium during the normal menstrual cycle. Am J Obstet Gynecol 1974;140:874-9.
33 Chan WY, Daweood MY. Prostaglandins levels on menstrual fluid of non-dysmenorrheic and dysmenorrheic subjects with and without oral contraceptives or ibuprofen. Adv Prostaglandin Tromboxane Res 1980;8:1443-47.
34 Lumsden MA, kelly RW, baird DT. Primary dysmenorrhea: the importance of both prostaglandins E2 and F2*, Br J Obstet Gynecol 1985;64:183-6.
35 Dawood MY. Current concepts in the etiology and treatment of the primary dysmenorrhea.Acta Obstet Gynecol Scand 1986;138 Supl:7-10.
36 Backon J. Negative correlation of cigarrette smoking and dysmenorrhea: reduced prostaglandin synthesis due to ß-endorphin, nicotine or acrolein antagonism. Med Hypoth 1989; 28: 213-4.