Ginecología
Tumor epitelial limítrofe (borderline) del ovario: estudio de 33 casos
Borderline epithelial tumor of the ovary: study of 33 cases
M. Cusidó
A. Sas
F. Treserras1
P. Grases1
R. Labastida
Departamento de Obstetricia y Ginecología
1 Departamento de Anatomía Patológica
Institut Universitari Dexeus. Barcelona
Correspondencia:
M.Cusidó
Institut Universitari Dexeus
Departamento de Obstetricia y Ginecología
Paseo Bonanova, 67
08017 Barcelona
Fecha de recepción: 17/12/98
Aceptado para publicación: 22/3/99
RESUMEN
Objetivo: Mostrar nuestra experiencia con los tumores limítrofes del ovario. Se ha estudiado un total de 33 tumores limítrofes del ovario con un seguimiento medio de 51 meses. El 85% de los casos estaban en estadio I y el 15% en estadio III. El tratamiento realizado fue conservador en el 54% de los casos en estadio I y radical en todos los estadios III. Se realizó quimioterapia a las pacientes en estadio III. El 55% de los tumores eran de la variedad serosa y el 30% mucinosos. La supervivencia para el estadio I es del 100% y para el estadio III del 80%.
Conclusiones: La buena evolución de estos tumores y la gran incidencia de mujeres en edades reproductivas hace que el tratamiento conservador esté en la primera línea de las opciones terapéuticas. No queda claro la necesidad de realizar terapia adyuvante a todas las pacientes en estadios avanzados. Se debe destacar la alta tasa de pacientes con antecedentes de esterilidad y/o tratamientos con drogas inductoras de la ovulación. Es necesario que se realicen trabajos prospectivos donde se analice la necesidad del tratamiento adyuvante para poder consensuar la terapia adecuada en este tipo de tumores.
PALABRAS CLAVE
Tumores limítrofe del ovario; Tratamiento; Quimioterapia; Esterilidad.
SUMMARY
Objective: With the aim of review our experience in the management of ovarian borderline tumors, a total of 33 cases with a mean follow-up of 51 months have been studied. A 85% of the cases were in stage I and 15% in stage II at the diagnosis. The treatment performed was conservatory in 54% of cases in stage I and radical in al patients in stage III, in these patients the surgery was followed by chemotherapy. A 55% of the tumor were serous and a 30% mucinous. The survival rate, was of 100% for patients in stage I and of 80% for those in stage II.
Conclusions: The good prognosis of ovarian borderfine tumors and their presentation in reproductive-age-females makes conservatory treatment be the first therapeutical choice. The role of chemotherapy as adjuvant therapy is uncertain. A point of interest is the high rate of previous history of infertility and/or ovulatory induction drugs in the patients of our serie. Prospective studies with the purpose of consensuate the adequate therapy and the role of adjuvant therapies are needed.
KEY WORDS
Ovarian borderline tumors; Treatment; Chemotherapy, Sterility.
INTRODUCCIÓN
Los tumores limítrofes del ovario fueron descritos en 1929 por Taylor(1), denominándolos tumores semimalignos, y los identificó como tumores caracterizados por un relativo buen pronóstico comparado con otros carcinomas. Posteriormente se reconocieron como una entidad clínico-patológica diferente. Este tipo de tumor posee unas características tanto histológicas como biológicas sobre las cuales existe consenso. En cambio, en la literatura hay controversia en cuanto a su tratamiento.
En 1971, la International Federation of Gynecology and Obstetrics (FIGO)(2), los reconoció como cistoadenomas con actividad proliferativa de las células epiteliales y atipias nucleares, pero sin invasión destructiva del estroma. La Organización Mundial de la Salud (OMS)(3) en 1973 los definió como «aquellos tumores que tienen alguna, pero no todas las características morfológicas de malignidad; entre éstas se incluyen en combinaciones variables: estratificación celular, anaplasia, mitosis anormales y atipias nucleares, sin existir clara invasión del estroma». De esta forma, el único criterio que distingue a los tumores limitrofes del ovario de los cánceres, es la invasión franca del estroma(4,5).
Los tumores limítrofes del ovario representan entre un 11-15% de todos los tumores malignos ováricos(6). El 95% de ellos son de la variedad serosa o mucinosa, aunque también se han descrito del tipo endometrioide, mixtos y de células de Brenner(7-9).
Estos tumores, dada su progresión larvada, suelen diagnosticarse en estadios iniciales, habitualmente Ia y sólo en un 15% se hallan en estadio avanzado en el momento del diagnóstico(7). Todavía resulta controvertida la evolución y supervivencia de las pacientes con tumores limítrofe diagnosticados en estadio avanzado. Aunque su evolución es claramente mejor que en los carcinomas invasivos(9), se ha publicado una morbilidad y mortalidad de un 30-40%(10) la cual está asociada básicamente a complicaciones como la invasión peritoneal progresiva, las adherencias y obstrucciones intestinales asociadas a implantes peritoneales y los efectos secundarios de los tratamientos adyuvantes. Excepcionalmente, en un 0,8%, se ha descrito la progresión a un carcinoma invasivo(11). Kurman(12), en un análisis de 22 series con un total de 953 pacientes refiere una supervivencia para los estadios I del 99%. Seidman confirma estos resultados(13). En los estadios avanzados, la supervivencia descrita es del 92%(12). La mayoría de pacientes con tumores limítrofe presentan la misma supervivencia que los controles sanos de su misma edad(4).
Puesto que este tipo de carcinomas tienen una evolución generalmente poco agresiva y por tanto un buen pronóstico, no existe consenso ni protocolo establecido en cuanto a su tratamiento. Mientras que unos autores optan por realizar un tratamiento quirúrgico conservador únicamente(12,14,15), otros realizan cirugía reglada en función del estadio(16,17).
Se presenta nuestra experiencia con este tipo de tumores durante los últimos años.
MATERIAL Y MÉTODOS
Se ha realizado un estudio retrospectivo sobre 33 carcinomas limítrofes del ovario, diagnosticados y tratados en nuestro centro en el período comprendido entre los años 1982 y 1997 (15 años). La estadificación de los tumores fue quirúrgica según la clasificación de la FIGO de 1990. La media de seguimiento para el grupo completo fue de 51 meses. El seguimiento medio de las pacientes en estadio I (E I) fue de 50 meses (rango entre 4-170 meses), y de 57 meses (rango: 9-122 meses) para el estadio III (E III). En nuestro estudio no había ninguna paciente en estadio II.
La edad media de las pacientes fue de treinta y nueve años con un rango entre diecinueve años y setenta y un años años. Para el E I, la edad media fue de treinta y ocho años (19-71) y para el E III de cuarenta y cinco años (35-53).
Debemos destacar también que el 18,2% (seis casos) de las pacientes presentaban antecedentes de esterilidad y cuatro de ellas (12,1% del total) habían sido sometidas a inducciones de la ovulación para ciclos de inseminación artificial o fecundación in vitro (FIV). De las pacientes tratadas con cirugía conservadora tres de ellas fueron sometidas a FIV.
El tratamiento realizado fue conservador entendiendo como tal la anexectomía unilateral o la quistectomía, en todas aquellas pacientes en EI con deseos genésicos, lo que representa un 54% de los casos en EI (15 pacientes). La quistectomía se ha realizado en cuatro ocasiones (14%). En el resto de pacientes se realizó histerectomía total abdominal + anexectomía bilateral. En todos los casos de EIII se realizó tratamiento radical: histerectomía total + anexectomía bilateral. En el 50% de los casos, independientemente del estadio se realizó cirugía de estadificación consistente en omentectomía, apendicectomía y linfadenectomía pélvica y aórtica (tablas1 y 2).
Tabla 1 Tipo de tratamiento según estadio | ||
| EI | EIII | |
| Conservador | 15 | 0 |
| Radical | 13 | 5 |
Tabla 2 Tipo de tratamiento según edad | ||
| < 40 años | > 40 años | |
| Conservador | 15 | 0 |
| Radical | 2* | 16 |
| * Estadio IIIc. | ||
El tratamiento adyuvante se planteó únicamente para los estadios avanzados, realizándose en el 75% de los EIII. Éste fue mediante quimioterapia (CMF). No se realizó radioterapia a ninguna de las pacientes. En el resto de las enfermas se realizaron controles clínicos y marcadores tumorales cada seis meses.
Todas las pacientes han sido controladas posteriormente en nuestro centro con un control medio de 51 meses, con un rango de cuatro a 170.
RESULTADOS
Sobre un total de 33 carcinomas limítrofes se hallaron 28 casos en estadio I que representan un 85% del total (18 = EIa, 3 = EIb y 7 = EIc), ningún caso en EII y 5 en EIII que son un 15% (dos en EIIIa y tres en EIIIc). Cabe destacar que en dos casos en estadio I se produjo ruptura capsular del quiste durante la intervención lo que representó el cambio de estadiaje pasando de un EIa a un EIc (tabla 3). En el 21% de los casos los tumores fueron bilaterales.
| Tabla 3 Tumores epiteliales limítrofes del ovario. Estadiaje | ||||
| N | % | |||
| Estadio I | 28 | 85 | ||
| Estadio Ia | 18 | |||
| Estadio Ib | 3 | |||
| Estadio Ic | 7 | |||
| Estadio III | 5 | 15 | ||
| Estadio IIIa | 2 | |||
| Estadio IIIb | 3 | |||
El 15% de pacientes tenía un crecimiento exofítico del tumor (excrecencias en la superficie del ovario), y de éstos, un 12% presentaba a su vez implantes peritoneales. Cuando se analizan las pacientes con implantes peritoneales, se puede observar que el 50% de las mismas tenían excrecencias tumorales. En ninguno de los casos los implantes peritoneales fueron invasivos.
El estudio anatomopatológico mostró mayoritariamente (55%) la variedad serosa. El tipo mucinoso se halló en un 30% de los casos, y en el 15% se trataba de un tumor sero-mucoso.
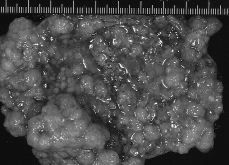
En la mayoría de los tumores limítrofes serosos encontramos un quiste unilocular de dimensiones variables, con múltiples excrecencias intraquísticas y papilas superficiales, predominantemente friables. El contenido era seroso y ocasionalmente turbio o hemorrágico. En los tumores limítrofes mucinosos se trataba de una lesión multilocular, desprovista de papilas y de mayor tamaño. El contenido era mucinoso y raramente hemorrágico. En los tumores seromucinosos se apreciaron rasgos combinados de cada una de las variedades mencionadas aunque para ello fuera necesario el estudio microscópico de muestras representativas de la lesión (Fig. 1).
Figura 1. Tumor limítrofe seroso: superficie interna de una lesión quística del ovario mostrando la presencia de múltiples excrecencias friables.
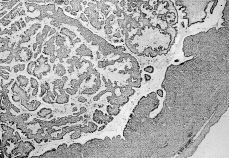
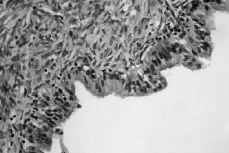
Microscópicamente ninguno de los casos mostró proliferación epitelial con infiltración ostensible del estroma. Se cumplieron los criterios de una proliferación del revestimiento epitelial con formación de menos de tres hileras celulares, con atipias nucleares y presencia de una cantidad variable de mitosis (Figs. 2 y 3).
Figura 2. Tumor limítrofe seroso: aspecto microspópico de una lesión constituida por papilas revestidas por células cúbicas con atipia nuclear. No se aprecia infiltración del estroma.
Figura 3. Tumor limítrofe mucinoso: aspecto microscópico de una lesión quística revestida por un epitelio cilíndrico, mucosecretor, con pesudoestratificación nuclear inferior a cuatro capas.
Todas excepto una paciente en estadio III estaban vivas en el momento del último control clínico. Esta falleció a consecuencia de la aparición como complicación de un pseudomixoma peritoneal. Esta misma paciente fue la única que presentó recidiva del tumor. La supervivencia hasta el momento actual para el estadio I es del 100% y para el estadio III del 80%.
DISCUSION
El predominio de pacientes en edad reproductiva pertenecientes a esta serie, hace que el tratamiento conservador esté en la primera línea de las opciones terapéuticas. Consideramos que dicho tratamiento es una buena estrategia en los estadios iniciales, aunque se aconseja cirugía de estadiaje. La apendicectomía debe realizarse de manera rutinaria en los tumores mucinosos por el riesgo de existir un tumor mucinoso intestinal sincrónico(4). Tazelaar, et al.(14) en una serie de 61, no halló tumor microscópico en ovarios macroscópicamente normales, por lo que no debe extirparse el ovario contralateral en una mujer joven con deseos de fertilidad aunque en ocasiones se han descrito lesiones precursoras en el ovario contralateral de mujeres con cáncer ovárico unilateral(18).
En nuestra serie, ninguno de los 15 casos tratados mediante cirugía conservadora ha recidivado tras 51 meses de seguimiento. Kennedy(12) por el contrario halla dos recurrencias entre 38 pacientes tratadas con cirugía conservadora. En la recopilación del GOG Barnhill(15) no halla recidivas en ninguna de las 146 pacientes tratadas de manera conservadora en su estudio. En este mismo trabajo, se considera la realización de una quistectomía en comparación con una ooforectomía, una terapéutica adecuada(10). En nuestra serie hay cuatro casos donde el tratamiento realizado únicamente ha sido la quistectomía. Las pacientes se hallan libres de enfermedad a los 24 meses de seguimiento, respectivamente.
Consecuentemente, cuando el diagnóstico de un tumor de baja malignidad se realiza a posteriori, no sería necesario extirpar el ovario preservado, puesto que el riesgo de recurrencia o de desarrollo de un nuevo tumor es del 10 al 15%, y la cirugía en estos casos suele ser fácil(12). La frecuencia de bilateralidad de los tumores de baja malignidad varía entre un 33% y un 75%(4). Nuestros casos requerirán mayor tiempo de seguimiento para poder confirmar estos datos.
Segal y Hart(19), ya en 1992, hallaron una importante relación entre la afectación de la superficie del ovario y la aparición sincrónica de implantes peritoneales. La presencia de tumor en la superficie del ovario, se halla en el 94% de las pacientes con implantes peritoneales. Cuando existe afectación más allá de los limites de la cápsula, el 62% de las pacientes presentan a su vez implantes peritoneales. Esta evidente relación plantea que aquellas pacientes con tumores en estadio I (limitados a los ovarios) que además posean afectación exofítica de la superficie, tendrán un riesgo aumentado de presentar implantes peritoneales. En nuestra experiencia no se ha hallado una correlación tan fuerte como la descrita a pesar de que existía una intensa correlación.
Los tumores en estadios avanzados merecen mención aparte dado su peor pronóstico. En estos casos sí parece consensuado que el tratamiento quirúrgico debe ser radical(12). Pero no está tan claro el papel que debe jugar la terapia adyuvante. Dados los buenos resultados descritos en la literatura en estos casos sin tratamiento adyuvante, puede ponerse en duda la necesidad del mismo, sobre todo en ausencia de gran tumor residual tras la cirugía(12). Los estadios II y III sin tratamiento adyuvante presentan una supervivencia libre de enfermedad a los 131 y 143 meses respectivamente(12). Además, gran parte de la morbilidad y mortalidad asociada a los tumores en estadio avanzado es debida a los efectos secundarios de dichas terapias. Raramente mueren pacientes a consecuencia de la progresión del tumor o a la malignización del mismo, 0,8% de los casos (un caso de 76 en la serie de Kennedy(12) y ocho de 953 en el estudio de Kurman(11)). En los pocos casos descritos de malignización, las pacientes habían recibido previamente tratamiento quimioterápico(12). Todos los autores coinciden en que las pacientes mueren más por las complicaciones de la enfermedad como la obstrucción intestinal asociada a la fibrosis producida por los implantes peritoneales que de carcinomatosis(11,12). En nuestra serie, únicamente una paciente en estadio avanzado ha muerto por una complicación de la enfermedad. La complicación se presentó en forma de un pseudomixoma peritoneal. Se ha descrito una peor supervivencia para las pacientes con tumores variedad mucinosa por la posibilidad de aparición de un pseudomixoma peritonea(14). En la serie de Nakashima sobre 52 pacientes, siete de las muertes descritas fueron a consecuencia de un pseudomixoma peritoneal(8).
La supervivencia hallada en nuestra serie, de un 100% para los estadios iniciales, y de un 80% para los avanzados, es perfectamente superponible a la serie de Kurman(11) (953 casos a partir de 22 series) con un seguimiento medio de siete años. En este estudio se cuestiona si los tumores borderline son realmente tumores malignos(11). Sobre 538 pacientes en estadio I halla un 99% de supervivencia con o sin enfermedad, y sobre 415 pacientes en estadio II o III un 92%. Posteriormente, Burks(5) describe el tumor seroso micropapilar, el cual presenta características histológicas propias. Puesto que estas neoplasias no presentan invasión del estroma, se habían clasificado previamente como tumores limítrofe, pero dada la diferente evolución clínica con aparición de recidivas y diseminación, deberían considerarse un grupo aparte de los tumores limítrofe del ovario y de los carcinomas claramente invasivos(5,13). Anatomopatológicamente se caracterizan por la formación de pseudopapilas adoptando un patrón en filigrana o cribiforme(5,13). En la serie de Seidman(13), con 11 casos de carcinoma seroso micropapilar, los implantes peritoneales fueron considerados invasivos en 10 casos (91%). En siete de los casos, los implantes tenían un crecimiento exofítico complejo caracterizado por la presencia de micropapilas como las del tumor principal.
El hallazgo mayoritario de tumores de la variedad serosa frente a los mucinosos en nuestra serie, no concuerda con los estudios de Klitman, et al.(7), Saygili, et al.(20), o los de Nakashima, et al.(8) en Japón, los cuales hallan una mayor frecuencia de carcinomas variedad mucinoso. Nakashima atribuye este hecho debido a una baja prevalencia del seroso, no a la elevada frecuencia del mucinoso(8).
Piura et al.(9), en Israel, realizó un estudio sobre 50 casos con unos resultados superponibles a los nuestros con un 64% tipo seroso y un 34% mucinoso. En un 2% de los casos el diagnóstico era de tumor endometrioide.
La valoración intraoperatoria del tumor es muy importante para el diagnóstico y para el tratamiento, ya que permite realizar la cirugía definitiva en un único acto. Aunque la sensibilidad y especificidad de este método es alta en las neoplasias malignas y benignas del ovario, es menor en los tumores limítrofe. Sobre una revisión retrospectiva de 383 casos, se observó que la sensibilidad de la biopsia peroperatoria en tumores malignos y para los tumores limítrofes era del 92,5% y 44,8% respectivamente(20).
En ninguno de nuestros casos se hallaron implantes peritoneales invasivos, siendo todos ellos no invasivos a diferencia de las últimas referencias publicadas. Kennedy(12), en su serie de 76 halla cuatro casos de microinvasión que desarrollaron recidiva del tumor y están vivos entre 27 y 156 meses después de la cirugía inicial. Tres de estos cuatro pacientes recibieron quimioterapia. Estos hallazgos confirman los ya descritos que el hallazgo de microinvasión estromal en el contexto de un tumor limítrofe típico, no necesariamente empeora el pronóstico y no garantiza el diagnóstico de un carcinoma seroso invasivo(21).
Un grupo de investigadores describe la presencia de invasión ganglionar subclínica en el 14-23% de los casos a los que se les practica una linfadenectomía. Concluyen con que la invasión de los ganglios linfáticos no afecta significativamente la supervivencia, pero los pacientes con enfermedad intraperitoneal localizada presentan con más frecuencia recurrencia de la enfermedad si tienen ganglios positivos que si éstos son negativos(10,22). Este hecho parece justificar la necesidad de realizar una correcta cirugía de estadiaje en todos los casos(23).
Se debe destacar la alta tasa de pacientes con antecedentes de esterilidad y/o tratamientos con drogas para la fertilidad que presentan este tipo de tumores. El meta-análisis realizado por el Collaborative Ovarian Cancer Group halló como factores protectores contra el desarrollo de tumores de baja malignidad, el embarazo, los anticonceptivos orales y la lactancia. Una historia de infertilidad incrementa el riesgo de tumores de bajo potencial de malignidad (odds ratio 1,9), mientras que el uso de fármacos para la fertilidad incrementa el riesgo de desarrollar un tumor de baja malignidad en pacientes con antecedentes o no de esterilidad(6). Goldberg y Runowicz presentaron tres casos de tumores de baja malignidad potencialmente asociados con infertilidad e inducción de la ovulación(24). En un estudio realizado en Israel se examinaron 164 mujeres con tumores invasivos del ovario y 36 con tumores borderline y se halló que el 11% de las pacientes con tumores invasivos y el 22% de las que tenían un tumor borderline, presentaban a su vez historia de tratamiento con gonadotrofina menopáusica humana o con citrato de clomífeno (CC)(25). Los resultados de este estudio mostraban que los agentes inductores de la ovulación incrementaban el riesgo de neoplasia ovárica, básicamente de tumores limítrofe del ovario(25). En la revisión de Saygili(20), únicamente un caso de 21 (4,7%), presentaba antecedentes de tratamiento con CC durante cinco ciclos. En nuestra serie, seis de 31 pacientes (19,4%) presentaban antecedentes de esterilidad y en cuatro casos (12,9%) se había realizado una inducción de la ovulación. En la serie de Parazzini también se halla una correlación entre el uso de fármacos para la fertilidad y el riesgo de tumores limítrofe del ovario(26).
Posiblemente deberemos esperar unos años para tener un adecuado seguimiento de las pacientes con tumores limítrofes del ovario, así como estudios prospectivos aleatorios que nos indiquen la necesidad o no de realizar tratamientos adyuvantes en este tipo de tumores.
BIBLIOGRAFIA
01 Taylor HC. Malignant and semimalignant tumors of the ovary. Surg Gynecol Obstet 1929;48:204-30.
02 International Federation of Gynecology and Obstetrics. Classification and staging of malignant tumors in the female pelvis. Acta Obstet Gynecol Scand 1971;50:1-7.
03 Serov SF, Scully RE, Sobin LH. International histologic classification and staging of tumors. No 9. Histologic typing of ovarian tumors. Geneva: World Health Organization; 1973.
04 Trimble CL, Trimble EL. Management of epithelial ovarian tumors of low malignant potential. Gynecol Oncol 1994;55:S52-S61.
05 Burks RT, Sherman ME, Kurman RJ. Micropapillary serous carcinoma of the ovary. Am J Surg Pathol 1996;20:1319-30.
06 Harris R, Whittemore AS, Intyre J. Collaborative analysis of 12 US case control studied III. Ephitelial tumours of low malignant potential in white women. Am J Epidemiol 1992;136: 1204.
07 Klitman C, Rome RM, Fortune DW. Low malignant potential tumors of the ovary: a study of 76 cases. Obstet Gynecol 1986;63:338-44.
08 Nakashima N, Nagasaka T, Oiwa N, Nara Y, Fukata S, Fukatsu T, Takeuchi J. Ovarian epithelial tumors of borderline malignancy in Japan. Gynecol Oncol 1990;38:90-8.
09 Piura B, Dganis R, Blicksteins I, Yanai-Inbar I, Czernobilsky B, Glezerman M. Epithelial ovarian tumors of borderline malignancy: a study of 50 cases. Int J Gynecol Cancer 1992;2:189-97.
10 Leake JF, Rader JS, Woodruff JD, Rosenshein NB. Retroperitoneal lymphatic involvement with epithelial ovarian tumors of low malignant potential. Gynecol Oncol 1991;42:124-30.
11 Kurman RJ, Trimble CL. The behavior of serous tumors of low malignant potential: are they malignant? Int J Gynecol Pathol 1993;12:120-7.
12 Kennedy AW, Hart WR. Ovarian papillary serous tumors of low malignant potential (serous borderline tumors). A long-term follow-up study, including patients with microinvasion, lymph node metastasis, and transformation to invasive serous carcinoma. Cancer 1996;78:278-86.
13 Seidman J.D., Kurman RJ. Subclasification of serous borderline tumors of the ovary into Bening and malignant types. Am J Surg Pathol 1996;20:1331-45.
14 Tazelaar HD, Bostwick DG, Ballon SC, Hendrickson MR, Kempson RL. Conservative treatment of borderline tumors. Obstet gynecol 1985;66:417-22.
15 Barnhill DR, Kurman RJ, Brady MF, Omura GA, Yordan E, Given FT, et al. Preliminary analysis of the behavior of stage I ovarian serous tumors of low malignant potential: a Gynecologic Oncology Group study. J Clin Oncol 1995;13:2752-6.
16 International Federation of Gynecology and Obstetrics. Annual report and results of treatment in gynecologic cancer. Int J Gynecol Obstet 1989;28:189-90.
17 Armas A, Hernández-Cortés G, Rodríguez R, Calero F. Tumores epiteliales borderline del ovario: estudio retrospectivo 53 casos. Prog Obstet Ginecol 1997;40:637-44.
18 Tresserra F, Grases PJ, Labastida R, Ubeda A. Histological features of contralateral ovary in patients with unilateral ovarian cancer: A case control study. Gynecol Oncol; 1998;71:437-41.
19 Segal GH, Hart WR. Ovarian serous tumors of low malignant potential (serous borderline tumors): the relationship of exophytic surface tumor to peritoneal «implants». Am J Surg Pathol 1992;16:577-83.
20 Saygili U, Uslu T, Erten O, et al. Borderline ovarian tumors: retrospective analysis of twenty-one cases. Eur J Gynaecol Oncol 1998;19:182-5.
21 Bell DA, Scully RE. Ovarian serous borderline tumors with stromal microinvasion: a report of 21 cases. Hum Pathol 1990;21:397-403.
22 Leake JF, Currie JL,Rosenshein NB, Woodruff JD. Long term follow-up of serous ovarian tumors of low malignant potential. Gynecol Oncol 1992;47:150-8.
23 Tusquets I, Serra B, Tresserra F, Dexeus S, Grases P, Razquin J. Tumor seroso borderline ovárico con afectación ganglionar pélvica sincrónica. Prog Obstet Ginecol 1996;39:372-5
24 Goldberg GL and Runowicz. Ovarian carcinoma of low malignant potential, infertility, and induction of ovulation. Is there a link? Am J Obstet Gynecol 1992;X:853-4
25 Shushan A, Paltiel O, Iscovich J, et al. Human menopausal gonadotrofin and the risk of epithelial ovarian cancer. Fertil Steril 1996;65:13.
26 Parazzini F, Negri E, et al. Treatment for fertility and risk of ovarian tumors of borderline malignancy. Gynecol Oncol 1998;68:226-8.