Casos clínicos
Herpes gestationis:a propósito de dos casos
Gestational herpes infection: report of two cases
M. López-Menéndez
C. Ara
M. Manubens
J. Mallafré
Departamento de Obstetricia y Ginecología
Instituto Universitario Dexeus
Barcelona
Correspondencia:
Dra. María López-Menéndez
Paseo Bonanova, 56 - 6.º - 3.ª
08017 Barcelona
Trabajo auspiciado por la Cátedra de Investigación en Obstetricia y Ginecología (Prot. S. Dexeus)
Fecha de recepción: 11/9/99
Aceptado para publicación: 13/3/00
López-Menéndez M, Ara C, Manubens M, Mallafré J. Herpes gestationis: a propósito de dos casos. Prog Obstet Ginecol 2000;423:275-278.
INTRODUCCIÓN
El herpes gestacional (HG) es una dermatosis bullosa autoinmune de la unión dermoepidérmica inducida por el embarazo, o más raramente por la toma de estrógenos y progestágenos, o también por los tumores trofoblásticos (mola hidatiforme, coriocarcinoma).
Los síntomas principales se presentan a nivel mucocutáneo, en forma de prurito y lesiones papulovesiculosas primordialmente, junto con alteraciones sistémicas leves.
Pertenece al grupo de penfigoides. Los dos tipos más frecuentes de dermatosis durante el embarazo son el pénfigo gestacional y la erupción polimorfa del embarazo.
El diagnóstico definitivo de HG es la inmunofluorescencia de biopsia de piel.
Su tratamiento se basa principalmente en la toma de esteroides.
DESCRIPCIÓN DE LOS CASOS
Caso 1
Mujer secundigesta primípara de 26 años de edad con antecedentes de un huevo anembrionado. El embarazo actual transcurre con normalidad, siendo los controles analíticos y ecográficos correctos hasta la semana 34, en la que inicia un cuadro de prurito intenso localizado en pies y manos, que se generaliza a las 48 horas. Ante el empeoramiento del cuadro, con prurito intenso, máculas eritematosas y pápulas edematosas con diferentes formas intermedias en extremidades inferiores y abdomen; se procede a su ingreso con el diagnóstico probable de herpes gestationis (HG) y en tratamiento con difenhidramina 50 mg/8 h, vía oral. Posteriormente se confirmó con la histología y la inmunofluorescencia directa (IFD). Se instaura terapia con difenhidramina 50 mg/8 h, vía oral. La sintomatología cede con la terapia y la paciente mejora. A las 24 horas del ingreso se realiza una cesárea de recurso por preeclampsia, extrayendo un feto femenino de 2.610 g (gramos), apgar al minuto de 9 y a los cinco minutos de 10, con un pH arterial de 7,39. El peso de la placenta fue de 620 g.
En el postoperatorio, a las 24 horas, presentó un brote de ampollas y máculas; iniciándose terapia corticoidea vía oral a 60 mg/24 h. A pesar del tratamiento, a las 72 horas hay un empeoramiento del cuadro y se incrementa la dosis en 10 mg/24 h, a la que se asocia urea al 10 por 100, corticoides vía tópica y sulfoles. El cuadro tiene sus brotes y la dosis de corticoides se incrementa hasta 85 mg/24 h. Los controles de glucemia, ionograma y constantes se mantuvieron dentro de los límites de la normalidad.
La paciente permaneció ingresada cinco meses por nuevos brotes de herpes gestationis, que se fueron controlando con disminución paulatina de la dosis de corticoides hasta el alta hospitalaria.
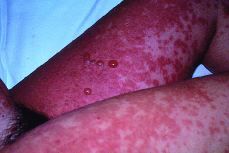
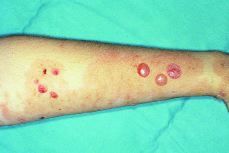
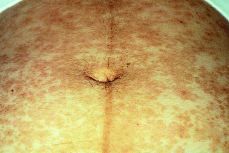
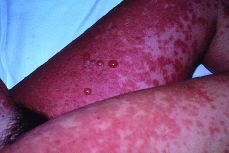
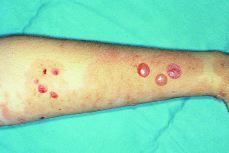
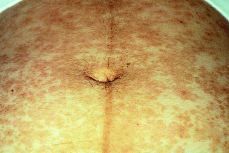
El recién nacido no presentó ningún síntoma cutáneo, ni signo neurológico (Figs. 1, 2 y 3).
Figura 1. Ambas extremidades inferiores donde se observan lesiones eritematosas, pruriginosas y algunas vesículas.Caso 2
Figura 2. Vesículas activas y pústulas secundarias al rascado, sobre lesiones residuales hiperpigmentadas en extremidad superior.
Figura 3. Abdomen que presenta lesiones antiguas asintomáticas hiperpigmentadas tras el parto.
Mujer de 29 años de edad, con antecedentes de asma extrínseca e intolerancia oral a la glucosa, amenorrea secundaria en tratamiento con progesterona y un aborto.
En su primer embarazo presentó controles analíticos y obstétricos normales hasta la semana 27 de amenorrea, que presentó una erupción generalizada, que se orientó como un exantema vírico, iniciándose el tratamiento con hidroxicina diclorhidrato y difenhidramina-calamina. El exantema se generalizó y se solicitaron pruebas hepáticas, que resultaron normales. En la semana 29 se realiza una biopsia de piel y con el diagnóstico de HG. Posteriormente se instaura tratamiento con corticoides y hidroxicina diclorhidrato. Debido a la agravación del cuadro cutáneo y al malestar de la paciente se ingresa a las 37 semanas. Durante este período se decide una cesárea electiva por intolerancia materna del cuadro cutáneo, tras amniocentesis tardía y pruebas de maduración pulmonar fetal positivas. Se asistió a un feto masculino de 3.660 g, apgar al primer minuto de 9 y a los cinco minutos de 10, pH arterial de 7,31. Durante el postparto se continuó con la terapia corticoidea profiláctica y a los diez días se da de alta con normalidad cutánea. El recién nacido no presentó síntomas cutáneos ni neurológicos.
En su segundo embarazo (a los tres años del primero), a las 13 semanas se diagnostica ecográficamente de inserción velamentosa de cordón. A las 20 semanas presenta un brote agudo de HG y se instaura tratamiento con corticoides a dosis de 60 mg/24 h. A las 24 semanas presenta un segundo brote de HG y se añade hidroxicina diclorhidrato al tratamiento. A las 26 semanas debutó una diabetes mellitus gestacional, probablemente secundaria a la terapia corticoidea (70 mg/24 h); que se controló con dieta. A las 33 semanas se ingresa por rotura prematura de membranas, y a las dos horas inicia dinámica uterina que no cede con antagonistas del calcio, por lo que se decide realizar una cesárea de recurso asistiendo a un feto femenino de 3.060 g, apgar al minuto de 9 y a los cinco minutos de 10, pH arterial de 7,25. El recién nacido fue un prematuro de 33 semanas, de elevado peso para su edad gestacional, presentando un síndrome infantil de madre diabética, miocardiopatía hipertrófica obstructiva leve, ictericia y se dio de alta al octavo día sin presentar síntomas cutáneos ni neurológicos.
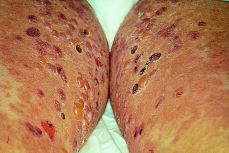
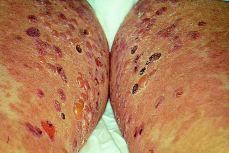
Durante el puerperio, la paciente ingresó durante 20 días por un nuevo brote de HG, que se controló con corticoides a dosis de 60 mg/24 h. La mujer continuó su tratamiento con corticoides durante dos meses, reduciendo paulatinamente la dosis y controlando el cuadro clínico (Fig. 4).
Figura 4. Lesiones en cara interna de los muslos secundarias al rascado, se observan distintos estadios: lesiones eritematosas primarias, vesículas y pequeñas ampollas, que posteriormente se complican con el rascado y aparecen pústulas y lesiones costrosas.
DISCUSION
Se trata de una dermatosis bullosa autoinmune.
La incidencia de herpes gestacional varía desde 1/4.000 hasta 1/50.000, observándose una tasa más baja cuando el diagnóstico de sospecha se confirma por estudios de inmunoluorescencia (IF)(1-3).
Frente a una dermatosis gestacional hay que realizar el diagnóstico diferencial entre: prurito gravídico, prúrigo gestacional, dermatitis autoinmune a la progesterona, erupción polimorfa del embarazo, dermatitis papular e impétigo herpetiforme.
A pesar de ser una enfermedad rara, los dos tipos más frecuentes de dermatosis bullosa en la gestación son: pénfigo gestacional y erupción polimorfa del embarazo(4).
Es importante realizar el diagnóstico diferencial entre ambas entidades, puesto que presentan distinto pronóstico. En la erupción polimorfa del embarazo no se observa recurrencia en posteriores gestaciones, ni aumenta la morbilidad fetal; mientras que en el pénfigo gestacional aumenta el número de prematuros y de mortalidad fetal(5).
El embarazo complicado con un pénfigo gestacional debe ser considerado como un embarazo de alto riesgo y controlarse estrictamente. El 60 por 100 se presenta entre la semana 28-32; mientras que sólo en el 14,69 por 100 de los casos los síntomas se presentan en el postparto(6). La recurrencia de la enfermedad y la aparición de un nuevo brote en el postparto puede indicar la persistencia de anticuerpos circulantes. Esta teoría apoya el desencadenamiento de los síntomas con anticonceptivos orales y algunos tumores trofoblásticos(7).
El mecanismo patogénico exacto es desconocido, pero el hecho de encontrarse depósitos de C3 en la membrana basal de la piel afecta y perilesional, y anticuerpos Ig G con avidez para fijar el complemento en el suero, implica un mecanismo inmunológico(8,9). La predisposición genética se encuentra en pacientes con fenotipos: HLA DR3, DR4 y B8(10).
A pesar de todo, se ha observado un incremento significativo de mortalidad fetal en pacientes con herpes gestacional(11); esta afirmación es discutida por otros autores(6). Largas series actuales apoyan documentadamente una tendencia mayor de prematuros y recién nacidos pequeños para la edad gestacional, pero no incrementa el número de abortos espontáneos ni de muertes fetales(12). Esta disparidad de resultados puede ser debida a los criterios de inclusión y exclusión de los distintos estudios.
La evidencia de vellosidades coriales placentarias con infiltración linfocitaria puede ser un método de despistaje para el diagnóstico precoz de herpes gestacional en período anteparto, debido a que las lesiones placentarias pueden preceder a las lesiones dérmicas(13).
El tratamiento habitual (esteroides) de HG no parece modificar el desarrollo fetal, mientras que mejora frecuentemente los síntomas maternos (prurito y lesiones dérmicas). El tratamiento sistémico con esteroides, especialmente a elevadas dosis, representa, por sí mismo, un factor de riesgo para la rotura prematura de membranas, parto pretérmino y efectos colaterales maternos.
El tratamiento precoz inhibe la formación de depósitos de inmunocomplejos en la placenta y previene la insuficiencia placentaria e incluso la sintomatología fulminante materna(14).
Elevadas dosis de corticoides no inhiben la aparición de nuevas formaciones ampollares ni de síntomas relevantes, incluso pueden inducir diabetes gestacional; por ello hay casos rebeldes que se pueden controlar con inmunosupresores, como la ciclosporina a 100 mg/24 h asociado a prednisona a menores dosis (25 mg/24 h).
Hay que tener en cuenta que la terapia inmunosupresora aumenta la incidencia de infecciones oportunistas de bacterias, virus y hongos; por ello estas pacientes deben seguir un control estricto de su estado inmunitario y el diagnóstico precoz y tratamiento de cualquier proceso inflamatorio que desarrollen.
El tratamiento con ciclosporina es tóxico para el hígado y riñón materno y reduce el número de linfocitos T sin interferir con la síntesis de interleukinas. El paso de ciclosporina por la placenta causa inmunidad fetal, exponiendo al niño a infecciones virales congénitas(15). El uso de inmunosupresores juega un papel importante en el crecimiento intrauterino retardado (CIR), mejorando el crecimiento fetal por interferencia con los osteoclastos y osteoblastos fetales.
Todo ello confirma la hipótesis sobre la influencia del HLA-DR en la patogenia del pénfigo, gestacional.
Hay autores que opinan que la ciclosporina puede ser una terapéutica adecuada en casos de herpes gestacional, porque disminuye el número de linfocitos T sin interferir con el desarrollo fetal y puede ser utilizado a dosis bajas(16).
En conclusión, el herpes gestacional es una alteración de la autoinmunidad de la gestación que parece causar principalmente morbilidad materna, mientras que las complicaciones fetales y neonatales parecen ser menos severas de lo que previamente se creía(17,18).
BIBLIOGRAFIA
1 Holmes RC, Black NM. The specific dermatoses of pregnancy: A reappraisal with special emphasis on a purposed simplified clinical classification. Clin Exp Dermatol 1982;7:65-73.
2 Noguera X, Protocolos SEGO. Dermopatías y gestación. Barcelona: IU Dexeus; 1994.
3 Sciarra Gyn Obst. 1992; Vol 2. Chap 32. Dermatosis en gestación.
4 Winton GB, Lewis CW. Dermatoses of pregnancy. J Am Acad Dermatol 1982;6:997-8.
5 Holmes RC, Black MM. The specific dermatoses of pregnancy. J Am Acad Dermatol 1993;8:405-7.
6 Mascarò JM, Lecha M. Fetal morbidity in herpes gestationis. Arch Dermatol 1995;141:1209-10.
7 Baxi LV, Kavilom OP, Collins MH, Walther RR. Recurrent herpes gestationis with postpartum flare: A case report. Am J Obstet Gynecol 1991;164:778-80.
8 Bonagura VR, Rohoswsky-Kochan C, Reed E, et al. Perturbation of the immune network in herpes gestationis. Hum Immunol 1986;15:211-9.
9 Karpati S, Stolz W, Meruer M, Falco OB, Kreig T. Herpes gestationis: Ultraestructural identification of the extracellular antigenic sites in diseased skin using immunogold techniques. Br J Dermatol 1991;125:317-24.
10 Yancey KB, Hall RP, Lawley TJ. Pruritic urticarial papules and plaques of pregnancy. J Am Acad Dermatol 1984;10:473.
11 Gleicher. Medicina en clínica obstétrica Madrid: Panamericana; 1989.
12 Lawley TJ, Stingl G, Katz SI. Fetal an maternal risk factors in herpes gestationis. Arch Dermatol 1978;114:552.
13 Ortone J-P, Hsi B-L, Verrando P, et al. Herpes gestationis factors reacts with the amniotic epithelial basement membrane. Br J Dermatol 1987;117:147.
14 Black MM. New observations on pemphigoid herpes gestationis. Dermatology 1994;189supl. 1:50-1.
15 Shomick JK, Black MM. Fetal risks in herpes gestationis. Am J Acad Dermatol 1992;8:214.
16 Holmes RC, Black MM, Jurecka W, et al. Clues to the aetiology and pathogenesis of herpes gestationis. Br J Dermatol 1983;109:131.