CASOS CLÍNICOS
Struma ovarii: tres presentaciones clínicas diferentes en un infrecuente tumor de ovario
Struma ovarii: three presentations of an uncommon ovarian tumor
F. Hernández1
L. San Frutos1
I. Gallego2
M. C. García-Andrade2
E. M. Soto1
F. Izquierdo1
1 Servicio de Obstetricia y Ginecología
2 Servicio de Anatomía Patológica
Hospital Universitario «Santa Cristina»
Madrid
Correspondencia:
Dr. Fernando Izquierdo González
Jefe Servicio Obstetricia y Ginecología
Hospital Universitario «Santa Cristina»
O''Donnell, 59
28009 Madrid
Fecha de recepción: 9/6/99
Aceptado para publicación: 13/3/00
Hernández F, San Frutos L, Gallego I, García-Andrade MC, Soto EM, Izquierdo F. Struma ovarii: tres presentaciones clínicas diferentes en un infrecuente tumor de ovario. Prog Obstet Ginecol 2000;43:269-273.
INTRODUCCION
Se define como struma ovarii a aquella neoplasia ovárica en la que el tejido tiroideo es el constituyente principal(1-3). El tejido tiroideo puede estar presente en aproximadamente un 5 a 15 por 100 de los teratomas, pero el verdadero struma ovarii sólo se da en menos del 25 por 100 de los teratomas que presentan tejido tiroideo; de ahí que represente aproximadamente un 2 por 100 de todos los teratomas(4,5). Representa el 0,3 por 100 de todas las neoplasias de origen ovárico. La mayoría son benignos; el struma ovarii maligno tiene una baja frecuencia, que oscila entre el 5 y 10 por 100 de todos los struma ovarii(6).
La edad de presentación sitúa sus frecuencias más altas entre la 5.ª y 6.ª décadas de la vida, sustancialmente más elevada que en el resto de los teratomas, aunque puede darse en edades extremas(7). La mayoría son asintomáticos; cuando presentan sintomatología, el dolor a nivel pélvico es el más frecuentes de los síntomas y la existencia de una masa ovárica perceptible a la exploración le sigue en frecuencia. Las pacientes pueden, en ocasiones, presentar hipertiroidismo o síntomas relacionados con éste en aproximadamente el 8 por 100 de los casos(8,9). La ascitis aparece aproximadamente en un 17 por 100 de los casos, sin que ésta tenga que implicar necesariamente malignidad(13). Las metástasis a distancia son muy infrecuentes, sólo se dan en el 5-6 por 100 de todos los struma ovarii malignos.
El objetivo de este artículo es presentar tres formas diferentes de presentación del struma ovarii.
DESCRIPCION DE LOS CASOS
Caso n.º 1
Paciente de 38 años M (menarquia) a los 13 años; TM (tipo menstrual) 4/26 días; G (gestaciones) siete; A (abortos) seis; P (partos) uno eutócico. Antecedentes personales: episodios de taquicardias paroxísticas controlados ambulatoriamente con verapamilo, hasta que tras 20 días de tratamiento presenta palpitaciones con disnea y dolor precordial; esta clínica la obliga a acudir a las urgencias de un hospital general. Exploración física normal. El episodio es diagnosticado como palpitaciones en relación con una situación de ansiedad y tratado con propanolol 10 mg cada 12 horas y bromazepan 1,5 mg por la noche. La paciente mejora en su situación clínica y está asintomática hasta que consulta en un centro ajeno a nuestro servicio a raíz de un dolor localizado en fosa ilíaca izquierda; allí, tras serle realizada una ecografía, se diagnostica como quiste endometriósico. Los marcadores Ca-125:11,30 U/ml CEA (antígeno carcinoembrionario): 2,90 ng/mL.
Es remitida a nuestro servicio, se efectúa una laparoscopia diagnóstica en la que se halla en anejo izquierdo dos quistes de aspecto funcional, así como un quiste endometriósico; se realiza enucleación de los tres quistes.
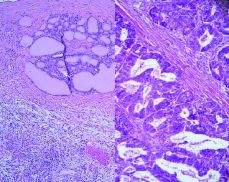
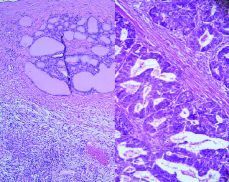
La anatomía patólogica informa las piezas como: ovarii puro y endometriosis quística de ovario (Fig.1).
Figura 1. Quiste endometriósico revestido por epitelio endometrial (parte superior de la fotografía) y abundantes folículos tiroideos repletos de material coloide.
Al mes de la intervención quirúrgica una determinación de hormonas tiroideas arrojaba los siguientes datos:
-- THS (Tiroid Hormone Stimulating): 0,85 microU/ml [0,5-5,5].
-- T4 (tretrayodotironina) libre: 2,00 ng/dL [0,9-2,1].
La paciente ha permanecido asintomática hasta el momento actual.
Caso n.º 2
Paciente de 58 años M14TM3/30G3A1P2 FUR (fecha de la última regla): 50 años, que acude a nuestro servicio por aumento del volumen abdominal. Antecedentes personales: anexectomía izquierda a los 35 años de edad; diagnóstico: teratoma. Trombosis venosa profunda. Hernia de hiato. Obesidad. Hipercolesterolemia. Exploración ginecológica: masa anexial derecha de consistencia quística de unos 6cm de diámetro máximo. Ecografía: útero en ante, normal. Anejo izquierdo no se visualiza. Anejo derecho de 130 x 74 mm, del cual parece depender una masa predominantemente quística, de 82 mm de eje máximo, tabicada; en el extremo superior de este tabique se observa una imagen hiperecogénica con sombra acústica posterior.
Marcadores: Ca 125: 30,0 U/ml. CEA: 2,6 ng/ml.
Laparotomía exploradora con los siguientes hallazgos: útero de tamaño, forma y consistencia normales. Anejo izquierdo ausente. Ocupando cavidad pélvica quiste de unos 20 cm de eje máximo que depende de anejo derecho. Se realiza anexectomía derecha.
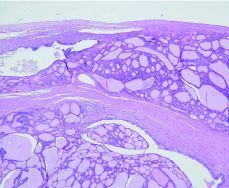
Los anatomopatólogos informan como: cistoadenoma seroso de ovario con área de teratoma maduro con struma ovarii (Fig. 2).
Figura 2. Superior: cavidad recubierta por epitelio ciliado no atípico acompañado de tejido tiroideo normal. Inferior: teratoma quístico maduro con áreas de tejido tiroideo.
Caso n.º 3
Paciente de 66 años. M13TM4/28 Nuligesta. FUR: 42 años. Antecedentes personales y familiares sin interés. Acude a nuestro servicio remitida por su médico general tras presentar metrorragia postmenopáusica de dos meses de evolución. Exploración ginecológica: anejo derecho aumentado de tamaño de unos 5 cm de eje máximo. Ecografía ginecológica: útero de 79 x 51 x 62 mm, con línea media de 20 mm, que parece invadir miometrio con una profundidad mayor que el 50 por 100 de éste. A nivel de fosa ilíaca derecha se visualiza una imagen predominantemente sólida, de 54 x 41 x 45 mm y una zona más hiperecogénica de 9 mm, así como numerosos tabiques y papilas. El índice de resistencia de la arteria uteroovárica es de 0,45.
Marcadores: Ca 125: 113,26 U/ml.
Se realiza una laparotomía exploradora que muestra los siguientes hallazgos: útero de tamaño normal muy fijo. Ovario izquierdo ligeramente aumentado de tamaño con algunas adherencias a fosa ovárica izquierda, trompa izquierda y sigma. El ovario derecho presenta una tumoración sólido-líquida de 5 cm de diámetro adherida intensamente (sin solución de continuidad) a fosa ovárica derecha y sigma. Todo el peritoneo de la pelvis menor se encuentra infiltrado. La plica vesicouterina presenta un nódulo irregular de unos 15 mm adherido a ésta. Se procede a la enucleación de ovario derecho tras lavado y aspiración de líquido peritoneal.
No es posible completar la cirugía de forma reglada por problemas técnicos debidos a las múltiples adherencias descritas.
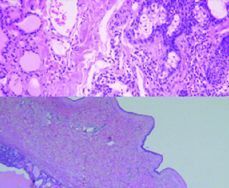
Los cortes histológicos informan de un adenocarcinoma seroso moderadamente diferenciado. Struma ovarii (Fig. 3).
Figura 3. Izquierda: tejido tiroideo maduro. Derecha: neoplasia epitelial maligna de patrón glándulo-papilar revestida por epitelio atípico.
El comité de tumores de nuestro hospital decide tratamiento consitente en seis ciclos de paclitaxel y carboplatino, tras el cual se realiza una histerectomía subtotal, al no poderse extirpar el cérvix por dificultades técnicas, con anexectomía izquierda, omentectomía y apendicectomía.
La pieza quirúrgica es informada de una masa papilar de 40 x 30 x 20 mm en interior de cavidad endometrial que corresponde a un adenocarcinoma endometroide moderadamente diferenciado que infiltra miometrio en más del 50 por 100 del grosor de éste, y que también alcanza a ovario izquierdo en su extensión. El ovario izquierdo presenta un quiste endometriósico y un tejido multinodular con 15 x 20 mm de extensión correspondiente con adenocarcinoma endometroide que se extiende hasta pared muscular de trompa izquierda sin afectar a la mucosa de ésta. Tanto el omento como el apéndice vermiforme están libres de afectación tumoral.
Tras la cirugía se procede a la aplicación de radioterapia externa y braquiterapia con un control al año que muestra una tomografía computerizada, mamografía y gammagrafía ósea completamente normales.
Al año de este control la paciente no presenta ninguna anomalía en la tomografía computerizada ni en la exploración ginecológica, que es negativa.
DISCUSION
Actualmente el acuerdo general es que el struma ovarii está compuesto de tejido tiroideo genuino y representa el desarollo unidireccional de un teratoma ovárico. Resultando ser el más frecuente de los teratomas monodérmicos ováricos.
Existen tres tipos histólogicos de struma ovarii fundamentalmente: 1) la mitad de los struma ovarii la constituyen aquellos tumores que se presentan como un cistoadenoma benigno en el que predomina el tejido tiroideo; 2) hasta en una tercera parte de los casos el tejido tiroideo no es el principal componente del cistoadenoma, y 3) en aproximadamente una sexta parte de los casos se presenta como un struma ovarii puro(6). El diagnóstico se facilitará con la inmunotinción para tiroglobulina(7).
En los casos en que se presentan síntomas de hipertiroidismo (8 por 100)(10,11) en ocasiones sólo se establece la relación al cesar estos síntomas tras la excisión quirúrgica del tumor, aunque a veces ocurre lo contrario: tras la ablación tumoral se desarrolla un bocio en respuesta compensatoria a la bajada de concentración de hormonas tiroideas en sangre(12).
Las metástasis a distancia son muy infrecuentes (5-6 por 100 de todos los struma ovarii malignos).
La diseminación puede ser a nivel local, afectando a estructuras vecinas como el tejido hepático o el epiplón. Las metástasis a distancia son por vía hemática. Hígado, pulmón, tejido óseo, son los elementos más frecuentemente afectados(8).
Se ha descrito una rara entidad denominada strumosis, consistente en la implantación peritoneal de focos metastásicos constituidos por struma ovarii benigno(13); esta entidad puede progresar con afectación de estructuras vecinas, por lo que es necesario, ante la menor duda, la toma de biopsias tanto de ovario contralateral como de cualquier zona sospechosa, ya que en caso de indicar strumosis deben ser tratadas mediante tiroidectomía y posterior administración de I131.
El diagnóstico de struma ovarii, aunque a veces puede estar apoyado en la clínica, es fundamentalmente postoperatorio. Recientemente se han descrito algunas aproximaciones en el campo del diagnóstico de imagen, que pueden ayudar a un mejor diagnóstico de esta entidad. Así, mediante el uso del doppler color se ha podido establecer un patrón ecográfico característico en el caso de struma ovarii consistente en la existencia no sólo de flujo sanguíneo alrededor de la cápsula quística en el 100 por 100 de los casos (fenómeno que sólo se produce en el 24,3 por 100 del resto de lesiones ováricas), sino también flujo que llega hasta el área central sólida (tejido dermoide)(14). Estas investigaciones, junto a otras que se están llevando a cabo en el área de la resonancia magnética(15) y la radioinmunofluorescencia(16) pueden permitir en un futuro una mejor aproximación en el diagnóstico preoperatorio del struma ovarii.
En la mayoría de los casos el struma ovarii es benigno y su diagnóstico es postoperatorio, por lo que la excisión del tumor resulta un tratamiento definitivo. Sin embargo, en ocasiones los cortes congelados de las biopsias intraoperatorias pueden informar como sospechosas de malignidad cuando en realidad son benignas. Esto debe prevenirnos ante la realización de una cirugía radical apoyándonos únicamente en una biopsia intraoperatoria, por lo que es recomendable mantener una conducta expectante hasta el diagnóstico definitivo(7).
El tratamiento más adecuado consiste en una cirugía conservadora en el caso de benignidad y de tipo radical ante struma ovarii maligno; con esta actitud suele ser suficiente. Aunque no se debe olvidar una vigilancia postoperatoria a pesar del bajo potencial metastásico de este tipo de tumores. La tiroglobulina puede ser usada como marcador de remisión al haber sido descrita su producción en el struma ovarii(2).
Ante la existencia de tumor residual y metástasis que producen una enfermedad funcional en algunos casos, el tratamiento consiste en tiroidectomía y administración de I131(17) con un posterior seguimiento de los niveles de tiroglobulina(18). En el caso de struma ovarii malignos muy pobremente diferenciados, que no son capaces de captar el I131, la radioterapia ha sido descrita como un tratamiento de carácter paliativo(18).
BIBLIOGRAFIA
1 Fox H, Langley FA. Tumours of the ovary. London: Heinemann Medical Books; 1976. p. 240.
2 Kurman RJ, Norris HJ. Germ cell tumors of the ovary. Somers SAC, Rosen MR, eds. Pathology Annual. East Norswalk, CT: Appleton-Century-Crofts; 1978. p. 291-325.
3 Norris HJ, Jansen RD. Relative frequency of ovarian neoplasms in children and adults. Cancer 1972;30:713.
4 Scully RE, Young RH, Clement PHB. Atlas of Tumor Pathology. Tumors of the ovary, Meldevoloped Gonads, Fallopian Tube and Broad Ligament. Third series. Fascicle 23. Washington DC: Armed Forces Institute of Pathology; 1998.
5 Caruso PA, Marsh MR, Minkowitz S, et al. An intense clinicopathologic study of 305 teratomas of the ovary. Cancer 1971; 27:343-53.
6 Marcus CC, Marcus SL. Struma ovarii: a report of 7 cases and a review of the subjet. Am J Obst Gynecol 1961;81:752-62.
7 Szyfelbein WM, Young RH, Scully RE. Cystic struma ovarii: A Frequently Unrecognized Tumor. Report of 20 cases. Am J Surg Pathol 1994;18:785-8.
8 Gould SF, López RL, Speers WC. Malignant struma ovarii: a case report and literature review. J Reprod Med 1983;28:415-9.
9 Haleston PHS, Kelehan PK, Whittaker JS, Burslem RW, Turner L. Bening and malignant struma ovarii. Arch Pathol Lab Med 1978;102:180.
10 March D, Desai AG, Park CH, Hendriks PK, Davis PS. Struma ovarii: Hyperthyroidism in a postmenopausal woman. J Nucl Med 1988;29:263.
11 Kempers RD, Dockerty MB, Hoffman DL, Bartholomew LG. Struma ovarii-ascitic, hypertyroid and asymptomatic syndromes. Ann Intern Med 1970;72:883-93.
12 Armes JE, Östör AG. A case of Malignant Strumal Carcinoid. Gynecol Oncol 1993;51:419-23.
13 Cohn DE, Folpe AL, Gown AM, Goff BA. Mesopthelial pelvic lymph node inclusions mimicking metastatic thyroid carcinoma. Gynecol Oncol 1998;68:210-3.
14 Zalel Y, Caspi B, Tepper R. Doppler flow characteristic of dermoid cyst: unique appearance of struma ovarii. J Ultrasound Med 1997;16:355-8.
15 Joja I, Asakawa R, Mitsumori A, Nakagawa R, Hiraki Y, Kudo T, et al. Struma ovarii: appearance on MR images. Abdom Imaging 1998;23:652-6.
16 Lieberman G, Buscombe JR, Hilson AJW, Thakrar S, Maclean A. The detection of struma ovarii in two patiens by radioinmunoscistingraphy. Am J Obstet Gynecol 1998;179:262-3.
17 Willemse PHB, Oosterhuis JW, Aalders JG, Piers DA, Sleijfer DT, Vermey A, et al. Malignant struma ovarii Treated by Ovariectomy, Thyroidectomy and 131 I Administration. Cancer 1987;60:178-82.
18 Van Herle AJ, Uller RP. Elevated serum thyroglobulin: A marker for metastasis in differentiated thyroid carcinoma. J Clin Invest 1975;56:272-7.