INTRODUCCIÓN
La interrupción del embarazo debida a una malformación fetal grave es un evento que ocasiona un gran trauma psicológico tanto a la pareja como a sus familiares.
Gracias a los avances en el diagnóstico prenatal, tanto de cromosomopatías como de malformaciones, la necesidad de llevar a cabo interrupciones se ha incrementado en los últimos años. Por ese motivo, numerosos centros hospitalarios han empleado diferentes procedimientos para llevar a cabo estas interrupciones, en un intento de disminuir al máximo todas las repercusiones que la técnica pudiera conllevar.
Hoy en día se dispone de diversos métodos, tanto quirúrgicos como médicos, que se pueden emplear para realizar las interrupciones. Dado que las técnicas quirúrgicas precisan de una mayor experiencia profesional, llevan asociadas un mayor número de complicaciones (perforaciones uterinas, desgarros cervicales y vaginales, síndromes de Asherman, infecciones...) y comportan un mayor coste económico, la mayoría de evacuaciones se realizan mediante pautas médicas1,2.
Dentro de la inducción médica, las prostaglandinas están adquiriendo cada día más importancia, tanto si se administran prelegrado como sin legrado posterior. Existen múltiples regímenes, cada uno de ellos con sus ventajas e inconvenientes, con sus tasas de éxito y sus complicaciones. Pero todavía hoy no se ha logrado llegar a un consenso acerca de cuál es el fármaco más eficaz, ni qué dosis y frecuencia de administración son las óptimas para lograr el mejor resultado con el menor malestar de la paciente.
Los objetivos principales que se persiguen cuando se inicia una interrupción son: por una parte, lograr una expulsión fetal espontánea en el menor tiempo posible y con el menor número de efectos adversos, mediante una técnica barata y de fácil aplicación; por otra parte, en los casos en los que se sospeche o se constate una malformación fetal o una cromosomopatía, obtener material fetal y ovular en condiciones óptimas para poder realizar un estudio anatomopatológico que confirme el diagnóstico y permita establecer un pronóstico de cara a futuras gestaciones.
Tipos de tratamiento médico
Prostaglandinas
Las prostaglandinas son metabolitos del ácido araquidónico que se engloban dentro del grupo de los eicosanoides, junto con las prostaciclinas, tromboxanos y leucotrienos.
Son ácidos carboxílicos con 20 átomos de carbono (ácidos grasos insaturados), de los cuales 5 constituyen un anillo ciclopentano que une las cadenas laterales. Se diferencian entre sí por el grado de sustitución e insaturación del anillo, así como por las cadenas laterales alifáticas que le confieren su actividad biológica específica. Según las sustituciones del anillo, las prostaglandinas se clasifican en diferentes grupos: A, B, C, D, E y F. La actividad depende de los dobles enlaces que contienen, y los más activos son los que tienen 2 enlaces dobles. El número de enlaces dobles viene indicado por el subíndice numérico.
Sus acciones biológicas afectan prácticamente a todos los sistemas orgánicos, pero los que tienen interés obstétrico son las de las series E y F, y en especial las de la serie E por su efecto sobre la contractilidad uterina y sobre la maduración y dilatación cervicales.
Dentro de las prostaglandinas de las series E y F se distinguen:
- F2*: ampollas (Hemabate®).
- E2 o dinoprostona: gel endocervical (Prepidil gel®), dispositivo vaginal (Propess®), comprimidos orales o ampollas intravenosas.
- Análogos de la E1: misoprostol (Cytotec®) o gemeprost3.
Todas ellas están contraindicadas en caso de asma severa no controlada, enfermedad coronaria, vascular o cerebral y alergia. Se deben tomar precauciones en caso de glaucoma, insuficiencia renal y hepática, y cirugía uterina previa.
Prostaglandina F2α. Análogo sintético de la prostaglandina F2α (PGF2α), con acción contráctil de la musculatura uterina. La administración intraamniótica consiste en una única dosis bajo control ecográfico para evitar la administración accidental, ya sea intramiometrial o intravascular.
Dinoprostona. Prostaglandina de la serie E que actúa, por una parte, estimulando la contracción del miometrio y, por otra, relajando la musculatura lisa del cérvix.
La incidencia y severidad de los efectos secundarios dependen de la dosis y de la vía de administración. Los más frecuentes se dan en el tracto gastrointestinal. Menos frecuentemente aparecen síntomas transitorios vagales.
Se han descrito casos de coagulación intravascular diseminada severa por la utilización de altas dosis asociadas a oxitocina. Por ello, la administración simultánea de oxitocina o de otros fármacos que estimulen las contracciones está contraindicada. Se recomienda que como mínimo hayan pasado 6 h en el caso del gel cervical y 30 min con el dispositivo vaginal.
Misoprostol. Análogo sintético de la prostaglandina E1 (PGE1) (15-deoxi-16-hidroxi-16 metil análogo). Se utiliza para la prevención y tratamiento de la úlcera péptica. Pero también es uterotónico, tiene una acción contráctil sobre la musculatura uterina y la fibra lisa en general4.
Su administración puede ser oral o vaginal. En ambos casos ha demostrado ser eficaz en la inducción del aborto, tanto de primero como de segundo trimestre4-6.
La vía vaginal parece ser más eficaz ya que, aunque no se logra un pico máximo tan elevado como cuando se administra por vía oral, la concentración sérica óptima se mantiene más tiempo (hasta 4 h) y, por tanto, la acción es más prolongada7. Ello comporta una serie de beneficios, entre ellos una menor duración del proceso, unos menores requerimientos de medicación e, indirectamente, menor número de efectos secundarios6. Además, se trata de una técnica barata, de fácil aplicación, y con pocos y leves efectos secundarios, los más frecuentes son fiebre y diarrea.
A pesar de que los estudios indican que el tiempo de inducción con misoprostol es mayor que con gemeprost, el menor coste económico justifica su uso.
Gemeprost. Al igual que el misoprostol, el gemeprost es un análogo sintético de la PGE1 (16,16-dimetil-trans-delta 2), que administrado vía vaginal induce abortos.
Inhibidores de la progesterona
La mifepristona o RU-486 (Mifegyne®) es un esteroide con acción antiprogesterona fundamentalmente, pero también posee una ligera acción antiglucocorticoidea y antiandrogénica, esta última aún más leve1. Actúa en endometrio y miometrio, y facilita la acción inductora de las prostaglandinas a la hora de provocar contracciones uterinas. La dosis recomendada y máxima es de 600 mg en una única administración. Su acción puede antagonizarse con la dexametasona (1 mg de dexametasona por cada 400 mg de mifepristona).
La indicación más conocida es la terminación del embarazo. En España está autorizado el uso de la mifepristona en 4 circunstancias:
- Terminación del embarazo de hasta 7 semanas de gestación.
-> Preparación del cérvix para la acción de las prostaglandinas en abortos de segundo trimestre.
- Muerte fetal intraútero.
- Preparación del cérvix antes del aborto quirúrgico1.
Está contraindicada en la insuficiencia renal crónica, asma severa no controlada médicamente, alergia y en pacientes mayores de 35 años fumadores de más de 10 cigarrillos al día.
Oxitocina
Análogo de la hormona natural hipofisiaria que ejerce un efecto idéntico al de la hormona endógena; estimula selectivamente las células musculares lisas del útero produciendo contracciones.
La sensibilidad miometrial a la oxitocina aumenta progresivamente a medida que progresa la gestación. El útero es relativamente insensible a esta hormona en las primeras semanas del embarazo y poco a poco la sensibilidad va aumentando. Se cree que se debe a un incremento del número de receptores intracelulares para esta hormona y al incremento de puentes de unión tipo ocludens entre las células miometriales.
No debe emplearse simultáneamente con prostaglandinas porque se han descrito casos de roturas y taquisistolias uterinas8. En cambio, sí puede administrarse de forma secuencial (6 h después de la aplicación del Prepidil® gel o 30 min después de la retirada del Propess®).
Tipos de tratamiento quirúrgico
Legrado
El legrado obstétrico puede realizarse:
Con cucharilla.
Por aspiración: en gestaciones menores de 12 semanas.
Previamente al legrado se requiere una dilatación cervical, ya sea mediante tallos o prostaglandinas.
Los tallos pueden ser:
Osmóticos: naturales o sintéticos (Dilapan® o Lamicel®): obtienen la máxima dilatación a las 4-12 h y pueden emplearse tanto en el primer trimestre como en el segundo, solos o asociados a otros tratamientos.
Metálicos de Hegar: producen mayor laceración cervical con riesgo de incompetencia cervical y, consecuentemente, riesgo de posteriores abortos espontáneos de segundo trimestre.
Histerotomía
La histerotomía se realiza en el cuerpo del útero, hecho que puede comprometer la evolución de embarazos ulteriores.
Objetivo
El objetivo del estudio ha sido comparar las diferentes pautas de inducción médica empleadas en el Hospital Universitario de Girona Dr. Josep Trueta en los últimos 10 años, para así disminuir el tiempo de expulsión desde la primera aplicación de prostaglandinas, el número de fracasos que precisan tratamiento quirúrgico y los efectos secundarios graves.
MATERIAL Y MÉTODOS
Se ha realizado un estudio de tipo retrospectivo con un total de 145 mujeres que se han sometido a una interrupción legal de embarazo en el Hospital Universitario de Girona Dr. Josep Trueta desde enero de 1993 hasta marzo de 2003.
Se incluyeron las gestaciones entre las 13 y 22 semanas con feto vivo único, en las que la madre presentase una enfermedad grave o el feto una malformación fetal grave o cromosomopatía (tabla 1). El antecedente de cesárea previa no se consideró criterio de exclusión, mientras que sí se excluyeron las gestaciones múltiples.
A la mayoría de las gestantes se les practicó la ecografía de las 13 semanas para determinar la edad gestacional, conocer el número de fetos y detectar malformaciones de aparición precoz, y la analítica del triple cribado a las 15 semanas. La amniocentesis se realizó en todas las pacientes en las que la ecografía mostró alguna malformación o los análisis indicaban un riesgo incrementado.
A lo largo de estos años, se han empleado 4 pautas diferentes de inducción médica para las interrupciones, todos ellas aprobadas por el comité de ética del centro:
1. Inyección intraamniótica única ecoguiada de 4-8 ampollas de Hemabate®, cada una con 250 μg de PGF2α, es decir, una dosis total de 1-2 mg en dosis única. Transcurridas 6-8 h se inicia la administración de Prepidil® gel 1 mg/6-8 h, con un máximo de 3 dosis. Después se inicia la prefusión de oxitocina, 30 ml/min de una dilución de 20 UI en 500 ml de suero glucosado al 5%.
2. Prepidil® gel 1 mg/6-8 h, con un máximo de 5 dosis, seguido de una perfusión de oxitocina al mismo ritmo que la pauta anterior.
3. Cytotec® vaginal 800 μg dosis única. A las 3-6 h se inicia la administración de 400 μg/3-4 h vía oral, con un máximo de 4 dosis orales. Seguidamente la perfusión de oxitocina.
4. Cytotec® vaginal 400 μg/2 h, con un máximo de 5 dosis, también seguido de la per,fusión de oxitocina.
En todos los casos, después de la expulsión fetal, aunque la placenta se expulsase en bloque con el feto, se realizó una revisión de la cavidad uterina y legrado posterior9.
A todas las gestantes, excepto a una, se les administró analgesia. En el 85% de casos se trataba de una anestesia peridural, sin que se observasen diferencias estadísticamente significativas entre los 4 grupos de gestantes. En el 15% restante se administró anestesia intradural o general en el momento de la revisión uterina y el legrado posterior.
Se han analizado 4 variables:
1. La duración media del tiempo que transcurre desde que se inicia la administración de prostaglandinas hasta que se logra la expulsión fetal espontánea.
2. La tasa de éxito en función del porcentaje de expulsiones espontáneas antes de las 12 h desde la primera dosis de prostaglandinas y antes de las 24 h.
3. El número de fracasos (se entiende por fracaso no lograr una expulsión fetal espontánea tras 30 h desde la primera dosis de prostaglandinas).
4. Los efectos secundarios.
El análisis estadístico se realizó mediante la prueba de la χ2 y el análisis de la varianza (ANOVA), y los contrastes a posteriori con la prueba de Scheffé. Un valor de p < 0,05 se consideró estadísticamente significativo. Los programas estadísticos empleados fueron SPSS versión 10 y Epidat versión 2.1.
RESULTADOS
La muestra de 145 gestantes se ha dividido en 4 grupos según el protocolo empleado (tabla 2).
Se han analizado diversas características demográficas en los 4 grupos, sin que ninguna de ellas mostrase diferencias estadísticamente significativas: la edad media y las semanas gestacionales (p = 0,56 y p = 0,94, respectivamente, estimadas con ANOVA), y también la paridad (p = 0,82, estimada con la prueba de la χ2) (tabla 3).
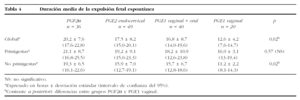
La duración media desde que se administra la primera dosis de prostaglandinas hasta la expulsión fetal espontánea se ha analizado, por una parte, en la tot alidad de gestantes y, por otra, en las mismas gestantes pero subdividiéndolas en primigestas y no primigestas. En los 3 casos (global, primigestas y no primigestas) las PGF2α son las menos eficaces, es decir, las que tienen tiempos más largos de expulsión (20,2 ± 7,6 h). La prostaglandina E2 (PGE2) endocervical y la PGE1 administrada vía oral y vaginal combinada tienen unos resultados similares, y la pauta que ofrece mejores resultados es la de PGE1 vaginal (12,6 ± 4,2 h). Las primigestas tienen una duración media algo superior que las no primigestas, y esta diferencia oscila entre 2 y 5 h según la pauta utilizada. Las diferencias son estadísticamente significativas (p = 0,02, estimada con ANOVA) cuando se analiza la duración media de manera global y en no primigestas. El contraste, a posteriori mediante la prueba de Scheffé, muestra que las diferencias existen entre el grupo de PGF2α y PGE1 vaginal (tabla 4).
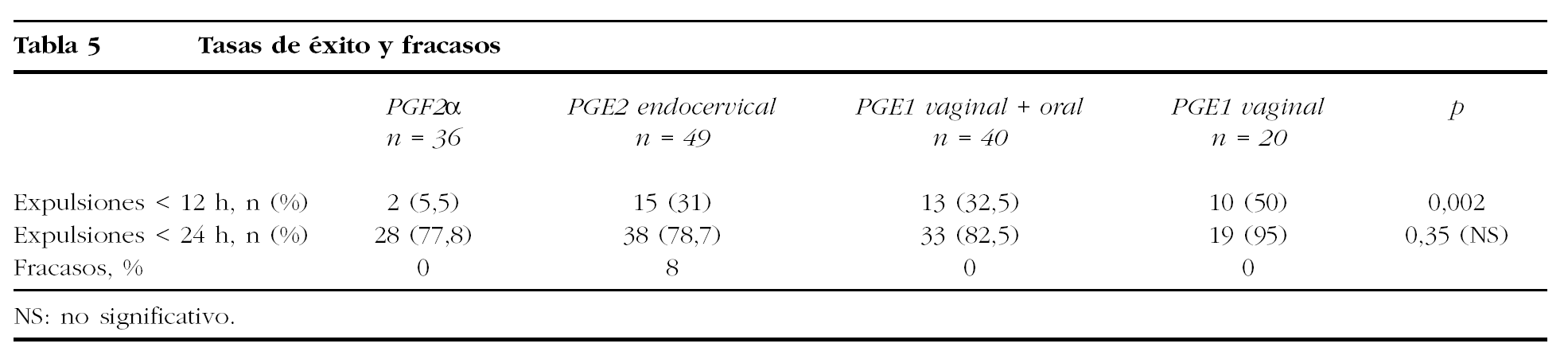
Las expulsiones fetales antes de las 24 h suceden en un elevado porcentaje de casos, y las diferencias son de poca magnitud al comparar las 4 pautas. Al ser más exigentes en la tasa de éxito y analizar las expulsiones antes de las 12 h, se encontraron diferencias más importantes. En ambos casos, las PGF2α intraamnióticas tienen las tasas de éxito más bajas (el 5,5 y el 77,8% a las 12 y 24 h, respectivamente). Los resultados mejoran con las PGE2 endocervicales y con la pauta combinada de Cytotec®. De nuevo, la mejor tasa de éxito la presenta el Cytotec® vaginal (el 50 y el 95% a las 12 y 24 h, respectivamente). Las diferencias no son estadísticamente significativas a las 24 h (p = 0,35, estimada con χ2), pero sí a las 12 h (p = 0,002, estimada con χ2) (tabla 5). Estos resultados muestran que con el Cytotec® vaginal se reducen los tiempos de expulsión en relación con otras pautas empleadas.
Se ha considerado como fracaso no lograr una expulsión fetal espontánea tras 30 h desde la primera dosis de prostaglandinas. Cuatro de las 49 interrupciones llevadas a cabo con el protocolo de PGE2 endocervical fracasaron y precisaron de una extracción instrumental (3 legrados y 1 caso de histerotomía). El resto de las pautas inductoras no han presentado ningún fracaso (tabla 5).
Los efectos secundarios han sido leves con 3 de las pautas empleadas (PGF2α, PGE1 combinado y vaginal exclusivo). En la mayoría de los casos se limitaba a trastornos gastrointestinales (dolor abdominal, vómitos y diarrea). Con el régimen de Cytotec® vaginal prácticamente la totalidad de los casos ha presentado hipertermia superior a 38 °C. Ningún caso se ha asociado con infección ni ha precisado antibiótico. En cambio, todos ellos se han resuelto espontáneamente tras el aborto sin más repercusiones.
Por el contrario, con la pauta de PGE2 endocervical se ha producido 1 caso de coagulación intravascular diseminada (CID) grave que precisó de una histerectomía abdominal total simple.
Sólo 9 (6,2%) de las gestantes se habían sometido previamente al menos a 1 cesárea (2 con Hemabate®, 4 con Prepidil®, 1 con Cytotec® vaginal y oral, y 2 con Cytotec® vaginal). En todos los casos se trataba de una laparotomía de tipo Pfannestiel con una histerotomía segmentaria baja. La edad media de estas pacientes era de 35 años (superior que en gestantes sin cesárea previa). En ninguna de ellas se produjo dehiscencia de la cicatriz ni rotura uterina.
DISCUSIÓN
Las 4 técnicas empleadas han demostrado ser métodos eficaces para la finalización de los embarazos durante el segundo trimestre10,11.
Las características demográficas son factores importantes a considerar, dado que el útero se hace más sensible a los agentes uterotónicos a medida que aumenta la edad gestacional. Esto se ha demostrado con las dosis decrecientes de misoprostol que se precisan para ser efectivo a medida que avanza el embarazo. En el primer trimestre se recomiendan dosis de hasta 800 μg, mientras que para la inducción de parto a término son suficientes dosis de 25-50 μg8. También es cierto que las inducciones se logran con más facilidad en multíparas que en primíparas5,6.
En relación con la administración de dinoprostona intravaginal, algunos autores afirman que es segura y efectiva12. Otros declaran casos de rotura uterina con el uso de misoprostol en el segundo trimestre, especialmente en caso de uso combinado con oxitocina8, y mayor incidencia de taquisistolia comparado con la dinoprostona13.
Nuestro estudio indica que sería preferible emplear el Cytotec® por 2 motivos: el primero es que la administración de Prepidil® intravaginal no siempre ha logrado la expulsión espontánea fetal y ha requerido en un 8% de las ocasiones de legrado o histerotomía; el segundo, y quizá más importante, es que se ha dado un caso de coagulación intravascular diseminada grave.
La administración de una única dosis de 200 μg de Cytotec® vaginal ha demostrado ser suficiente para la inducción de abortos de segundo trimestre14. Sin embargo, existen múltiples estudios publicados en los que se emplea el misoprostol vaginal a dosis de 100 a 800 μg a intervalos entre 3 y 24 h para la interrupción de embarazo de segundo trimestre que demuestran que, a dosis más altas, menor es el período de inducción pero mayor es la frecuencia de efectos secundarios, aunque éstos son leves y no precisan terapia alguna15,16.
En nuestro seguimiento, el régimen de Cytotec® vaginal cada 2 h, con un máximo de 5 dosis, es el que presenta mejores resultados. La duración media global es de 12,6 ± 4,2 h, lo cual es más breve que la vía oral6,7 (16,8 ± 8,7 h). Las tasas de éxito son del 50% a las 12 h y del 95% a las 24 h. De hecho, probablemente, serían del 100% ya que la paciente que no expulsó antes de las 24 h recibió una dosis de naproxeno como antitérmico en lugar de paracetamol, lo cual posiblemente inhibió la acción de la prostaglandina sintetasa. Y coincidiendo con la bibliografía, los efectos secundarios son leves y no precisan tratamiento.
A pesar de que existen casos publicados de rotura uterina en pacientes con antecedente de cesárea que se han sometido a una interrupción de embarazo empleando agentes uterotónicos, tanto solos como en combinación4,17,18, su frecuencia parece ser mucho menor que en la inducción a término, probablemente porque el segmento inferior no está tan adelgazado y porque no se precisa tanta dilatación cervical para lograr la expulsión fetal6.
Se ha descrito que en gestantes que se someten a una interrupción de embarazo, es mayor la incidencia de rotura uterina si tienen el antecedente de cesárea previa, el requerimiento de analgesia y la tasa de abortos incompletos19,20.
En nuestro caso, no nos es posible garantizar la inocuidad con ninguna de estas pautas en caso de existir un antecedente de cesárea previa, ya que el número de casos del que se dispone es muy reducido como para llegar a una conclusión.
Dado que la incidencia de cesáreas está aumentando, cada vez existirá un mayor número de mujeres que al someterse a una interrupción tendrá el antecedente de al menos una cesárea. Por ese motivo, es necesario conocer la verdadera incidencia de roturas uterinas en pacientes con cesárea anterior.
La administración vaginal de misoprostol empleada para las interrupciones de embarazo ha demostrado ser una técnica de elevada eficacia, al tiempo que segura. Queda pendiente demostrar su inocuidad en pacientes con cirugía uterina previa.