La malformación arteriovenosa uterina es una patología de presentación más frecuente de lo relatado y de consecuencias, en algunos casos, muy severas.
Material y métodoSe describen 8 casos.
Resultados y discusiónLa malformación arteriovenosa uterina; de origen congénito, infrecuente, o secundario a procesos obstétricos, se caracteriza por la presencia de un ovillo vascular, formado por dilataciones arteriovenosas, de localización intramiometrial que se extiende, solo en los casos congénitos, a otras zonas vasculares de la pelvis menor. Cursa siempre con un evento hemorrágico intenso. El diagnóstico es ecográfico Doppler y confirmación con angiografía. Es condición “sine qua non” una β-hCG negativa o su negativización previa. El tratamiento hoy recomendado es la embolización. Se describen los avances en el diagnóstico y tratamiento en base a 8 casos propios.
Uterine arteriovenous malformation (AVM) is more common than it is reported to be and is a potentially life-threatening condition often secondary to uterine trauma or pregnancy. Congenital origin is also reported but is less common.
Material and methodsEight cases are described.
Results and discussionAVM is characterised by the presence of an intra-myometrial arteriovenous skein. Congenital cases may extend to vascular zones of the minor pelvis and/or other organs. The onset of AVMs is usually severe bleeding. Doppler ultrasound is the first diagnosis approach, but, angiography remains the gold standard for diagnostic evaluation. A previous negative pregnancy test is a “sine qua non” condition. Embolization is the more acceptable form of treatment. The therapeutic advances in their diagnosis and treatment are described, based on 8 personal cases.
La malformación arteriovenosa uterina (MA-VU)1 es una anomalía vascular extremadamente infrecuente de la que existirían apenas 100 casos1–4. De hecho, las mayores estadísticas no superan los 25.
Son dilataciones varicosas, arteriovenosas intramiometriales, sin afectación capilar. Se clasifican en congénitas y adquiridas. Las primeras serían las genuinas e infrecuentes, mientras que de las adquiridas están siendo publicados cada vez más casos1,4. Las congénitas resultan del desarrollo embrionario anormal de estructuras vasculares primitivas, resultando en la presencia de múltiples dilataciones y comunicaciones anormales arteriovenosas. Tienden a mostrar5–7:
- •
Múltiples arterias alimenticias.
- •
Un ovillo de vasos con características histológicas arteriales y venosas.
- •
Numerosas venas de drenaje.
Las adquiridas, al contrario, muestran fístulas miometriales entre ramas arteriales y venosas8. Tienen arterias procedentes de las ilíacas internas normales, sin suplemento vascular extra al uterino y presentan el ovillo característico9. Muchos casos son asintomáticos, o solo con hipermenorreas, pudiendo ser confundidos con síndromes de congestión pélvica10, de aquí que su frecuencia debe ser más alta1,4.
En los congénitos hay anomalías vasculares en otras áreas pélvicas y/o resto del organismo (cerebro, piel, otras vísceras).
Las adquiridas son generalmente traumáticas, más comunes en casos previamente afectos de neoplasia trofoblástica gestacional (NTG) o tumor trofoblástico del lecho placentario (placental site trophoblastic tumour [PSTT]), donde la lesión que afecta al miometrio se puede producir y mantener4. Muchos son desencadenados por causas obstétricas (multiparidad, abortos), intervenciones (miomectomías, resectomías, legrados o cesáreas), problemas placentarios (acretismos) u otras patologías (cánceres de cérvix o endometrio).
Queda la duda, que puede solventarse con las imágenes ecográficas y la angiografía, sobre un sustrato vascular anómalo congénito previo en los casos adquiridos.
La historia es crítica para diferenciarlos, pues como veremos1–4 la imagen ecográfica transvaginal (EV) es muy similar.
Los adquiridos cursan con hemorragias vaginales intermitentes pero torrenciales, que sugieren una causa arterial8. Esta puede ser la clínica inicial, aunque generalmente, existe un antecedente hemorrágico previo. El reconocimiento de que el origen de la hemorragia es una MA-VU será fundamental para la evolución y tratamiento, ya que la práctica de un legrado hemostático puede agravarla, incluso conducir a la muerte4,9.
Tradicionalmente, han sido tratados con ligadura de arterias hipogástricas o histerectomía. La embolización es una alternativa que preserva la fertilidad, deseo común en varios de nuestros casos, brindando excelentes resultados.
Material y métodoDesde el año 2006, y entre todas las ecografías vaginales, se han colectado ocho casos que cumplen los criterios de MA-VU que se especifican más adelante. Todos ellos una vez confirmados fueron sometidos nuevamente a ecografía vaginal 2D angio-Doppler (Alpha 10, Aloka®, Japón, transductor sectorial de 5 y 7,5MHz) y 3D con angio-Doppler (Voluson GE®, USA, transductores lineales y sectoriales de 5 y 7,5MHz). En varios de los casos se pudo completar el diagnóstico, y especialmente la terapéutica, empleando tomografía computarizada (TAC), resonancia magnética (REMN) y angiografía. Se ha dispuesto en todos los casos de la evolución clínica y ecográfica como mínimo 6 meses.
En todos los casos una vez sospechada la naturaleza del proceso por ecografía vaginal Doppler, de inmediato se recurrió, para su confirmación a la 3D y, en los casos posibles, al TAC y RNM en las primeras 24h.
Debido a que el diagnóstico está basado en la visión del ovillo vascular, no se han practicado mediciones cuantitativas de los índices de flujo.
El tratamiento con embolización ha estado en dependencia de la gravedad clínica (ver resultados) y de la disponibilidad de la técnica.
Los criterios diagnósticos han sido:
- a.
Clínicos: metrorragia con β-hCG negativa o negativizada.
- b.
Ecográficos:
- •
Ovillo vascular con flujo multidireccional
- •
Curvas con elevados picos de velocidad sistólica y bajos índices de resistencia y pulsatilidad.
- •
- c.
Radiológicos: siempre que ha sido factible RNM y/o TAC
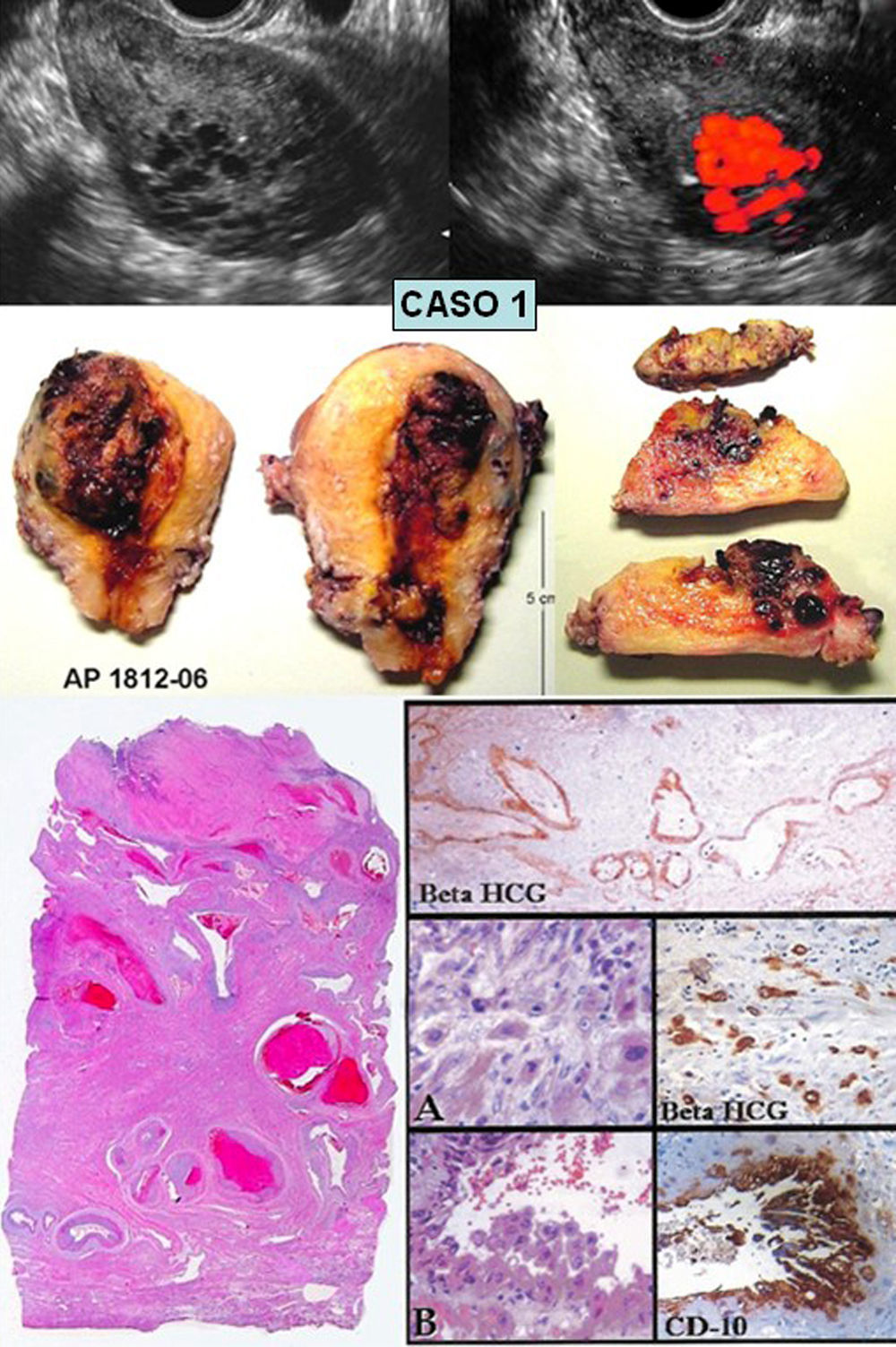
Fertilización in-vitro, gestación triple. Cesárea en semana 34. Dos placentas. Revisión a los 60 días. La EV muestra línea endometrial fina. En cara miometrial cerca del cérvix, áreas eco-negativas irregulares concentradas (fig. 1). Doppler muestra un ovillo y shunts de baja resistencia. Arterias uterinas normales. Sólo se indicó control.
Veinticuatro horas después, intensa metrorragia, inestabilidad, taquicardia y palidez. Se decide histerectomía. β-hCG previa a cirugía: negativa. Anatomía Patológica (AP): tejido angiomatoso, vasos exuberantes y congestivos. Microscópicamente extensa angiomatosis arteriovenosa. Presencia de deciduosis en la media y células trofoblásticas en estroma y vasos. La inmunohistoquímica muestra acretismo placentario, típico de PSTT.
Caso 2Aborto precoz legrado hace dos meses. Acude por hemorragia e inestabilidad hemodinámica. La EV muestra imágenes miometriales no-homogéneas y ovillo vascular (fig. 2). El Doppler resultó definitivo evidenciando shunts y fístulas de baja resistencia. Embolización selectiva para preservar fertilidad.
Caso 2: Arriba izquierda, ovillo vascular con flujos de baja resistencia en el interior del miometrio con Doppler Color. A la derecha el hallazgo correspondiente con RNM y angiografía.
Caso 3: Abajo a la izquierda idéntico hallazgo pero afectando al plexo de Santorini y vasos ilíacos que están enormemente distendidos. A la derecha, RNM con contraste para apreciar la afectación uterina y vascular de la pelvis menor.
Aborto inducido hace 10 años. Consulta por intensas hipermenorreas. La EV muestra arterias y venas intra-miometriales, que se extienden periováricas, al plexo de Santorini y hacia abdomen. Algunas muy gruesas. El Doppler, la 3D, la angiografía y la RNM muestran plexo varicoso afectando miometrio, vasos uterinos e iliacas hasta aorta (fig. 2). Se realizó una histerectomía directa.
Caso 4Dos abortos 5 años y 3 meses antes, legrados. Acude por hemorragia e hipogastralgia. La EV muestra en cara anterior uterina zona con vasos tortuosos, flujos turbulentos, y tumor vascular alimentado desde la arteria uterina derecha (fig. 3). La angiografía y la RNM muestran el ovillo.
Caso 4: A la izquierda arriba, tomografía ecográfica mostrando las imágenes lacunares econogativas miometriales caracteristicas. A la derecha RNM con angiografía para mostrar la afectación del ovillo vascular.
En el centro, Caso 5: imagen transvaginal 2D y Doppler energía de la afectación miometrial.
Abajo, Caso 6: ovillo vascular con flujos de muy baja resistencia observados con 2D y Doppler Color. Este último muestra shunts.
Hace 3 meses aborto espontáneo. Medicada con misoprostol. No vuelve a control. Tras amenorrea de 3 meses, sangrado de 12 días. β-hCG positiva. La EV (fig. 3) resulta sugestiva de MA-VU. Se ve el ovillo. Directamente arteriografía con embolización.
Caso 6Parto prematuro semana 24. Consulta por hemorragia persistente. β-hCG negativa. La EV muestra miometrio desestructurado en cara posterior y fundus. Imágenes lacunares irregulares características. Doppler: numerosísimos vasos de baja impedancia. Solo controlar. Al mes disminución de la masa vascular. A los dos Doppler normal y rescisión completa. (fig. 3).
Caso 7Aborto 9 semanas, legrada. A los 15 días: imagen intraútero de ovillo; β-hCG positiva. Al mes: imagen miometrial con β-hCG positiva en aumento. Se inicia quimioterapia. Segundo mes tras quimioterapia, β-hCG indetectable. Tercer mes: persiste el cuadro ecográfico. Embolización (fig. 4).
Caso 8Cesárea hace 5 años. Un legrado en otro hospital por aborto precoz. Al mes la ecografía revela escasos restos ovulares. β-hCG positiva. Practican histeroscopia que muestra imagen sugestiva de restos ovulares. Se pretenden extraer y acontece hemorragia cataclísmica cohibida mediante coagulación bipolar. La AP muestra vellosidades. Control al mes. EV: mola completa, β-hCG < 50mUI. Se trató, sin duda, de un error ecográfico.
Nos es remitida. La EV revela área ecogénica imprecisa intramiometrial. Doppler: vasos irregulares de diferentes calibres, en ovillo, con bajos flujos que comunican con un sistema vascular uterino normal. Con la sospecha de MA-VU se practica RNM que lo confirma. Medicada con gestágenos la evolución mostró desaparición tras seis meses (fig. 5).
La tabla 1 resume los casos. Siete casos fueron secundarios a procesos obstétricos, cuatro post aborto, uno tras NTG y dos problemas placentarios. Muestra que los primarios, son minoría y por ello la evolución favorable de muchos.
Resumen de los casos
| Caso | Edad | G,P,A | Antecedentes | Tiempo | β- hCG | Doppler | Tratamiento | Tipo Origen |
| 1 | 27 | 1,1,0 | FIV-TE. 2 Emb. Trillizos, Cesárea | 3 meses | +/− | ovillo | histerectomía | Sec. Acretismo |
| 2 | 25 | 1,0,1 | Ab, legrado | 2 meses | +/− | ovillo | embolización | Sec. Ab. |
| 3 | 45 | 1,0,1 | Ab, legrado | 10 años | − | ovillo vasos | histerectomía | Prim |
| 4 | 23 | 2,0,2 | Abs, legrados | 3 meses | +/− | ovillo | expectante | Sec. Ab. |
| 5 | 26 | 1,0,1 | Ab, misoprostol | 3 meses | +/+/− | ovillo | embolización | Sec. NTG |
| 6 | 21 | 1,1,0 | PP 24 semanas | 2 meses | +/− | ovillo | expectante | Sec. Part. |
| 7 | 28 | 1,0,1 | Ab. espontáneo | 3 meses | +/+/− | ovillo | embolización | Sec. Ab. |
| 8 | 35 | 2,0,1 | Ab. biopsia | 4 meses | +/+/− | ovillo | expectante | Sec. Ab |
G.P.A=gravidez, paridad, abortos; Prim=primaria; Sec=secundaria; Ab=aborto/s; Part=parto; PP=parto prematuro.
Todos negativizan la β-hCG, condición considerada “indispensable”. Tres fueron embolizados, otros tres controlados. El tiempo hasta la aparición de la clínica osciló entre meses y una década. La imagen característica ecográfica fue el ovillo vascular. La embolización o el control expectante en casos estables pueden ser suficientes, sin olvidar que hay casos con riesgo vital.
DiscusiónReferente al diagnóstico, se logra con la combinación de:
- •
La clínica.
- •
La β-hCG, negativa o haberse negativizado. Sino se trata de un proceso gestacional residual.
- •
La EV con Doppler espectral.
- •
La angiografía es definitiva y el TAC y RNM son recomendables, si hubiera tiempo, lo que no siempre acontece.
Respecto a la clínica, los casos adquiridos sintomáticos (probablemente existan los que nunca den sintomatología y no se diagnostiquen), cursan con imprevista e intensa metrorragia que pueden avocar casi a la muerte. Acontecen, por su origen traumático, durante la época fértil (18 a 45 años). Es frecuente el antecedente de legrado obstétrico por cualquier etiología1 (más frecuente tras NTG sin quimioterapia4 o aborto).
Casi todos muestran una primera hemorragia entre 1-6 meses tras el acto quirúrgico y con β-hCG negativa que descarta un proceso residual (NTG, aborto, restos placentarios o PSTT). De no existir este antecedente, es seguro que se trate de un caso congénito. Con el tiempo, de repetir el cuadro, el caso suele agravarse.
La EV muestra en miometrio:
- •
Sutil heterogeneidad, inespecífica.
- •
Pequeños espacios anecoicos irregulares, mal definidos. Concentrados caso de ser congénito y difusos en los adquiridos. Presentes en el 65 y 35%, respectivamente.
- •
Compatibles o muy semejantes a la adenomiosis.
- •
El diagnóstico definitivo solo con EV es incompleto.
El Doppler, color y la imagen espectral:
Muestran:
- •
Ovillo con flujo multidireccional de alta velocidad, que producen imagen de “mosaico” vascular, con áreas amarillas, correspondientes a las zonas de máxima reverberación, propias de shunts arteriovenosos y fístulas. El ovillo esta concentrado y ocupa las áreas econegativas observadas con escala de grises. Está presente en el 95% de los casos.
- •
Las pequeñas áreas econegativas miometriales se llenan de color pues son vasos, lo que no acontece cuando son focos de adenomiosis.
- •
La imagen espectral muestra curvas con elevados picos de velocidad sistólica y bajos índices de resistencia y pulsatilidad. Su presencia pueden considerarse patognomónica1,4,5,11–17.
- •
La confirmación viene de la mano de la angiografía.
Referente al tratamiento. Se basa en la situación clínica.
Los casos asintomáticos estables se tratan médicamente (controles, gestágenos, etc.), ya que incluso pueden desaparecer2,6,16,18,19.
Los inestables o con episodios recurrentes tienen indicación quirúrgica (histerectomía, ligadura de arterias hipogástricas) pero hoy debe recomendarse la embolización por su eficacia y conservación de fertilidad si es deseada.
La angiografía establece el diagnóstico y delimita la lesión. Aparecen las arterias uterinas alimentando una masa arterial hipertrofiada y tortuosa con grandes vasos alimenticios accesorios que drenan rápidamente en grandes venas.
El tamaño del ovillo es indiferente e independiente de la intensidad de la metrorragia1.
Se practica la embolización distal selectiva de ambas arterias uterinas (catéteres 5F-Cobra, Cook, Bloomington, IN) empleando esponjas de gelatina absorbible (Gelfoam, Upjohn, Kalamazoo, MI, USA), como nosotros, o partículas de alcohol polivinílo (PVA, Ivalon, Boston Scientific, Mississauga, Ontario, Canadá).
En casos de metrorragias masivas, como en uno de los nuestros, debe recurrirse de inmediato a la histerectomía, evitando intervenciones menores (también sugeridas) pues está en juego la vida de la paciente. El legrado hemostático1,4 está contraindicado pues puede acelerar la hemorragia con riesgo vital.
Comentarios, esta malformación plantea tres cuestiones:
- •
Su origen
- •
Su diagnóstico
- •
El tratamiento
El origen es, básicamente, adquirido, pero es muy probable que numerosos emerjan sobre una lesión congénita preexistente y que solo se manifiesten tras procesos obstétricos desencadenantes, especialmente los severos (NTG, PSTT o abortos). Los dos primeros, debido a su gran poder de invasión, pueden desencadenarlo sin necesidad de un factor vascular congénito previo. Se describe que son más frecuentes tras NTG tratadas con quimioterapia13,14 lo que habla en este sentido.
La literatura describe su aparición en jóvenes (20 a 40 años)1,2,4,16, pensamos pues que casos descritos años después como congestiones pélvicas sean formas leves de estos procesos10.
El diagnóstico: por todo lo anterior recomendamos la EV Doppler en todo control ginecológico y evidentemente en casos de metrorragia. La finalidad será valorar los vasos uterinos y pélvicos ya que solo el Doppler es capaz de establecerlo. Deberá ser la técnica inicial ideal y resultará suficiente. Solo se precisará recurrir a otras técnicas radiológicas en caso de dudas.
El diagnóstico definitivo surge de la conjunción de las técnicas de imagen y, de realizarse cirugía, de la AP de la pieza, mostrando la naturaleza vascular19,20 presentando vasos irregulares de amplios diámetros, ectasias vasculares, ausencia de inflamación acompañante y áreas de hemorragia difusa.
La búsqueda en la pieza de anticuerpos monoclonales puede resultar interesante para la diferenciación de primaria o secundaria. En los congénitos siempre serán negativos para β-hCG, pero en los adquiridos aunque la β-hCG plasmática sea negativa, pueden aparecer como consecuencia de restos gestacionales desencadenantes. De esta forma, y como en nuestro primer caso, se evidenciara su origen trofoblástico.
Dos de nuestros casos fueron positivos estando presentes en restos de vellosidades necróticas y en células trofoblásticas persistentes en miometrio y vasos (β hCG, CD-10 AE1/AE3 y PR), mostrando así ser secundarios a un acretismo y a una mola parcial, a pesar en el primero de que el alumbramiento fue normal.
El tratamiento, depende del estado hemodinámico e intensidad de la hemorragia. El legrado está contraindicado. Puede realizarse una histerectomía, pero hoy está indicada, de ser factible y por su rapidez, la embolización5. Conserva aparato genital, es muy eficaz, poco agresiva y preserva la fertilidad, algo muy ansiado en muchas por ser jóvenes y nulíparas6,18. Nuestros cuatro últimos casos fueron embolizados con resultados espectaculares.
La MA-VU debe pues considerarse como una patología más frecuente de lo referido, y sospecharse ante cualquier acúmulo vascular miometrial. El Doppler debe recomendarse en toda mujer y especialmente ante una metrorragia intensa indiferente del grosor endometrial que acompañe. La angiografía, de ser factible, será la técnica ideal de confirmación y tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.