La malformación arteriovenosa (MAV) uterina debe incluirse en el diagnóstico diferencial de pacientes con hemorragia posparto que no cede con medidas habituales y que, incluso, empeora tras el legrado. La ecografía con Doppler color puede ayudar al diagnóstico y al manejo clínico. Aunque el tratamiento clásico ha sido la histerectomía, en la actualidad el tratamiento conservador con la embolización de la arteria uterina debería considerarse la primera opción terapéutica de estas lesiones ya que resulta seguro y efectivo. Presentamos el caso de una paciente con hemorragia puerperal tardía y MAV resuelta exitosamente con la embolización selectiva de la arteria uterina izquierda.
Arteriovenous malformation (AVM) of the uterus should be included in the differential diagnosis of patients with postpartum hemorrhage that does not yield to routine measures and may even worsen after curettage. Color Doppler sonography can aid in the diagnosis and clinical management of this entity. Although the classical treatment has been hysterectomy, conservative treatment with uterine artery embolization should currently be considered the first therapeutic option for these lesions because of its safety and effectiveness. We report the case of a patient with delayed postpartum hemorrhage and AVM successfully resolved with selective embolization of the left uterine artery.
La hemorragia posparto supone una de las principales causas de mortalidad materna en todo el mundo1. Si ocurre en la primeras 24h posparto se considera primaria o temprana y la atonía uterina es su principal causante2,3. La hemorragia secundaria o tardía se define como un excesivo sangrado por genitales, con una pérdida de sangre de 500ml o más, que ocurre entre las primeras 24h tras el parto y la sexta semana del puerperio2,3. En países desarrollados acontece en el 1-3% de todos los nacimientos, y en su etiología se incluyen la retención de restos placentarios, las infecciones (endometritis, etc.), los traumatismos y la existencia de patología uterina previa (miomas, neoplasias, malformaciones vasculares, etc.).
La embolización arterial transcatéter ha surgido recientemente como una técnica percutánea altamente efectiva para controlar la hemorragia ginecológica y obstétrica. Presentamos un caso clínico para confirmar su utilidad en el caso de una hemorragia puerperal tardía secundaria a una malformación arteriovenosa uterina.
Caso clínicoPresentamos el caso de una paciente de 32 años que consultó por hemorragia profusa en la cuarta semana posparto.
Entre sus antecedentes únicamente destacaba un aborto precoz que precisó de varios legrados para su resolución.
La gestación actual había cursado con metrorragia escasa en la sexta semana. En la exploración ecográfica se apreció un saco gestacional acorde con su amenorrea y un embrión vivo de 8mm de CRL. El trofoblasto era irregular con algunas imágenes anecoicas en su interior, por lo que se solicitó una cuantificación de gonadotropina coriónica humana beta (HCG-β) que resultó muy elevada para la edad gestacional (133.751,8). Los controles posteriores resultaron normales; el cribado del primer trimestre y los marcadores ecográficos negativos fueron negativos, por lo que se desestimó realizar pruebas invasivas.
El resto de la gestación evolucionó satisfactoriamente y tuvo lugar el parto en la semana 39 con ayuda de espátulas para acortar el período expulsivo. Nació un feto mujer que pesó 3.680g y tuvo una puntuación en la prueba de Apgar de 9/10.
La paciente se fue de alta sin presentar ningún problema de sangrado y dando lactancia materna.
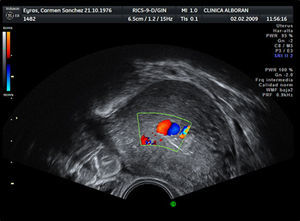
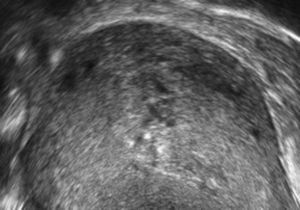
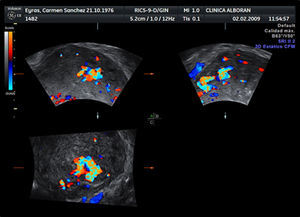
A los 28 días del parto, la paciente acudió por presentar hemorragia con emisión de abundantes coágulos. En la exploración se confirmó sangrado de cavidad, con un útero bien contraído. Al realizar la ecografía Doppler se observó una imagen sacular pulsátil endometrial que captó una señal de color (fig. 1) y un miometrio con múltiples espacios anecoicos (fig. 2) que se rellenan de color formando un mosaico (fig. 3). El análisis espectral de los vasos arteriales demostró una alta velocidad de flujo con un índice de resistencia bajo.
En el control analítico destacaban una anemia moderada (hemoglobina 9,8mg/ml; hematocrito 30) y una cifra de HCG-β < 2mU/mI.
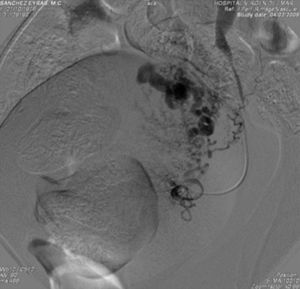
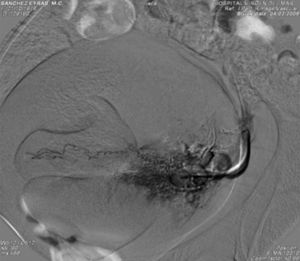
Ante la sospecha de malformación arteriovenosa (MAV), se indicó la realización de una arteriografía intravenosa, en la que se apreció una doble arteria renal izquierda y una acumulación de material de contraste correspondiente al angiograma de la arteria uterina izquierda, a modo de falso aneurisma (fig. 4). Utilizando una esponja de gelatina absorbible, se realizó la embolización selectiva de la arteria uterina y se comprobó la desaparición de la imagen preexistente, con una extravasación del contraste (fig. 5).
La duración del proceso fue de aproximadamente 60min, sin que existiera ningún tipo de reacción adversa, local o general. El sangrado cesó casi por completo tras el procedimiento y la paciente está asintomática tras un mes de la embolización.
DiscusiónLa MAV del útero es muy infrecuente, con menos de 100 casos descritos en la literatura científica4. Se describió por primera vez por Dubreuil y Loubat5 en 1926 y consiste en la comunicación anómala entre la arteria y la vena, con la formación de una red de canales capilares en el espesor miometrial.
Puede ser congénita o adquirida. La forma congénita es más frecuente y comprende múltiples conexiones vasculares que tienden a invadir las estructuras que la rodean (músculo, piel y vísceras). Se piensa que se debe a una detención en el desarrollo vascular embrionario. Por el contrario, la fístula arteriovenosa adquirida suele ser la unión de una sola arteria con una sola vena. Se relacionan con la existencia de un trauma uterino previo (cirugía pélvica, legrado, etc.), uso de dispositivos intrauterinos, patología del embarazo y tratamiento previo de una enfermedad trofoblástica gestacional.
La mayoría se diagnostica en mujeres de 20 a 40 años de edad, lo que sugiere que los cambios hormonales y la gestación pueden desempeñar un papel en su patogénesis.
En el caso de nuestra paciente existía el antecedente de un aborto precoz que precisó de varios legrados para su resolución.
Aunque la sintomatología puede variar, es típico el sangrado intermitente y torrencial, sugestivo de hemorragia arterial. Suele ocurrir tras un parto, un aborto o una intervención sobre el útero. La presencia de MAV se ha vinculado a aborto de repetición, potencialmente como resultado de que la hipervascularización que conlleva puede afectar al lugar de implantación del embrión6.
La ecografía es el método diagnóstico más empleado en los casos de hemorragia anormal. En 1979, Torres et al fueron los primeros en describir los hallazgos en escala de grises de una MAV como «múltiples estructuras anecoicas con un contorno serpenteante a través del miometrio»7. La incorporación del Doppler color aumentó la sensibilidad diagnóstica y aportó un método adicional en la investigación de una posible MAV, al demostrar que esas estructuras anecogénicas generan señales color en patrón mosaico que representa flujo turbulento. El análisis espectral de los vasos arteriales de la lesión muestra una velocidad de flujo alta con un índice de resistencia bajo (0,51-0,65). El análisis espectral del flujo venoso muestra velocidades altas con pico sistólico similar al patrón arterial. La mezcla de ondas de flujo arteriales y venosas se considera diagnóstica.
El diagnóstico definitivo ha sido clásicamente realizado por angiografía. Sus hallazgos incluyen hipertrofia bilateral de arterias uterinas, alimentando una tortuosa masa arterial con abundantes vasos nutricios y rápido drenaje en venas hipertróficas. Además, puede utilizarse para planificar la embolización angiográfica o la cirugía de las MAV pélvicas.
Hay algunos casos de lesiones intrauterinas pulsátiles diagnosticados en el transcurso de una histeroscopia8.
En cuanto al tratamiento de la MAV, depende de la severidad del sangrado, la edad de la paciente y su futuro deseo de fertilidad. En el caso de que la paciente esté asintomática, no se precisa tratar. Si hay sangrado profuso, se precisa de estabilización hemodinámica y su manejo (transfusión sanguínea, uso de prostaglandina F2 alfa, estrógenos parenterales, metilergonovina, danazol, etc.). La histerectomía era el tratamiento de elección antes de que se introdujera y aceptara la opción de la embolización. El tratamiento laparoscópico para coagular las arterias uterinas se ha descrito en el caso de una mujer de 66 años con una MAV asintomática9.
La primera descripción en la literatura científica de un tratamiento exitoso con embolización de una MAV data de 198610. El bloqueo del vaso debe ser selectivo incluso cuando no haya un sangrado activo en ese momento. Se han utilizado diversos agentes como esponja de gelatina recortada, como en el caso que presentamos, partículas de polivinil alcohol, hilos de acero o coils, pegamento N-butil cianocrilato, etc. La tasa de éxito publicada oscila entre el 90 y el 95%, y los casos fallidos están asociados al tratamiento unilateral.
Aunque es un procedimiento seguro, no está exento de algunas posibles complicaciones, como lesiones isquémicas11, dolor muscular12, daño neurológico13, necrosis vesical14 y fístula vesicovaginal15.
La tendencia de la MAV a proliferar en el embarazo se ha notificado, por lo que algunos autores consideran que la MAV supone una contraindicación para buscar gestación. Aunque no haya muchos casos comunicados, el embarazo es posible después de una embolización exitosa, aunque esta se ha asociado a una mayor incidencia de aborto y parto pretérmino. De todos modos, el verdadero riesgo de complicaciones en un embarazo postembolización queda limitado por el escaso número de casos comunicados, con sólo 13 hasta el año 200616, incluido el primero descrito por Chapman y Lutz17 en 198517. Resulta interesante conocer que 11 de los 13 casos tenían al menos un embarazo iniciado, 4 de ellos tenían antecedentes de embarazo molar y 6 tenían historia de 1-5 abortos previos. Sólo en 2 casos existió hemorragia posparto que se trató con fármacos16. Hubo una gestación gemelar tras una fecundación in vitro (Gopal, 2003) y sólo un recién nacido de los 14 de la serie precisó reanimación especial debido a una infección neonatal por Listeria (Tachi, 1988).
Como conclusión, presentamos un caso de hemorragia puerperal tardía en que el diagnóstico temprano de una MAV uterina, gracias a la imagen ecográfica y al Doppler color, nos permitió realizar un tratamiento conservador con embolización de la arteria uterina izquierda y evitó la realización de un legrado y una potencial histerectomía en una mujer joven con deseo de mayor descendencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.