INTRODUCCION
La consideración de los márgenes histológicos de resección es el principal factor de selección para la realización de cirugía conservadora de la mama en los estadios iniciales del cáncer. Existen diferentes definiciones de márgenes escasos (1, 2 o 3 mm como punto de corte), pero hay consenso general en cuanto a que cuando se han conseguido márgenes libres en cirugías conservadoras, hay una menor frecuencia de recidivas locales, incluso en estudios prospectivos y aleatorizados a muy largo plazo1-3.
El pronóstico de recurrencia local, en los casos de márgenes de resección escasos, está menos claro debido a la variabilidad de la definición y al seguimiento limitado en estos casos.
Para los casos con márgenes afectos, la mayoría de los análisis asocian una mayor incidencia de recurrencia.
Pero en cualquier caso, el objetivo final de la cirugía debe ser conseguir márgenes libres. Por otro lado, no siempre que los márgenes de resección están afectos existirá tumor residual en la pieza de ampliación, y la persistencia de carcinoma en las piezas de ampliación es de alrededor del 50% de los casos4.
El objetivo de nuestro estudio fue intentar demostrar la posible influencia de las características (de las pacientes, de las imágenes mamográficas y de los diferentes tipos histológicos) que pudieran influir, por un lado, en la existencia de márgenes libres en las biopsias con arpón inicial, y por otro, en la presencia de tumor residual en la pieza de ampliación en los casos en los que de inicio no se consiguieron márgenes libres.
MATERIAL Y MÉTODOS
Durante los años 2003 y 2004 se realizaron en el Servicio de Ginecología del Hospital Universitario Doce de Octubre de Madrid, y por lesiones mamográficas (no palpables), 281 biopsias tras marcaje con arpón manual. Intraoperatoriamente, se llevó a cabo una comprobación radiológica de inclusión de la lesión en la biopsia. El estudio histológico definitivo se hizo, en todos los casos, de forma diferida. No se realizó un estudio perioperatorio de márgenes ya que durante el acto quirúrgico de la biopsia no se conocía el diagnóstico de la existencia de carcinoma porque no se disponía aún (en el período del actual estudio) de la posibilidad de realizar core biopsia guiada por estereotaxia. Aun en el caso de que hubiésemos conocido la presencia de un carcinoma, la eficacia de la determinación intraoperatoria de afectación de bordes ha demostrado no ser apropiada en tumores < 10 mm, e impracticable en tumores < 5 mm5.
Se tintaron con tinta china los márgenes de la pieza quirúrgica (con distinto color cada uno de los 6 márgenes), y se los estudió histológicamente en busca de presencia de células malignas en ellos. Consideramos los márgenes histológicos de la biopsia con arpón inicial de los carcinomas como libres cuando el margen histológico tintado estuvo a más de 3 mm de las células tumorales. Se consideraron los márgenes «escasos» cuando, aunque éstos estuvieron libres, las células tumorales alcanzaron a sus proximidades, y pusimos el límite en ¾ 3 mm. Finalmente, se consideraron los márgenes de la biopsia como afectos cuando existieron células tumorales en el mismo margen tintado de la pieza quirúrgica. Como ya hemos comentado, en la literatura médica hay diferentes definiciones de márgenes escasos (rango de 1 a 5 mm)6-10, aunque la mayoría de los autores pone el punto de corte en los 2 o 3 mm para considerar los bordes escasos.
En los carcinomas ampliados, consideramos la ampliación como negativa cuando en la pieza histológica de ampliación no se encontró tumor residual, y positiva cuando se encontró carcinoma residual (ya fuera éste infiltrante o in situ, independientemente de la infiltración inicial).
Para los carcinomas ductales (tanto para los infiltrantes como para los in situ) se consideró el grado histológico. Los carcinomas se consideraron microinfiltrantes cuando había células cancerosas más allá de la membrana basal, pero en una extensión < 0,1 cm.
Para el estudio estadístico, se utilizó el programa de procesamiento estadístico SPSS para Windows (versión 12). Se aplicó el análisis de la χ2 para tablas de contingencia de variables cualitativas, o la prueba exacta de Fisher cuando el caso así lo requirió. Los datos de variables continuas se expresan en forma de media ± desviación estándar y mediana con rango intercuartílico. Para la comparación de dos medias entre sí, se utilizó la prueba de Mann-Whitney, y para la comparación de más de dos medias, la de Kruskal-Wallis. Se consideraron diferencias estadísticamente significativas los valores de p < 0,05.
RESULTADOS
Entre el 1 de enero de 2003 y el 31 de diciembre de 2004, se realizaron, en el Departamento de Ginecología del Hospital Universitario Doce de Octubre de Madrid, 281 biopsias con arpón, de las que 134 (48% de los casos, uno de ellos, un linfoma folicular) fueron diagnosticadas histológicamente de malignas, 22 (8%) resultaron ser hiperplasias atípicas y 125 (44%) tuvieron histología benigna.
Carcinomas
De nuestros 133 casos de carcinoma, la edad media fue de 60,0 años (rango: 37,9-84,0 años; rango intercuartílico: 49,5-71,0 años). El carcinoma más frecuentemente diagnosticado fue el ductal infiltrante (45,9%), seguido por el carcinoma ductal in situ (CDIS) (21,8%).
Los márgenes histológicos de las biopsias estuvieron afectos en 64 casos (48,1%) de los carcinomas diagnosticados tras marcaje con arpón, 27 casos (20,3%) tuvieron márgenes escasos y sólo 42 casos (31,6%), márgenes libres.
No hubo diferencias en cuanto a porcentajes de márgenes libres, escasos y afectos, según las distintas lesiones mamográficas que habían dado lugar a la biopsia (tabla 1).
Tampoco encontramos diferencias significativas en cuanto a porcentajes de márgenes libres, escasos o afectos dependiendo de si se trató de carcinomas in situ (12, 10 y 15 casos), microinfiltrantes (los 2 casos tuvieron bordes afectos) o infiltrantes (30, 17 y 47 casos, respectivamente).
Para el cálculo de media de tamaño se excluyeron todos los carcinomas lobulillares in situ (CLIS), por considerarse, únicamente, este tipo de carcinoma in situ como factor de riesgo de sufrir un carcinoma infiltrante en cualquiera de las mamas en un futuro. En la tabla 2 se presenta la media de los tamaños de todos los carcinomas, considerados globalmente, según estuvieran los márgenes libres, escasos o afectos (diferencias significativas al comparar la media de tamaño de los carcinomas con márgenes libres con la de afectos). Colocando un punto de corte en 12,5 mm, los carcinomas con tamaño histológico igual o menor tuvieron porcentajes de márgenes libres significativamente superiores a los de tamaño mayor de 12,5 mm (tabla 3).
Considerados de forma individual, hubo diferencia de medias de tamaño en los CDIS (tabla 4) cuando los márgenes estuvieron afectos comparados con la de los de bordes libres. No encontramos diferencias significativas en las medias de los tamaños de los carcinomas lobulillares (probablemente debido a que sólo tuvimos 16 casos), ya que fue de 8,33 mm en los libres, 10 mm en los escasos y 15,45 mm en los afectos, ni de los carcinomas ductales infiltrantes (CDI).
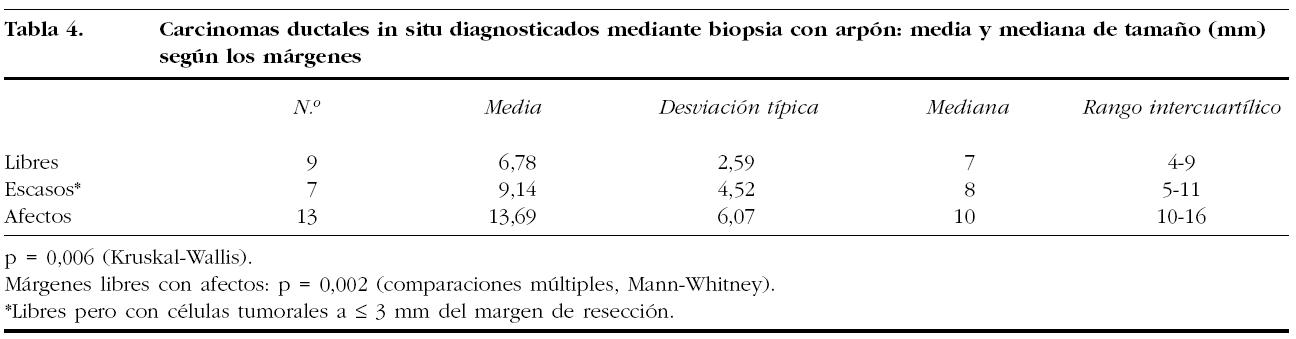
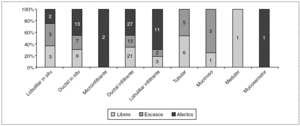
En cuanto al porcentaje del estado de los márgenes quirúrgicos (libres, escasos o afectos) por histología (fig. 1), no fueron significativamente diferentes. Tampoco encontramos diferencias en los casos de carcinomas con multifocalidad en cuanto al estado de los márgenes en la biopsia inicial, ya que correspondieron a carcinomas multifocales el 9,5% (4/42) de los márgenes libres, el 7,4% (2/27) de los escasos y 17,2% (11/64) de los márgenes afectos.
Figura 1. Histología de los carcinomas diagnosticados mediante biopsia con arpón y estado de los márgenes de resección. p = no significativo.
En 50 de los carcinomas diagnosticados mediante biopsia con arpón (37,59%), esa intervención diagnóstica no se amplió (en la mayoría de los casos porque presentaban márgenes libres) y fue la única intervención sobre la mama. No se amplió ninguno de los 8 CLIS (independientemente del estado de los márgenes), ni se consideraron en los posteriores análisis estadísticos. Tampoco se ampliaron 4 casos que presentaron márgenes escasos: 2 CDIS, 1 carcinoma ductal infiltrante (por riesgo quirúrgico) y 1 carcinoma mucinoso (por edad avanzada). De los carcinomas con los márgenes inicialmente afectos únicamente se dejó sin ampliar un CDIS (por expreso deseo de la paciente). El restante 62,41% de los carcinomas diagnosticados con arpón se amplió: el 33,09% mediante ampliación de la biopsia inicial (44 casos) y el 29,32% (39) mediante realización de mastectomía. Tuvimos 5 casos en que la paciente tuvo que ser sometida a una tercera intervención, todos ellos diagnosticados mediante la biopsia inicial como CDIS. El primer caso se trató de un CDIS de grado III que presentaba márgenes afectos, por lo que se programó una mastectomía como ampliación. El resultado histológico de esa ampliación mostró un área de carcinoma ductal infiltrante, motivo por el cual se reprogramó una tercera intervención, esta vez para la realización de linfadenectomía axilar. Los 4 casos restantes de necesidad de realización de una tercera intervención fueron también CDIS (3 de grados II y 1 de grado I), todos ellos con márgenes nuevamente afectos en la ampliación, por lo que se realizó, finalmente, en los cuatro una mastectomía por persistencia de márgenes afectos. Al sumarse estas 4 mastectomías a las ya realizadas como primera ampliación, los 3 tipos distintos de cirugía definitiva de la mama fueron: sólo biopsia con arpón en 50 (37,59%), ampliación de la biopsia en 40 (30,08%) (67,67% de cirugía conservadora en nuestros carcinomas de mama diagnosticados mediante biopsia con arpón) y mastectomía total en 43 (32,33%). Cinco de las biopsias con arpón se realizaron en pacientes que se habían sometido previamente a una cirugía conservadora por carcinoma de mama anterior (y habían recibido radioterapia adyuvante previamente), por lo que al diagnosticarse un nuevo carcinoma, se les programó para una mastectomía, independientemente del tamaño y de la histología de aquél.
En cuanto a positividad de las ampliaciones, no hubo diferencias significativas (p = 0,48) dependiendo de si los márgenes estuvieron afectos o fueron escasos (tabla 5).
Se ampliaron 2 carcinomas con márgenes libres (un ductal infiltrante y un lobulillar infiltrante), y no se encontró tumor residual en el tejido de ampliación en ninguno de los dos.
No encontramos asociación entre la histología positiva en la ampliación y la multifocalidad en los 83 casos que se ampliaron, ya que mientras que en 9 de los 14 carcinomas multifocales (64,3%) encontramos tumor residual, en 33 de los 69 casos sin multifocalidad (47,8%) la histología de la ampliación fue también positiva (p = no significativa).
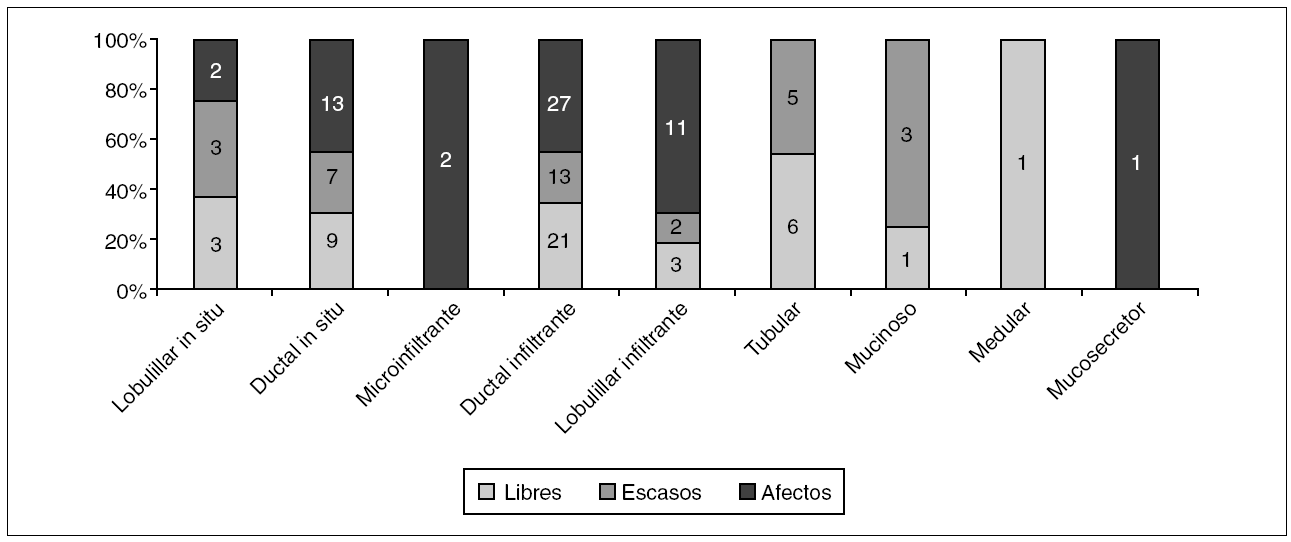
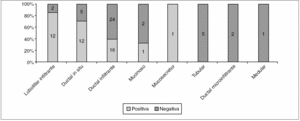
Aunque el porcentaje global de ampliaciones positivas fue de 50,6% (42/83), al clasificarlas por el tipo histológico (fig. 2) vemos que los carcinomas lobulillares infiltrantes son los que tienen un significativo mayor porcentaje de tumor residual, seguidos por los CDIS.
Figura 2. Histología de los carcinomas diagnosticados mediante biopsia con arpón y estado de los márgenes de resección. p = 0,001.
Para los 20 carcinomas con márgenes escasos que se ampliaron, el tipo histológico que con mayor frecuencia presentó tumor residual en la ampliación fue el lobulillar infiltrante, con un 100% en los 2 casos que se ampliaron, seguido por el CDIS, con un 60% (3/5) de positividad en la ampliación, y el ductal infiltrante, con un 33,33% (4/12); la histología de la ampliación del carcinoma medular fue negativa (p = no significativa).
De los 20 márgenes escasos que se ampliaron, no encontramos diferencias en cuanto a la positividad histológica de la ampliación, cuando fue únicamente un margen el escaso (7/14, 50%), fueron dos los márgenes escasos (1/4, 25%) o tres los márgenes escasos (1/2, 50%). Tampoco encontramos diferencias en cuanto a la positividad de las ampliaciones cuando los márgenes eran escasos inicialmente: a 1 mm (6/11; 54,45%), 2 mm (2/6; 33,3%) o 3 mm (1/3; 33,3%) de las células tumorales.
Para los carcinomas con márgenes afectos ampliados, el tipo histológico que significativamente (p = 0,001, en la prueba de Fisher) presentó un mayor porcentaje de tumor residual en la ampliación fue el lobulillar infiltrante, con un 90,91% (10/11) de los casos, frente al 75% (9/12) de CDIS y al 44,4% (12/27) de los carcinomas ductales infiltrantes.
En los 61 casos de márgenes afectos que se ampliaron, no encontramos diferencias en cuanto a la existencia de tumor residual en la pieza de ampliación, dependiendo del número de márgenes afectos en la pieza de biopsia inicial, ya que cuando un único margen estuvo afecto en el 51,9% (14/27) de las ampliaciones se encontró tumor residual histológico en la pieza de ampliación; con 2 márgenes afectos esto ocurrió en un 55% (11/20); con 3 márgenes, en un 54,5% (6/11); con 4 márgenes afectos iniciales, en un 50% (1/2) y con 6 márgenes, en un 100% (1 caso).
Se realizó una linfadenectomía a los 2 carcinomas microinfiltrantes y a 77 de los 94 carcinomas infiltrantes, y no se realizó a 12 pacientes con una edad media de 76,66 ± 4,49 años) ni a otras 5 pacientes por tratarse de recurrencias locales de carcinomas infiltrantes previamente sometidas a linfadenectomía en la anterior cirugía. En las 65 pacientes con carcinoma infiltrante a las que se sometió a ampliación con linfadenectomía axilar simultánea (tabla 6), hubo un porcentaje significativamente mayor de histologías con tumor residual en las que presentaron afectación axilar.
Carcinomas ductales in situ
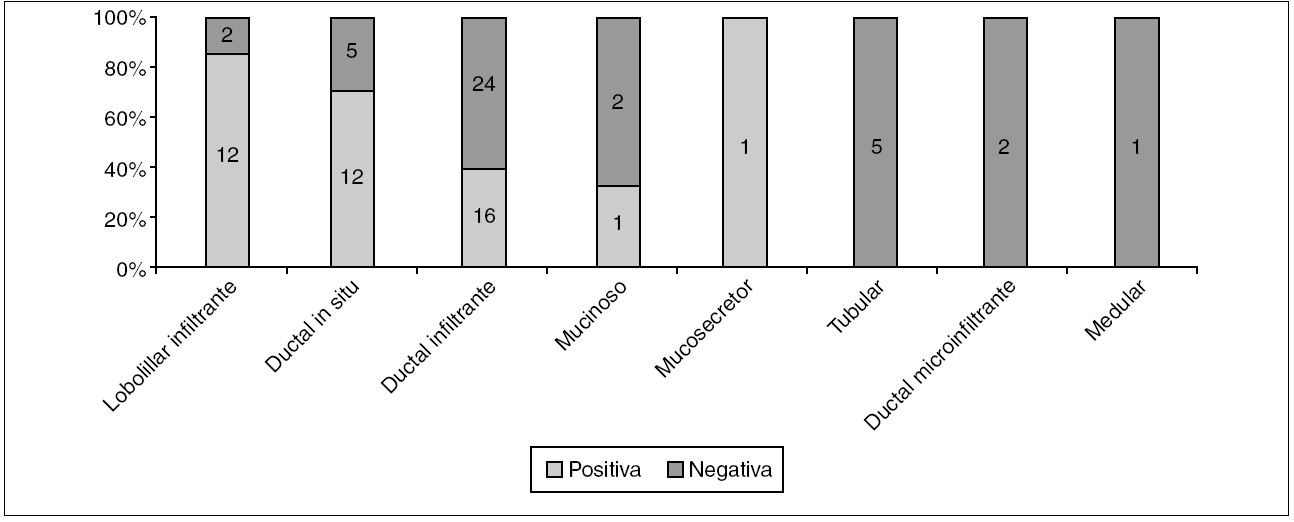
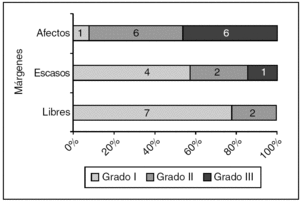
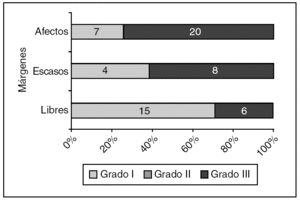
En 29 casos de CDIS, el estado de los márgenes histológicos de la biopsia inicial tuvo relación con el grado histológico (fig. 3).
Figura 3. Carcinoma ductal in situ: estado de los márgenes según el grado histológico. p = 0,012.
De los 17 CDIS que se ampliaron, la histología de la ampliación fue positiva en el 33,3% (1/3) de los de grados I, mientras que para los de grado II o III este porcentaje subió al 78% (11/14), aunque la diferencia no alcanzó la significación estadística (p = 0,19), probablemente debido al escaso número de casos.
Cuando los márgenes de los CDIS fueron escasos en la biopsia con arpón, el 60% (3/5) tuvo una histología positiva, mientras que en el 75% (9/12) de los CDIS con márgenes afectos se encontró tumor residual en la histología.
Tuvimos 4 casos en los que tras una primera ampliación hubo de realizarse otra nueva (esta vez con mastectomía); esto supone un 13,79% de todos los CDIS. De estas 4 reampliaciones, 2 (50%) mostraron CDIS residual.
Carcinomas ductales infiltrantes
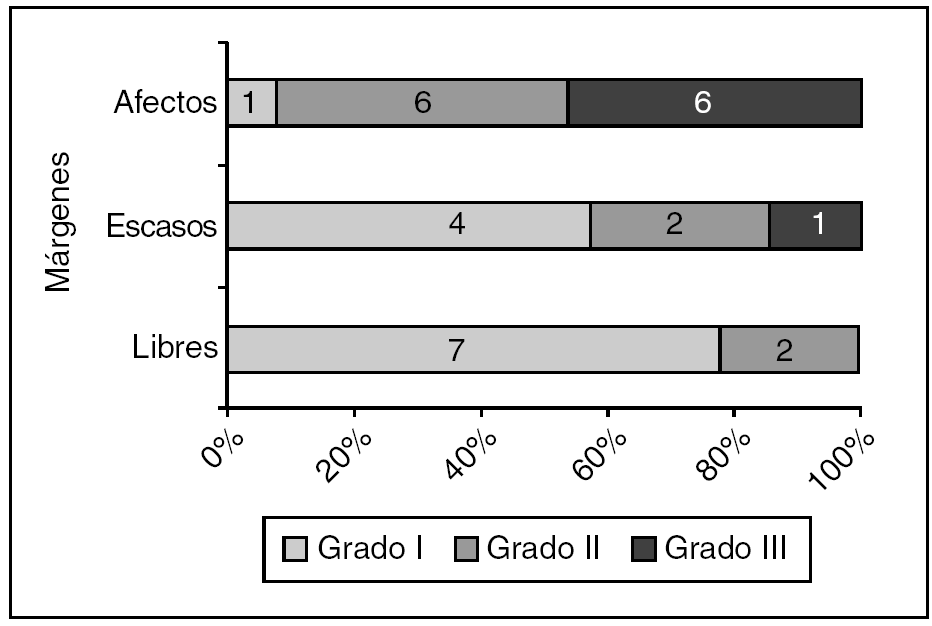
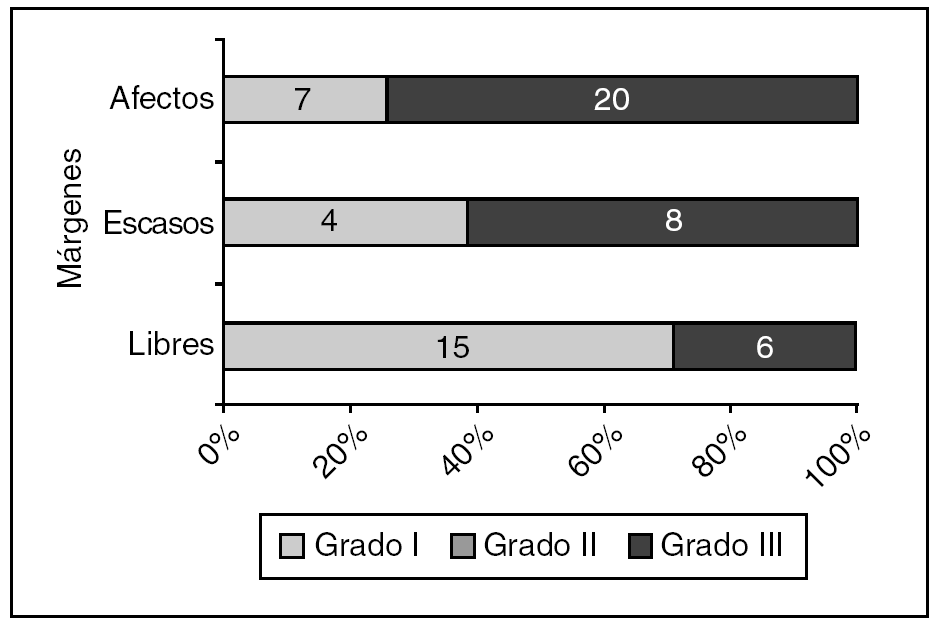
Tuvimos 61 casos de carcinoma ductal infiltrante. El estado de los márgenes (fig. 4) fue significativamente diferente para los de grado I frente a los de grados II o III de Bloom-Richardson.
Figura 4. Carcinoma ductal infiltrante: estado de los márgenes según el grado de Bloom-Richardson (grado I frente a grados II o III). p = 0,006.
De los 61 carcinomas ductales infiltrantes, 30 (49,2%) presentaron un componente de carcinoma ductal in situ asociado. No vimos diferencia alguna en cuanto al estado de los márgenes en los carcinomas ductales infiltrantes, dependiendo de si se asoció, o no, componente intraductal, ya que mientras que un 42,9% (9) de los márgenes libres tenía componente intraductal asociado, un 57,1% (12) no lo tenía. Para los márgenes escasos estos porcentajes fueron del 53,8% (7) y el 46,2% (6), y para los afectos, del 51,9% (14) frente al 48,1% (12). Tampoco encontramos asociación entre la existencia de componente intraductal asociado a una mayor positividad en la histología de la ampliación: el 50% (11/22) de los CDI que tuvieron componente intraductal asociado presentó un tumor residual en la ampliación frente al 33,3% (6/18) que no lo tuvo.
Ampliamos 40 carcinomas ductales infiltrantes, y en las ampliaciones positivas encontramos dependencia del grado histológico, ya que el 36,4% (4/11) de los de grado I que se ampliaron tuvo histología de la ampliación con tumor residual frente al 69% (20/29) cuando el grado fue II o III (a pesar de p = 0,08, probablemente debido al escaso número de casos).
De los 40 carcinomas ductales infiltrantes que se ampliaron, sólo 1 tenía los márgenes libres (la paciente optó voluntariamente por una mastectomía, que se realizó durante el mismo acto quirúrgico de la linfadenectomía). El resultado histológico de la pieza no evidenció un tumor residual. Cuando los márgenes iniciales de la biopsia con arpón estuvieron escasos, 4 casos (33%) tuvieron histología de la ampliación positiva. Cuando los márgenes habían estado afectos, 12 casos (44,4%) tuvieron ampliación positiva.
De los 16 carcinomas ductales infiltrantes cuyas ampliaciones resultaron positivas, sólo 3 (18,8%) mostraron carcinoma residual infiltrante, mientras que en 13 (81,3%) el tumor residual fue un CDIS.
Carcinomas lobulillares infiltrantes
El diagnóstico de carcinoma lobulillar infiltrante se hizo en 16 casos. De ellos, se ampliaron 14 (87,5%). En el único caso con márgenes libres que se amplió no se encontró tumor residual en la pieza de ampliación. Cuando los márgenes fueron escasos, el 100% de las ampliaciones mostró carcinoma residual, mientras que cuando estuvieron afectos (fig. 3), el 90,91% tuvo una histología de ampliación positiva.
DISCUSION
Chagpar et al11 analizaron, en un estudio prospectivo multiinstitucional, tanto las biopsias con arpón (lesiones no palpables) como las biopsias excisionales (nódulos clínicos) y no encontraron diferencias entre el porcentaje de márgenes afectos para ambas técnicas, pero sí según el tamaño histológico del carcinoma. En nuestros casos también observamos relación de márgenes con el tamaño tumoral, como lo demuestra el hecho de que en los carcinomas (considerados globalmente) con tamaño ¾ 12,5 mm, el porcentaje de márgenes libres fue significativamente mayor que en los de tamaño superior. La mediana de tamaño de todos los carcinomas con márgenes libres fue significativamente menor en aquellos carcinomas con márgenes afectos.
Chagpar et al11 encontraron un mayor porcentaje de márgenes afectos en los carcinomas lobulillares que en los ductales, punto que no hemos podido constatar en nuestros casos.
El porcentaje de márgenes afectos encontrados en los últimos años por los distintos autores para biopsias con arpón (con control mamográfico) tiene una amplia variabilidad, entre un 30 y un 50%12-14. Muchos de estos autores sólo sometieron a biopsia con arpón los casos diagnosticados previamente de carcinoma mediante core biopsia estereotáxica y, sin este diagnóstico previo, las lesiones mamográficas de muy alta sospecha. En las biopsias con arpón encontramos un 48,1% de márgenes afectos, si bien se sometieron a biopsia con arpón de entrada todas las lesiones mamográficas sospechosas (tanto de alta como de moderada sospecha), ya que en el período de estudio no teníamos aún la posibilidad de realizar diagnóstico percutáneo estereotáxico. Existe consenso general de la existencia de un mayor porcentaje de márgenes libres cuando se conoce de forma preoperatoria el diagnóstico de carcinoma en la lesión no palpable, ya sea el diagnóstico preoperatorio percutáneo con core biopsia15-18, o incluso mediante citología por punción-aspiración con aguja fina18. Conocer de antemano el diagnóstico de malignidad indudablemente hace que la biopsia con arpón realizada sea más ambiciosa en volumen. Así, en determinados casos, se puede modificar la técnica quirúrgica, como ocurriría en los carcinomas ductales in situ diagnosticados mediante core biopsia estereotáxica, en los que quizá se optaría por una segmentectomía con la consiguiente mayor posibilidad de obtención de bordes libres.
Autores como Keskek et al19 y Chagpar et al11 encontraron estadísticamente un mayor número de márgenes afectos en los casos de carcinoma lobulillar infiltrante. Sin embargo, no encontramos diferencias estadísticas en cuanto al estado de los márgenes dependiendo de los distintos tipos histológicos, probablemente debido al escaso número de casos de carcinomas lobulillares infiltrantes (un 68% de bordes afectos frente a un 44,8% de los CDIS o un 44,3% de los carcinomas infiltrantes).
Con respecto a la imagen mamográfica que dio lugar a la biopsia con arpón, el estudio de Besic et al13 halló estadísticamente márgenes libres más frecuentes en los casos de carcinoma con imagen mamográfica de nódulo espiculado. Florentine et al20 encontraron un mayor número de márgenes afectos en lesiones mamográficas con patrón cálcico exclusivo. No encontramos diferencias en cuanto a estado de márgenes según la imagen mamográfica previa, ni dividiendo las imágenes en patrón cálcico, patrón masa y patrón mixto.
En cuanto a la positividad de las histologías en las ampliaciones de la biopsia inicial, Cellini et al21 notificaron un 68% con tumor residual en la ampliación debida a márgenes afectos y un 53% de las debidas a márgenes escasos. Nuestros resultados son similares, con un 54,1% en el caso de bordes afectos y un 45% para los escasos.
Cellini et al21 observaron que los tumores de grado alto (grado III de Bloom) estuvieron asociados a un mayor porcentaje de tumor residual en todos los grupos. Nosotros, tanto en los CDIS como en los CDI, observamos un mayor porcentaje de ampliaciones con tumor residual en los grados II y III (aunque las diferencias no alcanzaron la significación estadística).
Se han relacionado otros distintos factores con una mayor positividad de las ampliaciones, como el peso de la biopsia (Besic et al13), el número de márgenes escasos o afectos (Cellini et al21), el tipo de histología (Miller et al22), la presencia de componente in situ asociado al carcinoma infiltrante (Besic et al13), el tamaño mayor de 20 mm (Cellini et al21) o la afectación axilar (Mullenis et al23). Cellini et al21 hallaron que a mayor número de márgenes escasos o afectos, mayor fue el porcentaje de histologías positivas. Sin embargo, en nuestros casos no hubo relación entre el número de bordes escasos ni el de afectos con la positividad de la ampliación.
Millar et al22, en un intento por discernir qué casos con márgenes afectos o escasos tuvieron histologías positivas en la ampliación, demostraron un mayor porcentaje de tumor residual en los carcinomas in situ y en los carcinomas con Her 2/neu positivo. Krecke y Gisoold24 atribuyeron a la escasa reacción desmoplásica del carcinoma lobulillar infiltrante un carácter más difuso en su propagación, y por tanto la existencia de células neoplásicas más allá de los límites macroscópicos, lo que eleva tanto el número de bordes afectos en este tipo de histología como el porcentaje de ampliaciones positivas. En nuestros casos, aunque hubo un porcentaje global del 50,6% de positividad en ampliaciones, al analizar según el tipo histológico inicial, los carcinomas lobulillares infiltrantes fueron los que tuvieron mayor porcentaje de tumor residual, seguidos por los CDIS y los ductales infiltrantes.
Aunque no vimos relación entre el componente in situ asociado al carcinoma ductal infiltrante, ni en cuanto al porcentaje de bordes libres ni en cuanto a positividad de la ampliación, Besic et al13 encontraron un mayor número de bordes libres en los carcinomas invasivos sin componente in situ asociado.
Brennin et al25 evidenciaron un mayor porcentaje de afectación ganglionar axilar en los carcinomas infiltrantes que precisaron ampliación y ésta fue positiva comparados con aquellos que tuvieron bordes libres de inicio o aquellos con ampliaciones sin tumor residual (a igualdad de tamaño histológico a nivel de la mama). También nosotros tuvimos un porcentaje significativamente superior de afectación axilar en las reexcisiones positivas. Esto demuestra el grado de agresividad del carcinoma inicial, tanto localmente (en la mama) como en la axila.
Keskek et al19, tras una primera ampliación por márgenes afectos, encontraron nuevamente márgenes afectos en el 14,3% de sus casos, por lo que realizaron una mastectomía como segunda ampliación. En nuestros carcinomas efectuamos una segunda ampliación por márgenes nuevamente afectos en el 3% de los casos (todos ellos CDIS, lo que supone un 13,79% de éstos).
A la luz de nuestros hallazgos, creemos conveniente ampliar los carcinomas lobulillares infiltrantes, los CDIS (sobre todo de grados II y III) y los ductales infiltrantes (también, sobre todo de grados II y III) que no tengan de inicio los márgenes de resección libres a más de 3 mm, e independientemente de las características histológicas, como tamaño inicial, número de márgenes escasos o afectos, y componente intraductal asociado o multifocalidad.
Los CDIS a veces son un reto para la cirugía conservadora, ya que en ocasiones es difícil conseguir márgenes libres, lo que nos puede llevar a la aparente paradoja de tener que realizar una mastectomía cuando, en casos de carcinomas infiltrantes, podemos efectuar cirugía conservadora sin empeorar el pronóstico de estas pacientes.
Correspondencia:
Dra. B. Sancho Pérez.
Departamento de Obstetricia y Ginecología.
Hospital Universitario Doce de Octubre.
Capitán Haya, 18. Madrid 28020. España.
Correo electrónico: bsancho.hdoc@salud.madrid.org
Fecha de recepción: 30/10/06.
Aceptado para su publicación: 6/2/07.