PROGRESOS DE OBSTETRICIA Y GINECOLOGÍA
Volumen 41 Número 6 Julio-agosto 1998
Obstetricia
Cambios hemostáticos en la gestación normal
Haemostatic changes in normal pregnancy
J. Bellart
Ll. Cabero1
R. Gilabert2
R. Saceda
J. Fontcuberta3
J. Monasterio4
R. M. Miralles
Servei de Obstetricia i Ginecologia, Unitat de Medicina Materno-fetal, Hospital Universitari de Tarragona Joan XXIII. Universitat Rovira i Virgili. Tarragona.
1 Servei de Obstetricia i Ginecologia, Hospital Universitari Materno-Infantil Vall d''Hebron, Universitat Autonoma. Barcelona
2 Unitat Anatomia Humana i Embriologia. Departament Ciències Mèdiques Bàsiques. Universitat Rovira i Virgili, Tarragona
3 Servei d''Hematologia, Hospital Santa Creu i Sant Pau. Universitat Autonoma. Barcelona
4 Unitat de Recerca Hemostasia, Hospital Universitari Vall d''Hebron. Universitat Autonoma. Barcelona
Correspondencia:
Jordi Bellart
Servei de Ginecologia i Obstetricia
Hospital Universitari de Tarragona Joan XXIII
Mallafre i Guasch, 4
43007 Tarragona. Spain
E-mail: jbellarta@meditex.es
Tel. (977) 29 58 00
Fax: (977) 22 40 11
Aceptado para publicación 12/3/98
Bellart J, Cabero Ll, Gilabert R, Saceda R, Fontcuberta J, Monasterio J, Miralles RM. Cambios hemostáticos en la gestación normal. Prog Obstet Ginecol 1998;41:329-338.
RESUMEN
Se han estudiado los cambios en el sistema hemostático en 100 mujeres embarazadas sanas. Los plasmas se obtuvieron al primer, segundo y tercer trimestre, durante el parto y tres días postparto. Durante la gestación algunos parámetros incrementaban (complejos trombina-antitrombina III, fibrinopéptido A, cofactor II de la heparina, activador tisular del plasminógeno, inhibidores del activador del plasminógeno y D-dímero), no se modificaban (fibronectina, factor tisular, antitrombina III y proteína C) o disminuían (proteína S). Los resultados sugieren una activación de la coagulación. No obstante, el equilibrio entre coagulacion y fibrinólisis se mantiene durante el embarazo, como se demuestra por la razón entre fibrinopéptida A y D-dímero; mientras que en el puerperio se aprecia una tendencia a la coagulación. Durante la gestación no se produce lesión endotelial ni activación de la vía extrínseca de la coagulación.
PALABRAS CLAVE
Embarazo; Coagulación; Fibrinólisis; Endotelio; Hemostasia.
ABSTRACT
The changes in hemostatic system were evaluated in 100 healthy pregnant women. Plasmas were obtained in the 1st, 2nd and 3rd trimester, during delivery and 3 days after delivery. During pregnancy some parameters increased (thrombin-antithrombin III complexes, fibrinopeptide A, heparin cofactor II, tissue plasminogen activator, plasminogen activator inhibitors and D-dimer), remained unchanged (fibronectin, tissue factor, antithrombin III and protein C) or were found depressed (protein S). The results suggest a coagulation activation. However, the balance coagulation/fibrinolysis is maintained during pregnancy and delivery, as shown by the ratio fibrinopeptide A/D-dimer, but a tendency towards coagulation process is developed in the early puerperium. No endothelial injury could be observed during pregnancy and no activation of intrinsic coagulation pathway.
KEY WORDS
Pregnancy; Coagulation; Fibrinolysis; Endothelium; Hemostasis.
INTRODUCCIÓN
Durante el embarazo se producen cambios adaptativos en el sistema hemostático materno destinados a asegurar una correcta placentación y a proteger al organismo de las posibles hemorragias. Desde el principio de la gestación pueden detectarse cambios en la concentración y/o actividad de los componentes de los sistemas de la coagulación y la fibrinólisis en el plasma materno (1-3). Estos cambios sugieren una activación de la coagulación, demostrable por el incremento de los complejos trombina-antitrombina (CTAT) y una disminución de los inhibidores de la coagulación (4-9). En cuanto al sistema fibrinolítico, se ha observado un incremento del plasminógeno circulante (10,11) y de los inhibidores de los activadores del plasminógeno (PAI) de tipo 1 y 2 (12,13). Asimismo, a pesar de que los resultados no son coincidentes entre diversos autores, se ha hallado una disminución de los activadores del plasminógeno, especialmente cuando se utilizan métodos funcionales para su detección (10,12). Estos resultados sugieren una disminución de la actividad fibrinolítica. No obstante, se ha descrito un aumento de los productos de degradación del fibrinógeno durante el embarazo, especialmente en las últimas semanas de gestación y en la primera semana postparto (11) que en cierto modo cuestiona la depresión de la fibrinólisis en la gestación normal y sugiere que, a pesar del incremento de los depósitos de fibrina en la pared vascular, existe una hiperfibrinólisis compensatoria (14).
El objetivo de este estudio es determinar los niveles plasmáticos de distintos indicadores de la coagulación y fibrinólisis, así como de marcadores endoteliales, durante el embarazo sin complicaciones, con el fin de estandarizar su comportamiento y poder utilizarlos como referencia en el estudio de diferentes anomalías.
MATERIAL Y MÉTODOS
Pacientes
El estudio comprende 100 mujeres embarazadas, con una media de edad de 29 años (20-43 años). Cincuenta y una mujeres eran primigrávidas y la tasa global de cesáreas fue del 13%. La media de peso del recién nacido fue de 3,3 kg (2,8-4,2 kg). Todas las mujeres eran sanas y no presentaron complicaciones durante el embarazo; ninguna presentó hipertensión, diabetes, patología autoinmune ni trastornos trombóticos o hemorrágicos.
Muestras sanguíneas
La sangre se recogió en tubos de citrato sódico (0,13 M) tras punción de la vena antecubital, se centrifugó durante 20 min. a 1.500 g y el plasma se congeló a 80 °C hasta el momento del procesado. Las muestras sanguíneas se obtuvieron en cinco períodos: primer trimestre (10-14 semana), segundo trimestre (24-28 semana), tercer trimestre (32-36 semana), fase activa del parto (39-41 semana) y tres días postparto.
Todas las determinaciones se realizaron mediante pruebas comerciales, siguiendo las intrucciones del proveedor: antitrombina III y proteína C funcional (Chromogenix, Stockolm), cofactor II de la heparina, proteína S total y libre (Diagnositica Stago, Francia), proteína C antigénica (Boehringer Mannheim-Hemodiagnostica Stago), trombina-antitrombina III, fibronectina, y fibrinopéptido A (Behring, Alemania), activadores del plasminógeno tipo 1 y 2 y activador tisular del plasminógeno (Biopool), factor tisular (American Diagnostica Inc, Greenwich) y D-dímero (Organon Teknika, Holanda). Los valores de referencia se obtuvieron a partir de plasmas de mujeres sanas no gestantes.
Expresión de resultados y análisis estadístico
Los valores se expresan como media e intervalo de confianza. Se utilizó el análisis de la varianza (test de Kruskall-Wallis) para estudiar la variabilidad de un parámetro en los distintos períodos estudiados. Cuando éste era significativo (p < 0,01) se utilizó el test U-Mann Whitney, para comparar cada determinación con el tercer día postparto. Se consideraron significativos los valores de p inferiores a 0,01. El coeficiente de regresión lineal r-Pearson se utilizó para determinar la correlación entre dos variables.
RESULTADOS
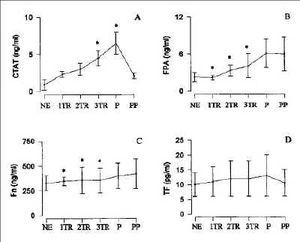
Complejos trombina-antitrombina (CTAT). Los niveles de CTAT fueron superiores a los de referencia durante todo el embarazo, parto y puerperio. La concentración de CTAT aumentó progresivamente desde el primer trimestre, consiguiéndose la máxima concentración en la fase activa del parto y diminuyó en el puerperio, mostrando al tercer día postparto niveles parecidos a los del primer trimestre (tabla 1, Fig. 1A). Se hallaron diferencias significativas entre los niveles al tercer trimestre y al parto, respecto a los obtenidos a los tres días postparto.
| Tabla 1 | Marcadores de la coagulación y endoteliales en el embarazo, parto y puerperio | ||||||||||
| Parámetro | No gestantes | n | 1.er trimestre | n | 2.º trimestre | n | 3.er trimestre | n | parto | n | postparto |
| CTAT, ng/ml | 0,2-2,0 | 60 | 2,3 (1,9-2,7) | 60 | 3,0 (2,2-3,8) | 64 | 4,5 (3,5-5,5)* | 44 | 6,5 (4,5-8,5)* | 50 | 2,1 (1,7-2,5) |
| FPA, ng/ml | 1,5-3,0 | 20 | 2,1 (1,8-2,5)* | 20 | 3,3 (2,4-5,6)* | 24 | 4,2 (2,1-8,0)* | 24 | 6,2 (2,6-11,8) | 30 | 6,0 (3,2-8,7) |
| Fn, ng/ml | 250-400 | 20 | 347 (230-390) | 26 | 357 (220-520) | 26 | 353 (230-660) | 36 | 397 (250-710) | 40 | 416 (230-880) |
| TF, pg/ml | 6-22 | 18 | 12 (6-16) | 18 | 12 (6-18) | 18 | 12 (6-18) | 18 | 12 (6-20) | 18 | 12.5 (6-15) |
| Media (rango). CTAT: complejos trombina-antitrombina III. FPA: fibrinopéptido A. Fn: fibronectina. TF: factor tisular. *p <0,01 vs postparto. | |||||||||||
Figura 1.CTAT = complejos trombina-antirombina III; FPA = fibrinopéptido A; Fn = fibronetcina; TF = factor tisular. NE = no embarazo; TR = trimestre. P= parto; PP = tres días postparto. Media y error estándar. *p <0,01 vs tres días postparto.
Fibrinopéptido A (FPA). Los niveles de FPA fueron superiores a los valores de referencia a partir del segundo trimestre. La concentración de FPA aumentó progresivamente desde el primer trimestre del embarazo, hallándose los niveles más altos en la fase activa del parto y puerperio. Se observaron diferencias significativas entre los valores del embarazo (primer, segundo y tercer trimestre) y los valores del parto y puerperio (tabla 1, Fig. 1B).
Fibronectina (Fn). Los niveles de Fn permanecieron dentro de los límites de referencia durante todo el embarazo. En la fase activa del parto se detectó un incremento de la Fn plasmática y los niveles se mantuvieron elevados a los tres días postparto. Se hallaron diferencias significativas al comparar los valores del embarazo (primer, segundo, tercer trimestre), parto y puerperio (tabla 1, Fig. 1C).
Factor tisular (tissue factor, TF). La concentración de TF se mantuvo constante durante el embarazo, parto y puerperio, hallándose sus niveles dentro de los considerados normales en la población no gestante (tabla 1, Fig. 1D).
Antitrombina III (ATIII). La actividad de ATIII estaba dentro de los valores de referencia durante todo el embarazo y el parto, observándose un ligero aumento en el puerperio (tabla 2, Fig. 2A).
| Tabla 2 | Inhibidores de la coagulación en el embarazo, parto y puerperio | ||||||||||
| Parámetro | No gestantes | n | 1.er trimestre | n | 2.¼ trimestre | n | 3.er trimestre | n | parto | n | 72 h postparto |
| ATIII, % | 95 (80-110) | 40 | 98 (94-102)* | 40 | 99 (95-103)* | 40 | 102 (98-106)* | 20 | 107 (99-115) | 20 | 115 (99-121) |
| HCII, % | 92 (65-120) | 40 | 140 (134-146)* | 60 | 149 (137-161)* | 64 | 151 (139-163)* | 44 | 114 (102-126) | 50 | 117 (111-129) |
| PC funcional, % | 105 (65-120) | 40 | 99 (93-105) | 40 | 102 (98-106) | 40 | 97 (91-103) | 20 | 88 (80-96)* | 20 | 106 (98-114) |
| PC antigénica, % | 105 (75-135) | 40 | 95 (89-100) | 40 | 95 (88-102) | 40 | 90 (82-98) | 20 | 82 (72-92)* | 20 | 93 (85-100) |
| PS total, % | 95 (65-125) | 40 | 90 (84-96) | 40 | 67 (61-73)* | 40 | 65 (60-70)* | 20 | 80 (68-92)* | 20 | 93 (85-100) |
| PS libre, % | 90 (60-120) | 40 | 80 (73-87) | 40 | 60 (54-66)* | 40 | 52 (46-56)* | 20 | 58 (52-65)* | 20 | 73 (67-80) |
| Media (rango). ATIII: antitrombina III. HCII: cofactor II de la heparina. PC: proteína C. PS: proteína S. *p <0,01 vs post-parto. | |||||||||||
Figura 2.ATIII = antitrombina III; HCII = cofactor II de la heparina; NE = no embarazo; TR = trimestre. P = parto; PP = tres días postparto; m= proteína C antigénica; o = proteína C funcional; l= proteína S total; n= proteína S libre. Media y erro estándar. *p < 0,01 vs tres días postparto.
Cofactor II de la heparina (HCII). Los niveles de HCII durante el embarazo (primer, segundo, tercer trimestre) fueron superiores a los de referencia. Los niveles de HCII se hallaron elevados desde el inicio del embarazo (semana 10-14), manteniéndose relativamente constantes hasta el tercer trimestre. En la fase activa del parto, los niveles de HCII disminuyeron recuperando los valores de referencia de la población no gestante (tabla 2, Fig. 2B).
Proteína C (PC). Los valores de PC antigénica y funcional se hallaron dentro de los límites de referencia en los cinco períodos estudiados. No obstante, se apreciaba una disminución, estadísticamente significativa, en la fase activa del parto, tanto de la PC funcional como antigénica (tabla 2, Fig. 2C). La correlación entre los niveles de PC funcional y antigénica fue de r = 0,89 (p < 0,05).
Proteína S (PS). Los valores de PS total y libre estaban dentro de los límites de referencia en el primer trimestre y en el puerperio inmediato. En el segundo y tercer trimestre se apreciaba una disminución, tanto la PS libre como de la total. Los niveles de PS iniciaron su recuperación en la fase activa del parto, siendo esta recuperación más evidente para la PS total que para la PS libre (tabla 2, Fig. 2D). La correlación entre los niveles de PS total y libre fue de r = 0,85 (p < 0,05).
Activador tisular del plasminógeno (t-PA). La concentración de t-PA se halló dentro de los valores de referencia en el primer trimestre, pero a partir del segundo trimestre los niveles de t-PA incrementaron consiguiéndose valores máximos en el parto. Al tercer día postparto, los niveles de t-PA disminuyeron recuperando los valores de referencia de la población no gestante. Se hallaron diferencias significativas entre los niveles de t-PA en el puerperio y los del segundo y tercer trimestre. Asimismo, los niveles de t-PA durante el parto fueron estadísticamente superiores a los de los demás períodos estudiados (tabla 3, Fig. 3A).
| Tabla 3 | Marcadores de la fibrinólisis en embarazo, parto y puerperio | ||||||||||
| Parámetro | No gestantes | n | 1.(er)trimestre | n | 2.º trimestre | n | 3.(er)trimestre | n | parto | n | 72 h postparto |
| t-PA, ng/ml | 3,5 (2-5) | 40 | 4,2 (2,0-6,5) | 40 | 5,4 (2,8-8,0) | 40 | 6,0 (3,0-9,0)(*) | 20 | 7,9 (4,1-12)(*) | 20 | 4,1 (2,3-6,0) |
| D-dímero, ng/ml | 0,2 (< 0,5) | 60 | 0,4 (0,2-0,6) | 60 | 0,7 (0,3-1,3)(*) | 64 | 0,8 (0,4-1,3)(*) | 44 | 1,9 (0,8-2,8)(*) | 20 | 1,1 (0,6-2,4) |
| PAI-1, ng/ml | 50 (< 100) | 40 | 24 (10-52) | 40 | 58 (28-90)(*) | 40 | 90 (50-120)(*) | 20 | 74 (24-114)(*) | 20 | 20 (10-40) |
| PAI-2, ng/ml | 5 (< 10) | 40 | 40 (22-76) | 40 | 153 (87-241)(*) | 40 | 225 (140-340)(*) | 20 | 186 (65-338)(*) | 20 | 44 (26-68) |
| Media (rango).t-PA: activador tisular del plasminógeno. PAI: inhibidor del activador del plasminógeno. (*)p < 0,01 vs postparto. | |||||||||||
Figura 3.t-PA = activador tisular del plasminógeno; PAI = inhibidor del activador del plasminogéno. NE = no embarazo; TR = trimestre. P = parto; PP = tres días postparto. Media y error estándar. *p <0,01 vs tres días postparto.
D-dímero. Entre el primer y tercer trimestre de embarazo se observó un incremento progresivo de los niveles de D-dímero. La concentración de D-dímero incrementó drásticamente en el parto, obteniéndose los niveles máximos. Tras el parto, la concentración de D-dímero disminuyó, aunque permanecía elevada respecto a la población no gestante (tabla 3, Fig. 3B).
Inhibidores del activador del plasminógeno (PAI). Los niveles de PAI-1 permanecieron dentro de los valores de referencia durante todo el embarazo, parto y puerperio. No obstante, la concentración de PAI-1 fue estadísticamente más elevada en el segundo y tercer trimestres y en el parto que en el primer trimestre y puerperio (tabla 3, Fig. 3C). Los niveles de PAI-2 fueron superiores a los de la población no gestante en todos los períodos estudiados. La concentración de PAI-2 incrementó desde el primer trimestre, consiguiéndose los niveles más altos en el tercer trimestre. A los tres días postparto, los niveles de PAI-2 fueron comparables a los obtenidos en el primer trimestre (tabla 3, Fig. 3D).
Relación coagulación/fibrinólisis. La relación entre FPA y D-dímero fue estudiada en cada una de las distintas determinaciones como índice del equilibrio entre coagulación y fibrinólisis. En la población no gestante esta relación se aproxima a 5,0. A pesar de que la concentración de FPA y D-dímero se modificó durante el embarazo, la relación entre ambas proteínas se mantenía relativamente constante a lo largo del embarazo (4,7-5,2) y del parto (4,2-4,8). En cambio, en el puerperio inmediato se apreció un incremento de esta relación (5,8-6,4).
DISCUSIÓN
Los niveles plasmáticos de CTAT y FPA han sido utilizados como indicadores de activación de la coagulación. El incremento de ambos marcadores desde el primer trimestre hasta la fase activa del parto (6,15,16), sugiere que durante la gestación se desarrolla un estado pretrombótico. Tras el parto, los dos marcadores tienen un comportamiento distinto; mientras los niveles de CTAT disminuyen rápidamente (17), los niveles de FPA persisten elevados. Ello sugiere una más lenta recuperación de los valores normales y el mantenimiento de una actividad trombínica elevada en los primeros días del puerperio.
Los inhibidores de la coagulación estudiados ofrecen un distinto comportamiento durante el embarazo, parto y puerperio. La actividad de la ATIII, considerada el inhibidor fisiológico más importante fuera del embarazo, no sufre variaciones importantes durante el embarazo, permaneciendo dentro de los límites de referencia y observándose un ligero incremento tras el parto (3,4,17). La proteína C, que neutraliza los factores V y VIII activados, tampoco mostró cambios importantes durante el embarazo (4,6), manteniendo sus niveles dentro de los límites considerados normales. La disminución de los niveles de PC observada en la fase activa del parto, probablemente este relacionada con la lesión tisular y liberación de tromboplastina a nivel uterino (7). La proteína S, cofactor de la PC, mostró una disminución significativa de sus niveles durante el segundo y tercer trimestre (16). Esta disminución fue evidente tanto para la PS total como para la PS libre, sugiriendo una no modificación de su actividad (18). Así, las modificaciones en los niveles de PS pueden atribuirse a un cambio en su síntesis. En este sentido, Malm y cols. (7) observaron una disminución significativa de los niveles de PS en mujeres en tratamiento con anticonceptivos orales, sugiriendo que su síntesis está regulada por cambios hormonales.
Los resultados correspondientes al HCII indican que es uno de los inhibidores de la coagulación que sufre mayores modificaciones durante el embarazo. Los niveles de HCII fueron muy superiores durante el embarazo respecto a los considerados normales en la población no gestante (19). La reacción del HCII con la trombina, para formar complejos trombina-HCII es más lenta que la de la ATIII para formar CTAT; no obstante, en presencia de dermatán sulfato la trombina generada se une con mayor proporción al HCII que a la ATIII (20). La presencia de dermatán sulfato circulante de origen placentario (21), junto al incremento de los HCII y de complejos HCII-trombina (22), parece indicar que, durante el embarazo, el HCII tiene una función relevante como inhibidor de la coagulación.
Los niveles de TF no han sido estudiados hasta el momento en el embarazo normal. El TF actúa como el mayor iniciador de la vía extrínseca de la coagulación tras una lesión vascular. El TF es una proteína latente de la membrana que se expresa en una gran variedad de tejidos (endotelio, monocitos, placenta) después de que las células hayan sido expuestas a un estímulo apropiado (principalmente citoquinas). La expresión de TF en la superficie celular conduce a la formación de complejos TF: factor VII que activan el factor X de la coagulación, responsable último de convertir la protrombina en trombina e inducir la formación de fibrina y activación plaquetar (23). En estudios recientes se ha relacionado el incremento de TF con procesos patológicos como sepsis, aterosclerosis, cáncer y coagulación intravascular diseminada, procesos todos ellos asociados a una activación de la coagulación y/o lesión celular (24,25).
El TF se expresa en la placenta, hallándose un incremento de su expresión en placentas con inmunopatías (26). Lockwood y cols. (27) mostraron un incremento de TF en el líquido amniótico dependiente de la edad gestacional. En cambio, no se aprecian variaciones en los niveles plasmáticos de TF a lo largo del embarazo normal, sugiriendo que, si bien puede tener una función en la correcta placentación, no parece participar en la activación de la coagulación observada a nivel sistémico y sugiere que durante la gestación la activación de la coagulación tiene lugar principalmente por la vía intrínseca.
La Fn fue considerada una proteína plasmática y de soporte extracelular sin una función específica. No obstante, en la última década se ha demostrado su participación en la «clearance» de fibrina circulante, adhesión plaquetar y respuesta inmune (28-30). La Fn ha sido ampliamente estudiada en el embarazo, fundamentalmente como marcador de lesión endotelial en estados hipertensivos y como un indicador de parto prematuro (31,32). No obstante, existen pocos trabajos en los que se estudie el comportamiento de sus niveles durante el embarazo normal y puerperio. Nuestros resultados indican el mantenimiento de los niveles de Fn hasta el final del embarazo. Cunze y cols. (33) observaron un incremento de Fn a partir de la 36 semana de gestación, atribuible a un incremento de la síntesis a nivel uterino y placentario y a una disminución de su consumo. Este incremento de Fn se mantiene en la fase activa del parto y persiste a los tres días postparto indicando una posible lesión celular provocada por las contracciones uterinas y la separación de la placenta en el momento del alumbramiento.
El sistema fibrinolítico tiene como función principal el control de la deposición de fibrina. Nuestros resultados muestran un incremento progresivo del t-PA antigénico durante el embarazo. En cambio, otros autores han evidenciado una disminución de su actividad sugerente de una depresión de la actividad fibrinolítica (34). En el parto, los niveles de t-PA incrementan drásticamente, probablemente debido a la activación endotelial secundaria a las contracciones uterinas (35). La inhibición de la fibrinólisis también se pone de manifiesto por el incremento de los PAIs. A pesar que ambos inhibidores aumentan durante el embarazo, su cinética es diferente, probablemente debido a su distinto origen: endotelial en el caso del PAI-1 y placentario para el PAI-2. Así, el PAI-1 mantiene sus niveles dentro de los de referencia, a pesar de observarse un incremento progresivo entre el primer y tercer trimestre. Por contra, el PAI-2 presenta unos niveles superiores durante todo el embarazo. En el puerperio se observa una lenta disminución de los niveles de PAI-2, apreciándose todavía valores superiores a los normales a los tres días postparto. El mantenimiento de niveles elevados en el puerperio inmediato puede representar un mecanismo de defensa frente a la rápida acción de la plasmina en los vasos uteroplacentarios y una protección frente a las hemorragias.
Los niveles elevados de D-dímero producto soluble de la degradación de la fibrina contradicen la existencia de una depresión de la fibrinólisis durante el embarazo y refuerzan la idea de un sistema fibrinolítico activo durante la gestación que compensa la activación de la coagulación (34,35).
El embarazo se ha considerado como un estado de hipercoagulabilidad al observarse un incremento de gran parte de los factores y marcadores de activación de la coagulación, junto a una disminución en los inhibidores de la coagulación. No obstante, durante el embarazo no se aprecia un incremento de los fenómenos trombóticos (36-38). Nuestros resultados sugieren que la activación de la coagulación esta compensada por una activación de la fibrinólisis, manteniéndose así el equilibrio hemostático. En este sentido, hemos observado un incremento de CTAT y FPA, pero la supuesta disminución en los inhibidores de la coagulación no existiría, ya que el importante incremento de HCII, unido a la presencia de dermatán sulfato circulante sugieren que el HCII podría actuar como principal inhibidor de la coagulación durante la gestación. Por otra parte, la respuesta fibrinolítica a la activación de la coagulación y, consecuentemente, el equilibrio coagulación/fibrinólisis puede ser valorada mediante la relación FPA/D-dímero (39), ya que, mientras el FPA es un indicador de la formación de fibrina inducida por trombina, el D-dímero es un marcador de la degradación de fibrina. Durante el embarazo normal, el incremento de FPA es paralelo al de D-dímero, manteniéndose la relación FPA/D-dímero próxima a 5,0, al igual que en la población no gestante. En cambio, tras el parto, esta relación aumenta, sugiriendo un predominio de la actividad trombínica frente a la fibrinolítica. Este resultado permite explicar la mayor incidencia de procesos trombóticos en el puerperio (36-38).
En cuanto a la participación del endotelio en el equilibrio hemostático, hemos observado cómo los niveles de Fn y TF permanecen relativamente constantes durante el embarazo y que los niveles de t-PA y PAI-1, a pesar de incrementar, se mantienen dentro de los límites de referencia para la población no gestante. De estos resultados se desprende que, si bien durante el embarazo existe una activación endotelial, ésta no está asociada a lesión celular. Durante el parto se aprecia la mayor variación en los niveles de Fn y t-PA, pudiéndose relacionar estas modificaciones con una activación endotelial asociada a las contracciones uterinas. Por otra parte, el mantenimiento de los niveles de TF sugieren que la activación de la coagulación en el embarazo normal no se produce a través de la vía extrínseca. Este resultado puede ser de gran utilidad para valorar los cambios en esta vía en aquellas patologías en las que la lesión endotelial tiene un papel relevante.
AGRADECIMIENTOS
Los autores agradecen al Servei d''Hematologia del Hospital de la Santa Creu i Sant Pau y a la Unitat de Recerca Hemostasia del Hospital Universitari de la Vall d''Hebron su colaboración en las determinaciones plasmáticas. Este trabajo ha sido parcialmente subvencionado por el FISS 93/0274, España.
BIBLIOGRAFíA
1 Bloom AL, Thomas DP. Haemostasis and thrombosis. Edimburgh: Churchill Livingstone, 1987.
2 Fletcher AP, Alkjaersig NK, Burstein R. The influence of pregnancy upon blood coagulation and plasma fibrinolytic enzyme function. Am J Obst Gynecol 1979;134:743-51.
3 Stirling Y, Woolf L, North WRS, Seghatchian MJ, Meade TW. Haemostasis in normal pregnancy. Thromb Haemostas 1984;52:176-82.
4 De Boer K, Ten Cate JW, Sturk A, Borm JJJ, Treffers PE. Enhanced thrombin generation in normal and hipertensive pregnancy. Am J Obstet Gynecol 1989;160:95-100.
5 Weiner CP, Brandt J. Plasma antithrombin III activity in normal pregnancy. Obstet Gynecol 1980;56:601-3.
6 Gilabert J, Galbis M, Aznar J, Monleón J. Clinica ginecológica: alteraciones de la hemostasia en obstetricia. Barcelona: Salvat Ed, 1988.
7 Malm J, Laurell M, Dahlbck B. Changes in the plasma levels of vitamin K-dependent proteins C and S and of C4b-binding protein during pregnancy and oral contraception. Br J Haematol 1988;68:437-43.
8 Bellart J, Gilabert R, Fontcuberta J, Borrell M, Miralles RM, Cabero L. Coagulation and fibrinolysis parameters in normal and in hypertensive pregnancies. Hypertens Preg 1997 (en prensa).
9 Bellart J, Gilabert R, Fontcuberta J, Carreras E, Miralles RM, Cabero L. Coagulation and fibrinolytic parameters in normal pregnancy and in pregnancy complicated by intrauterine growth retardation. Am J Perinat 1998;15(2): 81-5.
10 Beller FK, Ebert C. The coagulation and fibrinolytic enzyme system in pregnancy and in the puerperium. Eur J Obstet Gynec Reprod Biol 1982;13:177-97.
11 Bonnar J, McNicol GP, Douglas AS. Coagulation and fibrinolytic mechanisms during and after normal childbirth. Br Med J 1970;2:200-3.
12 Kruithof EKO, Trang-Thang CH, Gudinchet A. Fibrinolysis in pregnancy: a study of plasminogen activator inhibitors. Blood 1987;69:460-4.
13 Bellart J, Gilabert R, Fontcuberta J, Borrell M, Miralles RM, Cabero L. Fibrinolysis changes in normal pregnancy. J Perinat Med 1997;25:368-72.
14 Fletcher AP, Alkjaersig NK, Burstein R. The influence of pregnancy upon blood coagulation and plasma fibrinolytic enzyme function. Am J Obst Gynecol 1979;134:743-51.
15 Kobayashi T, Terao T. Preeclampsia as chronic disseminated intravascular coagulation. Study of two parameters: thrombin-antithrombin complex and D-dimer. Gynecol Obstet Invest 1987; 24:170-8
16 Gilabert J, Fernández JA, Espaa F, Aznar J, Estelles A. Physiological coagulation inhibitors (protein S, protein C, and antithrombin III) in severe preeclamptic states and in users of oral contraceptives. Thromb Res 1988;49:319-29.
17 Bremme K, stlund E, Almqvist I, Heinonen K, Blombck M.Enhanced thrombin generation and fibrinolytic activity in normal pregnancy and in the puerperium. Obstet Gynecol 1992;80:132-7.
18 Comp PHC, Gary R, Welsh J, Esmon CT. Functional and immunologic protein S levels are decreased during pregnancy. Blood 1986;68:881-5.
19 Massouh M, Jatoi A, Gordon EM, Ratnoff OD. Heparin cofactor II activity in plasma during pregnancy and oral contraceptive use. J Lab Clin Med 1989;114:679-99.
20 Tollefsen DM, Pestka CA, Monfao WJ. Activation of heparin cofactor II by dermatan sulfate. J Biol Chem 1983;258:6713-6.
21 Andrew M, Mitchell L, Berry L y cols. An anticoagulant dermatan sulfate proteoglycan circulates in the pregnant women and her fetus. J Clin Invest 1992;89:321-6.
22 Liu L, Dewar L, Song Y y cols. Inhibition of thrombin by antithrombin III and heparin cofactor II in vivo. Thromb Haemost 1995;73:405-12.
23 Nemerson Y. Tissue factor and hemostasis. Blood 1988;71:1-8.
24 Koyama T, Nishida K, Ohdama S, Sawada M, Murakami N, Hirosawa S, Kuriyama R, Matsuzawa K, Hasegawa R, Aoki N. Determination of plasma tissue factor antigen and its clinical significance. Br J Haematol 1994;87:343-7.
25 Kato K, Elsayed YA, Namoto M, Nakagawa K, Sueishi K. Enhanced expression of tissue factor activity in the atherosclerotic aortas of cholesterol -fed rabbits. Thromb Res 1996;82:335-7.
26 Labarrere CA, Faulk WP. Fetal stem vessel endothelial changes in placentae from normal and abnormal pregnancies. Am J Reprod Immunol 1992;27:97-100.
27 Lockwood CJ, Bach R, Guha A, Zhou X, Miller WA, Nemerson Y. Amniotic fluid contains tissue factor, a potent initiator of coagulation. Am J Obstet Gynecol 1991;165:1335-41.
28 Blystone SD, Kaplan JE. The role of fibronectin in macrophage fibrin binding: a potential mechanism for high affinity, high capacity clearance of circulating fibrin. Blood Coagul Fibrinolysis 1993;4:769-81.
29 Beumer S, Heijnen HF, Ijsseldijk MJ, Orlando E, De Groot PG, Sixma JJ. Platelet adhesion to fibronectin in flow: the importance of Von Willebrand factor and glycoprotein Ib. Blood 1995;86:3452-60.
30 Dyke MP, Forsyth KD. Plasma fibronectin levels in extremely preterm infants in the first 8 weeks of life. J. Pediatr Child Health 1994;30:36-9.
31 Friedman SA, Schiff E, Emeis JJ, Dekker GA, Sibai BM. Biochemical corroboration of endothelial involvement in severe preeclampsia. Am J Obstet Gynecol 1995;172:202-3.
32 Lockwood CJ, Senyei AE, Dische MR, Casal D, Shah KD, Thung SN, Jones L, Deligdisch L, Garite TJ. Fetal fibronectin in cervical and vaginal secretions as a predictor of preterm delivery. N Engl J Med 1991;325:669-74.
33 Cunze T, Osmers R, Lefhalm B, Wieding J, Fadaian-Motlagh S, Kuhn W. Fibronectin in the plasma during pregnancy and parturation. Gynecol Obstet Invest 1996;41:183-8.
34 Wright JG, Cooper P, Asted D. Fibrinolysis during normal human pregnancy: complex inter-relationships between plasma levels of t-PA and inhibitors and the euglobin clot lysis time. Br J Haematol 1988;69:253-5.
35 Francalanci I, Comeglio P, Liotta AA. D-dimer concentrations during normal pregnancy as measured by ELISA. 1995;78:399-403.
36 Drill VA, Calhoun DW. Oral contraceptives and thromboembolic disease. JAMA 1968;206:77-84.
37 Rudigoz RC, Arnaud MF, Dargent D, Magnin P. The risk of thrombo-embolism in pregnancy and in the postpartum period. A review of 28,828 pregnancies. J Gynecol Obstet Biol Reprod (París) 1981;10:155-61.
38 Kierkegaard A. Incidence and diagnosis of deep vein thrombosis associated with pregnancy. Acta Obstet Gynecol Scand 1983;62:239-43.
39 Prisco D, Paniccia R, Francalanci I, Bandinelli B, Filippini M, Bacci F, Rostagnao C, Abbate R, Gensini GF. Fibrin generation and digestion in patients with angina pectoris. Int J Clin Lab Res 1995;25:222-5.