PROGRESOS DE OBSTETRICIA Y GINECOLOGÍA
Volumen 41 Número 8 Octubre 1998
Obstetricia
Perfil lipoproteico en gestantes y tamaño placentario: ¿existe una relación?
Maternal lipoprotein profile and placental size in healthy pregnances: is there a connection?
J. Uberos 1
D. Cano 2
A. Molina 1
A. Muñoz 1
1 Grupo de Investigación 114. Universidad de Granada
2 Departamento de Fisiología. Universidad de Granada
Correspondencia:
Profesor A. Muñoz Hoyos
Grupo de Investigación CTS-190
Departamento de Pediatría
Universidad de Granada
18071 Granada
Aceptado para publicación 25/6/98
Uberos J, Cano D, Molina A, Muñoz A. Perfil lipoproteico en gestantes y tamaño placentario: ¿existe una relación? Prog Obstet Ginecol 1998;41:465-470.
RESUMEN
La viscosidad de plasma fetal depende de las fracciones proteicas circulantes que a su vez dependen de una transferencia adecuada de precursores desde la madre a través de la placenta. El objeto de nuestro estudio fue explorar la existencia de influencias entre el perfil lipídico maternofetal y el tamaño placentario y fetal. Se estudiaron 30 gestantes de curso no complicado, cuya edad media fue 26,5 (4,3) años. En cada caso se analizó sangre materna obtenida mediante punción venosa en dos momentos de la gestación: 1) durante el parto, y 2) inmediatamente después del parto de la arteria umbilical tras punción placentaria. Medimos en todos los casos los niveles séricos de colesterol total, triglicéridos, LDL-colesterol, VLDL, HDL, ácidos grasos libres, fosfolípidos y apoproteínas A y B. El análisis estadístico consistió en un test de normalidad de Shapiro & Wilk''s, test de Student y estudio de correlación lineal r de Pearson mediante el paquete estadístico SPSS 7.5. Nuestros resultados sugieren que existen relaciones de interés entre las concentraciones de LDL-colesterol y cocientes LDL/HDL y el tamaño placentario.
PALABRAS CLAVE
Lípidos; Gestación; Placenta; Recién nacido.
ABSTRACT
Foetal plasma viscosity will depend on protein fractions in circulation, and these depend on an adequate transference of precursors from mother to foetus through placenta. The object of our study is to establish the influence of foetal-maternal lipoprotein profiles on the placental size and foetal growth in healthy pregnancies. It was studied 30 pregnants, the age of the patients was 26.5 (4.3) years old with a gestational period of 283 (7) days and without pathological case histories. In each case we analysed two sets of blood samples: 1) Blood obtained from the mother at moment of delivery, 2) Blood obtained immediately after delivery from the umbilical artery. We measured total cholesterol, triglycerides, high-density lipoproteins cholesterol, low-density lipoprotein cholesterol, free fatty acids, phospholipids, apolipoprotein A and apolipoprotein. Statistical analysis consisted of Shapiro & Wilk''s test, t-test, and Pearson «r» correlation test with BMDP statistical software. Our results suggest that LDLC concentrations and LDLC/HDLC ratio affect both placental size and foetal growth. Moreover foetal lipid characteristics are consequence of the previous stages of the maternal-placental circulation.
KEY WORDS
Lipids; Placenta; Pregnants; Newborn.
INTRODUCCIÓN
Uno de los factores que determinan el crecimiento intrauterino es la cesión de nutrientes y oxígeno al feto, que depende de la perfusión inalterada de las cavidades intervellosas de la placenta (1). El flujo sanguíneo placentario aumenta hasta el último tercio de la gestación de forma paralela al aumento de peso del órgano. Las funciones de transporte de nutrientes desde la placenta hasta el feto varían en función del tipo de sustrato, siendo de difusión simple para los gases, difusión facilitada por transportadores para la glucosa y transporte activo contra gradiente para aminoácidos, proteínas de bajo peso molecular y oligoelementos; por su parte la viscosidad del plasma fetal va a depender de las fracciones proteicas circulantes (2-5) y éstas a su vez de una adecuada transferencia de precursores desde la madre hacia el feto a través de la placenta. Determinadas moléculas de naturaleza lipídica, fosfolípidos o apoproteínas pueden atravesar la placenta por mecanismo de picnocitosis (6,7). En el transcurso de la gestación mientras el feto aumenta su peso, la placenta no lo hace en consonancia, pudiendo ser esta disparidad la que acabaría abocando a una insuficiencia placentaria, que afectaría negativamente al bienestar fetal y probablemente interviene probablemente este mecanismo en el desencadenamiento del parto; aunque estas circunstancias son objeto de estudio por nuestro grupo en la actualidad. La comprobación en anteriores estudios (8,9) de que los índices aterogénicos del plasma aumentan en la gestante hasta el mismo momento del parto y que estos índices tienen repercusiones sobre la hemorreología del plasma fetal nos ha impulsado a estudiar las repercusiones del perfil lipídico de la gestante sobre las características morfométricas de la placenta.
MATERIAL Y MÉTODOS
Características y definición de la muestra. Se estudian 30 gestantes atendidas en nuestro hospital durante el parto y seleccionadas de acuerdo a los siguientes criterios: 1) Orden cronológico de llegada a nuestro hospital, 2) ausencia de patología detectada en controles obstétricos previos (hipertensión, diabetes, alteraciones del crecimiento fetal) y 3) ausencia de patologías crónicas previas al inicio de la gestación. El protocolo de estudio fue aprobado por el comité de ética de nuestro hospital.
Se registra peso de la placenta en gramos, tras el parto, en una balanza cuya precisión fue regularmente controlada; se respeta la superficie vellositaria coriónica que es el aspecto de la morfometría placentaria que mejor se relaciona con el crecimiento fetal (10). Tras el parto se pinza y se secciona el cordón umbilical a 3 cm de su inserción en la cara placentaria fetal. El grosor máximo de la placenta se obtuvo por control ecográfico previo al parto, siendo el coeficiente de variación de esta técnica en nuestro estudio de 0,58. Las placentas irregulares y multilobuladas fueron excluidas del estudio.
Analizamos en cada uno de los casos muestras de sangre de dos procedencias: 1) obtenidas de la madre durante el expulsivo, 2) obtenidas inmediatamente después del parto de arteria umbilical. Las muestras de sangre se obtuvieron por punción vascular con jeringuillas de un solo uso y se transfirieron a tubos de vidrio secos para las determinaciones en suero o con EDTA 10% (10 g/ml) para las determinaciones en plasma.
Procedimientos metodológicos. Se determina en cada caso: hematócrito (Hto), colesterol total (TC), triglicéridos (TG), lipoproteínas de alta densidad (HDL), lipoproteínas de densidad media (LDL), ácidos grasos libres (FFA), fosfolípidos (PL) microtécnica enzimática (11-14), apoproteína A (ApoA) y apopoproteína B (ApoB) inmunodifusión radial simple (15), proteínas séricas electroforesis en gel. El método usado para el cálculo del LDL-colesterol es la fórmula de Friedewald, que puede ser usada cuando los sujetos han permanecido en ayunas durante largos períodos; sin embargo, trabajos previos (12) muestran la ausencia de cambios significativos en el LDL-colesterol y apoproteínas tras ayunos de sólo seis horas, este hecho se tuvo en cuenta en todas nuestras pacientes. La viscosidad plasmática (PV) se midió con un viscosímetro capilar de Harkness, serie número 8052 (Coulter Electronics). El análisis estadístico consistió en un test de normalidad de Shapiro y Wilk''s, test de comparación de medias y test de correlación «r» de Pearson.
RESULTADOS
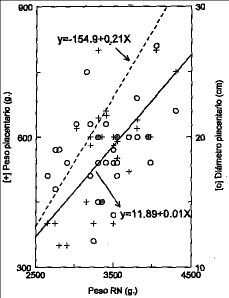
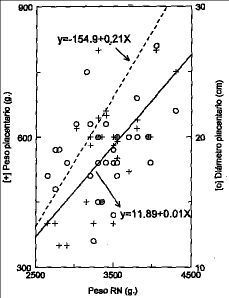
La edad de las gestantes fue de 26,5 (4,3) años y su peso fue de 68,8 (7,4) kg, con una talla de 159,6 (1,3) cm. La edad gestacional media de 283 (7) días. El peso placentario medio fue de 558,5 (123) g, el diámetro placentario medio fue de 18,7 (3,1) cm y el grosor placentario fue de 1,8 (1,03) cm. Encontramos correlaciones significativas entre peso y diámetro máximo de la placenta (r = 0,46; p < 0,01) y entre peso y grosor placentario (r = 0,36; p < 0,05) (Fig. 1). El peso placentario se relacionó significativamente con el peso del recién nacido (r = 0,66; p < 0,01) y con su talla (r = 0,35; p < 0,05); sin embargo, no encontramos relaciones significativas entre peso placentario y peso materno (r = 0,05; p = NS) o talla maternos (r = 0,04; r = NS).
Figura 1. Análisis de regresión entre peso del recién nacido y a) peso placentario y diámetro placentario.
Las concentraciones de lípidos plasmáticos son mayores en la madre que en el feto a excepción de las concentraciones de ácidos grasos libres que muestran concentraciones similares en madre y cordón umbilical (tabla 1).
| Tabla 1 Valores medios y desviación estándar de las variables analizadas en gestantes y su correspondiente cordón umbilical | |||||
| Gestantes | Arteria umbilical | ||||
| (n = 30) | (n = 30) | ||||
| RBC (106/l) | 4,21 (0,35) | * | 4,44 (0,36) | ||
| Hematócrito (%) | 37,2 (3,2) | *** | 47,9 (5,6) | ||
| Hemoglobina (g/dl) | 12,5 (1,2) | *** | 15,9 (1,7) | ||
| MCV (fl) | 86,1 (5,9) | *** | 107 (8,7) | ||
| MCH (pg) | 30 (1,9) | *** | 35,7 (2,2) | ||
| MCHC (g/dl) | 33,8 (2,5) | *** | 33,4 (1,7) | ||
| TC (mmol/l) | 6,49 (1,92) | *** | 1,66 (0,48) | ||
| TG (mmol/l) | 2,26 (1,2) | *** | 0,44 (0,22) | ||
| LDL (mmol/l) | 3,54 (1,48) | *** | 0,69 (0,24) | ||
| HDL (mmol/l) | 1,77 (0,44) | *** | 0,84 (0,26) | ||
| FFA (mmol/l) | 0,041 (0,021) | NS | 0,1 (0,35) | ||
| PL (mmol/l) | 2,57 (0,58) | *** | 1,2 (0,24) | ||
| ApoA (g/l) | 2,29 (0,55) | *** | 0,99 (0,22) | ||
| ApoB (g/l) | 1,61 (0,57) | *** | 0,39 (0,04) | ||
| ApoB/ApoA ratio | 0,73 (0,26) | *** | 0,41 (0,08) | ||
| TC/HDL ratio | 3,86 (1,37) | *** | 2,01 (0,41) | ||
| LDLC/HDL ratio | 2,14 (1,05) | *** | 0,85 (0,25) | ||
| HDL/ApoA ratio | 0,82 (0,26) | NS | 0,86 (0,2) | ||
| FFA/TG ratio | 0,02 (0,009) | NS | 0,25 (0,92) | ||
| ApoB, apoproteína A; ApoB, apopoproteína B; TC, colesterol total; | |||||
| TG, triglicéridos; HDL, lipoproteínas de alta densidad; LDL, lipoproteínas de densidad intermedia; FFA ácidos grasos libres; PL, fosfolípidos. (*) p < 0,05; (**) p < 0,01; (***) p < 0,001, significación estadística observada entre suero materno y arteria umbilical. | |||||
Encontramos una correlación estadísticamente significativa entre peso placentario y concentración de fosfolípidos maternos (r = 0,42; p < 0,05) y entre grosor placentario y volumen corpuscular medio de los hematíes (MCV) (r = 0,41; p < 0,05). El diámetro de la placenta es el parámetro morfológico de la placenta que se relaciona con las características lipídicas del plasma materno de forma más intensa. Hemos obtenido correlaciones significativas entre diámetro de la placenta y ApoA (r = 0,43; p < 0,05), fosfolípidos (r = 0,5; p < 0,01), HDL (r = 0,35; p < 0,05) y ratio ApoB/ApoA (r = 0,35; p < 0,05).
Algunas características hematológicas y hemorreológicas del plasma materno también se relacionan significativamente con el diámetro placentario; así obtenemos coeficientes de correlación significativos con MCV (r = 0,37; p < 0,05), MCH (r = 0,43; p < < 0,05) y PV (r = 0,39; p < 0,05).
El análisis de las relaciones del perfil lipídico del plasma fetal y las características morfométricas de la placenta muestra coeficientes de correlación estadísticamente significativos entre peso placentario y las variables LDL-colesterol (r = 0,36; p < 0,05), fosfolípidos (r = 0,37; p < 0,05) y cociente LDLC/HDL (r = 0,36; p < 0,05). El grosor placentario se relaciona significativamente con ApoA (r = 0,34; p < 0,05) y ratio ApoB/ApoA (r = 0,46; p < 0,01). La viscosidad plasmática se relaciona de forma significativa con el grosor de la placenta (r = 0,34; p < 0,05).
Según nuestros hallazgos el peso del recién nacido aumenta de forma paralela al tamaño de la placenta y a su peso (r = 0,66; p < 0,01), pero no encontramos relaciones de interés con el grosor de la placenta (r = 0,13; p = NS).
DISCUSIÓN
Distintos factores maternos pueden modificar el tamaño placentario y repercutir en diferente grado sobre el crecimiento del feto. La tensión arterial se ha relacionado con alteración vascular a nivel placentario y con el desarrollo fetal (16,17). Diversos autores (18,19,20), han relacionado el desarrollo fetal con los valores de viscosidad plasmática y sanguínea de la gestante y han descrito alteraciones en la microcirculación de la placenta (21).
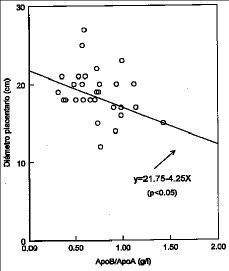
Figura 2. Análisis de regresión entre diámetro placentario y cociente ApoB/ApoA.
Las concentraciones de HDL-colesterol permanecen estacionarias a lo largo de la gestación hasta aproximadamente las semanas 25-34, en que experimentan un lento pero progresivo aumento (22); por otro lado, el incremento del tamaño placentario es progresivo hasta la semana 34-36 en que permanece estacionario (6), no estando claramente establecida la influencia del perfil lipídico del plasma materno sobre estos hallazgos (23,24,25).
Conforme a lo comunicado por otros autores (2,26), la viscosidad intraeritrocitaria parámetro reológico con influencia en la viscosidad sanguínea global se relacionaría con la concentración media de hemoglobina (MCH); en nuestro estudio no hemos medido la viscosidad intraeritrocitaria, pero esta relación podría servir para explicar nuestros hallazgos entre tamaño placentario y MCH. No resulta desconocido que los incrementos de la viscosidad sanguínea durante la gestación pueden modificar el flujo sanguíneo placentario y en consecuencia determinar defectos en el crecimiento placentario y fetal; ya que según nuestros resultados la viscosidad plasmática de la madre también se relaciona con el diámetro de la placenta. Estos hallazgos parecen indicar que los aumentos viscositarios sanguíneos de la madre se relacionan con diámetros placentarios menores.
Los incrementos de ApoB y del ratio ApoB/ApoA que como han comunicado otros autores (22) son buenos indicadores de la aterogenicidad del plasma se relacionan con diámetros placentarios más pequeños. En nuestra opinión las modificaciones reológicas de la sangre o el incremento de los índices aterogénicos del plasma contribuyen conjuntamente o por separado a una disminución del flujo sanguíneo placentario. Puesto que peso placentario y diámetro de la placenta tienen una relación directa y estadísticamente significativa, podemos deducir que los factores que contribuyen a enlentecer el flujo sanguíneo a este nivel podrían ser responsables de un menor tamaño placentario y menor peso del recién nacido. Del Priore y cols. (27) han comunicado una disminución de los niveles de lípidos sanguíneos durante el parto comparado con los valores existentes en el último trimestre de gestación, diversos factores como el propio estrés del parto y la secreción de mediadores hormonales podrían explicar sus resultados.
Los cocientes de lipoproteínas (tabla 1) ApoB/ApoA, TC/HDL y LDLC/HDL son significativamente mayores en la madre que en cordón umbilical. Aunque las concentraciones de ApoA y HDL son menores en cordón umbilical, el ratio HDL/ApoA no es significativamente diferente entre madre y cordón umbilical, ello indica que no existen diferencias significativas en la composición del HDL entre madre y feto. De forma similar, el ratio FFA/TG no difiere entre madre y cordón umbilical, de lo que se deduce que la lipólisis de triglicéridos endógenos debe ser similar en la madre y en su feto.
En base a nuestros resultados podemos concluir que el tamaño placentario puede verse modificado, tanto por las características reológicas de la madre como por las concentraciones de LDL-colesterol y el cociente LDL/HDL. Sin embargo, pensamos que son precisos estudios controlados más amplios para determinar la influencia real de estos parámetros en la población.
BIBLIOGRAFÍA
1 Hay WW. Energy and substrate requirements of the placenta and fetus. Proc Nutr Soc 1991;50:321-36.
2 Reinhart W, Dannoff SJ, King RG, Chien S. Rheology of fetal and maternal blood. Pediatr Res 1985;19:147-53.
3 Foley ME, Isherwwod DM, McNicol G. Viscosity haematocrit, fibrinogen and plasma proteins in maternal and cord blood. Brit J Obstet Gynaecol 1978;85:500-4.
4 Uberos J, Muñoz A, Puertas A, Valenzuela A, Molina A, Rodríguez MT, Molina Font JA. Análisis comparativo de la viscosidad plasmática durante la gestación y períodos feto-neonatal: contribución de las fracciones proteicas. An Esp Pediatr 1995;41:187-9.
5 Uberos J, Muñoz A, Valenzuela A, Bonillo A, Molina A, Rodríguez MT, Molina Font JA. Valoración de la viscosidad del plasma en situaciones que cursan con un disbalance hídrico. Arch Pediatr 1993;44:124-8.
6 Schneider H. The role of the placenta in nutrition of the human fetus. Am J Obstet Gynecol 1991;164:967-73.
7 Madsen H, Ditzel J. Blood-oxygen transport in first trimester of diabetic pregnancy. Acta Obstet Gynecol Scand 1984;63:317-20.
8 Muñoz A, Uberos J, Bonillo A, Valenzuela A, Puertas A, Narbona E, Molina Font JA. Plasma and internal erythrocyte viscosity in umbilical artery and vein of premature infants with and without acute asphyxia. Clin Hemorheol 1994;14:75-82.
9 Uberos J, Muñoz A, Molina A, Puertas A, Valenzuela A, Ruiz C, Molina JA. Lipoprotein profile in healthy pregnant women before and during delivery. Its influence on neonatal hemorheology. J Clin Pathol 1996;49:120-3.
10 Carter AM. Fetal Placental circulation. In: Hanson MA, Spencer JAD, Rodeck CH, eds. Fetus and neonate. Physiology and clinical applications. Cambridge: Cambridge University Press, 1993. p. 116-36.
11 Allain CL, Poon CJ, Chan CSG, Richmond WW, Fu PL. Enzymatic determination of total serum cholesterol. Clin Chem 1974;20:470-6.
12 Cano MD, Blázquez A, Cerezo JA, Cerezo C, Osorio C, Castillo M. Cholesterol distribution in plasma lipoprotein and electrophoretical lipoproteins analysis in normo and hypercholesterolemic subjects. Rev Diagno Biol 1987;36:161-3.
13 Takayama MN, Itoh S, Nagasaki T, Tinimizu I. A new enzymatic method for determination of serum choline containing phospholipids. Clin Chem Acta 1977;79:93-8.
14 Friedwald WT, Levy RI, Frederickson DS. Estimation of plasma low density lipoprotein cholesterol concentration without use of the preparative ultracentrifugation. Clin Chem 1972;18:499-509.
15 Martín Mateos MA. La respuesta inmune a las infecciones pediátricas. An Esp Pediatr 31, 1989, 31 Suppl. 38:20-4.
16 Hobbs JB, Oats JN, Palmer AA. Whole blood viscosity in preeclampsia. Am J Obstet Gynaecol 1982;142:288-92.
17 Gallery E.M, Hunyor SN, Gyory AZ. Plasma volume contraction. A significant factor in both pregnancy associated hypertension (pre-eclampsia) and chronic hypertension in pregnancy. Q J Med New Series 1979;48:593-602.
18 Sagen N, Koller O, Haram K. Haemoconcentration in severe preeclampsia. Brit J Obstet Gynaecol 1982;89:802-5.
19 Di Tommaso M, Ferretti C, Conforti D, D''Ancona RL, Baronci D, Cianciulli D, Branconi F. L''ematocrito e l''emoglobina, parametri di viscosità ematica, in corso di ipertensione gravidanza-indotta. Min Gynecol 1991;43:237-40.
20 Zondervan HA, Oosting J, Smorenberg-Schoorl ME, Treffers PE. Maternal whole blood viscosity in pregnancy hypertension. Gynecol Obstet Invest 1988;25:83-8.
21 Anceschi MM, Coata G, Cosmi V, Gaiti A, Trovarelli GF, Di Renzo GC. Erythrocyte membrane composition in pregnancy-induced hypertension: evidence for an altered lipid profile. Brit J Obstet Gynaecol 1992;99:503-7.
22 Piechota W, Staszewski A. Reference ranges of lipids and lipids and apolipoproteins in pregnancy. Eur J Obstet Gynecol Reprod Biol 45:27-35.
23 Watson WC. Lipaemia, heparin and blood viscosity. Lancet, 2, 1957;2:366-8.
24 Zamorano AF, Arnalich F, Ferro-Sánchez A, Grande C. Deformabilidad eritrocitaria y lípidos de la membrana eritrocitaria en la diabetes mellitus. Med Clin 1987;89:717-20.
25 Muñoz A, Uberos J, Molina A, Valenzuela A, Cano D, Ruiz C, Molina Font JA. Relationship of blood rheology to lipoprotein profile during normal pregnancies and those with intrauterine growth retardation. J Clin Pathol 1995;48:571-4.
26 Pfaferott C, Wenby R, Meiselman HJ. Morphologic and internal viscosity aspects of RBC rheologic behavior. Blood Cells 1982;8:65-78.
27 Del Priore G, Chatterton RT. Jr., Chandarana A, Silver R. Comparison of maternal serum lipids before and during parturition. Obstet Gynecol 1993;82:837-40.