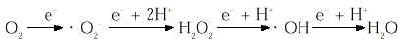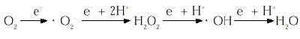PROGRESOS DE OBSTETRICIA Y GINECOLOGÍA
Volumen 41 Número 8 Octubre 1998
Ginecología
Efecto protector de los antioxidantes in vitro e in vivo frente al daño oxidativo en DNA y/o cromosomas
Protective effect of antioxidants in vitro and in vivo against oxidative damage to DNA and/or chromosomes
F. J. Vendrell
J. Ten
A. Cano
J. J. Tarín
Departamento de Pediatría, Obstetricia y Ginecología
Facultad de Medicina. Universidad de Valencia
Avda. Blasco Ibáñez, 17
46010 Valencia
Correspondencia:
Dr. Juan J. Tarín
Departamento de Pediatría, Obstetricia y Ginecología
Facultad de Medicina. Universidad de Valencia
Avda. Blasco Ibáñez, 17
46010 Valencia
Aceptado para publicación 18/5/98
Vendrell FJ, Ten J, Cano A, Tarín JJ. Efecto protector de los antioxidantes in vitro e in vivo frente al daño oxidativo en DNA y/o cromosomas. Prog Obstet Ginecol 1998;41:471-478.
RESUMEN
La producción de especies reactivas del oxígeno (ERO) en la cadena de transporte electrónico de la mitocondria se ha relacionado con un gran número de desórdenes. La «hipótesis del estrés oxidativo de los ovocitos» propuesta por Tarín asume que las ERO son uno de los principales factores capaces de explicar el aumento de las concepciones aneuploides con la edad materna. El presente trabajo presenta datos que demuestran un efecto beneficioso de los antioxidantes in vitro o in vivo contra el daño oxidativo inducido por agentes químicos o físicos. La ingestión de antioxidantes en la dieta parece ser una estrategia eficaz contra el descenso asociado con la edad en el potencial reproductivo y el aumento de la aneuploidia.
PALABRAS CLAVE
Aneuploidia; Edad materna; Estrés oxidativo; Ovocitos; Terapia antioxidante.
ABSTRACT
The production of reactive oxygen species (ROS) in the electron transport chain of mitochondria has been related to a great number of disorders. Tarín''s oxidative stres hypothesis of aneuploidy assumes ROS as a major factor for explaining the increase of aneuploidy conceptions with maternal age. Here, we show data demonstrating a beneficial effect of antioxidants in vitro or in vivoagainst oxidative damage to DNA and/or chromosomes induced by chemical or physical agents. Dietary intake of antioxidant appears to be an efficient strategy against age-associated decrease in reproductive potential and increase in aneuploidy.
KEY WORDS
Aneuploidy; Antioxidant therapy; Maternal age; Oocytes; Oxidative stress.
INTRODUCCIÓN
El estrés oxidativo provocado por las especies reactivas del oxígeno (ERO) causa graves daños sobre los ácidos nucleicos (DNA y RNA), los lípidos, las proteínas y los carbohidratos. Estos daños se acumulan con la edad y se han relacionado con toda una serie de patologías y/o desórdenes como son: el envejecimiento, la arteriosclerosis, ciertos tipos de cáncer, daños inflamatorios como consecuencia de la respuesta inmune o enfermedades autoinmunes (artritis reumatoide, lupus), SIDA, cataratas, disfunciones cerebrales, etc. (1-3). Los sistemas biológicos han desarrollado una serie de mecanismos antioxidantes para combatir el efecto de estas ERO [para consulta: (4)]. En general se distinguen: a) sistemas enzimáticos como la superóxido dismutasa (SOD), la catalasa, la glutación peroxidasa, glutación S-transferasa, proteasas que degradan proteínas oxidadas, glicosilasas, exonucleasas y endonucleasas que reparan el DNA oxidado; b) sistemas de defensa estructural que se basan en aislar o «secuestrar» las fuentes de ERO, por ejemplo: peroxisomas y quelantes de iones metálicos, y c) sistemas no enzimáticos como las dietas antioxidantes. En este caso, hablamos fundamentalmente de la vitamina A (retinoides y carotenoides), vitamina E (*-tocoferol) y vitamina C (ácido ascórbico) (1,5).
El presente trabajo intenta revisar los datos aparecidos en la bibliografía acerca del papel preventivo de los mecanismos antioxidantes frente al daño oxidativo sobre el DNA y/o cromosomas tanto en sistemas in vitro como in vivo. La suplementación de la dieta con antioxidantes puede ser una estrategia eficaz a la hora de prevenir enfermedades asociadas con el estrés oxidativo en general y la reducción de alto riesgo en concepciones aneuploides en mujeres perimenopáusicas, en particular.
Especies reactivas del oxígeno y estrés oxidativo
Para intentar explicar lo que son las ERO hemos de tener presente el concepto de la oxidación. La oxidación se conoce desde el siglo XVIII, a raíz del estudio de la fotosíntesis y la respiración realizados por Joseph Priestley y Antonie Lavoisier. Desde entonces , el concepto de la «toxicidad del oxígeno» ha sido objeto de numerosos estudios. En los organismos aerobios el oxígeno molecular (O2) se reduce complementamente a H2O al final de la cadena de transporte electrónico que está situada en la membrana mitocondrial interna. Continuamente se produce una salida de electrones de su ruta normal de transporte de forma que el O2, que tiene una gran capacidad de atraer electrones debido a su especial configuración electrónica, capta secuencialmente estos electrones generándose las especies reactivas del oxígeno en una reacción conocida como reducción monovalente del oxígeno:
Las especies reactivas formadas son en el ion superóxido (. O2-), el peróxido de hidrógeno (H2O2) y el radical hidróxilo (. OH). Estas especies tienen una gran capacidad de reaccionar con las estructuras celulares. Al presentar una configuración electrónica inestable reaccionan con gran facilidad provocando la oxidación de las moléculas con las que interaccionan y causan graves daños. Las alteraciones que causan los radicales libres en los sistemas biológicos son a distintos niveles: alteración del DNA (lesión celular, mutaciones), destrucción de coenzimas y alteración de su función, cambios en el estatus de NADP(H), alteración en la actividad de enzimas dependientes de grupos tiólicos, cambios en la relación tiol/disulfuro, unión covalente de lípidos y proteínas, cambios en la actividad de enzimas y metabolismo lipídico, alteración de proteínas y recambio proteico, peroxidación lipídica, cambios en la estructura y función de membranas celulares, alteración del transporte de matabolitos y lesión celular a distancia del foco inicial [(para consulta: (4,6-10)].
A lo largo de la evolución, la materia viva ha desarrollado unas defensas antioxidantes adecuadas para resistir la toxicidad del oxígeno. Podemos decir que nos encontramos ante una situación de «estrés oxidativo» cuando en un sistema, afectado por una serie de fuerzas prooxidantes y antioxidantes, existe un desequilibrio a favor de las primeras. En otras palabras, las especies oxidantes exceden la protección homeostática de las células.
Fuentes biológicas de radicales oxigénicos y especies reactivas
A la hora de estudiar el origen de las ERO en las células animales podemos distinguir dos fuentes fundamentales en función de la localización de las reacciones que las producen: fuentes endógenas y fuentes exógenas. Se destacan cuatro fuentes endógenas capaces de producir las ERO: a) en la cadena de transporte electrónico mitocondrial y microsomal existe una gran variedad de enzimas y complejos multienzimáticos implicados en el matabolismo celular capaces de trasferir electrones al O2. Muchos cofactores enzimáticos como son los derivados de las flavinas, nicotinamidas y quinonas, son capaces de reaccionar con el O2, a pesar de que el oxígeno no sea el sustrato fisiológico de estos compuestos. Los lugares clave de las reacciones fisiológicas con el oxígeno son las hemoproteínas de los complejos multienzimáticos microsomales (citocromo p 450) y mitocondriales (citocromo c oxidasa) [para consulta: (9)]; b) existe una gran variedad de enzimas implicados en el metabolismo celular, que pueden transferir electrones al oxígeno dando lugar a la formación de radicales libres. La generación de los radicales por los enzimas es el resultado de distintas condiciones y composición del medio (por ejemplo: pH, pO2). El oxígeno es sustrato de oxidasas y oxigenasas, dependiendo de si su reducción ocurre por la captación de un electrón procedente de un sustrato (oxidasas), o por interacción del electrón con un sustrato (incorporación del O2 por oxigenasas); c) los macrófagos y otras células, responden al ataque de bacterias, virus o parásitos, mediante la liberación de radicales libres tóxicos o citostáticos. Las células fagocíticas destruyen las bacterias o las células infectadas por virus por medio de una «explosión oxidativa» en la que se libera: óxido nítrico (NO), . O2, H2O2 y OCl; d) la autooxidación de los compuestos celulares es otra de las fuentes de ERO. De hecho, se ha pensado que la reacción de autoxidación podría haber sido uno de los procesos iniciales en la generación de los primeros radicales libres a partir de un carbohidrato extremadamente puro [para consulta: (6)].
Existe una serie de factores externos que pueden inducir estrés oxidativo por generación de radicales libres. Esto constituye lo que se conoce como fuentes exógenas de producción de ERO. Estos agentes son las radiaciones ionizantes o de alta energía, radiación solar, luz visible con fotosensibilización, biotransformación de drogas e inducción de ciclos redox, choque térmico, humo del tabaco y otros contaminantes ambientales. Además, podemos añadir una serie de compuestos que ingerimos de forma natural en la dieta y que pueden generar especies oxidantes por ciclos redox. Estos compuestos proceden de los vegetales y son fundamentalmente compuestos fenólicos naturales, la cafeína y otros agentes clorogénicos (1).
Hipótesis del «estrés oxidativo de los ovocitos»
La hipótesis del «estrés oxidativo de los ovocitos» propuesta por Tarín en 1995 (11) intenta explicar la aneuploidía asociada con la edad materna como consecuencia de un mecanismo basado en la producción de radicales libres. Esta hipótesis se basa en dos ideas previas. Por una parte, la «teoría de los radicales libres de envejecimiento» (12) que asume un daño peroxidativo sobre el DNA nuclear y las membranas celulares como el mecanismo fundamental para explicar la caída de la función celular con la edad y, por otra parte, en una posterior modificación de la teoría de Harman propuesta por Miquel [ver revisiones de: (8, 13-15)] en la que se asigna un papel clave al daño que producen las ERO sobre la mitocondria en el proceso de senescencia.
Los ovocitos primarios rodeados de una capa escamosa de células de pregranulosa (folículos primordiales), están «detenidos» en diplotene de la primera profase meiótica desde estadios perinatales hasta la ovulación, que en mujeres puede alcanzar edades de 45 o más años. Durante este tiempo, se puede generar estrés oxidativo en los ovocitos y/o en las células que rodean al ovario. Esto causaría una caída en la viabilidad del ovocito/concepto, resultando en una reducción de las tasas de embarazo, así como un aumento en las tasas de aborto espontáneo (16).
Como sugiere la hipótesis del estrés oxidativo de los ovocitos (11), las ERO afectarían fundamentalmente a las mitocondrias. En primer lugar, el daño oxidativo afectaría a los lípidos dañando la membrana interna mitocondrial (peroxidación lipídica), generándose productos citotóxicos, desorganización de la membrana, pérdida de fluidez y elasticidad y alteraciones en la permeabilidad iónica de las membranas celulares (8,9,14,15). En segundo lugar, se produce un aumento del daño oxidativo sobre las proteínas mitocondriales con la edad. Los daños son tanto sobre proteínas funcionales como sobre su síntesis y su tasa de recambio (8,14,15). Por último, la diana principal del ataque oxidativo es el DNA mitocondrial (DNAmt) debido a sus especiales características que lo hacen altamente susceptible. Un daño sobre el DNAmt aumentaría probablemente la generación de ERO por un desacoplamiento en el transporte de electrones [Revisiones: (8,14,15); ver también: (17)].
Todos los efectos mencionados darían lugar a una reducción en el número de mitocondrias funcionalmente activas y, por tanto, se reduciría la síntesis de ATP celular (8,9,14,15). Las mitocondrias defectuosas aumentarían la producción de ERO, provocando una caída del cociente glutatión reducido (GSH)/glutatión disulfuro (GSSG). La conversión del GSH a GSSG induciría la apertura del poro de transición de permeabilidad de las mitocondrias, liberándose Ca2+ desde la matriz hacia el citosol, dando lugar a una perturbación de la homeostasis intercelular del Ca2+ que resultaría en un aumento sustancial de la concentración de Ca2+ citosólico (18) [ver revisiones: (8,19,20)]. Cada uno de estos parámetros actuando juntos o separadamente podrían afectar al equilibrio dinámico de los microtúbulos (polimerización y despolimerización de la tubulina) y/o microfilamentos (polimerización y despolimerización de la actina) y, por tanto, podrían inducir las alteraciones en el citoesqueleto observadas en ovocitos de hembras envejecidas (16).
Efecto protector de los antioxidantes frente al daño oxidativo en el DNA y/o cromosomas
La hipótesis del estrés oxidativo (11) es atractiva por el hecho de que ofrece una posible prevención en la aparición de concepciones aneuploides mediante la administración de antioxidantes en la dieta. En la literatura aparecen datos acerca del papel preventivo de los antioxidantes tanto en sistemas in vitro como in vivo (dietas suplementadas). La tabla 1 hace referencia al efecto protector de los antioxidantes aplicados en sistemas in vitro. Los datos registrados muestran cómo los antioxidantes y/o las especies neutralizantes de ERO pueden inhibir el daño oxidativo sobre el DNA y/o cromosomas inducido, en sistemas in vitro por hiperoxia, efecto de los fagocitos, fármacos, radiaciones cercanas a la longitud de onda del UV, radiaciones * y UV y/o una fuente fría de luz fluorescente. Estos resultados vienen a complementar otros estudios que muestran cómo los agentes reductores de grupos S-S, como el ditioeritreitol, mercaptoetanol y GSH, previenen y/o revierten la inhibición de la polimerización de la tubulina in vitro por la diamida (36). Todo este grupo de evidencias nos lleva a pensar que los antioxidantes y/o especies neutralizantes de ERO pueden revertir el efecto perjudicial que ejerce el estrés oxidativo sobre la maquinaria de división celular y, por tanto, sugiere un mecanismo de protección de los gametos y las células somáticas en contra de aquellas condiciones de cultivo que pudieran inducir estrés oxidativo, como, por ejemplo, elevadas presiones parciales de O2 , incidencia de luz visible y presencia de metales de transición y/o sustancias prooxidantes en el medio de cultivo.
| Tabla 1 Efecto protector de antioxidantes frente al daño oxidativo en el DNA y/o cromosomas en sistemas in vitro | ||||
| Referencia | Población celular | Agente inductor del daño oxidativo | Antioxidante estudiado | Efecto protector |
| Shamberger y cols. (21) | Leucocitos humanos | Agentes carcinogénicos | Vitamina C | Roturas cromosómicas |
| Parshad y cols. (22) | Fibroblastos humanos | Fuente fría de luz fluorescente | Catalasa | Roturas cromosómicas Intercambios cromátides hermanas |
| Emerit y cols. (23) | Linfocitos humanos | Radiación UV, xantina + xantina oxidasa | SOD | Rotura cromosómica Intercambios cromátides hermanas |
| Small y Patterson (24) | Cél. ovario hámster chino Cél. pulmón hámster chino | Benzopireno | Vitamina E | Aberraciones cromosómicas 1 |
| Emerit y cols. (25) | Linfocitos humanos | Forbolmiristato (PMA) | SOD, GSH- peroxidasa | Aneuploidia y aberraciones cromosómicas |
| Sofuni e Ishidate (26) | Fibroblastos hámster chino | Hipoxantina + xantina oxidasa | Catalasa | Aberraciones cromosómicas |
| Weitberg y cols. (27) | Cél. ovario hámster chino | Acción de fagocitos | SOD, catalasa, benzoato, manitol y vitamina E | Intercambios cromátides hermanas |
| Biaglow y cols. (28) | Cél. carcinoma pulmón humano | Radiación * | GSH- peroxidasa | Entrecruzamientos DNA-proteína |
| Weitberg (29) | Cél. ovario hámster chino | Hipoxantina + xantina oxidasa | Catalasa, SOD vitamina E | Intercambios cromátides hermanas |
| Weitberg (30) | Cél. ovario hámster chino | Xantina + xantina oxidasa | Catalasa, SOD, | Intercambios cromátides hermanas |
| Paul y cols. (31) | Cél. tumorales mama ratón | Hipoxantina + xantina oxidasa | Catalasa | Roturas cadena DNA |
| Sandström y Marklund (32) | Carcinoma de colon y mesotelioma humanos | H2O2 + tBH | GSH- peroxidasa | Roturas cadena DNA |
| Gille y cols. (33) | Cél. ovario hámster chino | Hiperoxia (80-90% de O2) | Carnosina (ß-alanil- histidina) | Roturas cromosómicas |
| Dreosti y McGown (34) | Esplenocitos de ratón | Radiación UV | Vitaminas C y E | Formación de micronúcleos |
| Anderson y cols. (35) | Linfocitos humanos y cél. sanguíneas de ratón | Bleomicina | Vitaminas C y E | Aberraciones cromosómicas Formación micronúcleos |
| 1 Incluye: roturas, unión cromosómica, fusión, anillos, cromosomas dicéntricos y poliploidía. | ||||
La tabla 2 recoge algunos de los efectos beneficiosos contra el daño oxidativo en DNA y/o cromosomas por parte de antioxidantes ingeridos en la dieta como las vitaminas A, C, y E, antioxidantes sintéticos y mezcla de distintos antioxidantes. Como se puede observar, la ingesta de dietas suplementadas con antioxidantes inhibe el daño oxidativo sobre el DNA y/o cromosomas inducido de forma endógena, por fármacos, radiaciones UV, radiaciones *, o asociado con la edad. Estos resultados están en consonancia con los de Boxer y cols. (45) que demuestran cómo la administración diaria de vitamina E previene el ensamblaje de los microtúbulos inducido por el estrés oxidativo asociado con la fagocitosis en leucocitos polimorfonucleares procedentes de un niño con deficiencia congénita de la actividad glutatión sintetasa. La administración de vitamina E también provoca un aumento del cociente GSH/GSSG en las células cardíacas de cobaya (46). La suplementación de la dieta con vitaminas C y E protege contra la oxidación del GSH en sangre y mitocondrias de hígado y cerebro de ratas envejecidas (47). Todas estas evidencias hacen pensar en la suplementación de la dieta como una estrategia eficaz en la prevención de enfermedades asociadas con el estrés oxidativo, en particular daño oxidativo al DNA, cromosomas y microtúbulos.
| Tabla 2 Efecto protector de antioxidantes frente al daño oxidativo en el DNA y/o cromosomas en sistemas in vivo (dietas suplementadas) | ||||||
| Referencia | Población celular | Agente inductor | Antioxidante | Efecto protector | ||
| del daño oxidativo | estudiado | |||||
| Vogel y Spielman (37) | Conceptos preimplantatorios ratón | Ciclofosfamida | Vitamina C | Tasa metafases erróneas | ||
| Kola y cols. (38) | Intercambios cromátides hermanas | |||||
| Fraga y cols. (39) | Espermatozoides humanos | Oxidación endógena | Vitamina C ß-caroteno + | Niveles oxo8dG | ||
| Bianchi y cols. (40) | Linfocitos humanos | Bleomicina | + cantaxantina | Formación de micronúcleos | ||
| He y Yasumoto (41) | Hepatocitos de ratón | Paracuat | Hidroxitolueno de butilo (BHT) | Roturas cadena DNA | ||
| Cheng y cols. (42) | Linfocitos humanos | Nicotina | Vitamina A y Se | Intercambio cromátides hermanas | ||
| Gaziev y cols. (43) | Esplenocitos de ratón | Radiación * | Vitamina C + ß-caroteno + *-tocoferol + ácido ascórbico + rutina + Se + Zn | Mutaciones del locus de la hipoxantina-guanina fosforiltransferasa | ||
| Gaziev y cols. (44) | Linfocitos humanos | Edad + radiación * | Vitaminas A, C y E + ß-caroteno + ác. fólico + rutina | Formación de micronúcleos | ||
Futuras aplicaciones clínicas de la terapia antioxidante
Recientemente, nuestro grupo de investigación ha demostrado que las alteraciones en el citoesqueleto y los errores en la división meiótica y segregación cromosómica provocados por el estrés oxidativo inducido químicamente pueden neutralizarse o revertirse mediante la adición de antioxidantes al medio de cultivo (48). En particular, cuando los ovocitos de ratón eran madurados in vitro durante 16 horas, desde el estado de vesícula germinal (VH) hasta metafase II (MII) en presencia del agente oxidante diamida, se producía un aumento de ovocitos que mostraban bloqueo meiótico (ovocitos detenidos en MI) y retraso meiótico (ovocitos en telofase I). Ambos efectos disminuían significativamente en aquellos grupos tratados con diamida + ditiotreitol [DTT, agente reductor de puentes de disulfuro (S-S)].
Por otra parte, hemos podido detectar (49) que el envejecimiento in vitro de los ovocitos está asociado con una baja tasa de fecundación, una elevada proporción de conceptos que muestran fragmentación celular a las 24 horas después de la inseminación y una disminución del porcentaje de conceptos que alcanzan el estadio de blastocisto. Estos efectos eran prevenidos, al menos en parte, cuando los ovocitos eran incubados durante 12 horas antes de la inseminación en presencia de DTT. Estos datos aportan evidencias suficientes para pensar que la adición de antioxidantes a medios de cultivo puede ser una estrategia eficaz para mejorar los resultados en tratamientos de FIV en humanos.
En otro estudio analizamos el efecto de la edad materna y la suplementación dietética con antioxidantes sobre distintas variables reproductivas. Para ello, alimentábamos a hembras de ratón desde el momento del destete hasta su sacrificio a las 12, 28-32 ó 40 semanas de edad con una dieta de laboratorio convencional suplementada o no con una mezcla de antioxidantes [vitamina C (10 g/kg de dieta) y vitamina E (0,6 g/kg de dieta)] (48). Este protocolo nos permitió demostrar un efecto beneficioso de la dieta en la tasa de ovulación tras estimulación ovárica y en la segregación cromosómica durante la primera división meiótica. De hecho, el envejecimiento de las hembras hasta 40 semanas de edad alimentadas con una dieta de laboratorio convencional provocó una caída significativa en el número de ovocitos extraídos en MII. No obstante, este hecho revirtió significativamente en las hembras alimentadas con la misma dieta pero suplementada con antioxidantes. Por otra parte, demostramos que el porcentaje de ovocitos anormales (dispersión cromosómica y nuliploidia) o asincrónicos (anafases I o telofases I) eran 2,7 veces mayores en hembras envejecidas alimentadas con una dieta control que en hembras envejecidas alimentadas con la dieta suplementada con antioxidantes. Además, el porcentaje de aneuploidia y diploidia fue significativamente mayor en hembras envejecidas alimentadas con la dieta control que en hembras envejecidas alimentadas con la dieta suplementada.
Todos estos resultados nos hacen pensar que la ingesta de dietas suplementadas con vitaminas C y E reduce el riesgo de la aparición de anomalías con la edad materna. Aunque la extrapolación de estos datos a la especie humana debe hacerse con cautela, parece clara la relación entre la suplementación de la dieta con antioxidantes y la reducción del alto riesgo de concentraciones aneuploides en mujeres perimenopáusicas. Antes de la aplicación clínica de estos descubrimientos deberíamos conocer el tiempo óptimo de administración del tratamiento y la dosis adecuada en humanos. Las investigaciones futuras deben ir encaminadas a ver el efecto de un tiempo corto de tratamiento con dosis más bajas que las empleadas en animales de experimentación. Esta información es de especial interés debido a que la suplementación de la dieta con altas dosis de vitaminas C y E puede tener consecuencias adversas sobre la función reproductora (48).
BIBLIOGRAFÍA
1 Ames BN, Shigenaga MK, Hagen TM. Oxidants, antioxidants, and the degenerative diseases of aging. Proc Natl Arcad Sci USA 1993;90:7915-22.
2 Frei B. Reactive oxygen species and antioxidant vitamins: mechanisms of action. Am J Med 1994;97:5-13.
3 Jacob RA, Burri BJ. Oxidative damage and defense. Am J Clin Nutr 1996;63:985-90.
4 Halliwell B, Gutteridge JMC. Free radicals in Biology and Medicine. 2.ª Ed. Oxford: Clarendon Press, 1989. p. 543.
5 Sies H. Biochemistry of oxidative stress. Angw Chem Int Ed Engl 1986;25:1058-71.
6 Pryor WA. The role of free radical reactions in biological systems. In: Free radicals in Biology. Vol I-VI. Ed: Wiliam A. Pryor. New York: Academic Press, Inc., 1976. p. 1976-85.
7 Harman D. Free radical theory of ageing: role of free radicals in the organization and evolution of life, ageing and disease processes. In: Johnson JE, Walford R, Harman D, Miquel J (eds.). Free radicals, aging and degenerative diseases. Alan R. Liss, Inc., 1986. p. 1-76.
8 Miquel J, Fleming J. Theorical and experimental support for an «oxigen radical-mithocondrial injury» hypothesis of cell aging. In: Johnson JE, Walford R, Harman D, Miquel J. (eds.). Free radicals, aging and degenerative diseases. Alan R. Liss, Inc., 1986. p. 51-74.
9 Nohl H. Oxygen radical release in mitochondria: influence of age. In: Johnson JE, Walford R, Harman D, Miquel J. (eds.). Free radicals, aging and degenerative diseases. Alan R. Liss, Inc., 1986. p. 77-97.
10 Cheeseman KH, Slater TF. An introduction to free radical Biochemistry. Free radicals Biochemistry., 1993. p. 481-91.
11 Tarín JJ. Aetiology of age-associated aneuploidy: a mechanism bassed on the «free radical theory of ageing». Hum Reprod 1995;10:1563-5.
12 Harman D. Aging: a theory based on free radical and radiation chemistry. J Gerontol 1956;11:298-300.
13 Miquel J, Economos AC, Fleming J, Johnson JE. Mitochondrial role in cell ageing. Exp Gerontol 1980;15:575-91.
14 Shigenaga MK, Hagen TM, Ames BN. Oxidative damage and mitochondrial decay in aging. Proc Natl Acad Sci USA 1994; 91:10771-8.
15 Kalous M, Drahota Z. The role of mitochondria in aging. Physiol Res 1996;45:351-9.
16 Tarín JJ. Potential effects of age-associated oxidative stress on mammalian oocytes/embryos. Mol Hum Reprod 1996;2:717-24.
17 Keefe DL, Niven-Fairchild T, Powell S, Buradagunta S. Mitochodrial deoxybonucleic acid deletions in oocytes and reproductive aging in women. Fertil Steril 1995;64:577-83.
18 Beatrice MC, Stiers DL, Pfeiffer DR. The role of glutathione in the retention of Ca2+ by liver mitochondria. J Biol Chem 1984; 259:1279-87.
19 Gunter TE, Pfeiffer DR. Mechanisme by which mitochondria transport calcium. Am Phisiol Soc 1990;90:755-86.
20 Orrenius S, Burkitt MJ, Kass GEN y cols. Calcium ions and oxidative cell injury. Ann Neurol 1995;32:33-42.
21 Shamberger RJ, Baughman FF, Kalchert SL, Willis CE, Hoffman GC. Carcinogen-induced chromosomal breakage decreased by antioxidants. Proc Nat Acad Sci USA 1973;70:1461-3.
22 Parshad R, Taylor WG, Sandford K, Camalier RF, Gantt R, Tarone RE. Fluorescent light-induced chromosome damage in human IMR-90 fibroblasts. Role of hydrogen peroxide and related free radicals. Mut Res 1980;73:115-24.
23 Emerit I, Keck M, Levy A, Feingold J, Michelson AM. Actived oxygen species at the origin of chromosome breakage and sister-chromatid exchanges. Mut Res 1982;103:165-72.
24 Smalls E, Patterson RM. Reduction of benzo(a)pyrine induced chromosomal aberrations by DL-alpha-tocopherol. Eur J Cell Biol 1982;28:92-7.
25 Emerit I, Levy A, Cerutti P. Suppression of tumor promoter phorbolmyristate acetate-induced chromosome breakage by antioxidants and inhibitors of arachidonic acid metabolism. Mut Res 1983;110:327-35.
26 Sofuni T, Ishidate M. Induction of chomosomal aberrations in cultured Chinese hamster cells in a superoxide-generating system. Mut Res 1984;140:27-31.
27 Weitberg AB, Weitzman SA, Clark EP, Stossel TP. Effects of antioxidants on oxidant-induced sister chromatid exchange formation. J Clin Invest 1985;75:1835-41.
28 Biaglow JE, Varnes ME, Tuttle SW, Oleinick NL, Glazier K. The effect of L-buthionine sulfoximine on the aerobic radiation response of A549 human lung carcinoma cells. J Rad Onc Biol Phys 1986;12:1139-42.
29 Weitberg AB. Antioxidants inhibit the effect of vitamin C on oxygen radical-induced sister-chromatid exchanges. Mut Res 1987;191:53-6.
30 Weitberg AB. Effect of combinations of antioxidants on oxygen radical-induced sister chromatid exchanges. Clin Genet 1987; 32:114-7.
31 Paul LA, Fulton AM, Heppner GH. Reactive oxygen-mediated damage to murine mammary tumor cells. Mut Res 1989; 215:223-34.
32 Sandström BE, Marklund SL. Effects of variation in glutathion peroxidase activity on DNA damage and cell survival and human cells exposed to hydrogen peroxide and t-butyl hydroperoxide. Biochem J 1990;271:17-23.
33 Gille JJ, Pasma P, Van Berkel CG, Joenje H. Effect of antioxidants on hiperoxia-induced chromosomal breakage in Chines hamster ovary cells: protection by carnosine. Mutagenesis 1991:6:313-8.
34 Dreosti I, McGown M. Antioxidants and UV-induced genotoxicity. Res Commun Chem Patol Pharmacol 1992;75:251-4.
35 Anderson D, Basaran N, Blowers SD, Edwards AJ. The effect of antioxidants on bleomycin treatment in vitro and in vivo genotoxicity assays. Mut Res 1995;329:37-47.
36 Mellon MG, Rebhun LI. Sulfhyfryls and the in vitro polymerization of tubulin. J Cell Biol 1976;70:226-38.
37 Vogel R, Spielmann H. Beneficial effects of ascorbic acid on preimplantation mouse embryos after exposure to cyclophosphamide in vivo. Terato Carcino Mutagen 1989;9:51-9.
38 Kola I, Vogel R, Spielmann H. Co-administration of ascorbic acid with cyclophosphamide (CPA) to pregnant mice inhibits the clastogenic activity of CPA in preimplantation murine blastocysts. Mutagenesis 1989;4:297-301.
39 Fraga CG, Motchnik PA, Shigenaga MK, Helbock HJ, Jacob RA. Ascorbic acid protects against endogenus oxidative DNA damagein human sperm. Proc Natl Acad Sci USA 1991;88:11003-6.
40 Bianchi L, Tateo F, Pizzala R, Stivala LA, Bazia-Verri M, Melli R, Santamaría L. Carotenoids reduce the chromosomal damage induced by bleomycin in human cultured lymphocytes. Anticancer Res 1993;13:1007-10.
41 He P, Yasumoto K. Dietary butylated hydroxytoluene counteracts with paraquat to reduce the rate of hepatic DNA single strand breaks in senescence-accelerated mice. Mech Age Develop 1994;76:43-8.
42 Cheng TJ, Chistiani DC, Xu X, Wain JC, Wiencke JK, Kelsey KT. Glutathione S-transferase mu genotype, diet, and smoking as determinants of sister chromatid exchange frequency in lymphocytes. Cancer Epidemiol Biomarkers Prev 1995;4: 535-42.
43 Gaziev AI, Podlutsky AJ, Panfilov BM, Bradbury R. Dietary supplements of antioxidants reduce hptr mutant frequency in splenocytes of aging mice. Mut Res 1995;338:77-86.
44 Gaziev AI, Sologub GR, Fomenko LA, Zaichkina SI, Kosyakova NI, Bradbury RJ. Effect of vitamin-antioxidant micronutrients on the frequency of spontaneous and in vitro gamma-ray-induced micronuclei in lymphocytes of donors: the age factor. Carcinogenesis 1996;17:493-9.
45 Boxer LA, Oliver JM, Spielberg SP, Allen JM, Schullman JD. Protection of granulocytes by vitamin E in glutathione synthetase deficiency. N Engl J Med 1979;301:901-5.
46 Rojas C, Cadenas S, López-Torres M, Pérez-Campo R, Barja G. Increase in heart glutathione redox ratio and total antioxidant capacity and decreased in lipid peroxidation after vitamin E dietary supplementation in guinea pigs. Free Radic Biol Med 1996;21:907-15.
47 De la Asunción JC, Millán A, Plà R, Bruseghini L, Esteras A, Pallardó FV, Sastre J, Viña J. Mitochondrial glutathione oxidation correlates with age-associated oxidative damage to mitochondrial DNA. FASEB J. 1996;10:333-8.
48 Tarín JJ, Vendrell FJ, Ten J, Cano A. Antioxidant therapy counteracts the disturbing effects of diamide and matarnal ageing on meiotic division and chromosomal segregation in mouse oocytes. Mol Hum Reprod 1998;4:281-8.
49 Tarín JJ, Ten J, Vendrell FJ, Cano A. Dithiothreitol prevents age-associated decrease in oocytes/conceptus viability in vitro. Hum Reprod 1998;13:381-6.