01 POG
04
PROGRESOS
DE OBSTETRICIA
Y GINECOLOGÍA
Volumen 41
Número 3
Abril 1998
Ginecología
M. Morillo
E. Pérez
A. Mora
M. de Andrés
J. E. Arjona
S. Carrasco
Patrones mamográficos de Wolfe en pacientes con cáncer de mama y grupo control
Servicio de Obstetricia y Ginecología.
Hospital Universitario Reina Sofía
Córdoba
Correspondencia:
M. Morillo Cornejo
Hospital Universitario Reina Sofía
Servicio de Obstetricia y Ginecología
Avda. Menéndez Pidal, s/n
14004 Córdoba
Wolfe mammographic patterns in women with breast carcinoma and a control group
Morillo M, Pérez E, Mora A, de Andrés M, Arjona JE, Carrasco S. Patrones mamográficos de Wolfe en pacientes con cáncer de mama y grupo control. Prog Obstet Ginecol 1998;41:149-160
Aceptado para publicación 16/10/97
RESUMEN
Se estudian los patrones mamográficos de Wolfe en 461 pacientes con cáncer de mama y se comparan con un grupo control de 453 mujeres sin patología mamaria. No se observan diferencias significativas en el aumento de patrones de alto riesgo (P2 + DY) en las pacientes con cáncer. Solamente en las mujeres de 50 años o menos, encontramos un aumento del RR a medida que aumenta la densidad radiológica de la mama: con respecto a N1, resulta para P1 un RR = 2,66 (IC 95%: 1,47 - 4,84), para P2 un RR = 2,98 (IC 95%: 1,93 - 4,62) y para DY un
RR = 3,86 (IC 95%: 2,84 - 5,24). En este grupo de mujeres, los patrones densos (P2 + DY) tienen un RR de 1,51 (IC 95%: 1,26 - 1,82) frente a los patrones grasos (N1 + P1), con un exceso de riesgo del 51,2%.
En ambos grupos del estudio existe una relación significativa de los patrones grasos (N1 + P1) con el aumento de la edad, la paridad, la lactancia materna prolongada, el estado menopáusico y el incremento del índice de masa corporal. Por el contrario, los patrones densos (P2 + DY) están relacionados con una edad joven, la nuliparidad, la falta de lactancia materna, el estado premenopáusico y su peso normal.
Las pacientes con cáncer y patrones densos
(P2 + DY) con una edad similar a las del grupo control (46,6 ± 10,2), presentan una mayor lactancia (p < 0,001), un mayor tiempo de menopausia
(p < 0, 025) y una mayor obesidad (p < 0,025), lo que sugiere que en estas mujeres han tenido menor influencia estos factores para disminuir la densidad radiológica mamaria.
PALABRAS CLAVE
Patrones mamográficos de Wolfe; Cáncer de mama.
ABSTRACT
Wolfe mammographic patterns of 461 women with breast carcinoma are compared with a control group of 453 women without mammarian patology. There are no significative differences in the incidence of high risk patterns (P2 + DY) between both groups.
High radiology density increase the «relative risk» (RR) of breast cancer in women under 51 years: in relation to N1, P1 has a RR = 2.66 (IC 95%: 1.47 - 4.84), P2 has a RR = 2.98 (IC 95% 1.93 - 4.62) and DY has a RR = 3.86 (IC 95%: 2.84 - 5.24). In women from 25 to 50 years, the high density patterns (P2 + DY) have a RR of 1.51 (IC 95%: 1.26 - 1.82) in relation to low density patterns (fatty paterns), with a excess of risk 51.2%.
Both groups estudied have a significative relation of low density patterns to age, parity, long breast feding, menopausical estatus and the increase body mass index. Unlike, high density patterns are related to young women, mulliparity, no lactation, premenopausical estatus and a fitness body mass index.
Patients with breast cancer and high density patterns (P2 + DY) with a similar age to women of control groups (46.6 ± 10.7 vs 45.5 ± 10.2), note long breast feding (p < 0.001), long time menopausical estatus (p < 0.025) and increase of obesity (p < 0.025); these data suggest that these factors have less influence on decrease the mammographic density in the breast cancer group.
KEY WORDS
Wolfe mammographics patterns; Breast cancer.
INTRODUCCIÓN
Desde la clasificación por Wolfe en 1967 (1) de la densidad radiológica de la mama en cuatro patrones diferenctes (N1, P1, P2, DY), han sido muchos trabajos (2-14) los que han tratado de relacionar los patrones con densidad aumentada (P2 - DY), con una mayor incidencia de cánceres de mama o como un factor de riesgo para padecerlo. Otros auotres (15-18) han estudiado su relación con diferentes resultados histopatológicos, e incluso se han comparado los patrones radiológicos de las mamas de distintas razas, que a su vez presentan distinta incidencia de carcinoma de mama (19,20). Recientemente, estudios por láser han sido realizados para cuantificar automáticamente la densidad radiológica de la mama (21).
Pero como señala Kopans (22), es muy escaso nuestro conocimiento sobre la mama «normal» para poder clasificar a unos determinados patrones como normales o patológicos. Es difícil obtener información histológica sobre la mama normal a diferentes edades, ya que la mayoría de los datos provienen de series de autopsias que suelen corresponder a mujeres mayores. Además, no podemos considerar los patrones grasos (N1 - P1) como de bajo riesgo, ya que como afirma este mismo autor, casi un 70% de los cánceres se dan este tipo de patrones.
Tradicionalmente se ha dicho que la involución mamaria (la disminución de sus elementos epiteliales, estroma y lobulillos) tiene lugar después de la menopausia; sin embargo, esta involución puede empezar entre los 35-45 años, antes del cese de la actividad ovárica (23), o incluso en la tercera década de la vida, como se ha observado en estudios sobre autopsias (24).
No obstante, la norma general es que tras la menopausia el tejido gladular que llega a constituir la tercera parte de la mama adulta quede reducido a un 5%, y sea sustituido por tejido adiposo.
Para Kopans (22) en la evolución radiológica de la mama (seguimiento durante diez o más años) es raro encontrar cambios significativos en la densidad, a no ser que haya habido un incremento o disminución importante del peso corporal.
En el presente trabajo, hemos querido conocer los patrones mamográficos de mujeres en las que histológicamente se diagnosticó un carcinoma de mama y relacionarlos con los de aquellas en que clínicamente no existía patología mamaria.
MATERIAL Y MÉTODOS
Hemos realizado un estudio retrospectivo de los patrones mamográficos, siguiendo los criterios de Wolfe, de un grupo de 461 pacientes diagnosticadas y tratadas de carcinoma de mama entre los años 1980-96. El grupo control es de tipo contemporáneo o concurrente, formado por 453 pacientes tomadas al azar entre aquellas que en el mismo período de tiempo, y sin patología mamaria u oncología alguna, fueron estudiadas en la misma consulta de patología mamaria. Se rechazaron aquellas pacientes menopáusicas que ya habían iniciado algún tipo de tratamiento hormonal sustitutivo.
En todos los casos se analizaron la edad, estado hormonal, número de hijos, antecedentes familiares de cáncer de mama, lactancia materna, índice de masa corporal, etc. Los criterios de Wolfe para la clasificación del patrón mamográfico (N1 = Baja densidad del parénquima con alta proporción de tejido graso; P1 = Patrón ductal prominente implicado menos de 1/4 de la mama; P2 = Patrón ductal prominente implicado más de 1/4 de la mama y a menudo con un componente nodular; DY = Un mayor incremento de densidad del paréntesis mamario con o sin áreas de nodularidad) fueron siempre evaluados conjuntamente por las mismas personas, tanto en el grupo de pacientes con cáncer como en el grupo control.
Para el estudio de la masa corporal se ha realizado el Índice de Quetelet (IQ) (Peso en kg/talla en metros2), siguiendo los criterios de Jung y Chong (25) para la clasificación de la obesidad.
El estudio estadístico ha sido el análisis de la varianza (prueba de Newman-Keuls) para las medias múltiples relacionadas con un solo factor . El test de chi cuadrado ha sido utilizado para las variables cualitativas y la t de Student para el contraste bilateral de medidas. El riesgo relativo (RR) ha sido calculado por la fórmula de Bayes y la estimación de los intervalos de confianza (IC) por el método de Miettinem.
RESULTADOS
En la tabla 1 se exponen todos los datos de los dos grupos en estudio. Destacamos que las pacientes con cáncer tienen mayor edad media (55,4 años vs 50,4 años), un mayor tiempo de lactancia natural, una edad mayor en la menopausia, mayor tiempo de menopausia transcurrido entre ésta y la realización de la mamografía del estudio y un mayor índice de masa corporal.
La menopausia natural en el grupo control fue a los 48,3 ± 5,2 años y la quirúrgica a los 44,7 ± 6,7 años
(p < 0,001), y el tiempo de menopausia transcurrido de 11,9 ± 8,3 años para la primera y de 7,5 ± 6,4 años la segunda (p < 0,001). En las pacientes con cáncer la menopausia natural fue a los 48,5 ± 4,7 años y la quirúrgica a los 44,7 ± 6,2 años (p < 0,001), y unos tiempos de menopausias similares (15,8 ± 9,5 y 15,2 ± 9,2 años).
Hemos de destacar que no hemos encontrado diferencias significativas entre los patrones mamográficos observados en las pacientes con cáncer de mama y en el grupo control. En el N1: 116 casos (25,2%) en las mujeres con cáncer y 101 casos (22,3%) en el grupo control. En el P1: 137 casos (29,7%) frente a 136 (30,1%). En el P2: 139 (30,2%) frente a 160 (35,3%). En el DY: 69 (14,9%) frente a 56 casos (12,3%) del grupo control.
El RR de los diferentes patrones con respecto a N1 han sido: Para P1 un RR = 0,94 (IC 95%: 0,58 - 1,51), para P2 un RR = 0,87 (IC 95%: 0,69 - 1,08), y para DY un RR = 1,03 (IC 95%: 0,30 - 3,18)
Edad
Realizado el análisis de la varianza entre la edad y los distintos patrones mamográficos encontrados significativo (p < 0,01), para los dos grupos del estudio (tabla 2), un aumento del componente graso de la mama (patrones N1 y P1) a medida que aumenta la edad. La edad, media de los diferentes patrones es mayor en las pacientes con cáncer, siendo significativo en todos los tipos salvo en los P2.
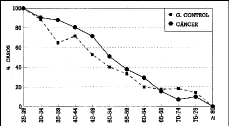
El porcentaje de patrones densos (P2 + DY) disminuye progresivamente con la edad, como se observa en la figura 1. En las pacientes del grupo control esta disminución es algo más acentuada que en las pacientes con cáncer, hasta llegar a los 65 años en que los porcentajes se superponen.
Considerando solamente a las mujeres de 50 o menos años (248 del grupo control y 175 del grupo con cáncer), encontramos significativo (p < 0,005) un mayor porcentaje de patrones DY en las pacientes con cáncer (33,7% vs 20,6%).
Calculando en este grupo de edad el RR de los diferentes patrones con respecto a N1, resulta para P1 un RR = 2,66 (IC 95%: 1,47 - 4,84), para P2 un RR = 2,98 (IC 95%: 1,93 - 4,62) y para DY un RR = 3,86 (IC 95%: 2,84 - 5,24). Los patrones densos (P2 + DY) presentan un RR respecto a los patrones grasos (N1 + P1) de 1,51 (IC 95%: 1,26 - 1,82), con un exceso de riesgo del 51,22%. La edad media de las pacientes de ambos grupos no son significativas (control: 42,1 ± 6,3 años; cáncer: 41,3 ± 6,1 años). En las mujeres mayores de 50 años, no se observan diferencias significtivas entre las patrones radilógicos de los dos grupos en estudio.
Paridad
Resulta significativo el análisis de la varianza (tabla 3), en los dos grupos del estudio, el hallazgo de patrones N1 y P1 en aquellas mujeres que han tenido más hijos, aunque no se observan diferencias entre los patrones P1 - P2 y P2 - DY. No existen diferencias entre la paridad de ambos grupos en los distintos patrones.
Estudiando distintos grados de paridad, encontramos significativo (p < 0,001) el mayor porcentaje de patrones DY en las mulíparas, tanto en el grupo control (25,4%) como en las pacientes con cáncer (27,8%). Existe un incremento de patrones N1 a medida que aumenta la paridad: un 41,2% de casos en el grupo control para las mujeres con más de tres partos, y un 38,7% para los casos con cáncer.
La relación del número de hijos en la distribución de los patrones se observa tanto en las menopáusicas como en las que aún reglaban. En el grupo control la relación del número de hijos con los patrones de Wolfe resulta p < 0,001 para las menopáusicas y p < 0,01 para la premenopáusicas. En las pacientes con cáncer la significación es de p < 0,01 para los dos estados hormonales.
No obstante, la paridad guarda estrecha relación con la lactancia, y hemos de observar que ni en las pacientes con cáncer ni en el grupo control existe relación significativa entre el número de hijos y el estado radiológico de la mama en aquellas mujeres que tuvieron hijos pero no lactaron.
Lactancia materna
Ya hemos señalado anteriormente, que la paridad no era significativa en las mujeres que no han amamantado a sus hijos. Es por tanto, la lactancia materna un factor importante en la configuración de los diferentes patrones mamográficos (tabla 4). La mayor lactancia ha sido observada en aquellas mujeres con patrones N1, disminuyendo significativamente en los P2 y DY.
Resulta significativo una mayor lactancia en los patrones N1, P2 y DY en las pacientes con cáncer respecto a los controles.
En aquellas mujeres que no lactaron nunca, encontramos (p < 0,001) para los dos grupos, un mayor porcentaje de patrones DY (19,6% en el grupo control y 22,5% en el grupo cáncer), siendo su incidencia casi nula (0% y 2,4%) en aquellas que lo hicieron más de tres años. Estas últimas presentan más de un 80% patrones grasos (N1 + P1). No se observan diferencias entre los resultados de los dos grupos del estudio. El número de meses de lactancia y la incidencia de los distintos patrones sigue siendo significativo (p < 0,001) al estudiarlo en las premenopáusicas y menopáusicas del grupo control y solamente en las menopáusicas del grupo con cáncer (p < 0,001).
Estado menopáusico
El estado hormonal de la mujer (menopáusica o no) resulta significativo (p < 0,001) en el estudio de los diferentes patrones de Wolfe. En la tabla 5 se exponen los hallazgos observados en los dos grupos del estudio, y aunque entre ellos no existen diferencias significativas, en cada grupo, el mayor número de patrones P2 - DY se encuentra en las mujeres con actividad menstrual. Por el contrario, los patrones
N1 - P1 presentan su mayor porcentaje (superior al 70%) en las mujeres menopáusicas.
No hemos encontrado diferencias significativas entre la edad de la menopausia o el tipo de ésta (natural o quirúrgica) y los diferentes patrones mamográficos. Es el tiempo de menopausia transcurrido el determinante para la observación de los diferentes patrones.
El análisis de la varianza (tabla 6) entre este tiempo y los distintos tipos de patrones sí resulta significativo (p < 0,001). Un mayor tiempo de menopausia se observa en los tipos N1 - P1, con un descenso de éste en los P2 - DY, aunque las diferencias no sean significativas, debido al pequeño número de casos de este tipo de patrones (hecho que ya señalamos al estudiar los patrones en el estado menopáusico).
A igualdad de patrones, el tiempo de menopausia transcurrido ha sido significativamente mayor en las pacientes con cáncer que en el grupo control, excepto en el tipo DY.
Índice de masa corporal
El índice de masa corporal también resulta significativo (p < 0,01), tanto en el grupo control como en las pacientes con cáncer, al relacionarlo con los patrones de Wolfe (tabla 7). Valores de obesidad grave se relacionan con patrones N1, observándose los de tipo DY en pacientes de peso normal del grupo control y en pacientes con índice de obesidad leve del grupo con cáncer. Estas diferencias son significativas para los tipos P1 y DY.
Divididos los casos en tres grupos: peso normal (IQ < 25), obesidad leve (IQ 26 - 30), y un tercero que engloba la obesidad grave y mórbida (IQ > 30). Resulta significativo (p < 0,001) en los dos grupos del estudio, un aumento de los patrones N1 - P1 a medida que se incrementa la masa corporal, y a la inversa, un mayor de patrones P2 - DY al disminuir ésta.
La frecuencia de los distintos patrones mamográficos son similares en las pacientes de peso normal de ambos grupos, sin embargo, resulta significativo
(p < 0,05) un mayor porcentaje de patrones DY en los casos de obesidad leve y grave de las mujeres con cáncer (23,9%) frente a las del grupo control (4,7%).
El estado hormonal (menopáusico o no) no modifica los resultados significativos que relacionan la masa corporal con los patrones radiológicos, sea en el grupo con cáncer o en el control.
Realizada una correlación simple entre el Índice de Quetelet y la edad, resulta significativo (p < 0,01) en ambos grupos, un incremento de la masa corporal con la edad. Para el grupo control IQ = 21,7 + 0,13 x edad, y para las pacientes con cáncer IQ= 22.6 + 0,11 x edad. No existen diferencias entre ellos.
Antecedentes familiares de cáncer de mama
El estudio de los antecedentes familiares de cáncer de mama no nos ha resultado significativo, en ninguno de los dos grupos, al relacionarlos con los patrones mamográficos. No se observa un incremento de patrones de alto riesgo en aquellas mujeres que tenían antecedentes de neoplasia mamaria. El grado del antecedente familiar (tres grados) tampoco nos resulta significativo en la distribución de los patrones de Wolfe. Tampoco se observan diferencias al relacionar el antecedente familiar con el tipo de patrón en los dos estados hormonales (menopáusica o no).
Si que observamos un aumento de los patrones densos (P2 + DY) en las nulíparas que tenían antecedentes familiares positivos frente a las que no los poseían. En las pacientes del grupo con cáncer (71,4 % vs 44,8%), y en el grupo control (92,8% vs 59,6%), con un significado de p < 0,05. No existen diferencias en la edad ni en el estado menopáusico entre estos grupos de mujeres.
Edad, estado hormonal y masa corporal
Dada la relevancia de la edad, la masa corporal y el estado menopáusico en la configuración de los distintos patrones mamográficos, hemos estudiado los porcentajes de dichos patrones en diferentes grupos de edad y en relación al estado hormonal (tabla 8). Tanto en el grupo control como en las pacientes con cáncer resulta muy significativo (p < 0,001) el aumento de los patrones N1 - P1 y disminución de los P2 - DY al aumentar la edad en las mujeres que aún tienen menstruaciones. En las menopáusicas sucede de igual forma, siendo escaso el número de patrones P2 - DY en las mujeres mayores de 65 años.
Calculado el índice de masa corporal en estos grupos de edades, solamente encontramos diferencias significativas (p < 0,05) entre las premenopáusicas menores de 36 años y las mayores de 45 años del grupo control. En las menopáusicas no existen variaciones significativas del Índice de Quetelet en los distintos grupos de edad.
Es de señalar, en nuestro estudio, la importancia de la menopausia y el incremento de la masa corporal como factores desencadenantes de la involución grasa de la mama.
Las mujeres premenopáusicas mayores de 45 años del grupo control (63 casos) tienen una edad media de 48,5 ± 2,2 años y un IQ medio de 26,7 ± 5,4, y las menopáusicas de 50 años o menos (62 casos) tienen una edad media de 45,7 ± 4,8 años y un IQ medio de 29,1 ± 5,4, con unas diferencias significativas de p < 0,001 para la edad y de p < 0,025 para el IQ. Los patrones resultan significativamente (p < 0,05) más grasos (mayor número de N1 - P1) en las pacientes menopáusicas, pese a ser menores de edad, ya sea por su estado hormonal o por su mayor obesidad, o por ambas causas.
Resultados similares se observan en las pacientes con cáncer, donde la edad media de las premenopáusicas mayores de 45 años (61 casos) es de 49,4 ± 2,5 años y el IQ medio de 27,2 ± 4,6, y de las menopáusicas de menos de 50 años (22 casos ) de 46.5 ± 2,7 años y el IQ medio de 30,7 ± 8,7 (p < 0,001 y
p < 0,05) respectivamente).
En los grupos de pacientes menopáusicas, donde no existen diferencias significativas en la masa corporal por grupo de edad, es el tiempo de menopausia el principal factor desencadenante de la involución mamaria.
En esta misma tabla se puede observar que las pacientes premenopáusicas con cáncer y con edades comprendidas entre los 36 y 45 años tienen significativamente (p < 0,05) mayor porcentaje de patrones P2 + DY que las del grupo control. En las menopáusicas este hecho solo se observa en las de 50 o menos años.
Características de las mujeres con patrones de alto y bajo riesgo
En la tabla 9, señalamos las caracterísitcas de las pacientes de los dos grupos estudiados, en relación a los patrones de Wolfe considerados de bajo (N1 + P1) y alto riesgo (P2 + DY).
En ella podemos observar que la edad del primer parto, la edad de la menarquía, el tiempo de actividad hormonal (el transcurrido entre la menarquía y la menopausia), la edad de la menopausia, y los antecedentes familiares de cáncer de mama no influyen, ya sea en el grupo con cáncer o en el control, en la configuración de los patrones mamográficos. La edad, el número de hijos, la lactancia, el tiempo de menopausia transcurrido y el índice de masa corporal sí son significativos a la hora de valorar la densidad radiológica de la mama.
Tenemos que señalar que las pacientes con cáncer y patrones densos (P2 + DY) con una edad similar a las del grupo control (46,6 ± 10,7 va 45,5 ± 10,2), presentan una mayor lactancia (p < 0,001), un mayor tiempo de menopausia (p < 0,025) y una mayor obesidad (p < 0,025), lo que sugiere que en estas mujeres han tenido menor influencia estos factores para disminuir la densidad radiológica mamaria.
Hay autores (6) que han observado un mayor porcentaje de estadios I en aquellas pacientes con patrones grasos (N1 + P1), debido posiblemente al retraso en el diagnóstico de los tumores que se encontraban en mamas densas. Nosotros hemos observado porcentajes similares de estadios I tanto en los patrones grasos como en los densos (19,4% vs 19,7%); no obstante, aunque sin llegar a ser significativo, encontramos una mayor proporción de carcinomas avanzados en las mujeres con patrones densos (23,3% vs 31,3%).
Los diagnósticos mamográficos falsos negativos en las mujeres con cáncer sí que aumentan de una manera significativa (p < 0,001), a medida que el patrón es más denso: encontramos para los N1 el 1,7%, para los P1 el 66,6% en los P2 el 15,5% y en los DY el 30,4% de diagnósticos falsos negativos.
DISCUSIÓN Y COMENTARIOS
Aunque el aspecto radiológico de la mama es enormemente variable, variabilidad de origen multifactorial (factores genéticos, edad, estado hormonal, hábito corporal, etc.), y su clasificación en cuatro patrones una medida simplista, no deja de tener interés el estudiar la relación de estos patrones parenquimatosos con el cáncer a pesar de su limitada utilidad clínica.
Ya hemos señalado ateriormente que la consideración de los patrones grasos (N1 + P1) como de «bajo riesgo» es cuestionable. Un elevado porcentaje de cánceres se observan en esta modalidaad de patrones. Para nosotros, el 54,9% de los casos se presentó en estos patrones (posiblemente por la gran masa corporal de nuestras pacientes), otros autores señalan cifras del 37% (3), 43% (13) y 36% (16), diferencias que guardan relación con los diferentes grupos de edades estudiados.
La mayor o menor densidad radiológica de la mama ha guardado, en nuestro estudio, una relación significativa con la edad, paridad, lactancia, estado menopáusico y masa corporal, coincidiendo con los trabajos de De Stavola y cols. (12), aunque no encontramos una relación con la edad de la menarquia y del primer parto como señalan estos mismos autores. Bucchi y cols. (18) y Funkhouser y cols. (26) observan estas mismas correspondencias y señalan un incremento de los patrones densos con el consumo de alcohol y el uso de anticonceptivos. Otro estudio (27) encuentra una relación significativa entre el aumento de la densidad radiológica y el mayor consumo de grasa total (ácidos grasos saturados e insaturados).
Kaufman y cols. (28) en el análisis de los patrones de Wolfe en relación a los antecedentes familiares de cáncer de mama, no encuentran asociación alguna. Nosotros tampoco la hemos observado, aunque sí encontramos significativo el incremento de los tipos densos en las nulíparas con antecedentes familiares frente a las que no los tenían, tanto en las pacientes con cáncer como en el grupo control.
Los trabajos de Hart y cols. (19) sobre la evolución de la densidad radiológica de la mama con la edad demuestran que las indias americanas (con menor incidencia de carcinomas) presentan patrones menos densos, a igualdad de edad, que las americanas e hispanas,
Turnbull y cols. (20) comparando las mamografías de mujeres de 50 a 64 años, asiáticas y caucasianas, observan en las primeras una cantidad significativamente menor de patrones P2 y DY, señalando igualmente la menor incidencia de cáncer de mama en esta raza. Otros trabajos (17) refieren resultados similares.
Sin embargo, en los estudios que tratan de relacionar los patrones radiológicos con los hallazgos histológicos no coinciden la mayoría de los auto-
res. Para algunos (5,15,29) no existen correspondencia, otros (2,3,7,16) por el contrario, observan dicha relación. Wolfe (2) en el seguimiento durante dos años y medio de más de cinco mil mujeres mayores de 30 años, diagnostica 40 cánceres, de los cuales el 78% se observaron en mujeres con patrones densos (P2 + DY), indicando que estos patrones representaban solamente el 33% de todo el grupo. Bland y cols. (16) encuentran muy significativo en las mujeres de 35 a 49 años, un incremento de las lesiones proliferativas, no proliferativas y carcinomas en los patrones densos, señalando que en este grupo de mujeres el 83% de los cánceres presentaban estos tipos de patrones. Estos resultados no los observan en mujeres mayores de esa edad. Moskowitz y cols. (3), en mujeres de edades similares, encuentran que el 62% de las hiperplasias y el 72% de los cánceres tenían patrones densos. Nosotros, en las mujeres de 50 o menos años, encontramos que el 78,3% de los cánceres tenían patrones densos, cuando éstos representan el 63,9%
de las mujeres de similar edad del grupo control
(p < 0,005).
La cuantificación del riesgo para padecer cáncer de mama basándose en la densidad radiológica de la misma ha sido desde los trabajos de Wolfe (1,2), una aportación continua a la literatura médica. En una
revisión de 22 estudios realizada por Goodwin y
Boyd (4) el RR del patrón DY con respecto al N1 oscila de 0,24 a 12. En los autores consultados (3,6,7,10,12-14,16), el RR varía de unos a otros dependiendo de los grupos de edad estudiados. El RR de DY con respecto a N1 oscila de 4,2 a 9,7, aunque este último se refiere solamente a mujeres menores de 50 años. En los patrones densos con respecto a los grados señalan unos RR de 1,4 a 2,6, llegando a 4,6 para las menores de 50 años.
Nosotros ya hemos señalado, que únicamente encontramos un mayor riesgo en las mujeres menores de 50 años, con un RR del patrón DY de 3,8 con respecto a N1 y un RR de 1,5 de los patrones densos frente a los grasos.
Otros autores (30) han estudiado, en mujeres con carcinomas, la relación de la densidad radiológica con los receptores hormonales del tumor, sin encontrar correspondencia alguna. Nosotros tampoco la hemos observado, encontrando porcentajes similares de RE y RR positivo en patrones densos o grasos. Tan sólo al relacionar los estudios bioquímicos y hormonales de las pacientes con cáncer de mama y sus patrones de Wolfe observamos un aumento significativo (p < 0,01) de los triglicéridos en las pacientes con patrones grasos, y lógicamente una mayor cantidad de FSH y LH en este grupo de mujeres. En las pacientes con patrones densos encontramos un aumento significativo (p < 0,05) de las cifras de prolactina.
No obstante, con los conocimientos actuales no podemos considerar a los patrones de Wolfe como un factor aislado para predecir el riesgo de padecer o no un cáncer de mama, pues como señala Oza y Boyd (8) tan sólo el estudio de los factores de crecimiento y otros mecanismos de la carcinogénesis en los tejidos de estos patrones pueden determinar la asociación de éstos con un mayor riesgo de padecer un cáncer. El hallazgo de un patrón mamográfico denso debe hacernos pensar, además de una disminución de la sensibilidad diagnóstica de la mamografía, en adoptar un intervalo de screening más corto en este grupo de mujeres.
1 Wolfe JN. A study of breast parenchyma by mammography in the normal woman and those with bening and malignant di-
sease. Radiology 1967;89:201-5.
2 Wolfe JN. Risk for breast cancer development determined by mammographic parenchymal pattern. Cancer 1976;37:2486-92.
3 Moskowitz M, Gartside P, McLaughlin C. Mammographic patterns as markers for high-risk benign breast disease and incident cancers. Radiology 1980;134:293-5.
4 Goodwin PJ, Boyd NF.: Mammographic parenchymal pattern and breast cancer risk: a critical appraisal of the evidence. Am J Epidemiol 1988;127:1097-108.
5 Arthur JE, Ellis IO, Flowers C, Roebuck E, Elston CW, Blamey EW. The relationship of «high risk» mammographic patterns to histological risk factors for development of cancer in the human breast. Br J Radiol 1990;63:845-9.
6 Ciatto S, Zappa M. A prospective study of the value of mammographic pattern as indicators of breast cancer risk in a screening experience. Eur J Radiol 1993;17:122-5.
7 Boyd NF, Jensen HM, Cooke G, Han HL. Relationship between mammographic and histological risk factors for breast cancer. J Natl Cancer Inst 1992;84:1170-9.
8 Oza AM, Boyd NF. Mammographic parenchymal patterns: a marker of breast cancer risk. Epidemiol Rev 1993;15:196-208.
9 Warner E, Lockwood G, Trichler D, Boyd NF. The risk of breast cancer associated with mammographics parenchymal pattern: a meta-analysis of the published literature to examine the effect of method of classification. Cancer Detect Prev 1992;16:67-72.
10 Saftlas AF, Hoover RN, Brinton LA, Szklo M, Olson DR, Salane M y cols. Mammographic densities and risk of breast cancer (See comments). Cancer 1991;67:2833-8.
11 Toniolo P, Bleich AR, Beinart C, Koening KL. Reproducibility of Wolfe''s classification of mammographics parenchymal patters. Prev Med 1992;21:1-7.
12 De Stavola BL, Gravelle IH, Wang DY, Allen DS, Bulbrook RD, Fentiman IS y cols. Relationship of mammographic parenchymal patterns with breast cancer risk factors and risk of breast cancer in a prospective study. Int J Epidemiol 1990;19:247-54.
13 Ciatto S, Bravetti P, Cecchini S, Cirillo A. Mammographics parenchymal patterns and breast cancer risk. A case control study of a population-based screening experience. Radiol Med 1990; 79:3466-348.
14 Boyd NF, Byng JW, Jong RA, Fishell EL, Little LE, Miller AB y cols. Quantitative classification of mammographics densities and breast cancer risk: result from the Canadian National Breast Screening Study. J Natl Cancer Inst 1995;87:670-5.
15 Fisher ER, Palekar A, Ki WS, Redmond. The histopathology of mammographic pattern. Am J Clin Pathol 1987;69:421-6.
16 Bland KI, Kuhns JG, Buchanan JB, Dwyer PA, Heuser LF,
O''Connor CA y cols.. A clinicopathologic correlation of mammographic parenchymal patterns and associated risk factors for human mammary carcinoma. Ann Surg. 1982;5:582-92.
17 Bartow SA, Pathak DR, Mettler FA. Radiographic microcalicification and parenchymal patter as indicators of histologic high-risk begin breast disease. Cancer 1990;66:1721-5.
18 Bucchi L, Costantini M, Buzzi G, Bravetti P, Cicognani A, Torta M y cols. Wolfe''s mammographics patterns is women with gross cystic disease of the breast. J Clin Epidemiol 1995;48:969-76.
19 Hart BL, Steinbock RT, Mettler FA Jr; Pathak DR, Bartow SA. Age and race related changes in mammographic parenchymal patterns. Cancer 1989;63:2537-9.
20 Turbull AE, Kapera L, Cohen ME. Mammographics parenchymal pattern in Asian and Caucasian women attending for
screening. Clin Radiol 1993;48:38-40.
21 Tahoces PG, Correa J, Souto M, Gómez L, Vidal JJ. Computer-assisted diagnosis: the classification of mammographics breast parenchymal patterns. Phys Med Biol 1995;40:103-17.
22 Kopans DB. La mama en imagen. Madrid: Marbán; 1994
23 Vorherr H. Fibrocystic breast disease: pathomorphology clinical picture and management. Am J Obstet Gynecol 1986;154:161-79.
24 Huston SW, Cowen PN, Bird CC. Morphometric studies of agerelated changes in normal human breast and their significance for evolution of mammary cancer. J Clin Pathol 1985;38:281.
25 Jung T, Chong P. The management of obesity. Clin Endocrinology 1991;35:11-20.
26 Funkhouser E, Waterbor JW, Cole P, Rubin E. Mammographic patterns and breast cancer risk factors among women having elective screenig. South Med J 1993;86:177-80.
27 Nordevang E, Azavedo E, Svane G, Nilsson B, Holm LE. Dietary habits and mammographics patterns in patients with
breast cancer. Breast Cancer Res Treat 1993;26:207-15.
28 Kaufman Z, Garstin WI, Hayes R, Michell MJ, Baum M. The mammographic parenchymal pattern of nulliparous women and women with a family history of breast cancer. Clin Radiol 1991;43:385-8.
29 Brigth RA, Morrison AS, Brisson J y cols.. Relationship between mammographic and histologic features of breast tissue in woman with bening biopsies. Cancer 1988;61:266-71.
30 Ainge GR, Choping RH, Bechtold RE, Muss HB, Case LD; Kute TE. Relationship between mammographic features and hormone receptor content in patients with breast cancer. South Med J 1989;82:1506-11.
Tabla 1 Características de los grupos en estudio
G. control Cáncer Valor p
| N.º de casos | 453 | 461 | |
| Edad media ± DE | 50,4 ± 11,3 | 55,4 ± 13,5 | 0,001 |
| Rango edad | 25-79 | 25-86 | |
| Mediana edad | 49 | 55 | |
| Edad menarquia ± DE | 12,8 ± 1,5 | 12,9 ± 1,6 | N.S |
| Menopáusicas | 259 (57,2%) | 281 (60,9%) | N.S |
| Edad menopausia ± DE | 46,9 ± 6,1 | 48,1 ± 5,1 | 0,01 |
| Tiempo de menopausia | 10,2 ± 7,9 | 15,4 ± 9,6 | 0,001 |
| Menopausia quirúrgica | 101 (39%) | 40 (14,2%) | 0,001 |
| Menopausia natural | 158 (61%) | 241 (85,8%) | |
| N.º de partos | 2,5 ± 1,7 | 2,6 ± 1,8 | N.S |
| Nulíparas | 71 (15,7%) | 72 (15,6%) | N.S |
| Edad 1er parto ± DE | 24,6 ± 3,8 | 26,2 ± 4,3 | 0,001 |
| Lactancia materna | 281 (64%) | 309 (67%) | N.S |
| Meses de lactancia ± DE | 14,4 ± 22,9 | 19,9 ± 27,8 | 0,001 |
| Ant. familiares ca. mama | 75 (16,6%) | 83 (18,0%) | N.S |
| Peso | 70,1 ± 13,1 | 68,9 ± 12,5 | N.S |
| Talla | 158,1 ± 6,5 | 154,8 ± 6,6 | 0,001 |
| Índice de Quetelet | 28,1 ± 5,3 | 28,8 ± 5,3 | 0,025 |
Figura 1.Evolución con la edad de los patrones (P2 + DY) pacientes con cáncer de mama y grupo control.
Tabla 2 Edad y patrones de Wolfe en pacientes con cáncer de mama y grupo control. Análisis de la varianza
(Newman-Keuls)
Grupo control Cáncer de mama
Patrón Wolfe Edad media ± DE N.° casos Valor p Edad media ± DE N.° casos Valor p
| N1 | 56,9 ± 10,3* | 101 | N1 - P1 < 0,1 | 67,1 ± 9,3 | 116 | N1 - P1 < 0,01 |
| P1 | 53,4 ± 10,1* | 136 | N1 - P2 < 0,01 | 59,1 ± 11,2 | 137 | N1 - P2 < 0,01 |
| P2 | 47,6 ± 10,1** | 160 | N1 - DY < 0,01 | 48,6 ± 10,9 | 139 | N1 - DY < 0,01 |
| DY | 39,2 ± 8,1*** | 56 | P1 - P2 < 0,01 | 42,5 ± 9,1 | 69 | P1 - P2 < 0,01 |
P1 - DY < 0,01 P1 - DY < 0,01
P2 - DY < 0,01 P2 - DY < 0,01
(*) : p < 0,001; p < 0,01; (**): N.S. (***): p < 0,025
Tabla 3 Número de partos y patrones de Wolfe. Pacientes con cáncer de mama y grupo control. Análisis de la varianza (Newman-Keuls)
Grupo control Cáncer de mama
Patrón Wolfe N.° de partos ± DE N.° casos Valor p N.° de partos ± DE N.° casos Valor p
| N1 | 3,3 ± 10,3* | 101 | N1 - P1 < 0,05 | 3,2 ± 2,1 | 116 | N1 - P1 < 0,05 | |
| P1 | 2,6 ± 1,7* | 136 | N1 - P2 < 0,01 | 2,5 ± 1,8 | 137 | N1 - P2 < 0,01 | |
| P2 | 2,2 ± 1,5* | 160 | N1 - DY < 0,01 | 2,4 ± 1,5 | 139 | N1 - DY < 0,01 | |
| DY | 1,6 ± 1,3* | 56 | P1 - P2 NS | 1,8 ± 1,5 | 69 | P1 - P2 NS | |
P1 - DY < 0,01 P1 - DY < 0,05
P2 - DY NS P2 - DY < 0,1
(*): N.S., p < 0,01.
Tabla 4 Tiempo de lactancia y patrones de Wolfe. Pacientes con cáncer de mama y grupo control. Análisis de la
varianza (Newman - Keuls)
Grupo control Cáncer de mama
Patrón Wolfe Meses de lactancia ± DE N.° casos Valor p Meses de lactancia ± DE N.° casos Valor p
| N1 | 28,1 ± 34,4* | 96 | N1 - P1 < 0,01 | 37,0 ± 38,4 | 111 | N1 - P1 < 0,01 |
| P1 | 16,6 ± 22,2* | 127 | N1 - P2 < 0,01 | 20,2 ± 25,3 | 135 | N1 - P2 < 0,01 |
| P2 | 8,1 ± 11,8* | 158 | N1 - DY < 0,01 | 11,9 ± 16,2 | 134 | N1 - DY < 0,01 |
| DY | 3,7 ± 6,1+ | 55 | P1 - P2 < 0,05 | 7,2 ± 12,6 | 67 | P1 - P2 < 0,1 |
P1 - DY < 0,01 P1 - DY < 0,05
P2 - DY NS P2 - DY < NS
(*): p < 0,05; (**): NS; p < 0,01.
Tabla 5 Estado menopáusico y patrones de Wolfe.
Pacientes con cáncer de mama y grupo control
Grupo control Cáncer de mama
| Patrón | Sí | No | Sí | No |
| Wolfe | menopausia | menopausia | menopausia | menopausia |
| N1 | 87 (33,6%) | 14 (7,2%) | 111 (39,5%) | 5 (2,8%) |
| P1 | 98 (37,8%) | 38 (19.6%) | 108 (38,4%) | 29 (16,1%) |
| P2 | 68 (26,3%) | 92 (47,4%) | 53 (18,9%) | 86 (47,8%) |
| DY | 6 (2,3%) | 50 (25.8%) | 9 (3,3%) | 60 (33,3%) |
X2: 110,34; p < 0,001; X2: 174,17; p < 0,001
Tabla 6 Tiempo de menopausia y patrones de Wolfe. Pacientes con cáncer de mama y grupo control. Análisis de la
varianza (Newman-Keuls)
Grupo control Cáncer de mama
Patrón Wolfe Años de menopausia N.° casos Valor p Años de menopausia N.° casos Valor p
± DE ± DE
| N1 | 12,2 ± 8,4* | 87 | N1 - P1 NS | 19,4 ± 8,8 | 111 | N1 - P1 < 0,01 | |
| P1 | 10,6 ± 7,4* | 98 | N1 - P2 < 0,01 | 14,6 ± 9,7 | 108 | N1 - P2 < 0,01 | |
| P2 | 7,6 ± 7,3** | 68 | N1 - DY NS | 10,4 ± 7,4 | 53 | N1 - DY < 0,01 | |
| DY | 5,5 ± 5,3*** | 6 | P1 - P2 < 0,1 | 9,1 ± 9,6 | 9 | P1 - P2 < 0,1 | |
P1 - DY NS P1 - DY NS
P2 - DY NS P2 - DY NS
(*): p < 0,001; (**): p < 0,025; (***): NS; p < 0,01.
Tabla 7 Índice de masa corporal y patrones de Wolfe. Pacientes con cáncer de mama y grupo control.
Análisis de la varianza (Newman-Keuls).
Grupo control Cáncer de mama
Patrón Wolfe Í. Quetelet ± DE N.° casos Valor p Í. Quetelet ± DE N.° casos Valor p
| N1 | 32,2 ± 4,4* | 101 | N1 - P1 < 0,01 | 31,7 ± 5,9 | 116 | N1 - P1 < 0,05 | ||
| P1 | 27,9 ± 4,4** | 136 | N1 - P2 < 0,01 | 29,4 ± 4,9 | 137 | N1 - P2 < 0,01 | ||
| P2 | 27,1 ± 4,7* | 160 | N1 - DY < 0,01 | 27,7 ± 4,5 | 139 | N1 - DY < 0,01 | ||
| DY | 23,1 ± 2,2** | 56 | P1 - P2 NS | 25,7 ± 4,4 | 69 | P1 - P2 NS | ||
P1 - DY < 0,01 P1 - DY < 0,01
P2 - DY < 0,01 P2 - DY NS
(*): NS; (**): p < 0,001; p < 0,01.
Tabla 8 Patrones de Wolfe en relación a la edad y estado menopáusico. Pacientes con cáncer de mama
y grupo control
Grupo control Cáncer de mama
| Grupos | % | % | % | % | % | % | % | % | IQ | IQ |
| de edad | N1 | P1 | P2 | DY | N1 | P1 | P2 | DY | control | cáncer |
| ¾ 35 | 2,4 | 12,2 | 34,1 | 51,2 | 0,0 | 9,4 | 40,6 | 50,0 | 24,6 ± 4,4 | 25,7 ± 4,3 |
| 36 - 40 | 2,8 | 22,9 | 51,4 | 22,9 | 0,0 | 9,8 | 63,4 | 26,8 | 25,7 ± 3,5 | 26,9 ± 4,5 |
| 41 - 45 | 8,0 | 20,0 | 46,0 | 26,0 | 2,3 | 20,5 | 34,1 | 43,1 | 26,5 ± 4,1 | 27,1 ± 4,9 |
| > 45 | 11,1 | 22,2 | 55,6 | 11,1 | 6,4 | 20,9 | 50,0 | 22,7 | 26,7 ± 5,4 | 27,2 ± 4,6 |
| ¾ 50 | 28,6 | 31,7 | 36,5 | 3,2 | 15,8 | 42,1 | 31,6 | 10,5 | 29,1 ± 5,4 | 30,7 ± 8,7 |
| 51 - 55 | 22,4 | 50,0 | 24,1 | 3,4 | 21,6 | 35,1 | 37,8 | 5,4 | 29,6 ± 4,4 | 28,9 ± 4,7 |
| 56 - 60 | 33,3 | 31,2 | 31,2 | 4,2 | 25,5 | 49,1 | 21,5 | 3,9 | 29,6 ± 4,9 | 29,7 ± 4,3 |
| 61 - 65 | 50,0 | 32,5 | 17,5 | 0,0 | 36,5 | 38,5 | 21,2 | 3,8 | 30,3 ± 5,8 | 31,1 ± 4,9 |
| > 65 | 40,0 | 42,0 | 18,0 | 0,0 | 55,3 | 34,1 | 9,8 | 0,8 | 28,9 ± 6,2 | 30,1 ± 5,7 |
Premenopáusicas
Menopáusicas
Tabla 9 Resultados en los grupos (N1 + P1) y (P2 + DY). Pacientes con cáncer de mama y grupo control
Grupo control Cáncer de mama
N1 + P1 P2 + DY Valor p N1 + P1 P2 + DY Valor p
| Edad media ± DE | 54,9 ± 10,3 | 45,5 ± 10,2 | 0,001 | 62,7 ± 11,1 | 46,6 ± 10,7 | 0,001 | ||||
| N.° de partos | 2,9 ± 1,8 | 2,0 ± 1,4 | 0,001 | 2,8 ± 1,9 | 2,2 ± 1,5 | 0,001 | ||||
| Edad 1.er parto | 24,4 ± 3,8 | 24,8 ± 3,9 | N.S. | 26,1 ± 3,9 | 26,2 ± 4,6 | N.S. | ||||
| Meses lactancia | 21,5 ± 28,6 | 6,9 ± 10,8 | 0,001 | 27,8 ± 32,9 | 10,3 ± 15,2 | 0,001 | ||||
| Edad menarquia | 12,9 ± 1,6 | 12,8 ± 1,5 | N.S. | 12,9 ± 1,6 | 12,8 ± 1,6 | N.S. | ||||
| Edad menopausia | 46,9 ± 5,6 | 46,9 ± 7,0 | N.S. | 48,1 ± 5,1 | 48,2 ± 4,9 | N.S. | ||||
| Tiempo de menopausia | 11,4 ± 7,9 | 7,4 ± 7,2 | 0,001 | 17,0 ± 9,6 | 10,2 ± 7,7 | 0,001 | ||||
| Tiempo menarquia-menopausia | 33,9 ± 5,8 | 34,1 ± 7,2 | N.S. | 35,1 ± 5,3 | 35,4 ± 5,2 | N.S. | ||||
| Índice de Quetelet | 28,8 ± 5,3 | 26,1 ± 4,6 | 0,001 | 30,4 ± 5,5 | 27,0 ± 4,6 | 0,001 | ||||
| Ant. familiares de ca. mama | 13,9% | 19,4% | N.S. | 16,2% | 20,2% | N.S. | ||||
| Menopáusicas | 78,1% | 34,3% | 0,001 | 86,6% | 30,3% | 0,001 | ||||
| Nulíparas | 10,1% | 21,8% | 0,001 | 14,2% | 17,3% | N.S. | ||||
| Lactancia materna | 72,1% | 55,4% | 0,001 | 73,2% | 61,7% | 0,01 | ||||
BIBLIOGRAFÍA