Evaluar los resultados perinatales entre diferentes dosis de corticoides antenatales.
Sujetos y métodosEstudio retrospectivo de 61 gestaciones únicas con amenaza de parto prematuro, sin otra patología asociada, y con al menos una dosis estándar de betametasona por vía intramuscular (2 dosis de 12 mg/24 h). Dos grupos de estudio: grupo 1: dosis estándar, y grupo 2: una o más dosis adicionales semanales de 12 mg de betametasona. Variables maternas: semanas de gestación al inicio del tratamiento corticoideo, semanas al parto, tipo de parto, patología puerperal, entre otras; variables neonatales: sexo, índice de Apgar, peso, talla, perímetro cefálico y patología neonatal. Se realizó un estudio descriptivo y comparativo de ambos grupos.
ResultadosNo hubo diferencias estadísticamente significativas en los grupos. Sin embargo, se registraron más casos de displasia broncopulmonar (p = 0,09) en el grupo 1.
ConclusionesLa repetición semanal de las dosis de corticoides no mejora los resultados perinatales ni asocia efectos adversos.
To evaluate perinatal outcomes between different doses of antenatal corticosteroids.
Subjects and methodsRetrospective study of 61 single pregnancies at risk of premature birth, with no other associated pathology and with at least one standard dose of intramuscular betamethasone (two doses of 12 mg/24h). There were two study groups: Group 1: standard dose, and Group 2: one or more additional weekly doses of 12 mg. Maternal variables: gestational weeks at the beginning of steroid treatment, weeks at delivery, type of birth, puerperal pathology; neonatal variables: sex, Apgar score, weight, height and cephalic perimeter at birth, and neonatal pathology. We performed a descriptive and comparative study on both groups.
ResultsNo statistically significant differences were found between the groups. However, there were more cases of bronchopulmonary dysplasia (P=.09) in group 1.
ConclusionsRepeated weekly doses of corticosteroids do not improve perinatal outcomes and are not associated with adverse effects.
En las tres últimas décadas se han realizado grandes progresos en el diagnóstico, el tratamiento y la prevención de múltiples enfermedades perinatales. Sin embargo, la prematuridad continúa siendo hoy día la principal causa de morbimortalidad neonatal en prácticamente todo el mundo y su incidencia sigue aumentando1. Por todo ello, el parto pretérmino continúa siendo hoy día un gran problema de la medicina perinatal y lleva asociadas importantes complicaciones, tanto a corto como a largo plazo2. Por esta razón, el tratamiento farmacológico de la amenaza de parto prematuro (APP) va encaminado a conseguir dos objetivos concretos: por un lado, la tocólisis y, por otro, la aceleración farmacológica de la madurez pulmonar fetal.
Estudios realizados en animales han demostrado la capacidad de los corticoides para estimular la citodiferenciación y/o inducir una maduración temprana en diferentes tejidos, acelerando la diferenciación celular sin alterar la secuencia normal de desarrollo de estos3. La placenta humana expresa la enzima 11β-hidroxiesteroide deshidrogenasa (11 β-HSD), causante de la conversión del cortisol y la corticosterona en productos inactivos (cortisona y 11-dehidrocorticosterona). Sin embargo, esta enzima tiene muy baja afinidad por los esteroides halogenados, como la betametasona y la dexametasona, los cuales sufren un metabolismo placentario mínimo4,5 y pasan relativamente rápido de la circulación materna al feto. Por este motivo, estos dos esteroides han sido los más ampliamente utilizados en APP.
Liggins y Howie6 publicaron, en 1972, su artículo original sobre el uso de los esteroides prenatales (EP) y la descripción de la dosis estándar para inducción de la maduración pulmonar fetal: dos dosis de 12mg de betametasona por vía intramuscular (IM) separadas 24h, con las cuales se saturaban más del 75% de los receptores. Estos mismos autores6 observaron que con esta dosis los efectos se iniciaban incluso antes de las 24h de su administración y se mantenían durante 7 días, pero sus efectos estructurales persistían7, mejorando sustancialmente los resultados neonatales. En cuanto a la dexametasona, la pauta administrada consiste en 4 dosis de 6mg IM cada 12 h8.
Con la administración de EP, se ha conseguido reducir la incidencia del síndrome de distrés respiratorio neonatal en aproximadamente un 50%9, disminuir la incidencia de hemorragia intraventricular (IVH) hasta en un 60%7,99 y descender la incidencia de la persistencia del ductus arterioso10,11. Igualmente, se ha demostrado una reducción global de un 40-50%7,9 de la mortalidad neonatal con el uso de EP.
Posteriormente, tras la dosis estándar se fueron aplicando dosis semanales de EP en los casos en que el parto no se presentaba en los 7 días siguientes a la primera administración. Esta práctica habitual ha generado controversia en los últimos anos, ya que algunos estudios han demostrado efectos adversos tras el uso de múltiples dosis de corticoides. En animales de experimentación, algunos de los efectos observados han sido: disminución de peso12,13 y del perímetro cefálico14 al nacer, degeneración hipocampal dependiente de la dosis15, retardo en la mielinización de axones ópticos16 y retardo en la formación de conexiones sinápticas17. Estudios realizados en humanos asociaron efectos indeseables, tanto en madres como en neonatos, tras recibir repetidas dosis de EP: descenso transitorio de valores de cortisol fetal18, síndrome cushingoide neonatal19, disminución del perímetro cefálico y peso al nacer20,21, sepsis neonatal temprana22, aumento de la mortalidad neonatal21,22, retraso en el desarrollo mental y habilidades motoras23, parálisis cerebral24 y mayor incidencia de endometritis puerperal20,22.
El objetivo de nuestro estudio fue determinar si dosis repetidas semanales de EP aportan los mismos beneficios en los resultados perinatales que la aplicación de una dosis estándar o si asocian efectos adversos, tanto maternos como neonatales.
SUJETOS Y MÉTODOSSe realizó un estudio retrospectivo en 61 embarazadas con feto único, con una edad gestacional comprendida entre las 23 y 37 semanas, ingresadas con diagnóstico de APP, a las que se les habían administrado al menos una dosis estándar de EP para maduración pulmonar fetal y que dieron a luz antes de la semana 37 completa de gestación, en el Servicio de Obstetricia y Ginecología del Hospital Universitario Central de Asturias, entre junio de 1994 y junio de 2002. Se excluyeron todos los casos que presentaron enfermedades crónicas maternas, diabetes gestacional, preeclampsia, placenta previa, desprendimiento prematuro de placenta normoinserta, toxicomanías y rotura prematura de membranas de más de 24h de evolución.
Esta muestra inicial de 61 gestaciones se dividió en dos grupos para su estudio, en función de la dosis administrada de EP: grupo 1: compuesto por 39 gestantes que habían recibido una dosis estándar de betametasona (Celestone cronodose®) y grupo 2: compuesto por 22 gestantes que habían recibido, además de la dosis estándar, una o más dosis semanales de recuerdo de 12mg de betametasona IM.
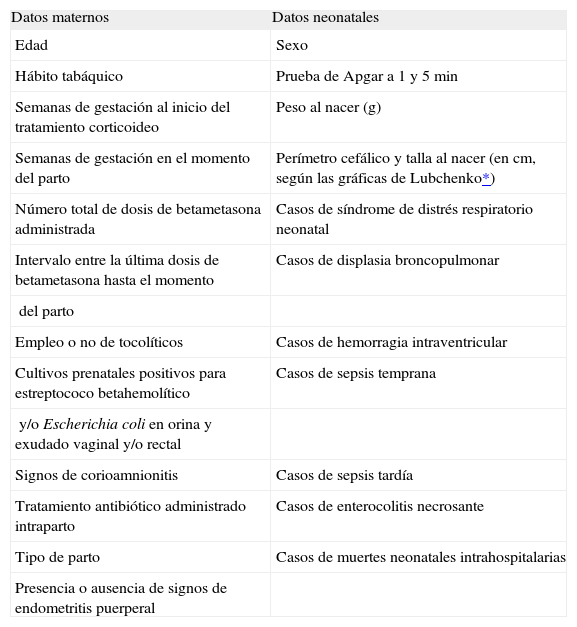
Las variables analizadas en el estudio para ambos grupos se reflejan en la tabla 1.
Variables maternas y neonatales analizadas
| Datos maternos | Datos neonatales |
| Edad | Sexo |
| Hábito tabáquico | Prueba de Apgar a 1 y 5min |
| Semanas de gestación al inicio del tratamiento corticoideo | Peso al nacer (g) |
| Semanas de gestación en el momento del parto | Perímetro cefálico y talla al nacer (en cm, según las gráficas de Lubchenko*) |
| Número total de dosis de betametasona administrada | Casos de síndrome de distrés respiratorio neonatal |
| Intervalo entre la última dosis de betametasona hasta el momento | Casos de displasia broncopulmonar |
| del parto | |
| Empleo o no de tocolíticos | Casos de hemorragia intraventricular |
| Cultivos prenatales positivos para estreptococo betahemolítico | Casos de sepsis temprana |
| y/o Escherichia coli en orina y exudado vaginal y/o rectal | |
| Signos de corioamnionitis | Casos de sepsis tardía |
| Tratamiento antibiótico administrado intraparto | Casos de enterocolitis necrosante |
| Tipo de parto | Casos de muertes neonatales intrahospitalarias |
| Presencia o ausencia de signos de endometritis puerperal |
Se realizó un estudio descriptivo analizando cada una de las variables de los dos grupos y un estudio comparativo entre ambos. Los resultados de las variables cuantitativas se expresan en media±desviación estándar (DE) y los de las variables cualitativas en porcentajes. Para comparar variables cualitativas se utilizaron la prueba de la χ2 o la prueba exacta bilateral de Fisher, cuando fue necesario. Las variables numéricas se compararon mediante el análisis de la varianza (ANOVA). Se consideraron significativos los valores de p<0,05. Todos los valores se introdujeron en la base de datos Excel de Microsoft Office 2000 y se analizaron con el paquete informático SPSS 11.0. Se contó con la colaboración de la Unidad de Bioestadística del Hospital Universitario Central de Asturias (HUCA).
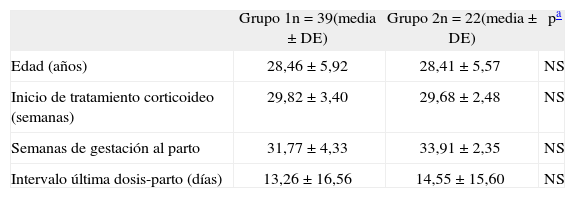
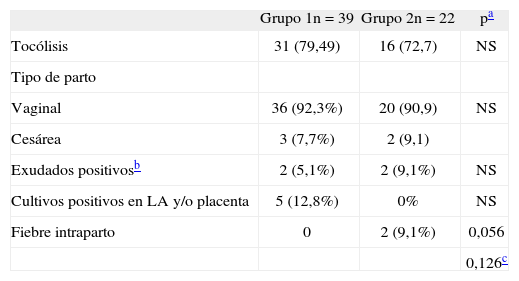
RESULTADOSLa comparación de las variables maternas entre ambos grupos no mostró diferencias estadísticamente significativas, lo que los hizo homogéneos y comparables para la realización del estudio (tabla 2). La fiebre intraparto sólo se observó en el grupo 2, aunque la diferencia tampoco fue significativa (tabla 3).
Comparación de variables maternas
| Grupo 1n=39(media±DE) | Grupo 2n=22(media±DE) | pa | |
| Edad (años) | 28,46±5,92 | 28,41±5,57 | NS |
| Inicio de tratamiento corticoideo (semanas) | 29,82±3,40 | 29,68±2,48 | NS |
| Semanas de gestación al parto | 31,77±4,33 | 33,91±2,35 | NS |
| Intervalo última dosis-parto (días) | 13,26±16,56 | 14,55±15,60 | NS |
DE: desviación estándar.
Comparación de variables maternas
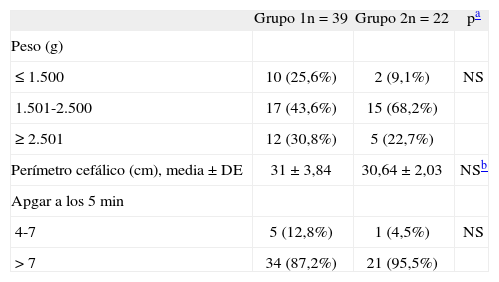
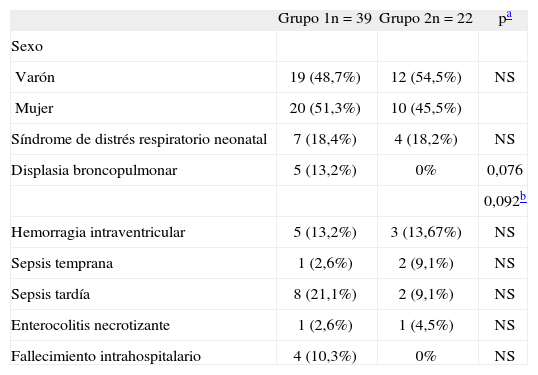
En cuanto a la comparación de las variables neonatales, no se hallaron diferencias estadísticamente significativas entre los grupos (tabla 4). Tampoco se encontraron diferencias estadísticamente significativas entre los grupos en cuanto a la morbimortalidad neonatal, excepto en los casos de displasia broncopulmonar que únicamente se presentaron en 5 neonatos del grupo 1 (13,2%); no hubo ningún caso en el grupo 2 y se obtuvo una diferencia casi estadísticamente significativa (tabla 5).
Comparación de variables neonatales
| Grupo 1n=39 | Grupo 2n=22 | pa | |
| Peso (g) | |||
| ≤ 1.500 | 10 (25,6%) | 2 (9,1%) | NS |
| 1.501-2.500 | 17 (43,6%) | 15 (68,2%) | |
| ≥ 2.501 | 12 (30,8%) | 5 (22,7%) | |
| Perímetro cefálico (cm), media±DE | 31±3,84 | 30,64±2,03 | NSb |
| Apgar a los 5min | |||
| 4-7 | 5 (12,8%) | 1 (4,5%) | NS |
| > 7 | 34 (87,2%) | 21 (95,5%) |
DE: desviación estándar.
Morbimortalidad comparada
| Grupo 1n=39 | Grupo 2n=22 | pa | |
| Sexo | |||
| Varón | 19 (48,7%) | 12 (54,5%) | NS |
| Mujer | 20 (51,3%) | 10 (45,5%) | |
| Síndrome de distrés respiratorio neonatal | 7 (18,4%) | 4 (18,2%) | NS |
| Displasia broncopulmonar | 5 (13,2%) | 0% | 0,076 |
| 0,092b | |||
| Hemorragia intraventricular | 5 (13,2%) | 3 (13,67%) | NS |
| Sepsis temprana | 1 (2,6%) | 2 (9,1%) | NS |
| Sepsis tardía | 8 (21,1%) | 2 (9,1%) | NS |
| Enterocolitis necrotizante | 1 (2,6%) | 1 (4,5%) | NS |
| Fallecimiento intrahospitalario | 4 (10,3%) | 0% | NS |
Teniendo en cuenta las semanas de gestación en el momento del parto, se observó en ambos grupos una mayor proporción de partos entre las 28 y 34 semanas. Se realizó un estudio comparativo de todas las variables en este subgrupo porque la muestra era más uniforme; no se encontraron diferencias estadísticamente significativas.
COMENTARIOS Y DISCUSIÓNEn los últimos años, se han obtenido distintos resultados en función del tipo de corticoide administrado. Algunos autores25 no han encontrado diferencias en cuanto a la reducción de la morbimortalidad neonatal entre la betametasona y la dexametasona, e incluso han observado una mayor reducción de la incidencia de IVH con el uso de esta última. Sin embargo, una revisión de artículos de la Cochrane Library26 objetivó que la betametasona es una de las mejores opciones en la corticoterapia antenatal, pues ha demostrado ser la única que disminuye la mortalidad neonatal de forma significativa. Igualmente, un estudio retrospectivo27 demostró una disminución del riesgo de leucomalacia periventricular en los neonatos expuestos a betametasona, pero no en los expuestos a dexametasona respecto al grupo control. Asimismo, estudios recientes28 han demostrado un mayor riesgo de IVH y de retinopatía del prematuro con el uso de dexametasona en comparación con la betametasona. Hasta la fecha, hay más estudios que favorecen el uso de la betametasona frente a dexametasona, haciendo cuestionable el uso clínico de este último corticoide27,28
En cuanto a los efectos de las diferentes dosis de EP, la asociación entre múltiples dosis de betametasona y disminución del perímetro cefálico al nacer la sugirieron Abbasi et al20. Sin embargo, hay que tener en cuenta que en su estudio retrospectivo incluía gestaciones múltiples y preeclampsias. Igualmente, Banks et al21 realizaron un estudio retrospectivo de 710 neonatos reclutados en el North American Thyrotropin-Releasing Hormone Trial y objetivaron asociación entre el grupo expuesto a múltiples dosis con una disminución del peso fetal al nacer (p=0,016). No obstante, utilizaron betametasona y dexametasona, y no especificaron si existían diferencias en función del corticoide administrado. En nuestro estudio, sin embargo, no encontramos diferencias significativas en cuanto al peso y perímetro cefálico neonatal entre los grupos. Nuestros resultados concuerdan así con los hallados por Pratt et al29.
En cuanto a la incidencia de sepsis neonatal, en nuestro estudio no encontramos diferencias estadísticamente significativas entre los grupos, lo que coincide con los resultados obtenidos en el ensayo clínico aleatorizado de Thorp et al30. Sin embargo, Vermillion et al22 encontraron una asociación significativa entre la sepsis neonatal temprana y el grupo que había recibido múltiples dosis de EP (p=0,017). Igualmente, estos últimos autores22 y el estudio realizado por Banks et al21 obtuvieron un aumento en la mortalidad perinatal tras la administración de dosis repetidas de EP. No obstante, en nuestro estudio no hallamos esa asociación, coincidiendo con los resultados obtenidos en los estudios de Thorp et al30 y Pratt et al29. Coincidiendo con los resultados obtenidos por estos dos últimos autores29,30, no hemos encontrado asociación entre las dosis repetidas de corticoides y aumento de endometritis puerperal, a diferencia de los resultados hallados en los estudios de Vermillion et al22 y Abbasi et al20.
Finalmente, en relación con la morbimortalidad perinatal, nosotros no obtuvimos mayores beneficios tras el uso de múltiples dosis de EP frente a la aplicación de la dosis estándar. Estos resultados coinciden con los hallados en los estudios de Guinn et al31 y de Dirnberger et al32.
Es importante señalar que en nuestro estudio encontramos una diferencia casi estadísticamente significativa en los casos de displasia broncopulmonar (p=0,09).
Esta patología se presentó en 5 neonatos que pertenecían exclusivamente al grupo 1 y todos ellos habían nacido con menos de 28 semanas de gestación. En el grupo 2 sólo hubo un neonato nacido antes de las 28 semanas, que no presentó displasia broncopulmonar, y su madre había recibido 4 dosis de betametasona. Este hallazgo nos parece interesante pues podría apuntar a un mayor beneficio de las dosis repetidas semanales de EP en APP por debajo de las 28 semanas de gestación, pero al tener sólo un caso para comparar no podemos obtener conclusiones al respecto. Por ello, este dato debería corroborarse en estudios posteriores.
A la luz de los datos aportados en diferentes estudios, el National Institute of Health (NIH)33 estableció las siguientes recomendaciones. Todas las gestaciones con APP entre las 24 a 34 semanas de gestación deben considerarse candidatas al tratamiento con una dosis estándar de corticoides. Debido a la insuficiente base científica que existe hasta el momento, las dosis repetidas semanales de corticoides no deberían administrarse de forma rutinaria.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.