Ginecología
Sarcoma primitivo de mama
Primitive breast sarcoma
M. de la Calle
L. Fernández-Sanguino
F. Gómez-Pastrana
R. Sánchez1
N. Ramón
J. M. Inocente
F. Calero
Servicio de Ginecología y Oncología
1 Servicio de Anatomía Patológica Hospital «La Paz» Madrid
Correspondencia:
Dra. M. de la Calle Fernández-Miranda
Servicio de Ginecología y Obstetricia
Hospital «La Paz»
Paseo de la Castellana, 261
28046 Madrid
Fecha de recepción: 25/8/99
Aceptado para publicación: 15/12/99
RESUMEN
Objetivos: Determinar la incidencia del sarcoma de mama en nuestro medio, la sensibilidad de los métodos diagnósticos de que disponemos y el abordaje terapéutico más adecuado junto con los resultados pronósticos a largo plazo de este tumor maligno que tantas cuestiones plantea en la actualidad.
Sujetos y métodos: Se presentan los datos clínicos, patológicos, diagnósticos y terapéuticos de un estudio retrospectivo en pacientes con sarcoma primitivo de mama diagnosticados entre 1970 y 1998 en el Hospital «La Paz» de Madrid.
Resultados: El rango de edad de las pacientes estaba entre 19 y 86 años. La mama izquierda era la afectada en ocho de nueve casos. La media del tamaño del tumor fue de 6,5 cm, siendo el primer síntoma de consulta la presencia de una gran masa indolora de crecimiento rápido en la mama. La mamografía y la punción aspiración con aguja fina (PAAF) no diagnosticaron el sarcoma. La biopsia reveló: dos angiosarcomas, dos fibrosarcomas, dos osteosarcomas, un histiocitoma fibroso maligno, un leiomiosarcoma y un dermatofibroma protuberans. El tratamiento fue la excisión local seguida de mastectomía total sin linfadenectomía (excepto en un caso). En cuatro de los casos se trató con quimioterapia adyuvante. Fallecieron tres pacientes a los pocos meses del diagnóstico, dos de ellas con osteosarcoma.
Conclusiones: Aunque el sarcoma de mama es un tumor muy poco frecuente, debe tenerse siempre presente debido a su gran agresividad y a su dificultad diagnóstica con los métodos usuales de diagnóstico como la mamografía o la PAAF. La sospecha diagnóstica viene dada por la clínica ante una tumoración de gran tamaño y rápido crecimiento, que no suele afectar al pezón ni a ganglios axilares. La mastectomía total seguida de quimioterapia es el tratamiento de elección, habiéndose publicado beneficios en la supervivencia. En nuestra serie el osteosarcoma fue el sarcoma de peor pronóstico.
PALABRAS CLAVE
Sarcoma primitivo de mama; Mamografía; Mastectomía; Quimioterapia.
SUMMARY
Objective: To determine the incidence of the breast sarcoma in our country, the best ways in the diagnosis, the different kinds of therapies and the prognosis depending on the treatment or the histology.
Patients and methods: We present a retrospective review of nine cases of primary sarcoma of the breast (cistosarcoma phyllodes excluded) between 1970 and 1998 in the Department of Oncologic Gynecolgy in the Hospital «La Paz», Madrid.
Results: The age ranged from 19 to 86 years. Most of the tumours (8 of 9) were in the left breast. A painless large breast mass was the most frequent sympton. Average tumour size was 6.5 cm. The histopathology revealed: 2 angiosarcomas, 2 fibrosarcomas, 2 osteogenic sarcomas, one malignant fibrous histiocytoma, one leiomyosarcoma and one dermatofibroma protuberans. Only the biopsy diagnosed the short of tumour. Local wide excision and posterior mastectomy without axillary disection were performed in all patients. Only the most recent cases (2 osteogenic sarcomas, one fibrosarcoma and one dermatofibroma protuberans) have been treated with coadjuvant chemotherapy. There were two cases of carly malignant recurrence: the two osteosarcomas. Three patients died few months after the diagnosis.
Conclusions: Mammary sarcomas are rare but aggressive tumours. They are difficult to diagnose by routine methods as mammography or citology, because they are not useful to diferentiate benign from malignant lesions and only the biopsy help us to reveal the histogenesis. It must be suspect in a palpable mass with a history of rapid growth without nipple involvement or axillary adenopathy. Mastectomy and coadjuvant chemotherapy are the elective therapies inducing a survival benefit. Mortality rates are worse with osteogenic sarcomas.
KEY WORDS
Primitive breast sarcoma; Mammography; Mastectomy; Chemotherapy.
De la Calle M, Fernández-Sanguino L, Gómez-Pastrana F, Sánchez R, Ramón N, Inocente JM, et al. Sarcoma primitivo de mama. Prog Obstet Ginecol 2000;43:130-136.
INTRODUCCIÓN
Los sarcomas de tejidos blandos constituyen el 0,7 por 100 de todos los tumores malignos, representando los sarcomas de mama menos del 5 por 100 de todos los sarcomas(1,2). Esto supone que los sarcomas de mama constituyen menos del 1 por 100 de las tumoraciones malignas de la mama(3).
La palabra «sarkoma» procede del griego y significa «crecimiento grande y carnoso». Los sarcomas son tumores no epiteliales que derivan del mesénquima primitivo y tienen su origen en el estroma, el tejido adiposo y el endotelio de los vasos sanguíneos. El comportamiento de los sarcomas de mama es similar al de otros sarcomas de tejidos blandos: crecimiento unifocal, expansión hacia tejidos de baja resistencia, respeto de límites anatómicos, metástasis vía hematógena hacia pulmón y tejido óseo fundamentalmente y muy rara afectación ganglionar.
Desde que fuera descrito por primera vez por Celius en 1828(4), muchos han sido los estudios que han tratado de acercarse a este tipo de tumores, de tan rara incidencia (17,5 nuevos casos por millón de mujeres)(5) y, sin embargo, tan alta agresividad. La clasificación de los sarcomas de mama ha sufrido múltiples cambios en las últimas décadas, basándose actualmente en los hallazgos histológicos. La inmunohistoquímica y la microscopía electrónica han permitido un mayor conocimiento de estos tumores, permitiendo excluir de su clasificación los sarcomas metastásicos, los sarcomas con componente epitelial como los tumores filodes y el linfangiosarcoma postmastectomía radical o síndrome de Stewart-Treves.
Ajustándonos a la nueva clasificación de los sarcomas de mama, hemos realizado una revisión de todos los casos diagnosticados en el Hospital «La Paz» de Madrid en los últimos veintiocho años para intentar conseguir un mejor conocimiento del comportamiento de estos tumores.
MATERIAL Y MÉTODOS
Se estudiaron nueve casos de sarcoma de mama que se diagnosticaron y se trataron en el Hospital «La Paz» de Madrid entre 1970 y 1998. Este grupo de pacientes suponía el 0,25 por 100 de los 3.500 casos de tumoraciones malignas de mama tratadas en el Hospital «La Paz» en el mismo período de tiempo del estudio.
Los datos fueron recogidos retrospectivamente de las historias clínicas, cumplimentando un formulario diseñado al efecto en el que se recogían: la edad de la paciente, la mama afectada, el tamaño del tumor, los datos mamográficos y de la citología, la anatomía patológica posterior a la biopsia, el tipo de cirugía, los tratamientos adyuvantes y la supervivencia.
El programa informático empleado ha sido el Word''97 para Windows.
RESULTADOS
Los resultados vienen resumidos en la tabla 1.
| Tabla 1 | |||||||
| Caso | Edad | Mama | Mamografía | PAAF | AP | TTO | Supervivencia |
| 1 | 19 | Izquierda 2,5 cm | Fibroadenoma | Cels. estromales atípicas | Fibrosarcoma | Tumorectomía + mastectomía | Libre de enfermedad |
| 2 | 22 | Izquierda 4 cm | Secuela traumática | MFQ infectada | Angiosarcoma | Tumorectomía + mastectomía + QT | Libre de enfermedad |
| 3 | 26 | Izquierda 5 cm | Fibroadenoma | Tumor phyllodes | Fibrosarcoma | Tumorectomía + mastectomía + QT | Libre de enfermedad |
| 4 | 40 | Izquierda 7 cm | Fibroadenoma | Cels. estromales atípicas | Dermatofibroma protuberans | Tumorectomía + mastectomía | Libre de enfermedad |
| 5 | 49 | Izquierda 9 cm | -- | -- | Osteosarcoma | Mastectomía + linfadenectomía + QT | Muerte en siete meses |
| 6 | 55 | Izquierda 8 cm | Tumor phyllodes | Cels. estromales atípicas | Angiosarcoma | Tumorectomía + mastectomía | Libre de enfermedad |
| 7 | 69 | Izquierda 5 cm | Carcinoma | Cels. estromales atípicas | Fibrohistiocitoma maligno | Mastectomía | Libre de enfermedad |
| 8 | 72 | Derecha 10 cm | Carcinoma | -- | Osteosarcoma | Mastectomía + QT | Muerte en seis meses |
| 9 | 86 | Izquierda 8 cm | -- | -- | Leiomiosarcoma | Mastectomía | Muerte |
La edad media de las pacientes fue de 48,6 años, con un rango comprendido entre los 19 y los 86 años. El 50 por 100 de ellas eran premenopáusicas. En cuanto al tamaño tumoral, la media fue de 6,5 cm (con un rango de 2,5 a 10 cm), predominando el tumor en la mama izquierda (88,9 por 100). El motivo principal de consulta fue la presencia de una gran masa indolora en la mama de aparición reciente (unos meses de evolución) y de crecimiento muy rápido. Uno de los casos refirió la aparición de la tumoración tras un traumatismo, por lo que en un principio se calificó de contusión con hematoma.
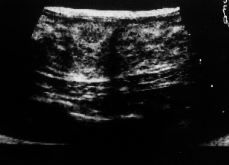
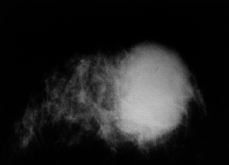
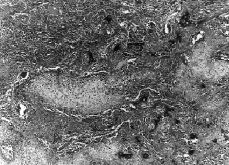
Se realizó mamografía en siete de las nueve pacientes (Figs. 1-3), no siendo en ninguno de los casos concluyente y diagnosticándose en tres casos de fibroadenoma (en las pacientes más jóvenes) y de carcinoma o tumor phillodes en otras tres pacientes de entre 55 y 72 años. La PAAF realizada en seis pacientes informó de células estromales atípicas en cuatro casos, de tumor filodes en un caso y de mastopatía fibroquística infectada en el caso del traumatismo. La anatomía patológica tras la biopsia mamaria reveló: dos fibrosarcomas (Figs. 1 y 4), dos angiosarcomas (Fig. 3 y 5), dos osteosarcomas (Figs. 2 y 6), un fibrohistiocitoma maligno, un leiomiosarcoma y un dermatofibroma protuberans.
Figura 1. Mamografía de un fibrosarcoma.
Figura 2. Mamografía de un osteosarcoma.
Figura 3. Mamografía de un angiosarcoma.
Figura 4. Ecografía de un fibrosarcoma.
Figura 5. Angiosarcoma de mama: canales vasculares neoplásicos que proliferan anastomosándose e infiltran disecando la grasa y estructuras ductales de la mama (H-E x 10).
Figura 6. Osteosarcoma de mama: células estromales fusocelulares capaces de diferenciarse formando osteoide y matriz condroide que se calcifica focalmente (H-E amplificación original x 40).
El tratamiento en todas ellas fue la mastectomía total, en cinco de los casos precedida de tumorectomía. En uno de los casos se realizó linfadenectomía axilar sin evidencia de afectación metastásica. Se empleó tratamiento adyuvante con quimioterapia en cuatro pacientes (44,4 por 100): una paciente con siete ciclos de adriamicina, dos pacientes con tres ciclos de 4-epirrubicina + ifosfamida y una paciente con tres ciclos de 4-epirrubicina + ifosfamida + MESNA. No se consideró la administración de radioterapia a ninguna de las pacientes.
Respecto a la evolución, se siguió semestralmente a todas las pacientes con mamografía contralateral, serie ósea, radiografía de tórax y marcadores tumorales CA 125 y CA 15,3 sin observarse modificación en los valores de estos últimos incluso cuando había recidiva. Dos casos, ambos de osteosarcomas, recidivaron en uno y tres meses postmastectomía. Se les trató con quimioterapia: en un caso se administró adriamicina desarrollando metástasis en columna vertebral y ganglios supraclaviculares y falleciendo a los seis meses, y en el segundo caso se trató con 4-epirrubicina + ifosfamida, metastatizando en el sistema nervioso central y falleciendo a los 10 meses. La paciente de 86 años falleció a los 12 meses de la cirugía. La mortalidad fue del 33,3 por 100 (tres de nueve pacientes), siendo la supervivencia en cinco años libre de enfermedad de 62,5 por 100 (cinco de ocho pacientes), ya que una de las pacientes fue diagnosticada en noviembre de 1998, no habiendo transcurrido tiempo suficiente para la evaluación de la supervivencia.
DISCUSIÓN
Aunque la mayoría de los tumores malignos de la mama tienen un origen epitelial en forma de carcinomas ductales o lobulillares, un pequeño porcentaje (menos del 1 por 100 en general, y el 0,25 por 100 en nuestra serie) de estas tumoraciones malignas surgen del estroma mamario.
La edad de presentación es variable con un rango entre la pubertad y la postmenopausia (15 y 89 años), teniendo un pico entre los 40 y los 50 años según los distintos estudios(6-9). La media de edad (48,6 años) es entre una y dos décadas mayor que la de los fibroadenomas y, sin embargo, está por debajo de la media de edad de las mujeres con carcinoma de mama(6,10).
El sarcoma se presenta como una tumoración de gran tamaño con unas dimensiones aproximadamente de unos 5 y 6 cm de media(6,9), como pudimos comprobar. Rara vez aparece de forma bilateral, salvo en algún caso aislado descrito(11), sin predominio sobre ninguna mama para algunos autores(7), con predilección sobre la mama derecha para otros(8) o sobre la mama izquierda como en nuestro estudio. La aparición de una gran tumoración en la mama es la principal causa de consulta en estas pacientes con sarcoma mamario(6-9), siendo a la exploración indolora y no adherida a planos profundos ni superficiales. No afecta al pezón ni la aréola (a excepción del leiomiosarcoma), ni a la piel adyacente (a excepción del angiosarcoma). Estas características y la ausencia de afectación de ganglios axilares (salvo en estados terminales) nos permite hacer un rápido diagnóstico diferencial con los carcinomas. La velocidad de su crecimiento diferencia a los sarcomas de los fibroadenomas, que por lo demás tienen unas características clínicas similares(6,12).
En cuanto a las técnicas diagnósticas, la mamografía parece ser un método poco útil, ya que, aunque demuestra la lesión, no diferencia de forma aceptable entre la benignidad y la malignidad de la misma(7,12-14), apareciendo en la mayoría de los casos como una masa radiodensa relativamente bien delimitada, de bordes no espiculados y raramente asociada con microcalcificaciones, lo que con frecuencia conduce al error diagnóstico de benignidad(14) (Figs. 1, 2, 3). La ecografía no resulta un método eficaz. La citología con PAAF tampoco es una técnica sensible en el diagnóstico de los sarcomas de mama, aunque permite descartar la atipia celular en algunos casos, no confirmando el diagnóstico en más de la mitad de las punciones(7).
El diagnóstico de sarcoma se pone de manifiesto con la biopsia de la tumoración(6,12) que nos permite clasificar histológicamente cada tipo de sarcoma. En general, los sarcomas de mama son histológicamente similares a los que aparecen en otras partes del cuerpo. Respecto a la estirpe anatomo-patológica, el angiosarcoma es el más frecuente en algunas series(7,8) (Figs. 3 y 5), mientras que para otros autores es el fibrosarcoma el de mayor aparición(6,12).
El tratamiento de los sarcomas de mama debe ser quirúrgico(6-8,12). Actualmente existe una gran controversia sobre la realización de mastectomía total o excisión local con amplios márgenes(7,8,15,16).
Para algunos autores, el tipo de cirugía depende de la estirpe histológica, proponiendo mastectomía para los fibrosarcomas(17) y excisión local con márgenes amplios para el angiosarcoma(18).
Debido a que la diseminación linfática es extremadamente rara en los sarcomas, no suele haber afectación ganglionar axilar(7,19); y por tanto, no se recomienda la realización de linfadenectomía axilar, aun incluso en los casos terminales en los que aparecen afectados los ganglios clínicamente(7,19-22). Sólo hay una excepción, el liposarcoma mamario, donde se ha observado una incidencia de metástasis axilar del 10 por 100(23).
El papel de la terapia adyuvante en los sarcomas de mama se presta a controversia. Respecto a la radioterapia, para algunos autores no supone ningún beneficio en la frenación del curso de la enfermedad(7,16,24), mientras que otros estudios encontraron una disminución de la recidiva local en los sarcomas de alto grado, pero no en los de bajo grado(24-27). De cualquier manera, la radioterapia en los sarcomas de mama no aumenta la supervivencia de las pacientes, debido a la gran radiorresistencia de este tipo de tumores(6).
La quimioterapia parece ser en la actualidad la terapia coadyuvante con mejores resultados en el sarcoma de mama. Diversos estudios encontraron un aumento de la supervivencia libre de enfermedad respecto a las pacientes sin tratamiento(7,28,29). Sin embargo, para otros autores no había diferencia en la supervivencia tras la quimioterapia(30,31). La recomendación actual es que la quimioterapia debe ser utilizada en los casos de sarcomas de alto grado o tumoraciones de gran tamaño, que son los de mayor quimiosensibilidad, aumentando así la eficacia del tratamiento(12,32-34). Dentro de las múltiples pautas de quimioterapia se han descrito ciclos con doxorrubicina(8), doxorrubicina y ciclofosfamida(28), epirrubicina y 5-fluoruracilo(35) o actinomicina(36).
En el pronóstico del sarcoma de mama, la recidiva local determina la evolución del tumor, presentándose en forma de lesiones multifocales, lesiones vasculares, lesiones cutáneas o invasión de la parrilla costal(7). La aparición de recidivas locales incrementa con el tamaño del tumor, teniendo una mayor supervivencia los menores de 5 cm(7,37). Las características histológicas determinan la supervivencia de la paciente, teniendo un peor pronóstico aquellos tumores con infiltración de los márgenes, más de ocho mitosis por campo o moderada o severa atipia nuclear(6,9). Aunque para muchos autores el angiosarcoma es el tipo de peor pronóstico(7,19) (Figs. 3 y 5), en nuestra casuística fue el osteosarcoma el tumor que tuvo menor supervivencia (Figs. 2 y 6). La supervivencia a los cinco años descrita es de un 60 por 100, similar a la nuestra de 62,5 por 100(15).
En conclusión, aunque el sarcoma de mama es un tumor muy poco frecuente, debe sospecharse ante la presencia de un nódulo mamario de gran tamaño y rápido crecimiento, a cualquier edad, debido a que son tumores muy agresivos y su diagnóstico precoz puede determinar un mejor pronóstico. Aunque actualmente la mastectomía y la quimioterapia son los tratamientos de elección, la excisión amplia local junto con la inmunoterapia están abriendo nuevas vías terapéuticas frente a estos tumores.
BIBLIOGRAFIA
01 Oberman N. Sarcomas of the breast. Cancer 1965;18:1233-43.
02 Russel W, Cohen J, Enzinger R. A clinical and pathological staging system for soft tissue sarcomas. Cancer 1977;40:1562-70.
03 Soiler S. Sarcoma of the breast. Am J Cancer 1937;31:183-206.
04 Celius MJ. Teleangiektasie. Heidelberger: Klin Ann; 1828. p. 499-517.
05 May DS, Stroup NE. The incidence of sarcomas of the breast among women in US 1973-1986. Plast Reconstruct Surg 1991; 87:193-4.
06 Moore MP, Kinne DW. Breast sarcoma. Surg Clin of North America 1996;76:383-94.
07 Gutman H, Pollack RE, Ross M, Benjamin RS, Johnston DA, Janjan NA, Romsdahl M. Sarcoma of the breast: implications for the extent of therapy. Surgery 1994;116:505-9.
08 North JH, Mc Phee M, Arredondo M, Edge S. Sarcoma of the breast: implications of the extent of local therapy. Am Surg 1998;64:1059-61.
09 Barnes L, Pietruzka M. Sarcomas of the breast: A clinicopathological analysis of ten cases. Cancer 1977;40:1577-85.
10 Masin M, Masin F. Cytology of angiosarcoma, of the breast. A case report. Acta Cytol 1977;22:162-4.
11 Bundred N, O''Reilly K, Smart J. Long term survival following bilateral breast angiosarcoma. Eur J Surg Oncol 1989;263-4.
12 Reynonlds J, Mies C, Daly JM. Breast: Mesenchimal infiltrating tumors. 6.ª ed. Barcelona: Masson; 1995. p. 210-21.
13 Berger S, Gershan-Cohen J. Mammograpy of the breast sarcoma. Am J Roentgenol 1962;87:76.
14 Elston B, Ikeda D, Andersson I. Fibrosarcoma of the breast: Mammographic findings. AJR 1992;158:993-5.
15 Berg JW, De Cosse JJ, Fracchia AA. Stromal sarcomas of the breast: a unified approach to connective tissue sarcomas other than the cystosarcoma phyllodes. Cancer 1962;13:418-24.
16 Pollard GS, Merks PV, Temple LN, Thompson NH. Breast sarcoma. A clinicopathological review of 25 cases. Cancer 1990;66:941-4.
17 Donegan WL. Sarcoma of the breast. Philadelphia: WB Sounders; 1988. p. 689-715.
18 Treves N, Sunderland DA. Cystosarcoma of the breast: a malignant and bening tumor. Clinicopathological study of seventyfive cases. Cancer 1951;4:1286-332.
19 Christensen L, Schnidt T, Blicher-Toft M. Sarcomas of the breast. A clinicopathologic study of 67 patients with long, term follow up. Eur J Surg Oncol 1988;14;241-7.
20 Smola M, Rotschek M, Amann W. The impact of resection margins in the treatment of primary sarcomas of the breast. Eur J Surg Oncol 1993;19:61.
21 Terrier P, Terrier-Cocombe M, Mouriesse H. Primary breast sarcoma. A rewiev of 33 cases with immunohistochemistry and prognostic factors. Breast Cancer Res Treat 1989;13:39-48.
22 Fong Y, Coit D, Woadruft J. Lymph node metastasis for soft tissue sarcoma in adults. Analysis of data from a prospective data of 1722 sarcoma patients. Am Surg 1993;217:72-7.
23 Li K, Hizawa K, Okazaki K. Liposarcoma of the breast fine structural and histochemical study of a case and review of 42 cases in the literature. Tokushima J Exp Med 1980;27:49.
24 Johnstone P, Pierce L, Merino M. Primary soft tissue sarcoma of the breast: local-regional control with postoperative radiotherapy. Int J Radio Oncol Biol Phys 1993;27:671-5.
25 Suit HID. Patterns of failure after treatment of sarcoma by radical surgery or by conservative surgery and radiation. Cancer Treat Symp 1983;2:241-6.
26 Harrison I, Franzese F, Gaynor J. Long term results of a prospective randomized trial of adjuvant brachytherapy in the management of completed resected soft tissue sarcoma of the extremity and superficial trunk. Int Radiot Oncol Biol Phys 1993;27:259-65.
27 Pisters P, Harrison L, Woodruff J. A prospective randomized trial of adjuvant brachytherapy in the management of low grade soft tissue sarcomas of the extremity and superficial trunk. J Clin Oncol 1994;12:1150-5.
28 Rosenberg, SA, Tepper J, Glatstein E. Prospective randomized evaluation of adyuvant chemotheraphy in adults with soft tissue arcomas of the extremities. Cancer 1983;52:424-34.
29 Glenn J, Kinsella T, Glatstein E. A randomized, prospective trial of adyuvant therapy in adults with soft tissue sarcomas of the head and neck, breast and trunk. Cancer 1985;55:1206-214.
30 Edmonson JM, Fleming TR, Ivins JL. Randomized study of systemic chemotherapy following complete excision of non osseous sarcomas. Proc Am Soc Clin Oncol 1982;45:182.
31 Casper E, Gaynor J, Harrison L. Preoperative and postoperative adjuvant combination chemotherapy for adults with high grade soft tissue sarcoma. Cancer 1994;73:1644-51.
32 Pezzi CM, Pollack RE, Evans ML. Preoperative chemotherapy for soft tissue sarcoma of the extremities. Ann Surg 1990;211: 476-81.
33 Mc Grath P, Sloan D, Kenedy D. Adjuvant therapy of soft tissue sarcoma. Clin Plast Surg 1999;22:21-9.
34 Eilber F, Giuliano A, Huth J, Mirra J, Rosen G, Morton D. Neoadjuvant chemotherapy radiation and limited surgery for high grade soft tissue sarcoma of the extremity. Dev Oncol 1988;55:115-22.
35 De Medici D, Cebrelli CF, Venegani A, Mottola D. Sarcoma osteogenico della mammellla. Minerva Chir 1997;52:135-8.
36 Dannel RM, Rosen PP, Lieberman PH. Angiosarcoma and other vascular tumors of the breast. Am J Surg Pathol 1981;7: 53-60.
37 Ciatto S, Bonardi R, Cataliotti G. Sarcoma of the breast: a multicenter series of 70 cases. Neoplasia 1992;39:375-9.
38 Martini N, Mc Cormick PM, Bains MS. Surgery for solitary and multiple pulmonary metastasis. NY State J Med 1978;78: 1711-3.
39 Rosenberg SA, Lotze MJ, Buvl LM. A progress report on the treatment of 157 patients with advanced cancer using lymphokine-activated killer cells and interleukin-2 or high dose interleukin-2 alone. N Engl J Med 1987;316:889-97.