Los accidentes cerebrovasculares (ACV) son una causa frecuente de mortalidad y morbilidad neurológica crónica en niños. El ACV perinatal se define como aquel que ocurre entre la semana 28 de gestación y los 28 días de vida. Se suele manifestar en forma de convulsiones en las primeras semanas de vida, aunque puede permanecer asintomático hasta meses después del parto, cuando aparecen alteraciones en la lateralidad de la función motora fina, fallo al alcanzar los hitos del desarrollo o convulsiones. Gracias a la mejora de los métodos diagnósticos de imagen, esta patología se ha incluido como diagnóstico diferencial en los recién nacidos con sintomatología neurológica. Los obstetras se encargan del seguimiento de los embarazos de alto riesgo trombótico, pero rara vez tienen en cuenta el efecto de este riesgo en el feto o en el recién nacido. Se presenta un caso de ACV perinatal asociado a déficit de proteína C.
Stroke is an important cause of mortality and chronic neurological morbidity in children. Perinatal stroke has been defined as a cerebrovascular event occurring between 28 weeks of fetal life and the 28th postnatal day. The most common manifestation of stroke is neonatal seizures but this entity may also be asymptomatic until months after birth when asymmetry of reach and grasp, failure to reach developmental milestones, or postnatal seizures can develop. Improvements in neuroimaging and its availability have increased the diagnosis and awareness of perinatal stroke in newborns and infants with neurological symptoms. Obstetricians are responsible for monitoring pregnancies at high thromboembolic risk, but rarely consider the effect this has on the fetus or newborn. We present the case of a newborn with perinatal stroke associated with protein-C deficiency.
Los accidentes cerebrovasculares (ACV) son la tercera causa de muerte en adultos en nuestro medio y también el origen de mortalidad y morbilidad neurológica crónica en niños1. De hecho, la tasa de infartos cerebrales en neonatos es tan alta como la incidencia anual de infartos de grandes vasos en adultos2, y es la segunda causa más frecuente de convulsiones en el recién nacido a término3, tras la encefalopatía hipóxico-isquémica.
El ACV perinatal se define como aquel que ocurre entre la semana 28 de gestación y los 28 días de vida4. Su forma sintomática se da en 1 de 4.000 neonatos a término5 y después del primer mes de vida tiene una incidencia de 1/30.000 niños6. No se tiene información sobre los ACV perinatales que transcurren de forma asintomática, ya que no se diagnostican excepto cuando se realizan estudios por aparición de una discapacidad posterior. El riesgo de ACV en la madre al final de embarazo está incrementado7,8, y es unas 34 veces más frecuente en los 2 días antes y en el día posterior al parto que durante el resto del embarazo o fuera de la gestación8. Este aumento es riesgo, tanto en la madre como en el feto, así como el aumento de las trombosis en otros puntos de la economía9,10, probablemente se deban a la activación de la coagulación que tiene lugar alrededor del parto11,12, y es posible que se trate de una adaptación para disminuir el riesgo de hemorragia en este período.
Los ACV se pueden producir por hemorragia, isquemia o por trombos procedentes de vasos intra y extracraneales, del corazón o de la placenta. Normalmente, el origen es imposible de determinar1, pero el placentario se sospecha en la mayoría de los casos. La mayoría se dan en el territorio de la arteria cerebral media, con predominancia en el hemisferio izquierdo, como en este caso, lo que podría deberse a las diferencias hemodinámicas causadas por un ductus arterioso persistente13, o por una ruta más directa a través de la carótida común izquierda.
Los datos de amplios estudios pediátricos sugieren una fuerte asociación entre las trombofilias congénitas y adquiridas y los ACV en la infancia. En el caso descrito, la paciente fue diagnosticada de déficit de la proteína C, heredada de su padre. Los pacientes heterocigotos para déficit de proteína C o S suelen tener el primer episodio trombótico en la edad adulta y muchos de ellos no llegan a tener una trombosis. Sus niveles se encuentran entre el 30 y el 60% del valor medio. La proteína C es activada por la trombina (factor IIa) para convertirse en la proteína C activada. La proteína S actúa como cofactor incrementando la unión de la proteína C activada a las plaquetas y a las células endoteliales, donde ejerce su función anticoagulante produciendo la proteólisis de los factores V y VIII14. Además, la proteína C activada forma complejos con el PAI-1, lo que sirve para disminuirlo y así reduce la inhibición del activador del plasminógeno tisular. El activador del plasminógeno tisular convierte el plasminógeno en plasmina15.
El ACV perinatal se puede manifestar como convulsiones durante las primeras semanas de vida o permanecer asintomático hasta meses después, cuando se perciben alteraciones en la lateralidad de la función motora fina2. Gracias a la mejora de los métodos de imagen, ha aumentado el diagnóstico de esta patología y se ha incluido como diagnóstico diferencial en los recién nacidos con sintomatología neurológica1. Su resultado es variable, y depende de la gravedad, la localización anatómica y otros factores aún no bien determinados. Hasta el 50% de los niños con ACV documentado en el período neonatal no desarrollan hemiparesia2.
Caso clínicoPrimípara de 26 años de edad sin antecedentes de interés, con control extraclínico hasta la semana 26, en la que acude por primera vez a nuestras consultas.
Se encontraba en reposo por sensación moderada de dinámica uterina. Las ecografías previas eran normales y la prueba combinada de cribado bioquímico de cromosomopatías fue de bajo riesgo (1/10.000). La serología de la toxoplasmosis fue negativa y la prueba de O¿Sullivan era normal. El grupo sanguíneo es O Rh (+) y los cultivos vaginal y rectal para estreptococo del grupo B fueron negativos. El embarazo siguió un curso normal, produciéndose el parto, tipo eutócico, en la semana 394; nació una mujer que pesó 3.580g, con una puntuación en la prueba de Apgar de 9/9 y reanimación tipo I.
A las 24 horas de vida se trasladó el neonato a la unidad de cuidados intensivos pediátrica por cuatro episodios de movimientos clónicos de extremidades derechas. Al ingreso se obtuvo la siguiente exploración: peso 3.580g, talla 51cm, perímetro craneal 34,5cm; frecuencia cardíaca 130 lpm; presión arterial 59/30; temperatura 36,5°C; SatO2 98%; FR 59rpm; BEG. Adecuado color cutáneo-mucoso. Normo configurada. Edad gestacional clínica acorde a la cronológica. ACP: buena entrada de aire bilateral, sin soplos. Pulsos periféricos normales. Abdomen: blando, depresible, no masas ni visceromegalias. Genitales femeninos externos normo configurados. Neurológico: activa y reactiva. Tonos activo y pasivo normales. ROT presentes, simétricos con clonus aquíleo bilateral. Reflejos arcaicos: presentes.
Se inició monitorización de la función cerebral continua objetivando, a la hora de ingreso, una nueva crisis que no cede tras la administración de piridoxina (100mg). Ante la persistencia de las crisis, se inicia tratamiento con fenobarbital intravenoso. Las crisis continúan con una frecuencia constante cada hora, de 2-5min de duración. En las primeras 12h de ingreso, persisten con las mismas características (movimientos clónicos de miembros superior e inferior derechos, sin pérdida de conciencia). Posteriormente, no se objetivan nuevos episodios clínicos y el monitor de función cerebral no muestra actividad epiléptica.
Se mantiene el tratamiento con fenobarbital a dosis de mantenimiento, que se suspende 5 días antes del alta por presentar valores elevados en sangre. Se sustituye por ácido valproico oral (20mg/kg/día) que se mantiene en el momento del alta.
Las pruebas complementarias realizadas durante el ingreso comprenden:
- –
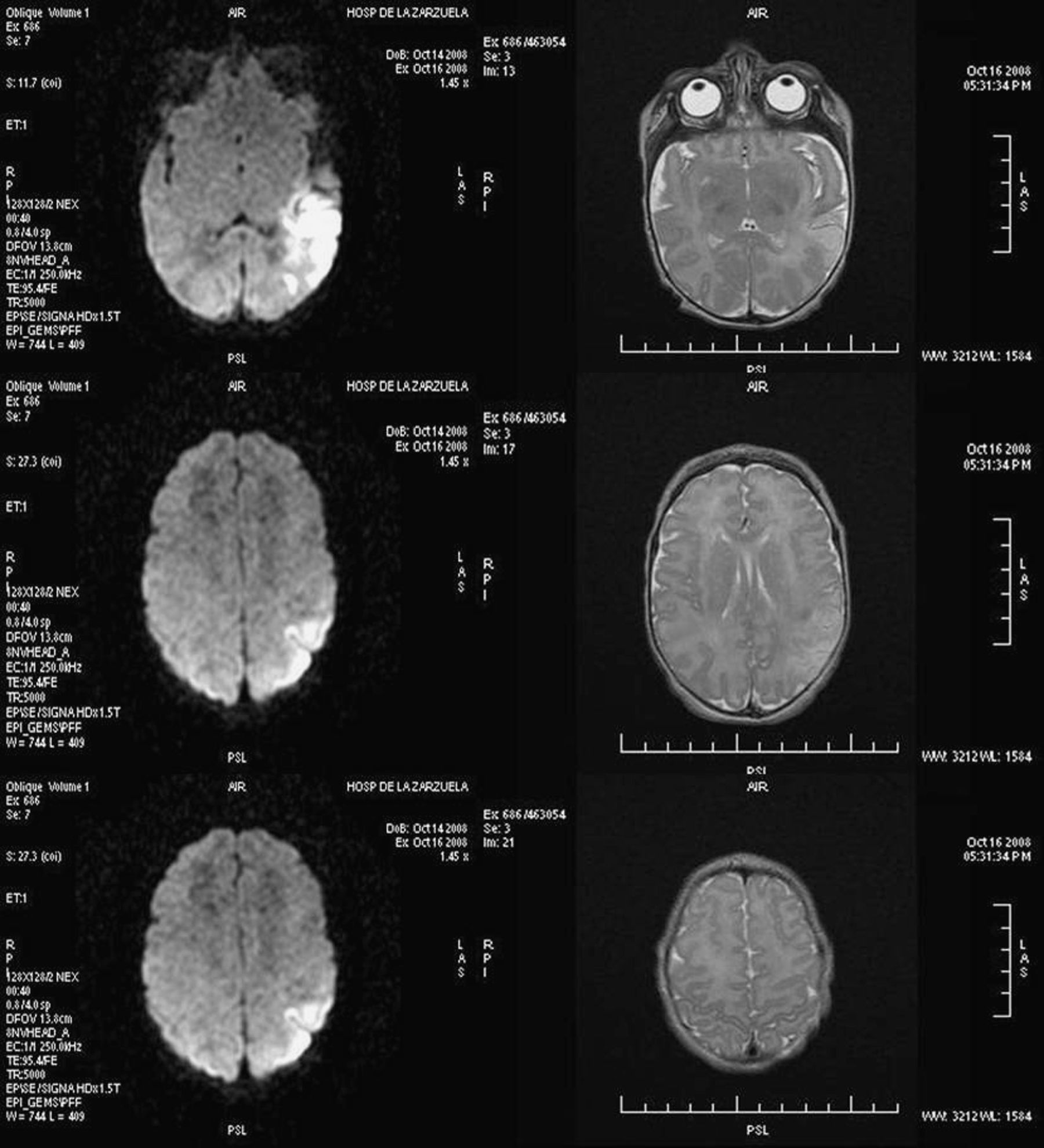
Resonancia magnética (RM) craneal: la RM convencional no presenta ninguna imagen clara, mientras que en la RM con imágenes de difusión se objetiva infarto agudo en el territorio posterior de la arteria cerebral media izquierda (fig. 1).
Figura 1.A la izquierda se encuentran tres cortes de resonancia magnética (RM) por difusión en los que se aprecia una zona hiperrefringente que se corresponde con la zona infartada (rama posterior de la arteria cerebral media izquierda), mientras que en las imágenes de RM convencional, a la derecha, no se encuentra alteración.
(0.28MB). - –
Hemograma, bioquímica, gasometría, citoquímico de líquido cefalorraquídeo (LCR) y estudio metabólico en sangre/orina/LCR, normales.
- –
Cultivo LCR negativo.
- –
Virus herpes simple en LCR: negativo.
- –
Serologías frente a citomegalovirus (CMV)/toxoplasma: negativas.
- –
Electrocardiograma (EEG) (24h de vida): presencia de dos crisis focales frontales izquierdas sobre una actividad de rangos normales, para la edad de la paciente.
- –
EEG (9 días de vida): sin hallazgos para la edad del paciente, no se observan anomalías epileptiformes, con mejoría con respecto al previo.
- –
Estudio de trastornos protrombóticos: coagulación: normal; antitrombina III (actividad) 40,8%; proteína C reactiva: 14,3%; proteína S: 51,3%; homocisteína: 4,9; anticoagulante lúpico negativo; anticuerpos anticardiolipina/antifosfolípido, mutación factor V Leiden/gen protrombina 20210: normales.
En las revisiones realizadas hasta el sexto mes de edad, la niña presentó un desarrollo psicomotor normal con leve hipotonía de hemicuerpo derecho inicial que desaparece en posteriores revisiones. Mantuvo tratamiento con ácido valproico sin presentar nuevas crisis epilépticas. La resonancia de control los 5 meses de vida fue normal. Los niveles de proteína C se mantenían bajos (38%), por lo que se realizó estudio a la familia detectándose en el padre déficit de proteína C.
En la actualidad, la niña está asintomática, con controles de EEG y RM normales, por lo que se retiró el tratamiento con ácido valproico, y no ha presentado nuevas crisis.
El diagnóstico final del caso es infarto agudo en territorio posterior de arteria cerebral media izquierda y déficit de proteína C.
DiscusiónEl ACV isquémico perinatal se produce alrededor del momento del nacimiento, con evidencia radiológica o patológica de infarto focal arterial. Es principalmente una alteración en los neonatos a término o casi a término16. Antiguamente, se diagnosticaba en las autopsias, mientras que en la actualidad su diagnóstico se basa en criterios neurorradiológicos. En su presentación, en el período neonatal destaca la presencia de convulsiones, normalmente sin otros signos de encefalopatía (alteraciones del tono, de la alimentación o disminución del nivel de conciencia)17, como ocurrió en el caso presentado. Otros signos, si aparecen, son inespecíficos: hipotonía, letargia o apnea18,19. En otros casos se diagnostica más adelante, por asimetría en la función motora fina, dificultad para alcanzar hitos del desarrollo o convulsiones posneonatales20. El diagnóstico retrospectivo depende de los hallazgos en las técnicas de neuroimagen.
Las exploraciones neurorradiológicas incluyen el uso de RM, tomografía computarizada (TC) y ecografía. La RM convencional potenciada en T1 y en T2 y, sobre todo, la RM con la práctica de imágenes de difusión son las técnicas de elección porque son particularmente sensibles para detectar infartos de forma temprana, cuando otras técnicas no detectarían anormalidades. La angio-RM también es útil para detectar vasos ocluidos o hipoplásicos. La ecografía cerebral resulta siempre diagnóstica de infarto cerebral cuando se realiza al menos 72h después del inicio de los síntomas, mientras que sólo es útil en el 44% de los pacientes en los que se efectúa previamente21. El diagnóstico prenatal4 mediante ecografía tiene una baja sensibilidad. El EEG es útil para el pronóstico y se debe realizar en las primeras 24h. Un trazado anormal unilateral o bilateral está en la mayoría de las ocasiones asociado a un mal pronóstico motor21, lo cual no parece cumplirse en nuestro caso.
La distribución de los infartos cerebrales es diferente según la edad gestacional. Así, los fetos pretérmino tienden a tener lesiones multifocales1, que afectan a las ramas corticales o lenticuloestriadas de la arteria cerebral media, mientras que los recién nacidos a término tienden a tener oclusiones en las ramas principales3,16.
Una vez establecido el diagnóstico, las demás pruebas deben centrarse en encontrar los posibles factores de riesgo asociados1. Varios autores han sugerido que existen una serie de factores de riesgo adquiridos o innatos; maternos, placentarios y fetales, que se asocian a esta patología (tabla 1). Aún así, no se encuentra la causa en el 50% de los casos22. Los factores que afectan a la coagulación en el período perinatal son la presencia de hemoglobina fetal, proteínas fetales y hematocrito y viscosidad altos. La concentración de factores procoagulantes y anticoagulantes varía a lo largo de la gestación y en el período posnatal, hay una activación de la coagulación tanto en la madre como en el feto en el momento cercano al parto12. Las infecciones placentarias pueden alterar también la coagulación. La asociación con el parto instrumental no se ha demostrado claramente, aunque existen casos descritos en la literatura científica21.
Patologías asociadas al aacidente cerebrovascular fetal1,20
| Factores maternos |
| Cetoacidosis diabética |
| Púrpura trombocitopénica |
| Anticoagulantes orales |
| Trombofilias |
| Traumatismo |
| Fiebre materna asociada a gastroenteritis |
| Antiepilépticos |
| Cocaína |
| Anticuerpos anticardiolipina |
| Edad |
| Obesidad |
| Historia familiar de fenómenos tromboembólicos |
| Cirugía (incluida cesárea) |
| Deshidratación |
| Reposo prolongado |
| Factores relacionados con la gestación |
| Trombocitopenia aloinmune fetal |
| Hemorragia placentaria |
| Trombos placentarios |
| Desprendimiento prematuro de placenta |
| Hemorragia feto-materna |
| Corioamnionitis |
| Gestación múltiple |
| Síndrome de transfusión feto-fetal |
| Factores fetales |
| Deficiencia de piruvato decarboxilasa |
| Infección por citomegalovirus |
| Hepatitis C |
| Traumatismo en el parto |
| Enfermedad de Von Willebrand |
| Deficiencia de proteína C |
| Policitemia |
| Mutación 20210A de la protrombina |
| Factor V Leiden |
| Cardiopatías congénitas |
| Sepsis |
| Coagulación intravascular diseminada |
| Meningitis |
De Veber describe que hay alteraciones de la coagulación en el 15% de los casos diagnosticados en la infancia. Pero el papel de las coagulopatías en la patogénesis del ACV perinatal es todavía desconocido, ya que no hay estudios de cribado de trombofilias en los niños con ACV perinatal22. Este cribado debe realizarse de forma dirigida; de otra manera, el coste sería inmenso. Además, se debe realizar de forma diferida, ya que no influye en el manejo y es sólo útil para el consejo a los padres para futuros embarazos22,23.
Se considera de gran importancia el hecho de que para realizar el diagnóstico hay que tener en cuenta que los niveles de antitrombina III, proteína C y proteína S en el recién nacido son menores que los hallados en niños y adultos. De hecho, los valores normales en el recién nacido son del 63% (39-87%), el 35% (17-53%) y el 36% (12-60%) de los valores del adulto, respectivamente15. Estos niveles experimentan una elevación rápida en las primeras semanas de vida y alcanzan los niveles del adulto alrededor de los 6 meses24. En el caso presentado, también se produce este incremento de la proteína C del primer al segundo control hemático.
El infarto cerebral neonatal es una importante causa de parálisis cerebral y de otras secuelas neurológicas, como epilepsia y retraso cognitivo21. Es responsable de al menos el 22-70% de la parálisis cerebral congénita hemipléjica de la población a la que afecta. En ocasiones, el ACV ha pasado inadvertido y no es diagnosticado ni sospechado, por lo que esta patología neurológica se achaca a otras causas (partos instrumentales, iatrogenia, etc.). La topografía de la lesión es crucial para determinar el pronóstico motor, de manera que se desarrolla con más frecuencia una hemiparesia espástica en los infartos cerebrales que afectan al tronco principal de la arteria cerebral media que en los que afectan a vasos distales21. La tasa de mortalidad por infarto cerebral es mucho mayor en el año posterior al nacimiento que durante la infancia y durante los siguientes 50 años. El período perinatal es el de mayor tasa de isquemias cerebrales durante la infancia1. Tanto el EEG como las técnicas de neuroimagen dan mucha información sobre el pronóstico de estos niños1.
Pero el pronóstico del ACV diagnosticado en el período perinatal no siempre es desfavorable. En una revisión de los últimos 30 años1, el 40% de los niños con ACV perinatal fueron neurológicamente normales; el 57% presentaba alguna deficiencia cognitiva y un 3% falleció5. En otra revisión llevada a cabo por Levene et al25, los autores concluyen que la mitad de los niños con ACV neonatal eran clínicamente normales a los 12-18 meses de vida. En cuanto al nivel cognitivo, el pronóstico es más complicado y no hay muchos estudios publicados y, en general, no se hallan diferencias en cuanto al comportamiento con respecto a los controles. Sí que se han encontrado diferencias en el lenguaje entre los niños con afectación del hemisferio izquierdo, con respecto a los afectados en el hemisferio derecho y a los controles4.
El diagnóstico retrospectivo suele estar ocasionado por la presencia de alteraciones neurológicas que llevan a la práctica de pruebas neurorradiológicas y las alteraciones, en caso de ser moderadas-severas, normalmente persisten26.
Por último, el riesgo de recurrencia es difícil de determinar y deben tenerse en cuenta los factores de riesgo etiológicos. Se estima entre el 3-5%20.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Deseamos agradecer al servicio de radiodiagnóstico del Hospital La Zarzuela, que nos ha facilitado las imágenes que ilustran el caso, y en especial a Don Rubén Ajo y al Dr. Córdoba, por su amabilidad.