INTRODUCCION
El tumor de células de la granulosa es un tipo de carcinoma ovárico inusual y de pronóstico diferente a las neoplasias epiteliales y mucinosas habituales. Hay 2 variedades, adulto y juvenil, con diverso comportamiento; es más común el primero y con mayor tendencia a la recidiva, aunque con mejor pronóstico que los tumores ováricos más frecuentes.
Describimos un caso de este cáncer tan atípico y revisamos sus características definitorias clínicas, diagnósticas, terapéuticas y pronósticas específicas.
CASO CLINICO
Paciente de 62 años de edad, sin antecedentes familiares oncológicos de interés ni alergias medicamentosas conocidas y con los siguientes antecedentes personales: G0P0A0; menarquia a los 13 años y menopausia a los 58; hipertensión arterial. En 1988 presenta metrorragias repetidas, y se efectúa un legrado dificultoso por estenosis cervical y con material diagnóstico escaso. Al mes siguiente acude a urgencias por clínica similar y anemia microcítica hipocrómica grave, sin hallazgos patológicos en la exploración ginecológica, salvo una histerometría de 7 cm. Se realiza histerectomía y doble anexectomía, y la anatomía patológica informa de hiperplasia endometrial quística con endometriosis intramural, ovario derecho normal y tumor de células de la granulosa en el ovario izquierdo en estadio Ic. No recibió tratamiento adyuvante con quimioterapia ni radioterapia. La paciente siguió efectuando las revisiones ginecológicas, que fueron compatibles con la normalidad.
En septiembre de 1994 ingresó por disnea de moderados esfuerzos secundaria a un derrame pleural derecho. Se trataba de un exudado serosanguinolento, con predominio de mononucleares, y ADA y glucosa normales. La citología y la biopsia pleural resultaron no concluyentes. La broncoscopia y el cultivo de Lowenstein fueron normales. En la tomografía computarizada (TC) toracoabdominopélvica se observa una masa pélvica de 15 x 10 x 11,5 cm, supravesical, que desplaza la vejiga y el recto, y adenopatías patológicas en las cadenas ilíacas, además del mencionado derrame pleural derecho y una lesión hepática de 1 cm en el lóbulo hepático izquierdo. La ecografía endovaginal y la exploración ginecológica confirmaban el hallazgo de una masa tumoral en la pelvis menor. En la analítica se evidenciaba Ca 125: 252 (0-35) con normalidad de AFP y beta-HCG. Se procede a cirugía de second-look, omentectomía, apendicectomía y extirpación de colon, ya que en la intervención quirúrgica se visualizaba una tumoración adherida profundamente al sigma, recubierta con una cápsula rojiza y con notable trama vascular; en el hígado aparecían 2 nódulos en el lóbulo hepático izquierdo, que se decide no resecar en el contexto de probable enfermedad metastásica pleural y hepática. En el epiplón no había implantes macroscópicos ni microscópicos. La anatomía patológica fue compatible con una recidiva del tumor de células de la granulosa inicial (1988) con infiltración de segmento de colon. Posteriormente, la paciente recibió tratamiento quimioterápico; en octubre de 1994 inició un esquema CAP (ciclofosfamida, adriamicina y cisplatino), finalizando el sexto y último ciclo en abril de 1995. En la TC abdominopélvica y la ecografía tras tratamiento se puso de manifiesto una colección quística residual, con la desaparición del derrame pleural, sin datos que indicaran una enfermedad neoplásica.
Hasta febrero de 2000, la paciente continúa efectuando las revisiones protocolizadas compatibles con la normalidad; en esa fecha, en una ecografía abdominopélvica se observó una masa pélvica retrovesical de 4 cm que indica una recidiva. Se procedió a su exéresis, que era compatible con metástasis del tumor inicial, al igual que la citología del líquido ascítico. Recibió quimioterapia con cisplatino y paclitaxel durante 6 ciclos, con respuesta parcial, y neuropatía de grado I como toxicidad, y tamoxifeno después, hasta agosto de 2004. En esta fecha se visualiza en la TC abdominopélvica una masa de 5 cm en la cavidad pélvica que impronta el recto y lo desplaza hacia la derecha. Rechaza voluntariamente una nueva pauta de quimioterapia, y durante un año se observa un crecimiento progresivo del tumor. En agosto de 2005 recibió radioterapia paliativa, ya que presentaba un linfedema bilateral en los miembros inferiores e hidronefrosis secundarias al crecimiento de la masa y ganglionar regional, con gran mejoría sintomática.
Actualmente, la paciente continúa las revisiones, y está libre de síntomas.
RESULTADOS
La histología inicial y las recidivas fueron compatibles con tumor de célula germinativa (TCG). En el tumor inicial no se observaban zonas con atipia nuclear significativa, patrón de crecimiento sólido o índice mitótico elevado (8-12 mitosis/campo de gran aumento), pero su rotura en el acto quirúrgico constituía un dato de mal pronóstico.
DISCUSION
El TCG representa el 2-5% de todos los carcinomas del ovario. Como su nombre indica, deriva de las células de la granulosa que forman parte de la estroma ovárica y son responsables de la producción de estradiol. Se divide en tipo adulto y juvenil, con clínica y hallazgos histopatológicos diferentes entre sí. El subtipo adulto constituye el 95% de los TCG; el juvenil sólo el 5%, y afecta a mujeres menores de 30 años y niñas prepúberes1,2 que pueden presentar seudopubertad precoz.
El TCG del adulto puede presentar clínica indolente, frecuentemente sensación de plenitud posprandial y aumento del perímetro abdominal, lo que suele retrasar el diagnóstico. Afecta a mujeres perimenopáusicas o al inicio del período menopáusico, habitualmente entre los 50 y 54 años2,3. El sangrado posmenopáusico es el signo más común de presentación (como en este caso), causado por la exposición del endometrio al estradiol secretado por el tumor, y puede confundirse o coexistir con una hiperplasia, e incluso con un adenocarcinoma endometrial.
El primer paso es realizar un examen físico (normal o masa palpable pélvica o abdominal) y un estudio ecográfico que puede revelar una masa ecogénica quística o septada en el ovario. El pilar fundamental del tratamiento y la estadificación es la cirugía, similar a la reglada en el resto de los tumores ováricos. El estudio histopatológico exhaustivo debe descartar la concomitancia de un adenocarcinoma uterino, en mujeres que lo presentan con
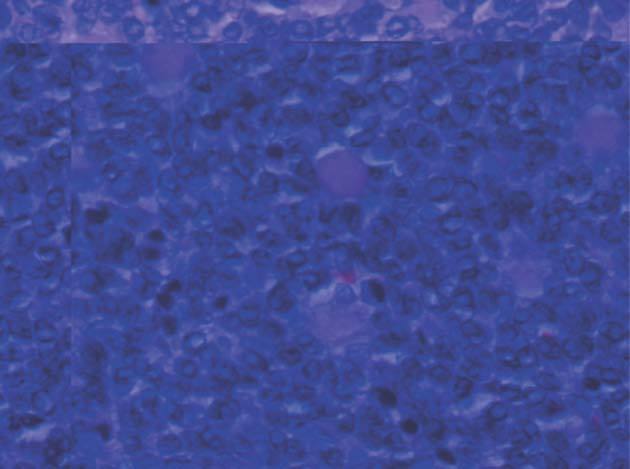
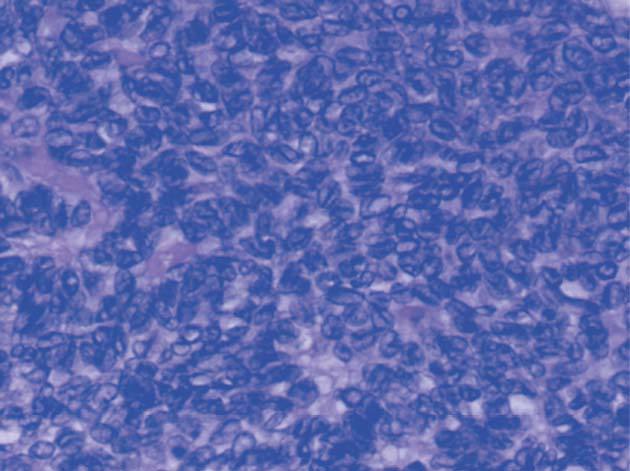
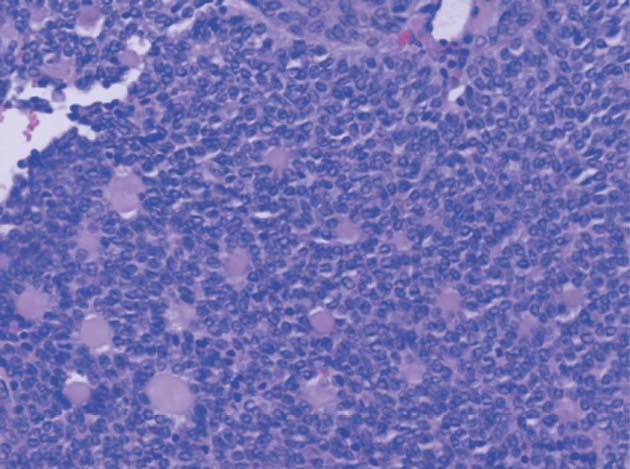
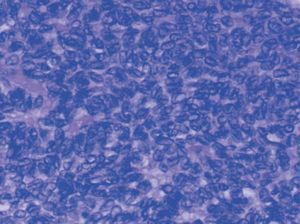
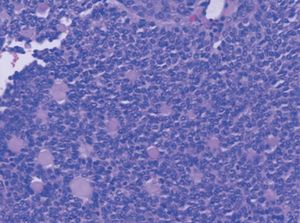
metrorragias1, como en este caso. Se observa una masa quística amarillenta, constituida por células de la granulosa, solas o en combinación con otras de la estroma de los cordones sexuales. Éstas son redondas u ovales (fig. 1), pequeñas y con núcleo en grano de café (fig. 2); los cuerpos de Call-Exner (fig. 3) aparecen en el 30-60% de los casos4. Estas peculiaridades sirven para diferenciar a este carcinoma de los tumores indiferenciados ováricos, en ocasiones muy difícil de realizar.
Figura 1.Tumor de la granulosa (HE, x200). Patrón microfolicular con cuerpos de Call-Exner.
Figura 2.Tumor de la granulosa (HE, x400). Detalle del patrón microfolicular.
Figura 3.Tumor de la granulosa (HE, x400). Patrón difuso de células con hendiduras longitudinales (en grano de café).
El estradiol, la inhibina y la sustancia mulleriana inhibidora (MSI) se proponen como marcadores tumorales para el seguimiento, en detrimento del CA 125 clásico3,5. El primero fue identificado como una de las primeras sustancias secretadas por el TCG y responsable de muchas de sus manifestaciones1,2. No obstante, un 30% de pacientes con TCG no presentan aumento en su secreción, relacionada con la falta de células de la teca en el tumor. La inhibina puede estar aumentada, aunque no específicamente, también en los carcinomas epiteliales y mucinosos. La MSI suele incrementarse incluso 12 meses antes de la recaída clínica o patológica4.
Entre los factores de mal pronóstico se han propuesto el estadio y el tamaño del tumor, su rotura, el índice mitótico y las anormalidades en el cariotipo5,6. Otros, como la invasión linfovascular, la edad, la paridad y el estado reproductivo no son reproducibles en los diferentes estudios.
La terapia estándar establecida es la cirugía. No está indicada la quimioterapia adyuvante en la mayoría de los casos; únicamente en los de mal pronóstico: estadios II, III y IV y estadio I con gran tamaño tumoral, alto índice mitótico o rotura tumoral. Sin embargo, por la rareza de este tumor, no hay na casuística suficiente para realizar ensayos aleatorizados que demuestren un beneficio en la supervivencia global. Parece intuirse, en casos retrospectivos, un beneficio en la supervivencia libre de enfermedad7. Tiene mucho mejor pronóstico que el tumor epitelial o mucinoso ováricos, aunque hay una tendencia a la recaída local que, detectada precozmente, puede rescatarse quirúrgicamente; la recaída sistémica no es común.
Ésta es una neoplasia potencialmente quimiosensible, en la que se observan respuestas a adriamicina, ciclofosfamida y derivados del platino7,8. Los regímenes con mayor respuesta son el PVB (cisplatino, vinblastina y bleomicina) y el BEP (bleomicina, etopósido y cisplatino), no así en los adenocarcinomas, cuyo esquema de elección es el paclitaxel-carboplatino. Se consiguen hasta un 65% de respuestas (parciales y completas)3. La radioterapia se utiliza para completar localmente un abordaje quirúrgico y con intención paliativa, en grandes masas no susceptibles de exéresis (como en el caso presentado) como tratamiento sintomático. Parece aumentar la supervivencia libre de recaída en las pacientes9. Puede observarse también cierta respuesta a maniobras hormonales, como el tamoxifeno y el acetato de megestrol10.
En conclusión, el TCG del adulto es un inusual tumor ovárico que produce síntomas derivados de la secreción de estradiol; con mucho mejor pronóstico, menor agresividad, mayores posibilidades de rescate quirúrgico en las recurrencias y una historia natural más prolongada. La cirugía constituye el principal abordaje diagnóstico, de estadificación y de disminución del volumen tumoral y terapéutico. La quimioterapia adyuvante sólo se recomienda en estadios precoces con factores de riesgo o en estadios avanzados, ya que parece disminuir la supervivencia libre de enfermedad y la superviviencia libre de recaída, al igual que la radioterapia. El rescate quirúrgico de las recurrencias debe plantearse siempre que sea posible, ya que la evolución tumoral es la recaída local más que a distancia.
Correspondencia:
Dra. M.E. Pérez López.
Servicio de Oncología Médica. Complejo Hospitalario de Ourense.
Ramón Puga, 52-54. 32005 Ourense. España.
Correo electrónico: mevaplo@hotmail.com
maria.eva.perez.lopez@sergas.es
Fecha de recepción: 18/1/2006.
Aceptado para su publicación: 25/4/2006.