Introducción
A mediados de los años ochenta varios grupos de investigación clínica y científica pudieron aislar y cultivar células de hueso humanas (osteoblastos) de una forma reproducible. Inicialmente los cultivos se utilizaban sólo para realizar pruebas de biocompatibilidad6,9,11,16,18 de materiales de sustitución ósea cerámicos y de superficies metálicas de implantes1,3,13,22,29. En la década de los noventa, coincidiendo con la aparición de la «ingeniería tisular», se intensificó la investigación centrada en la combinación de células óseas con soportes para la generación biotecnológica de tejido duro. El objetivo era obtener un método alternativo a los injertos de hueso autólogo2,5,12,14,26,28. Uno de los puntos clave de la investigación fue el estudio de la influencia de la micro y de la macroarquitectura de los soportes de las células4,17,34. Los resultados arrojados por la investigación establecieron un requisito indispensable: un cociente elevado entre superficie y volumen para favorecer la neoformación de vasos sanguíneos y garantizar la vascularización de los osteoblastos durante la fase de cultivo celular y especialmente después de colocar un injerto. Para conservar la función diferenciada de los osteoblastos es necesario que la distancia de difusión de O2 no supere los 200 a 300 micrómetros7,31,40. Por esa razón, es necesario que la arquitectura interior del soporte celular favorezca in vitro la entrada y la salida del medio de cultivo y la vascularización in vivo8,15,27.
En la cirugía oral y maxilofacial se puede ver una gama muy diversa clínicamente de defectos que requieren la restitución de tejido óseo. Dicha gama abarca desde los defectos óseos a que da lugar la extracción de un diente o la quistectomía hasta las grandes pérdidas de hueso como consecuencia de un traumatismo o un tumor. Estos defectos, que se suelen rellenar con hueso esponjoso autólogo o con partículas de hueso molido, constituyen un campo de aplicación óptimo para los injertos creados mediante la «ingeniería tisular». Los defectos en los que existe una afectación biomecánica menor resultan idóneos desde un punto de vista clínico para soportes celulares muy porosos, que presentan una resistencia mecánica muy escasa10,20. Actualmente, en Europa se combinan materiales biorreabsorbibles autorizados (con marcado CE), como son distintos tipos de mallas de colágeno o Vicryl, con osteoblastos autólogos cultivados y se someten a estudios clínicos para determinar su eficacia en la regeneración ósea en defectos secundarios a la extirpación de un quiste o a la extracción de un diente. En algunos casos se cubrieron las paredes de la cavidad quística con una esponja de colágeno que fue colonizada simultáneamente con osteoblastos autólogos, lo que proporcionó una mayor velocidad de osificación que la utilización de esponja de colágeno sin osteoblastos11,21,35,36.
El primer injerto óseo cultivado en un laboratorio autorizado en Europa como producto médico (BioSeed-Oral Bone, BioTissue Technologies, Friburgo) se compone de células osteoblásticas autólogas cultivadas procedentes del periostio del maxilar, de un adhesivo de fibrina y de Ethisorb (Ethicon, Hamburgo), un polímero de fibras no entrelazadas de ácido poliláctico y ácido poliglicólido que actúa como andamiaje. De acuerdo con los primeros resultados clínicos, este injerto óseo se puede utilizar para mejorar las condiciones del lecho del implante25,33,39. El desarrollo de la tecnología de cultivo tridimensional del injerto de hueso fue impulsado por el Priv.-Doz. Dr. M. Sittinger y su grupo de trabajo, del hospital Charité de Berlín, y por el Prof. Dr. Dr. R. Schmelzeisen, del Hospital Universitario de Friburgo, que en el año 2001 utilizó estos autoinjertos de hueso por primera vez en todo el mundo18,30,36,37.
Material y métodos
BioSeed-Oral Bone se utiliza tanto para aumentar de forma absoluta el volumen de hueso maxilar disponible (elevación sinusal) como para reconstruir el hueso después de una inflamación periimplantaria. En las instrucciones de uso del fabricante se pueden consultar los detalles del material. En principio, en el momento del trasplante del injerto no debería existir ningún proceso inflamatorio activo. Con los pacientes que sufren sinusitis parece no haber ningún problema, puesto que la membrana de Schneider suele ser muy estable. Schmelzeisen recomienda recubrir las perforaciones de la mucosa del seno maxilar con una lámina de colágeno equino18,36,37. A continuación, se puede proceder con la intervención sin ningún problema. Al igual que con los métodos alternativos, el hábito tabáquico severo puede llevar a obtener peores resultados terapéuticos. No obstante, ésta es una impresión subjetiva que todavía no ha sido demostrada por medio de un número elevado de casos y de estudios comparativos32,36,37.
Para que el tratamiento con BioSeed-Oral Bone tenga éxito es imprescindible que exista una cantidad suficiente de hueso disponible. La posibilidad de realizar una elevación sinusal en un tiempo puede servir de referencia. Si se pueden anclar implantes con una buena estabilidad primaria, quedará establecida la indicación para el tratamiento. En tal caso es indiferente si el clínico se decide por un procedimiento en uno o en dos tiempos. La altura del hueso remanente será de importancia en tanto en cuanto la vascularización del material de aumento proceda de dicho hueso remanente. Es imprescindible garantizar una nutrición suficiente de las células vivas contenidas en BioSeed-Oral Bone. Por esa razón, la altura máxima del aumento en la elevación sinusal no debería ser superior a 1 cm30,35,38. En la mayoría de los casos se pueden colocar implantes y lograr una buena estabilidad primaria si el hueso remanente dispone de una altura de entre 4 y 7 mm. No obstante, también en dichos casos es recomendable aumentar el volumen de hueso por medio de BioSeed-Oral Bone, dado que de ese modo se incrementa notablemente la estabilidad a largo plazo. Las partículas de hueso se pueden embeber en sangre procedente del defecto o en sangre venosa del paciente antes de colocarlas en el seno maxilar. De esta forma, se sustituye la sangre pobre en nutrientes19,30,31.
La extracción de sangre se puede realizar directamente en la consulta dental, lo que le ahorraría al paciente la molestia de acudir a un centro de transfusiones. Para la extracción no es necesario que el paciente acuda en ayunas, pero sí es conveniente que los alimentos ingeridos en las 12 h anteriores sean bajos en grasas y ricos en hidratos de carbono. Después de una fase de coagulación de unos 20 min a temperatura ambiente (18 a 22 ºC), los tubos con la sangre deben conservarse en el frigorífico (entre 4 y 8 ºC) hasta el momento del envío. La sangre extraída y el periostio se envían a Friburgo, Alemania, para su procesamiento posterior. Allí se llevan a cabo de forma centralizada la fabricación del suero y los análisis serológicos necesarios para determinar la presencia del VIH y de las hepatitis B y C en cumplimiento de las normas de seguridad pertinentes30,36,37. Para obtener una cantidad suficiente de células del cambium necesarias se extrae mediante biopsia un fragmento de periostio de 1 cm2 aproximadamente de la región del ángulo mandibular derecho o izquierdo (región de los dientes 6/7/8).
En principio se puede obtener el tejido de otras zonas donantes, como el mentón, pero se recomienda recurrir a ellas sólo en casos excepcionales.
La extracción de periostio en la zona de inserción de los músculos masticatorios debe evitarse por principio. La operación consiste en exponer el periostio, perfilar la porción a extraer con un bisturí y desprenderla del hueso utilizando un raspador afilado y ejerciendo presión. También se pueden utilizar virutas óseas de menor tamaño en la consulta para controlar el éxito de la biopsia. Éstas garantizan la obtención, junto con el periostio, de la capa del cambium que yace directamente sobre el hueso. Teóricamente es posible realizar una biopsia ósea alternativa para obtener células osteogénicas, aunque resultaría mucho menos eficaz. Además, un procedimiento de ese tipo no está validado por el procedimiento de fabricación en un laboratorio GMP30,36,37 (Good Manufacturing Practice).
Como material de partida para la fabricación de Bio-Seed-Oral Bone se utiliza un fragmento de periostio de aproximadamente 1 cm2 obtenido mediante biopsia, que se envía por mensajería a la empresa BioTissue Technologies de Friburgo, Alemania, junto con sangre total del propio paciente. En dicho centro se aíslan las células del cambium y se favorece su proliferación durante una fase de expansión de unas cuatro semanas y media hasta que se obtiene la cantidad de células necesaria. La diferenciación en células osteogénicas y la formación de la matriz se consiguen por medio de un cultivo tridimensional que se prolonga unas dos semanas y media. Para ello se incorpora cada vez una media de 1,5 millones de células en un soporte biodegradable de fibras Vicryl no entrelazadas. Para garantizar la distribución uniforme y la fijación de las células se agrega un adhesivo de fibrina. Durante todo el proceso de fabricación se suministra el medio nutritivo de las células, que, entre otros, contiene el suero autólogo. La calidad y la cantidad de las células se someten a controles continuos. La vitalidad de las células formadoras de matriz en el complejo tridimensional se determina, entre otros, por su consumo de glucosa. El hueso BioSeed-Oral Bone calcificado está disponible a las siete semanas y media y, una vez terminado, se conserva durante 48 h. Dado que se trata de un producto biológico, la duración exacta del cultivo se ve influenciada por distintos aspectos, como el tamaño y la calidad del periostio obtenido mediante biopsia. El momento idóneo para realizar el injerto se suele acordar unas dos semanas después de la recepción del periostio entre el médico responsable del tratamiento y el departamento de atención al cliente de BioTissue Technologies30,36,37.
Caso clínico
Anamnesis y plan de tratamiento
Una paciente de 60 años de edad acudió a nuestro centro para solicitar un tratamiento con implantes. Presentaba una situación de extremo libre bilateral (clase IIa en el maxilar y relación de clase I de Angle) con una distancia vertical algo disminuida de -2 mm. Los márgenes coronarios de los dientes ferulizados 13 a 23 estaban expuestos 3 mm, por lo que era necesaria una renovación. Las coronas de los dientes 45, 46 y 47 también eran deficientes; presentaban un área cervical expuesta de 3 mm y era preciso sustituirlas. A excepción del diente 36, que había sido tratado con una endodoncia y una reconstrucción del muñón, todos los dientes eran vitales. La atrofia vertical de la apófisis alveolar en las regiones del 14 al 17 y del 24 al 27 hacía suponer que el hueso vertical disponible iba a ser insuficiente para colocar los implantes con la técnica convencional. En el plano horizontal, el grado de atrofia era reducido. Por lo que respecta a los tejidos blandos, existía una pérdida de 2 mm de encía insertada. No obstante, seguía existiendo una distancia suficiente entre el límite mucogingival y la posición prevista del implante. Este «excedente de encía» se correlacionaba con la atrofia ósea. Al inicio, la higiene oral de la paciente era regular, pero durante el tratamiento pasó a ser muy buena gracias a la instrucción recibida y al aumento de la motivación. La exploración periodontal arrojó la presencia de bolsas sin inflamación de entre 4 y 6 mm; sólo el diente 47 presentaba una movilidad de grado II.
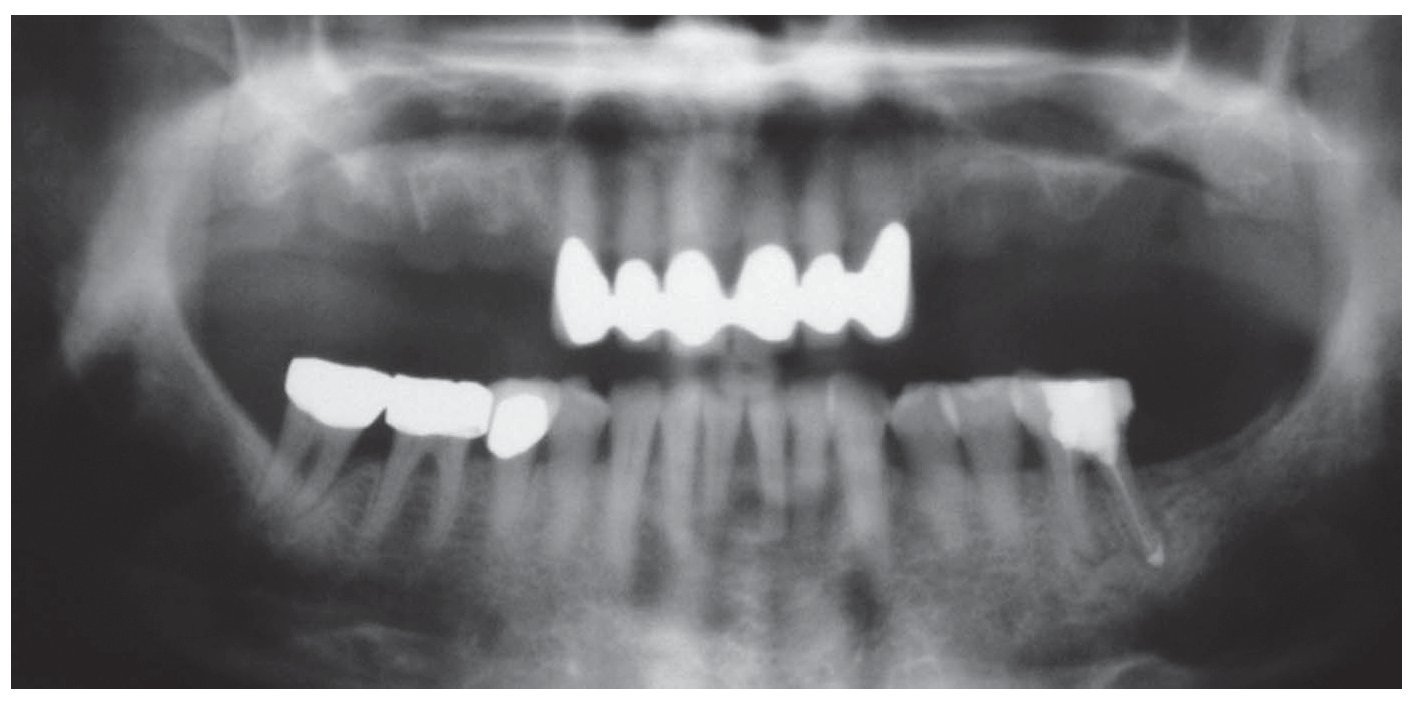
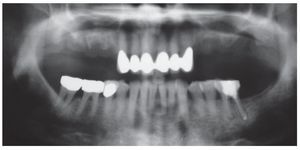
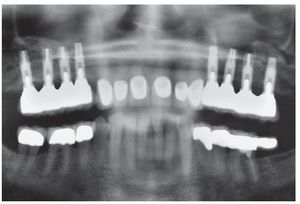
En la ortopantomografía se apreciaba una escasa disponibilidad de hueso en sentido vertical en la región de los dientes 14 a 17 y 24 a 27 (fig. 1). Todavía se apreciaban algunos de los alvéolos de extracción. La exploración arrojó así mismo una sobreobturación del conducto radicular distal del diente 36 y una osteólisis leve en el conducto mesial, que presentaba una obturación incompleta. En el diente 46 se apreciaba una radiolucidez interradicular y el diente 47 presentaba una bolsa periodontal mesial.
Figura 1. En la ortopantomografía inicial se aprecia una situación de extremo libre bilateral en el maxilar (clase IIa) después de la extracción de los dientes 14 a 17 y 24 a 27 realizada ocho semanas antes. Así mismo, se observa una sobreobturación del conducto distal del diente 36 y una osteólisis incipiente en la raíz mesial con una obturación incompleta, un área radiolúcida interradicular en el diente 46 y una bolsa periodontal mesial en el diente 47. Reabsorción de hueso generalizada en todos los dientes debido a una periodontitis marginal profunda.
Durante las sesiones informativas se explicaron a la paciente el diagnóstico y las diferentes opciones de tratamiento. En su caso quedaba descartada una prótesis de base colada convencional, dado que los dientes remanentes tenían el periodonto dañado y las prótesis removibles retenidas por ganchos están contraindicadas en presencia de periodontitis. Habría sido posible realizar una rehabilitación con coronas telescópicas incluyendo la dentición remanente, pero fue rechazada por la paciente, que se mostró firme en su deseo de recibir una prótesis fija. Por consiguiente, se explicó a la paciente en qué consistía el procedimiento de elevación sinusal en uno y en dos pasos, dado que la recuperación de tejido óseo en sentido vertical era indispensable para la rehabilitación. Se debe distinguir entre el procedimiento en dos tiempos, con una primera sesión en la que se incrementa la disponibilidad de hueso con un autoinjerto y una segunda, a los tres meses, en la que se realiza la implantación, y el procedimiento en un solo tiempo, que concentra el aumento de hueso y la implantación en una sesión.
Los requisitos esenciales para que se produzca una buena osteointegración de los implantes son la presencia de una altura mínima de hueso de 4 mm, un posicionamiento estable de los implantes en el hueso y la ausencia de carga durante la fase de cicatrización. Estos requisitos imponen determinadas exigencias tanto a los implantes como al procedimiento: en relación con el tipo de implante, ofrecen mayores ventajas aquellos que permiten una integración sumergida, dado que este método permite garantizar mejor la ausencia de carga funcional durante la fase de cicatrización. Por otro lado, los implantes roscados pueden ofrecer mayores garantías de estabilidad posicional que los implantes cilíndricos incluso en situaciones en las que el hueso disponible es muy escaso. En relación con el procedimiento se debe distinguir, de nuevo, entre dos grupos: si el hueso remanente dispone de una altura superior a 4 mm, suele ser posible colocar el implante de forma estable incluso en hueso maxilar blando.
En el presente caso la cantidad de hueso disponible era muy reducida. Dado que el hueso remanente tenía una altura que rondaba los 4 mm, era necesario realizar una elevación sinusal con un injerto óseo. Para la paciente la obtención de hueso esponjoso de la cresta ilíaca no era una opción viable dadas las consecuencias habituales asociadas a este método, como la aparición de dolor y la limitación de movilidad. Además, la paciente tenía fobia a una intervención en la cadera para la obtención de hueso. Dada la disponibilidad de tiempo y la posibilidad de realizar la intervención en un solo paso, la paciente se decidió por una elevación sinusal con implantación simultánea de cuatro implantes en sendos cuadrantes, en las regiones del 14 al 17 y del 24 al 27. Para garantizar la estabilidad de la rehabilitación implantosoportada se planificó la colocación de un injerto con BioSeed-Oral Bone. Así mismo, el tratamiento incluyó la restauración de los dientes 13 a 23 con coronas unitarias Cercon (DeguDent, Hanau) con el fin de mejorar la estética del sector anterior y de conseguir una adaptación marginal óptima. Dado que la paciente no deseaba bajo ningún concepto llevar una prótesis removible durante la fase de integración, de entre 9 y 12 meses, fue necesario insertar implantes provisionales (IPI, Immediate Provisional Implant System, Nobel Biocare, Colonia, Alemania) en las regiones de los dientes 15, 16, 17 y 25, y 26 a 27, sobre los que se colocó un provisional de larga duración. Gracias a dicha prótesis provisional la paciente no sufrió ningún tipo de limitaciones ni en la esfera privada ni en el entorno profesional.
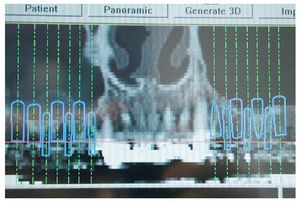
Los riesgos de la intervención se mantienen dentro de un margen aceptable si se deja en manos de un especialista. Las complicaciones a mencionar en el momento de explicar los riesgos a la paciente, como la pérdida total de injerto e implante, poco probable en el procedimiento en dos tiempos, deben ponderarse junto con las ventajas que supone un menor tiempo de espera hasta recibir la prótesis y la ausencia de una segunda intervención quirúrgica. El procedimiento en un solo tiempo (elevación sinusal e implantación simultáneas) ha demostrado ser eficaz cuando se tienen en cuenta aspectos como la correcta elección del paciente, una planificación precisa con el sistema Denta-CT, el uso de un sistema de navegación y la facilitación de toda la información al paciente. También en el seguimiento a largo plazo este método muestra un éxito convincente en la literatura, de modo que en muchos casos supone una solución al problema de la escasez de hueso disponible.
Fases del tratamiento
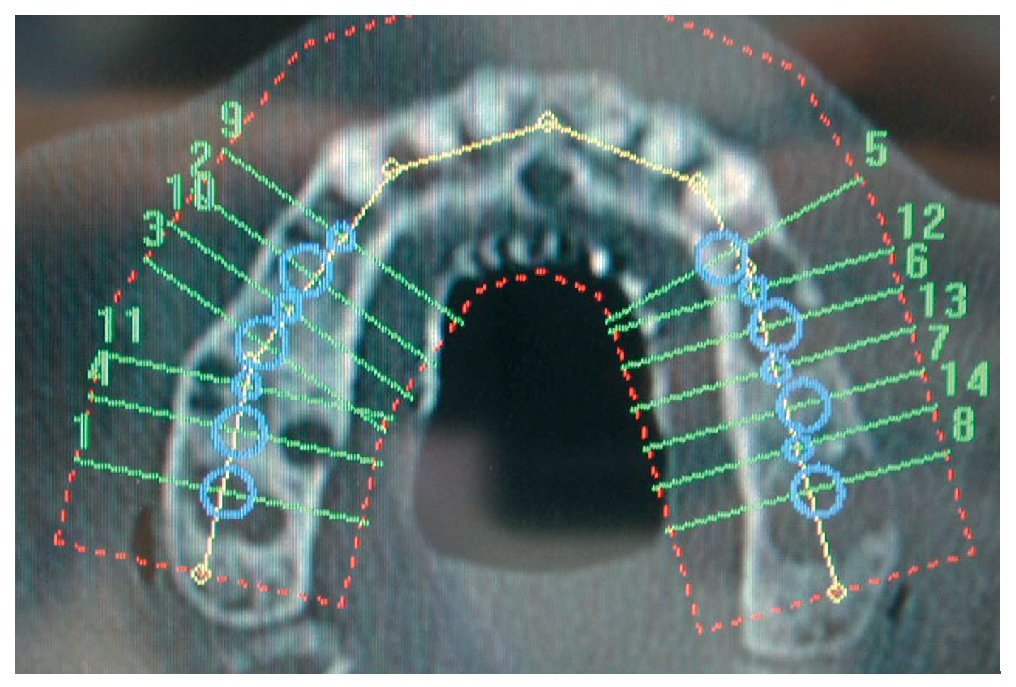
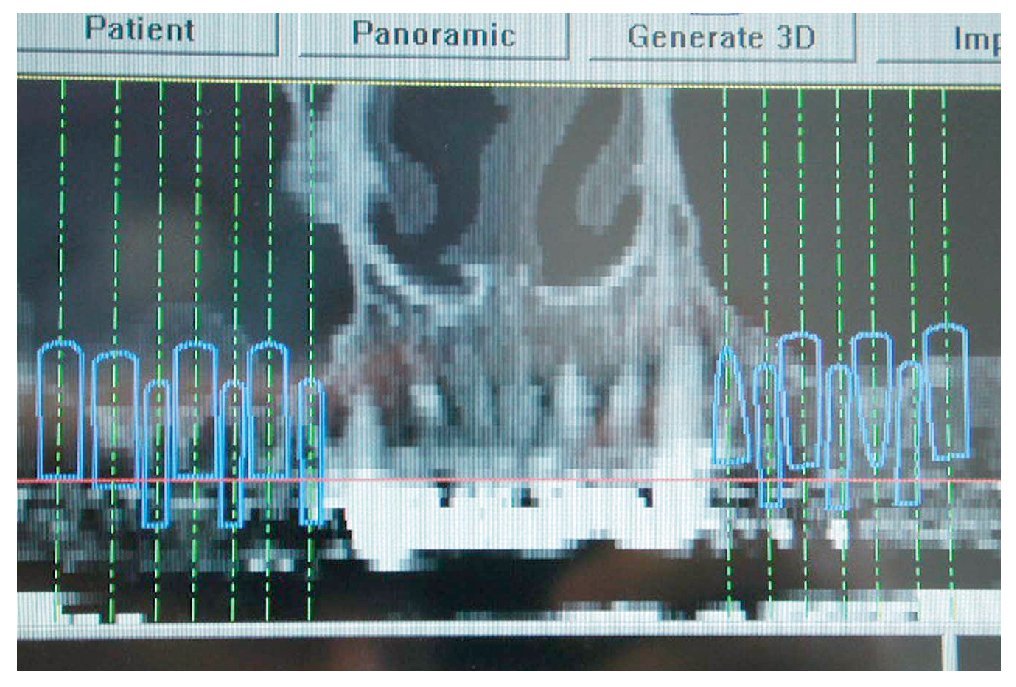
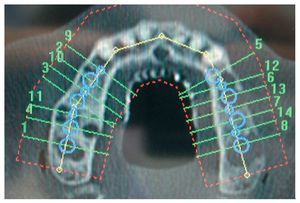
En primer lugar, se realizó una simulación del posible resultado del tratamiento después de confeccionar un encerado y una férula para TC utilizando un sistema de navegación. Esto permitió realizar una evaluación prospectiva del resultado antes del inicio del tratamiento («backward planning»). Este método de tratamiento, denominado «top-down-treatment», se aplica principalmente cuando se adoptan medidas de aumento quirúrgicas preimplantarias con el fin de reconstruir una cantidad suficiente de estructura ósea que permita la integración de los implantes en la posición idónea desde un punto de vista protésico. Las posiciones de los implantes necesarios se planificaron en un modelo 3D (figs. 2 y 3) y se transfirieron al campo quirúrgico mediante una férula de navegación a escala 1:1. Los cortes transversales calculados en las zonas de los implantes permitieron realizar una planificación exacta de las medidas de aumento necesarias. Para el cultivo de las células autógenas se obtuvo en primer lugar un fragmento de periostio de 1 cm2 del ángulo mandibular derecho mediante biopsia. Para ello se realizó una incisión en la mucosa, se perfiló la porción a extraer con un bisturí y se desprendió el periostio del hueso utilizando un raspador afilado. Mediante este procedimiento se obtienen junto con el periostio las células del cambium que yacen directamente sobre el hueso. Para el cultivo de las células se le realizó a la paciente una extracción de sangre total. El volumen de sangre dependerá de la cantidad de partículas o «chips» de hueso necesarias. En este caso el número de partículas de hueso a cultivar era de 40 (20 por cuadrante).
Figura 2. Posicionamiento y orientación virtual de los implantes y de los implantes provisionales utilizando el programa de planificación RoboDent (RoboDent, Berlín), vista oclusal.
Figura 3. Situación y orientación de los implantes y de los implantes provisionales en el maxilar.
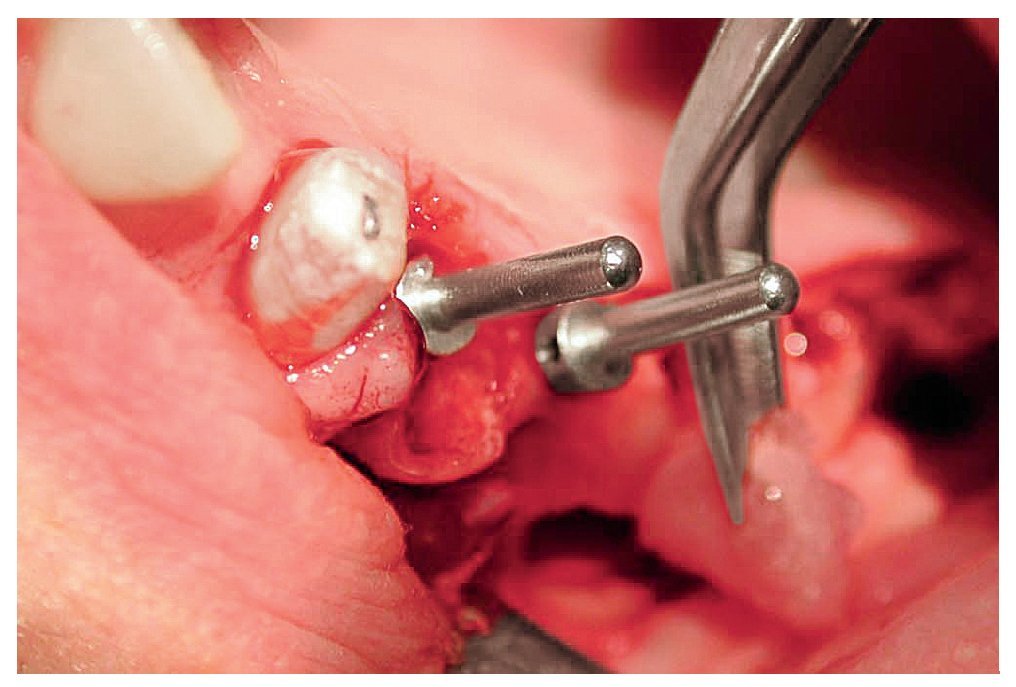
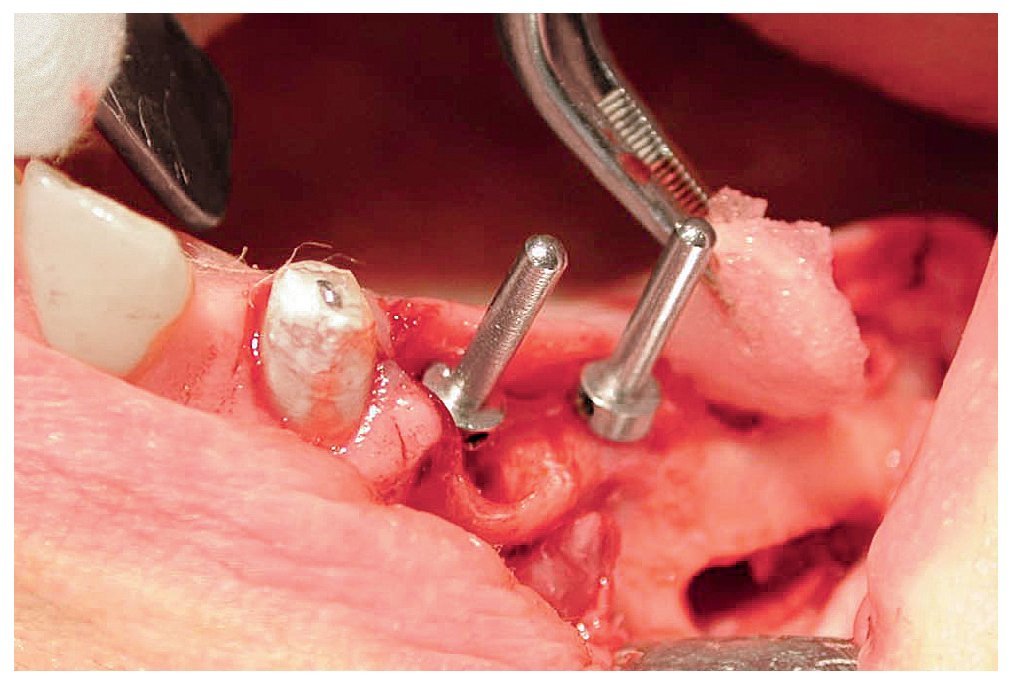
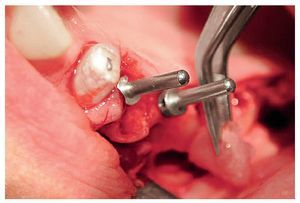
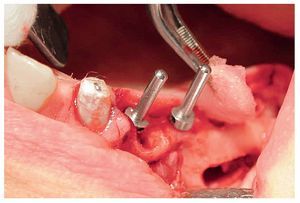
A las ocho semanas, el hueso cultivado estaba listo para ser injertado. Después de practicar una incisión crestal con descargas en distal de los dientes 23 y 13 y sobre la tuberosidad maxilar, se expuso el hueso maxilar en ambos lados en las regiones de los dientes 14 a 17 y 24 a 27 sucesivamente. Después de desplazar el colgajo mucoperióstico se creó una tapa ósea con una fresa redonda diamantada. A continuación, se levantaron hacia craneal la tapa ósea y la mucosa. Para la colocación de las partículas de hueso (figs. 4 y 5) en las cavidades preparadas de los senos maxilares se utilizó una pinza anatómica. Seguidamente, se procedió a la colocación guiada por navegación de cuatro implantes (Osseotite, 3i Implant Innovations Deutschland, Karlsruhe, longitud: 13 mm, diámetro: 3,75 mm) y de tres implantes provisionales (IPI, longitud: 14 mm, diámetro: 1,2 mm) en cada cuadrante (figs. 6 y 7). A continuación, se colocaron las partículas de hueso en aposición alrededor de todo el perímetro de los implantes. Los implantes 25 a 27 y 16 y 17 se fijaron con una placa de osteosíntesis tipo SIS (Mondeal Medical Systems, Tuttlingen) y cuatro tornillos de 12 mm de longitud según el modelo de Göttingen (satélite) a fin de asegurar una estabilidad primaria adicional y una buena integración de los implantes.
Figura 4. Contenedor y medio de transporte (líquido rojo y partículas de hueso sumergidas en él).
Figura 5. Partículas osteogénicas vitales preparadas para realizar el aumento de volumen óseo.
Figura 6. Creación de la ventana sinusal, preparación y movilización de la membrana de Schneider y colocación de las partículas de hueso.
Figura 7. Implantación simultánea en la porción aumentada.
Después de comprobar la estabilidad primaria de los implantes se suturó la herida con una sutura discontinua. Las partículas de hueso colocadas deben encontrarse completamente cubiertas de mucosa. Por último, se cementó el puente provisional de resina con un cemento provisional de acrílico sin eugenol (ImProv, Nobel Biocare) sobre los seis implantes provisionales IPI y los seis dientes anteriores (del 17 al 27). Pasados 10 días se retiró la sutura y se realizó un control radiográfico. La fase de integración transcurrió sin complicaciones y la paciente se mostró muy satisfecha con la prótesis provisional inmediata (fig. 8).
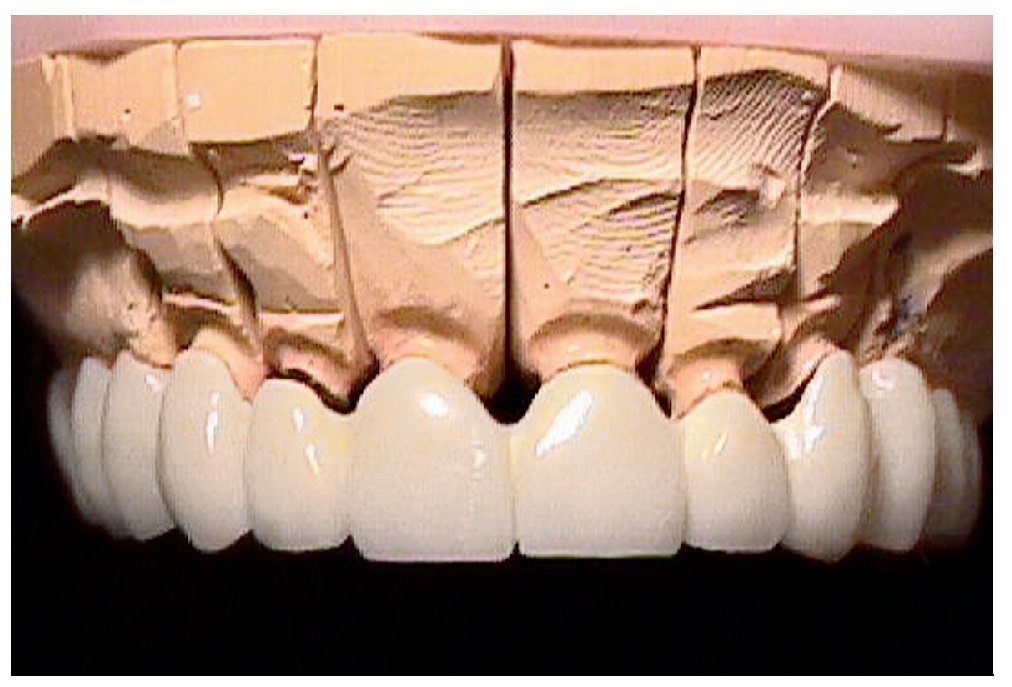
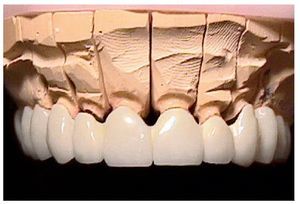
Figura 8. Vista frontal del provisional de larga duración sobre el modelo maestro.
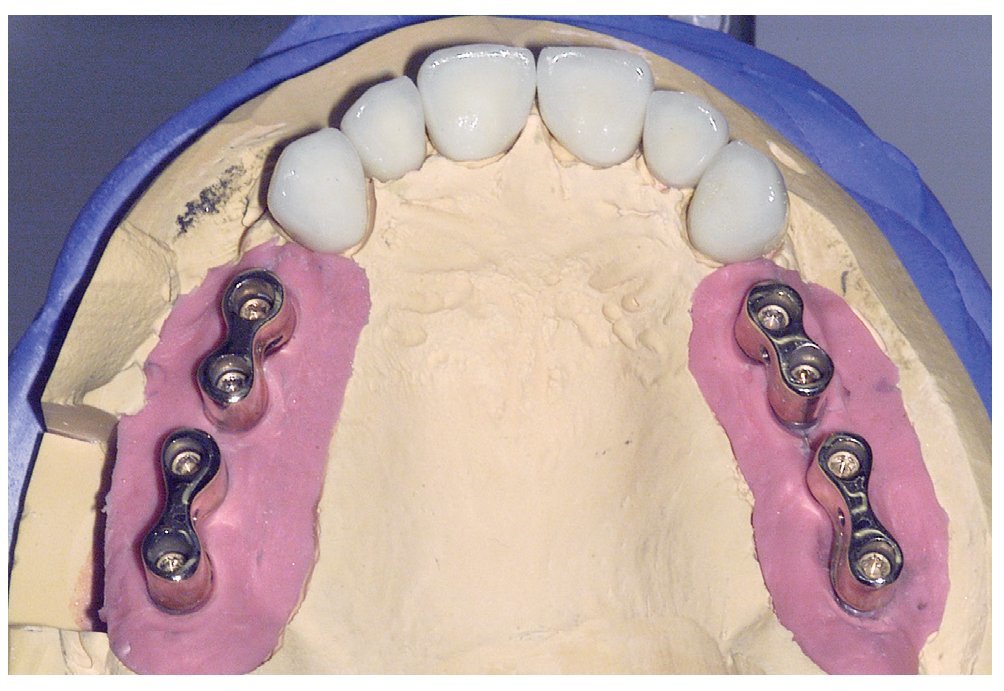
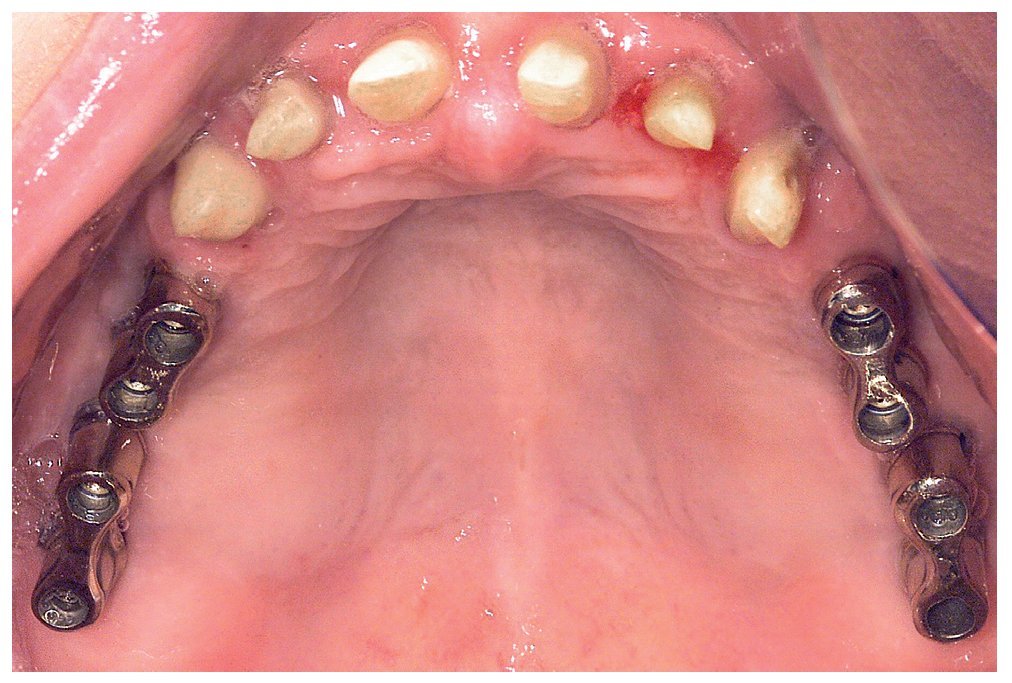
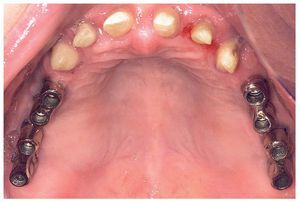
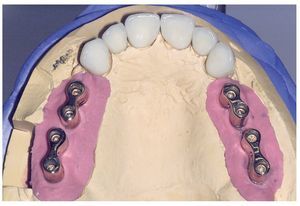
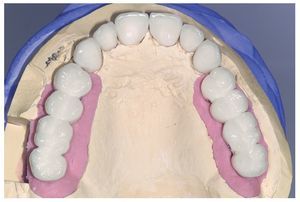
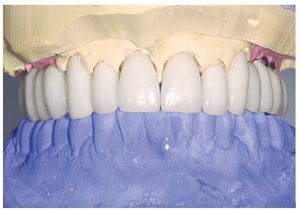
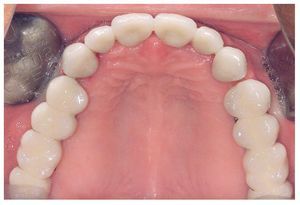
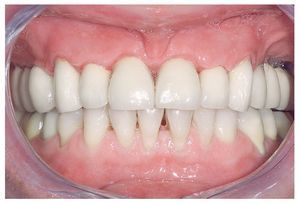
A los ocho meses, una vez concluida la fase de integración, se procedió a la exposición de los implantes y a la retirada de las placas SIS y de los implantes IPI. En primer lugar, se atornillaron pilares de cicatrización (longitud: 2 mm, diámetro: 4 mm) en los implantes integrados con estabilidad primaria. Después de una fase de regeneración del tejido blando de dos semanas de duración, se realizó la toma de impresiones de los implantes y se tallaron los dientes 13 a 23 con un hombro de 1,5 mm para la colocación de coronas cerámicas sin metal Cercon. Con una cubeta individual se realizó la toma de impresiones de los muñones dentarios 13 a 23 (fig. 9) y de los implantes 14 a 17 y 24 a 27 con un poliéter (Impregum, 3M Espe, Seefeld) utilizando la técnica de cubeta abierta. Acto seguido se confeccionaron sobre el modelo maestro (figs. 10 a 12) puentes telescópicos removibles con atornillado palatino secundario y seis coronas unitarias cerámicas sin metal Cercon en el sector anterior. En las dos sesiones de tratamiento siguientes se realizó una prueba de la subestructura y una prueba de bizcocho antes de proceder a la colocación definitiva de las restauraciones (figs. 13 a 15). Los pilares se atornillaron con un torque de 35 N/cm2 de acuerdo con las instrucciones del fabricante y las coronas cerámicas sin metal Cercon se cementaron con el cemento provisional Temp Bond (Kerr, Karlsruhe). En los controles posteriores (figs. 16 y 17) se pudo observar una mejora de la situación del tejido blando periimplantario.
Figura 9. Vista oclusal de las coronas primarias y de los dientes anteriores preparados con un hombro cervical de 2 mm in situ.
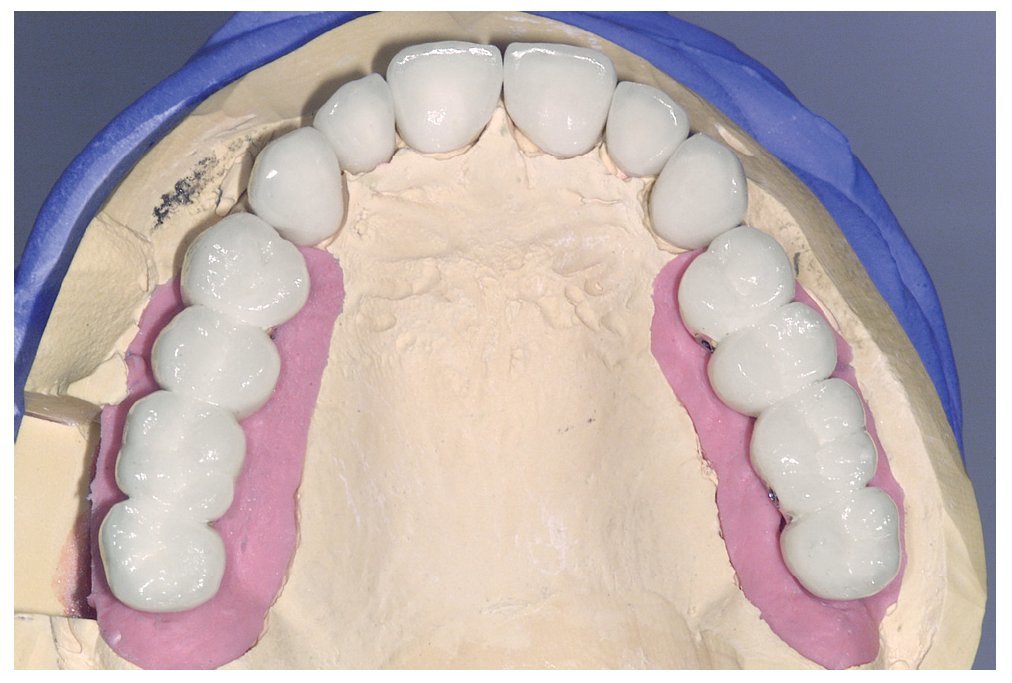
Figura 10. Vista oclusal de las coronas primarias y las coronas Cercon en el modelo maestro.
Figura 11. Vista oclusal de las coronas Cercon y los puentes telescópicos parcialmente removibles sobre el modelo maestro.
Figura 12. Vista frontal de las coronas Cercon y los puentes telescópicos parcialmente removibles sobre el mode-lo maestro después del registro.
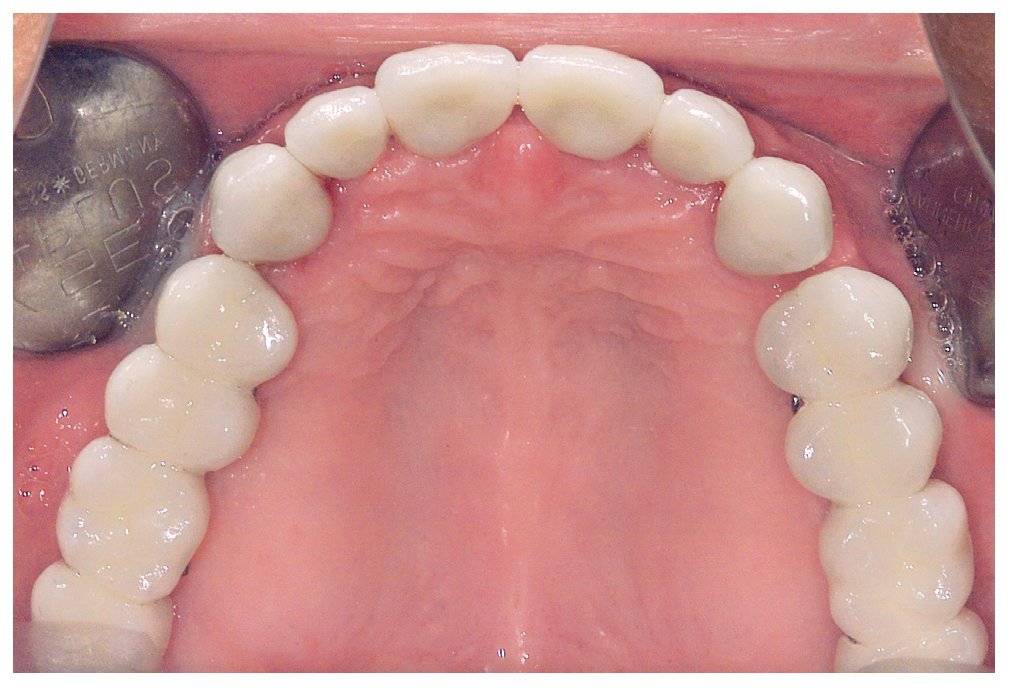
Figura 13. Vista oclusal de las coronas unitarias y los puentes cerámicos in situ.
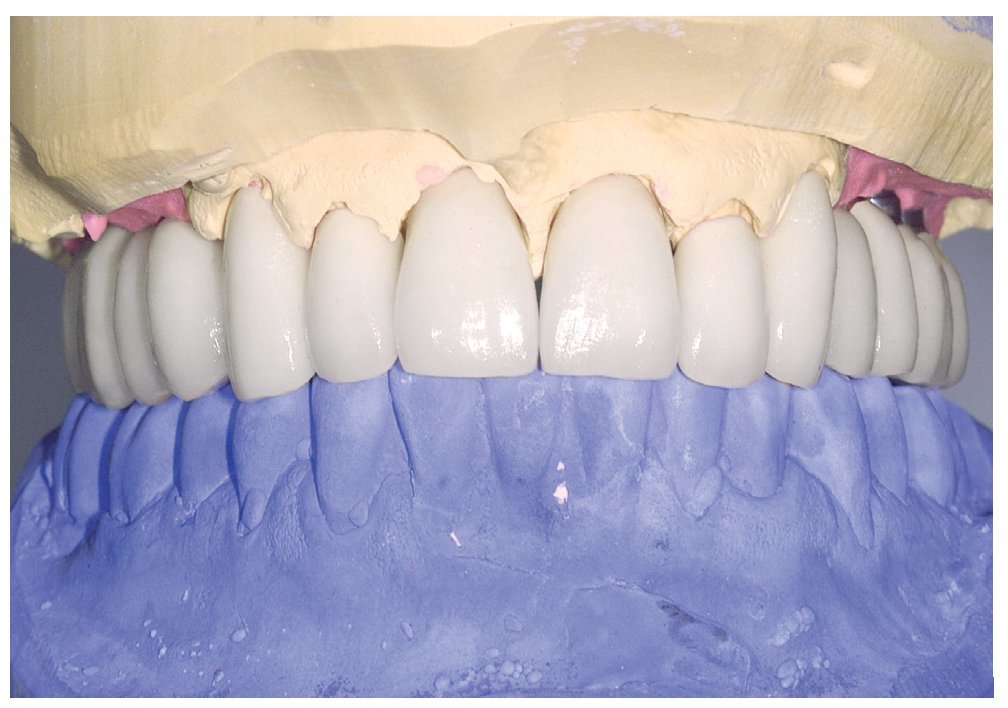
Figura 14. Vista frontal de las restauraciones terminadas in situ.
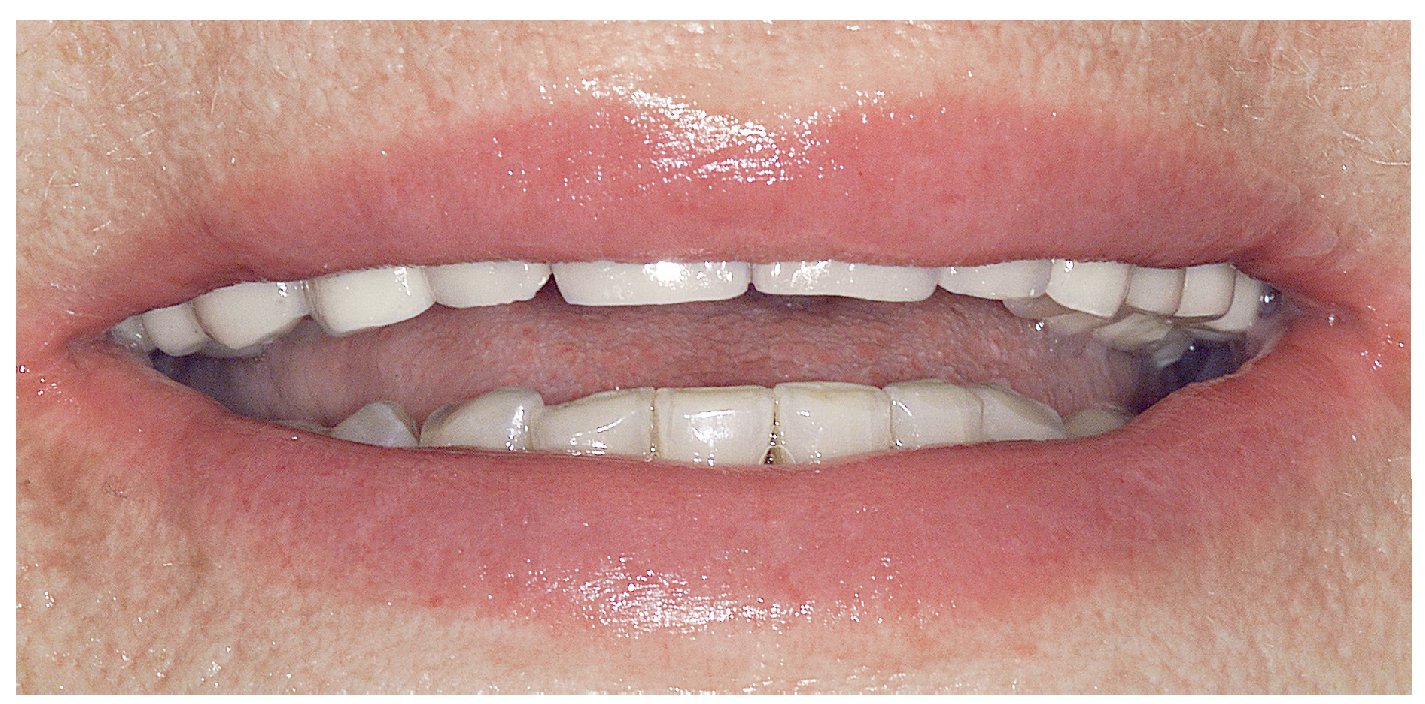
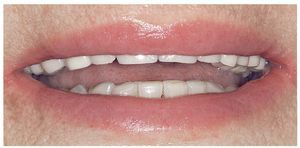
Figura 15. Restauraciones terminadas (imagen con labios).
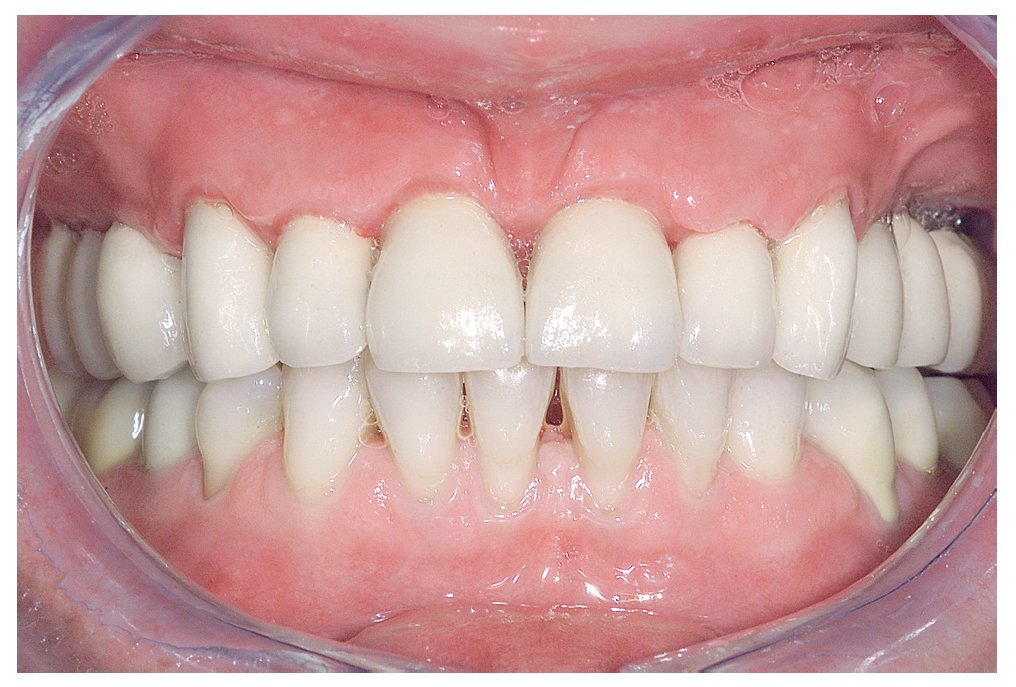
Figura 16. Restauraciones terminadas (imagen de frente).
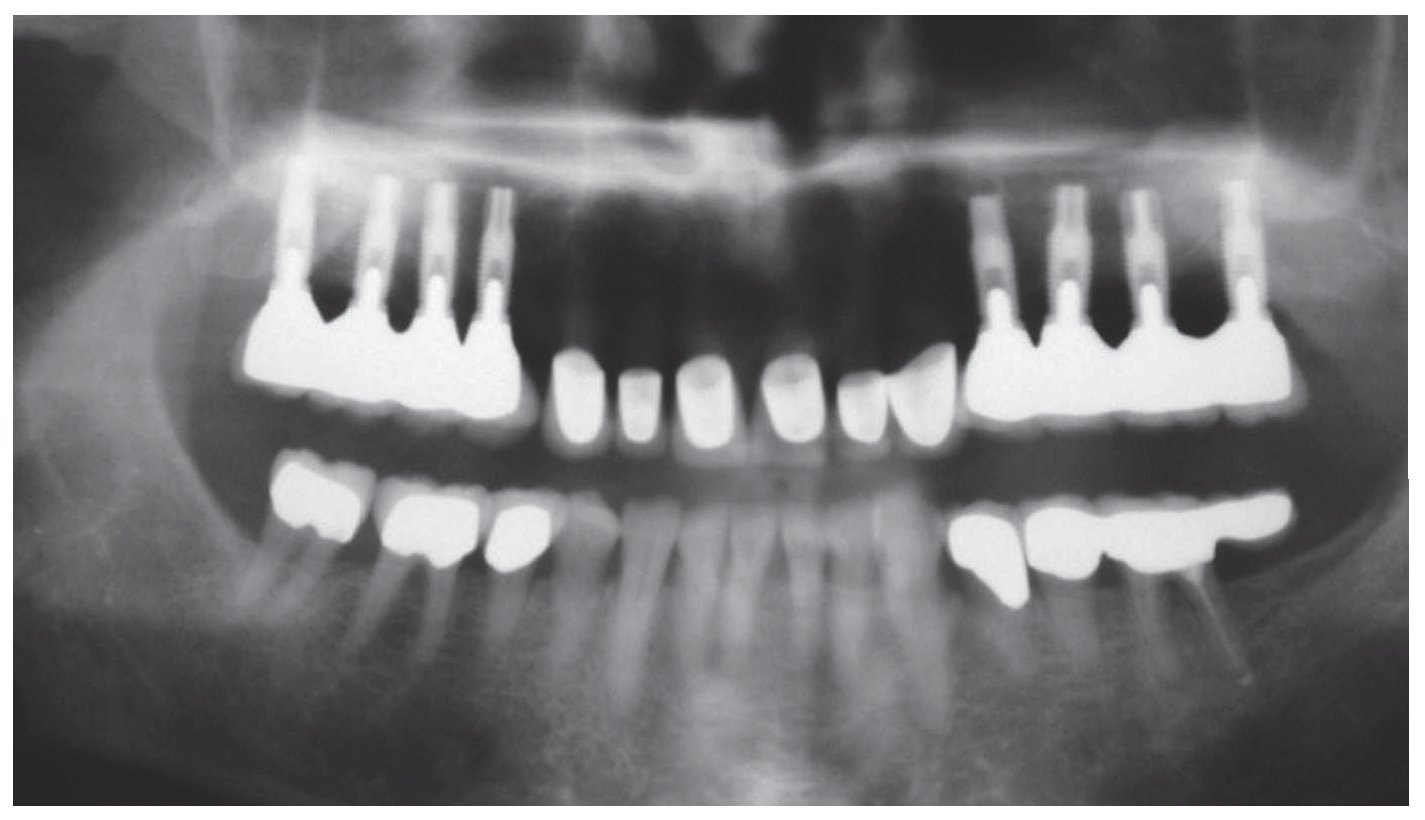
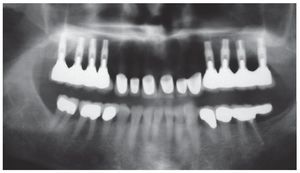
Figura 17. Control radiográfico mediante ortopantomografía después de la colocación de los puentes telescópicos y las coronas Cercon a los 8 meses. Aumento nítido de la radioopacidad, un indicio de que se ha producido la regeneración de hueso en la zona de la elevación sinusal con partículas de hueso. Dato adicional: mandíbula tratada con prótesis y tratamiento periodontal.
Resultado del tratamiento
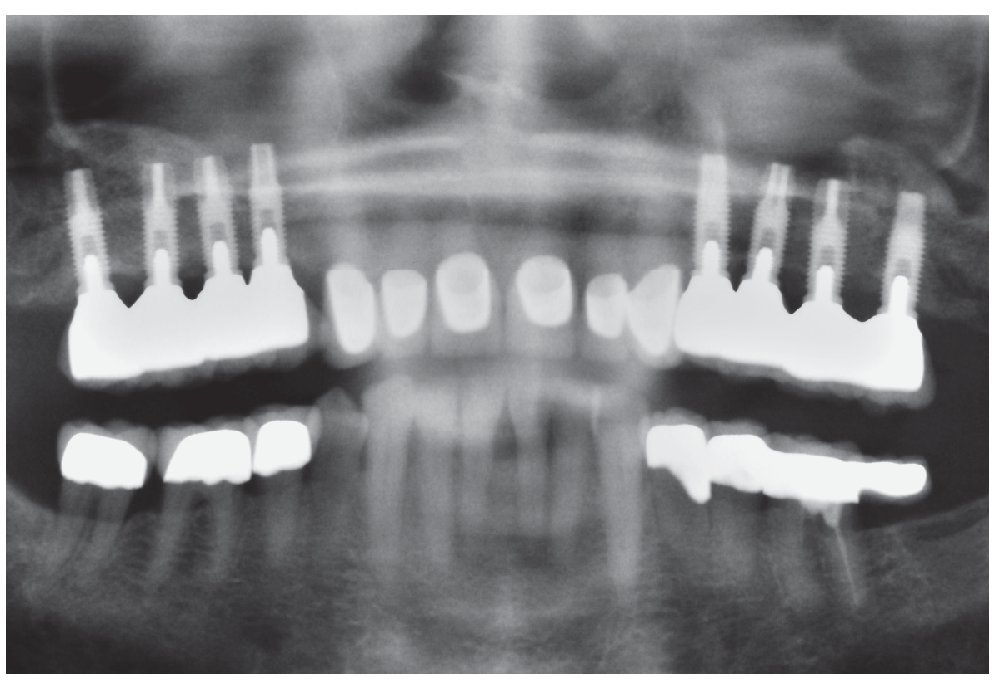
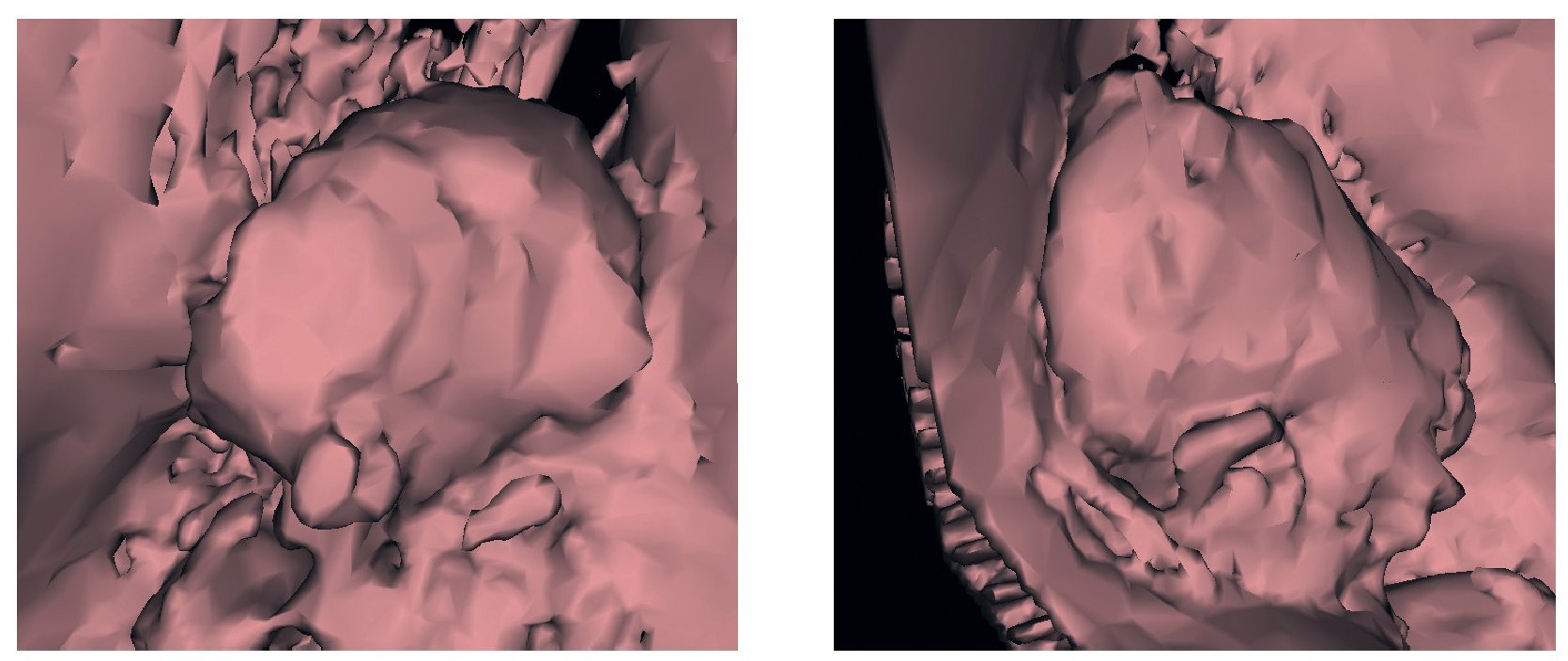
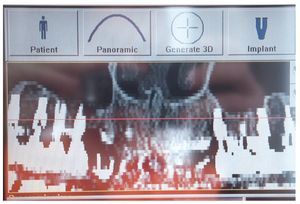
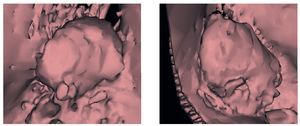
El examen clínico a los 6 meses de la colocación de las restauraciones mostró una situación periimplantaria estable. No se habían incrementado las profundidades de sondaje ni existía sangrado al sondaje. Se dio por finalizada la regeneración de las pseudopapilas. Se realizó el cementado definitivo de las coronas Cercon con cemento de vidrio ionómero (Ketac-cem, 3M Espe). La tomografía y la ortopantomografía realizadas a los 4 años muestran el crecimiento homólogo de hueso a partir de las partículas óseas, que se apoya completamente sobre la rosca del implante, y la ausencia de indicios de reabsorción (figs. 18 y 19). En las tomografías postoperatorias (figs. 20 y 21) se observa además hueso maduro estable en el seno maxilar en ambos lados.
Figura 18. Corte vertical con injerto BioSeed y seno maxilar sin signos inflamatorios a los 4 años del aumento de volumen óseo.
Figura 19. Ortopantomografía a los 4 años del aumento de volumen óseo (2007).
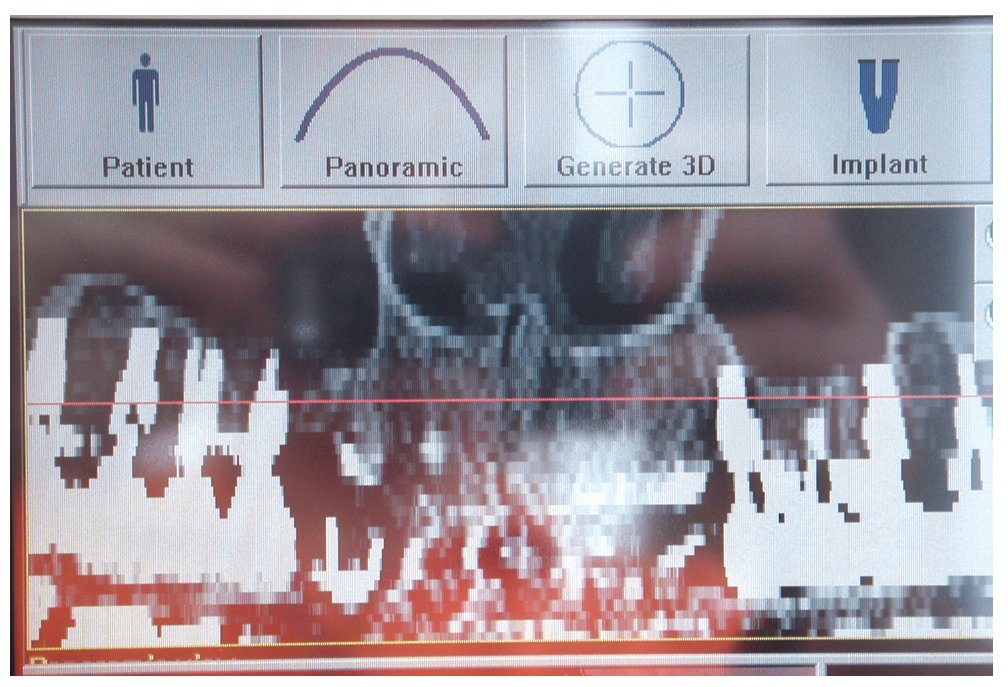
Figuras 20 y 21. Imagen en 3D del aumento de volumen óseo con BioSeed-Oral Bone.
Discusión
El método de tratamiento descrito demuestra que es posible rehabilitar el sector posterior mediante una prótesis fija en presencia de atrofia maxilar. La elevación sinusal constituye una intervención estandarizada que en los últimos diez años se ha consolidado como método habitual para incrementar la disponibilidad de hueso en el maxilar atrofiado antes de la inserción de implantes endoóseos para la rehabilitación protésica. Los procedimientos modernos de la biotecnología ofrecen además al paciente una alternativa a la regeneración de hueso utilizando hueso esponjoso de la cresta ilíaca. La generación de hueso osteoinductivo con ayuda de material osteocítico autógeno vivo a partir de las células del cambium es un método clínico establecido en nuestra consulta. Con un índice de supervivencia de los implantes endoóseos superior al 90% a los 10 años, esta intervención preprotésica puede ser considerada una firme alternativa a la prostodoncia convencional. Con ayuda de un estabilizador de implantes sinusal, también es posible realizar una elevación del seno maxilar en una sola fase en aquellos casos en los que la altura del hueso remanente es escasa. De ese modo se puede, por un lado, evitar una segunda intervención y, por el otro, conseguir un ahorro de tiempo de 3 meses. Esto hace que la elevación sinusal pase de ser una intervención notablemente traumática y de larga duración (dos fases) a una operación atraumática y rápida, lo que beneficia tanto al implantólogo como al paciente.
No obstante, la utilización del autoinjerto de células periósticas vivas como técnica de aumento subantral habitual requiere indefectiblemente la conservación a largo plazo de estas estructuras. Mediante el seguimiento realizado con el sistema Denta-CT se constató que las partículas de hueso autólogo garantizan la conservación de la estructura periimplantaria a los 2 y a los 4 años. Así, el cultivo de hueso constituye un método de reconstrucción eficaz para corregir el déficit óseo en el sector posterosuperior. Para el tratamiento de las arcadas acortadas en ambos lados se debe dar preferencia a la rehabilitación protésica implantosoportada frente a la prótesis periodontal convencional por muchas razones. Con dicho método los esfuerzos terapéuticos se centran en la conservación del tejido dental y óseo existente y en lograr que la prótesis fija sea lo más cómoda posible para el paciente. Teniendo en cuenta la cantidad y la calidad del hueso, una «restauración diente a diente» sería lo que más se aproximaría a una reconstrucción bucal completa.
Correspondencia: Ralf Luckey.
DIG - Centro de diagnóstico de implantología y estética facial. Richard-Wagner-Strasse 28, 30177 Hanóver, Alemania.
Correo electrónico: drlucki@t-online.de