Introducción
La pulpa dentaria es un tejido especial dado que, por un lado, no forma tejido duro de forma espontánea pero, por otro lado, tiene la capacidad de mineralizar progresivamente la dentina por procesos de envejecimiento o de generar dentina reparadora después de la exposición20. El objetivo principal de la aplicación de un material de recubrimiento es inducir la neoformación específica de tejido duro por las células pulpares y conservar de este modo la vitalidad de la pulpa51. La capacidad de formar dentina reparadora puede ser el resultado de un efecto biológico inductivo del material de recubrimiento sobre las células pulpares o formar parte del mecanismo de cicatrización de la pulpa lesionada. La cicatrización del tejido pulpar implica la activación de células, lo que conlleva, por un lado, la diferenciación de las mismas en odontoblastos y, por otro lado, la formación de un puente de tejido duro a nivel de la exposición pulpar51.
La eliminación de los factores irritantes, el control de la infección y la biocompatibilidad del material de recubrimiento son condiciones esenciales para el éxito del recubrimiento directo52. Kakehashi et al39 mostraron en un experimento clásico que, en ausencia de microorganismos, la pulpa posee la capacidad regeneradora de cerrar con tejido duro la zona de exposición sin medicamentos ni material de recubrimiento. La presencia o ausencia de microorganismos es el factor decisivo en la cicatrización del tejido pulpar expuesto. Es decir, este tejido posee la capacidad de cicatrizar después de una lesión, siempre que no exista contaminación bacteriana51.
En presencia de una pulpa sana probablemente se forme tejido duro nuevo bajo un gran número de materiales de recubrimiento distintos7. Por lo tanto, la cicatrización de la herida pulpar no se asocia a un medicamento o un apósito específicos8. Ahora bien, los medicamentos para el tratamiento de la pulpa expuesta deberían fomentar la capacidad natural de las células pulpares para la formación de tejido duro51. Un material de recubrimiento ideal debe ser capaz de proteger el tejido pulpar de infecciones y estimular al mismo tiempo la pulpa para la neoformación dentinaria con cierre de la zona de exposición.
En la bibliografía se encuentra una relación extensa de posibles materiales de recubrimiento42. A continuación, se describen más detalladamente algunos de los materiales de uso más frecuente en la consulta dental.
Suspensiones acuosas de hidróxido de calcio (figs. 1 y 2)
Figura 1. Producto comercial de hidróxido de calcio para el recubrimiento directo (Calxyl rot, OCO, Dirmstein).
Figura 2. Hidróxido de calcio en polvo para mezclar con agua para la preparación de suspensiones (hidróxido de calcio ≥ 96% en polvo, Carl Roth, Karlsruhe).
Utilizado en el recubrimiento directo, el hidróxido de calcio ha mostrado buenos resultados en numerosos estudios clínicos e histológicos, dado que es capaz de estimular la formación de dentina reparadora en contacto con tejido pulpar vital. Esto se ha confirmado en estudios de investigación básica y a través de documentación clínica, con una tasa de éxito del recubrimiento directo que puede llegar a ser superior al 80%8,54. El hidróxido de calcio y los preparados de hidróxido de calcio son actualmente los materiales mejor documentados y más seguros para el recubrimiento directo de la pulpa36. Por lo tanto, el hidróxido de calcio es el «patrón oro» con el que hay que comparar los materiales nuevos3,36.
El hidróxido de calcio [Ca(OH)2] es poco, pero suficientemente hidrosoluble, por lo que se disocia en un ión Ca2+ y en dos iones OH. Por lo tanto, una suspensión de hidróxido de calcio posee un pH de 12 a 13 in vitro54.
La gran ventaja del hidróxido de calcio es que apenas tiene efectos sistémicos importantes. El efecto químico de los iones hidroxilo es limitado, dado que es neutralizado rápidamente por el efecto tampón de los fluidos tisulares. Los iones de calcio se encuentran de forma natural en el organismo. A diferencia de otros materiales con acción antibacteriana, el hidróxido de calcio tampoco desencadena reacciones antígeno-anticuerpo55. En las pruebas de cultivo celular con células pulpares humanas, el hidróxido de calcio mostró ser atóxico a pesar del pH alcalino. El pH inicial alto no parece influir en la proliferación celular a largo plazo19.
En contacto con un tejido vital, como la pulpa, se desencadena una necrosis por coagulación que se debe a los grupos hidroxilo (OH) formados. De este modo, se detiene la hemorragia y la pérdida de líquidos tisulares. Debido a su alcalinidad, el hidróxido de calcio neutraliza el pH desplazado hacia la zona ácida en el tejido inflamado, por lo que tiene un efecto antiinflamatorio y bactericida. El tejido pulpar vital que está en contacto directo con el hidróxido de calcio se necrosa, pero la cicatrización se inicia ya al cabo de 24 h54.
En resumen, se puede afirmar que la aplicación de hidróxido de calcio sobre el tejido pulpar expuesto persigue:
El tamponamiento del medio ácido generado por bacterias de la caries en la zona tratada
La estimulación de las células pulpares parecidas a los odontoblastos para la neoformación de tejido duro (dentina reparadora)
La liberación de factores de crecimiento de la dentina
La desinfección del área tratada
La hemostasia en la zona de la pulpa expuesta como efecto complementario16.
Sin embargo, el uso de hidróxido de calcio tiene algunas desventajas:
El hidróxido de calcio se adhiere mal a la dentina
Se han observado signos de reabsorción y una falta de resistencia mecánica del material
El hidróxido de calcio no proporciona una protección a largo plazo frente a la pérdida de estanqueidad (microfiltraciones)
El tejido duro neoformado tiene porosidades. Se sospecha que estos «defectos tunelares» son la vía de entrada de microorganismos que pueden provocar una infección secundaria del tejido pulpar y, por lo tanto, son los responsables del fracaso de la conservación de la vitalidad pulpar de un diente
El elevado pH de 12,5 de las suspensiones de hidróxido de calcio provoca una necrosis coagulativa en la capa superficial del tejido pulpar15
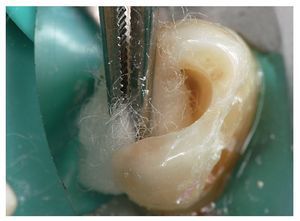
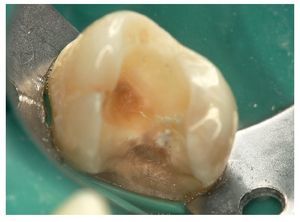
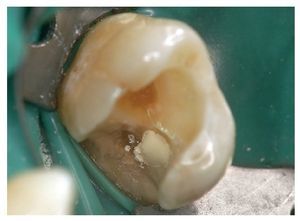
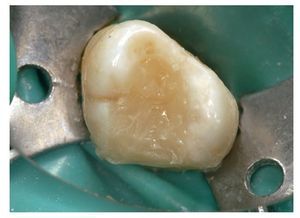
Las figuras 3 a 7 muestran el procedimiento clínico habitual para el recubrimiento directo con hidróxido de calcio.
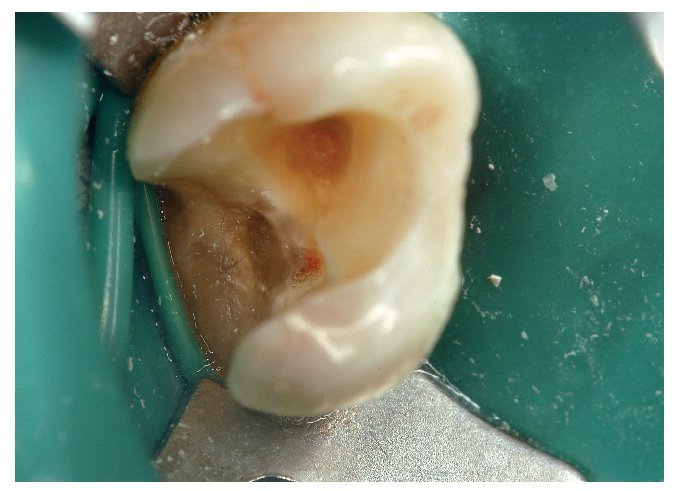
Figura 3. Exposición iatrogénica de la pulpa durante la remoción de una caries dentinaria. El tratamiento debe realizarse bajo aislamiento con dique de goma para prevenir la infección bacteriana del tejido pulpar.
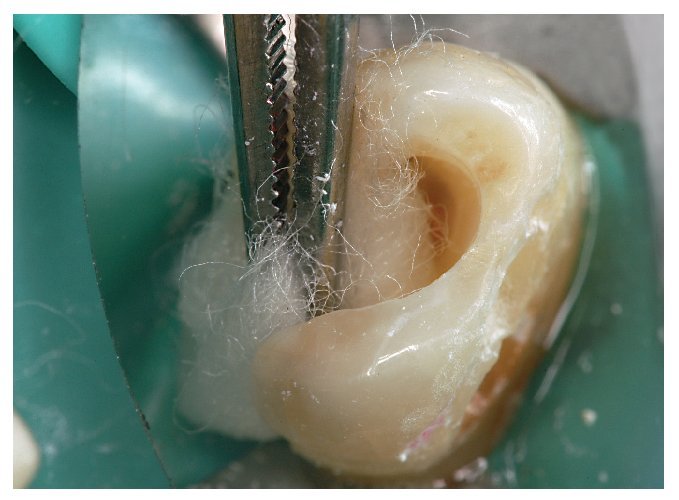
Figura 4. Para la desinfección hacen falta una hemostasia adecuada y la limpieza de las cavidades. El H2O2 (3%), la CHX (2%) y también el NaOCl (2,5%) son útiles para este procedimiento.
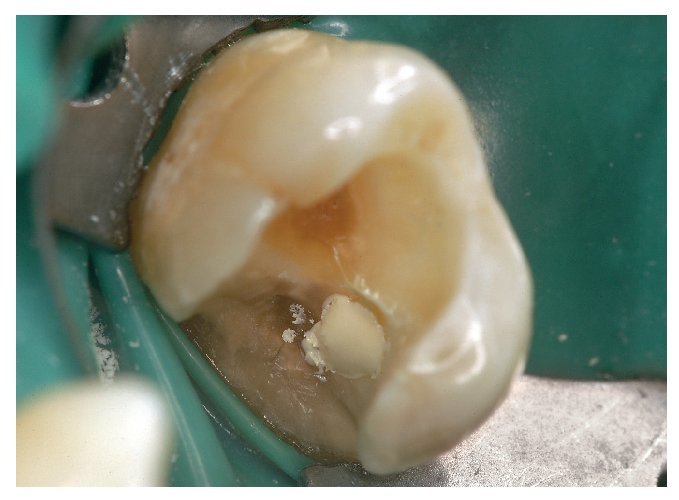
Figura 5. Aplicación de una suspensión acuosa de hidróxido de calcio.
Figura 6. Se recomienda recubrir la suspensión de hidróxido de calcio con un cemento de hidróxido de calcio y éster salicílico, dado que los cementos de base cavitaria ácidos, los adhesivos dentinarios y los geles de grabado neutralizan el hidróxido de calcio alcalino y pueden alterar el efecto. La aplicación directa del cemento de hidróxido de calcio y éster salicílico sobre el tejido pulpar expuesto no es recomendable debido a la mala cicatrización histológica.
Figura 7. Se recomienda realizar una obturación a prueba de bacterias definitiva, por ejemplo con composite, en la misma sesión para evitar una (re)infección. Las obturaciones provisionales con cemento no han resultado ser suficientemente herméticas a las bacterias, de modo que el uso de cierres provisionales se asocia probablemente a una tasa mayor de fracasos.
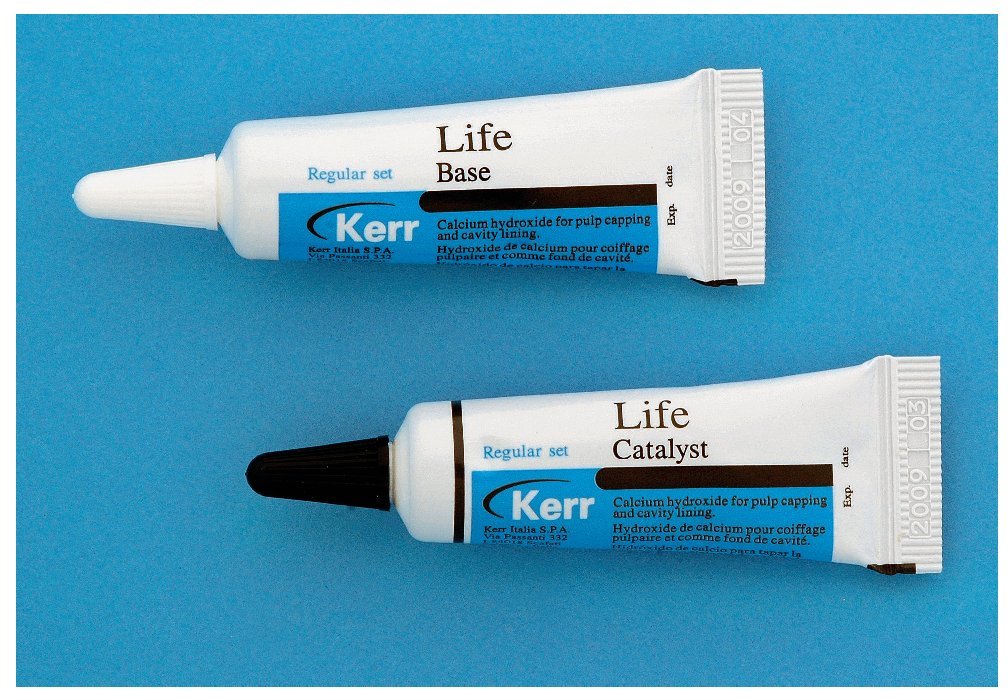
Cementos de hidróxido de calcio y éster salicílico fraguables (fig. 8)
Figura 8. Cemento de hidróxido de calcio y éster salicílico fraguable (Life, KerrHawe, Bioggio, Suiza).
Las ventajas de los cementos de hidróxido de calcio fraguables (como Life, KerrHawe, Bioggio, Suiza; Dycal, Dentsply DeTrey, Konstanz, Alemania) en comparación con las suspensiones acuosas de hidróxido de calcio son una mejor aplicabilidad, una mayor resistencia mecánica y una mejor adherencia a la dentina. Sin embargo, se encuentran datos en la bibliografía según los que las suspensiones acuosas de hidróxido de calcio son superiores a los cementos de hidróxido de calcio y éster salicílico para el recubrimiento directo. Parece ser que la dentina reparadora se genera con mayor rapidez y con una forma más uniforme y más densa. Por lo tanto, los cementos de hidróxido de calcio y éster salicílico pueden dar lugar a un tejido duro neoformado más débil. Además, las suspensiones de hidróxido de calcio provocan menos reacciones inflamatorias, es decir, se puede considerar que el estado de la pulpa es mejor46,49,51. Algunos aditivos de fraguado de los preparados de hidróxido de calcio podrían ser incluso tóxicos para el tejido pulpar46.
Las suspensiones acuosas de hidróxido de calcio provocan una necrosis superficial en contacto directo con el tejido pulpar vital, lo que no se pudo demostrar mediante microscopía óptica en los cementos de hidróxido de calcio y éster salicílico: en contacto directo con el cemento, se forma tejido duro49,51. Las diferentes reacciones tisulares se pueden justificar por diferencias de pH así como por la liberación de iones hidroxilo y de iones de calcio51. Con valores de aproximadamente 10 a 11, el pH de los cementos de hidróxido de calcio y éster salicílico es claramente inferior al de las suspensiones acuosas de hidróxido de calcio54. Si bien los cementos de hidróxido de calcio y éster salicílico liberan continuamente iones, es decir, en el momento de la aplicación no se alcanzan valores máximos (como en el caso de las suspensiones acuosas de hidróxido de calcio), la cantidad total de iones liberados es muy inferior a la de las suspensiones acuosas de hidróxido de calcio. Por lo tanto, el efecto antibacteriano es claramente inferior al de las suspensiones acuosas de hidróxido de calcio54.
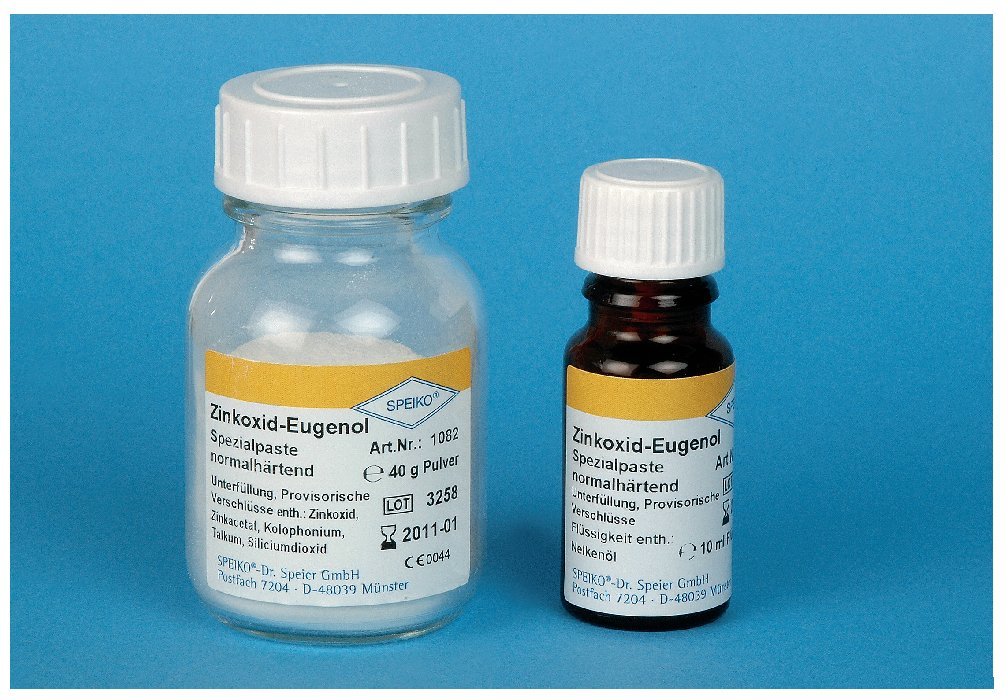
Cementos de óxido de cinc-eugenol (fig. 9)
Figura 9. Cemento de óxido de cinc-eugenol (Zinkoxid-Eugenol Spezialpaste, Speiko, Münster).
Otro material de recubrimiento, citado sobre todo en la bibliografía más antigua, son los cementos de óxido de cinc-eugenol. Como ventajas destacan el efecto analgésico y el efecto antibacteriano. Pero el uso del cemento de óxido de cinc-eugenol en la pulpa expuesta entraña algunos riesgos. Es posible que, como resultado del efecto analgésico, algunos pacientes con un recubrimiento directo defectuoso estén asintomáticos, pero que la curación clínica sea ficticia10. El eugenol (esencia de clavo) es neurotóxico y citotóxico29,45. Existe una publicación que data de 1900 en la que se rechazan todos los materiales de recubrimiento que contienen eugenol o esencia de clavo debido a su efecto tóxico sobre la pulpa17. Se dispone de evidencias histológicas que se remontan a más de 50 años de que, después del recubrimiento directo con cemento de hidróxido de calcio-eugenol, no se produce tejido duro nuevo, sino una inflamación crónica persistente64. El recubrimiento directo con cemento de hidróxido de calcio-eugenol puede provocar daños irreversibles en la pulpa que, en el peor de los casos, pueden evolucionar a necrosis extensas29. Además, el eugenol inhibe la polimerización de los composites, de modo que estos cementos están contraindicados en caso de utilizarse la técnica adhesiva. Además, la estabilidad química del cemento de óxido de cinc-eugenol es relativamente baja: la humedad provoca la extracción del eugenol de los túbulos dentinarios con formación de oquedades llenas de agua, lo que puede dar lugar al derrumbamiento del material de recubrimiento47. Por lo tanto, el recubrimiento directo con cemento de óxido de cinc-eugenol está contraindicado.
Adhesivos dentinarios (fig. 10)
Figura 10. Adhesivo dentinario (Optibond FL, KerrHawe).
Las desventajas del hidróxido de calcio en el recubrimiento directo antes descritas impulsan la búsqueda incesante de alternativas. De estas alternativas forma parte el recubrimiento directo de tejido pulpar vital con adhesivos dentinarios. El uso de estos productos para esta indicación se viene promocionando desde mediados de los años noventa33, sin que hasta ahora se hayan podido confirmar los resultados favorables mediante estudios clínicos o histológicos a largo plazo.
Los componentes de los adhesivos dentinarios o del composite entran en contacto directo con el tejido pulpar vital en el momento del recubrimiento. Esta forma de proceder se basa en la idea de que el material de recubrimiento no tiene por qué ser un medicamento que inicie la formación de tejido duro. Más bien se trata de evitar a toda costa la contaminación bacteriana secundaria (después de la obturación) de la pulpa mediante un sellado marginal absolutamente hermético. En opinión de algunos autores, no hace falta que el producto para el recubrimiento directo muestre una tolerabilidad tisular excelente, ya que se ha comprobado que el tejido pulpar expuesto cicatriza bajo numerosos materiales diferentes, siempre que se pueda asegurar un aislamiento de la cavidad oral a prueba de bacterias15. La capacidad de los adhesivos dentinarios de establecer una unión estanca entre la dentina y el composite ha sido ampliamente estudiada. Por ello, algunos autores consideran que los adhesivos dentinarios son especialmente adecuados para el recubrimiento directo, ya que se puede evitar la (re)infección de la pulpa gracias a su buena estanqueidad15. Sin embargo, hasta ahora no se dispone de estudios en animales de experimentación que demuestren una superioridad indiscutible de los adhesivos dentinarios frente al hidróxido de calcio36. Al contrario, la mayoría de los estudios realizados en humanos mostraron que el recubrimiento directo con adhesivos dentinarios no es recomendable debido a los resultados histológicos significativamente peores4,13,14,21,25,31,32,36,48,53,56.
A pesar de que las reacciones patológicas de la pulpa al recubrimiento directo se deben esencialmente a la contaminación bacteriana, es posible que algunos componentes del composite también contribuyan al fracaso8,12. En pruebas in vitro en células pulpares humanas, los adhesivos dentinarios mostraron una citotoxicidad clara en caso de contacto directo. Ahora bien, la dentina puede actuar a modo de filtro y rebajar la citotoxicidad de los adhesivos dentinarios, de modo que se ha de tener en cuenta este factor si se comparan los resultados de estudios in vitro con los de estudios in vivo9.
En resumen, se puede afirmar que tanto los adhesivos dentinarios no polimerizados como los polimerizados y también los envejecidos liberan componentes químicos que son manifiestamente citotóxicos12. La citotoxicidad de los componentes de los adhesivos dentinarios puede explicar los malos resultados del recubrimiento directo con adhesivos dentinarios en humanos3. Además, es posible que los monómeros procedentes de los materiales de obturación (adhesivos dentinarios/composite) sufran un proceso de interacción con el sistema inmunitario de la pulpa, lo que conlleva un debilitamiento del sistema defensivo en caso de una invasión por microorganismos8,12. Se supone que, en caso de contacto directo con adhesivos dentinarios o composites, se produce una disminución de la acción defensiva de la pulpa secundaria a la citotoxicidad o a cambios específicos en la respuesta inmunitaria38. De acuerdo con esto, parece ser que determinados componentes de los adhesivos inhiben la proliferación de células inmunocompetentes y dan lugar a una inmunosupresión química que favorece el desarrollo de alteraciones patológicas de la pulpa8.
Medicamentos combinados de cortisona y antibióticos (Ledermix) (fig. 11)
Figura 11. Compuesto de antibiótico y corticosteroide (Ledermix, Riemser Arzneimittel, Greifswald).
Entre los medicamentos basados en un antibiótico y un corticosteroide, Ledermix (Riemser Arzneimittel, Greifswald) es probablemente el más popular en Alemania para el uso odontológico. Un gramo de pasta contiene 30,21 mg de demeclociclina (tetraciclina) y 10 mg de acetónido de triamcinolona (corticosteroide). En este caso, la sustancia realmente activa, en opinión del fabricante, es el corticosteroide. Debido a la acción antiinflamatoria de los corticosteroides, el dolor pulpar puede disminuir. El antibiótico carece de efecto en este sentido24. Sin embargo, entre los facultativos no existe unanimidad respecto al uso tópico de antibióticos y de corticosteroides. Los corticosteroides disminuyen la respuesta inmunitaria endógena con el aumento consiguiente de la predisposición a las infecciones. No existen evidencias de que la combinación con antibióticos pueda compensar este defecto. La aplicación de corticosteroides sobre tejido pulpar vital puede favorecer la diseminación de bacterias11. En caso de fracaso no aparece dolor y los dientes no presentan síntomas, lo que llevaría a pensar en una aparente curación. Pero la ausencia de síntomas no significa que no exista proceso patológico después del uso de Ledermix1. Algunos estudios han mostrado que el recubrimiento directo con Ledermix no induce la formación de puentes de tejido duro, es decir, no se produce cicatrización, sino inflamaciones pulpares moderadas a graves27. Ningún estudio científico demuestra que los preparados combinados de antibióticos y corticosteroides son adecuados para el recubrimiento directo. Sin duda, la recomendación sería utilizar Ledermix únicamente como medicamento en un tratamiento provisional de urgencia hasta el momento de la endodoncia definitiva.
Agregado trióxido mineral (MTA) (fig. 12)
Figura 12. Agregado trióxido mineral (MTA, Dentsply De-Trey, Konstanz).
ProRoot MTA fue introducido en la odontología por Torabinejad y White63 a mediados de los años noventa. Según las instrucciones del fabricante, las indicaciones de ProRoot MTA como «cemento de reparación endodóntico» incluyen, además de las perforaciones de los conductos radiculares y de los ápices expuestos, el recubrimiento directo y la obturación retrógrada de conductos radiculares.
ProRoot MTA es un cemento Pórtland que contiene distintos compuestos óxidos18 (óxidos de sodio y potasio, óxido de silicio, óxido de hierro, óxido de aluminio, óxido de magnesio) y que forma un gel coloidal con un pH de hasta aproximadamente 12,5 en presencia de agua. Se endurece al cabo de unas 4 h58.
ProRoot MTA contiene óxido de calcio que en contacto con el fluido tisular se transforma en hidróxido de calcio. El hidróxido de calcio se descompone en iones de calcio e hidroxilo, lo que provoca un aumento del pH y una liberación de iones calcio26,34. Por lo tanto, Pro-Root MTA puede ser utilizado en odontología como alternativa a los preparados de hidróxido de calcio35, dado que el componente químico principal de MTA, que se libera finalmente en una solución acuosa, es el hidróxido de calcio28. El pH del MTA después de la mezcla in vitro, indicado en la bibliografía, es de 9,2223 a 12,558. Debido a su pH parecido y a la liberación de iones Ca2+ y de iones OH-, los MTA y el hidróxido de calcio tienen también un efecto antimicrobiano comparable6. Es posible que posean además un mecanismo similar de neoformación de tejido duro pulpar22.
El MTA tiene un efecto antibacteriano60, no es mutagénico41 y es poco citotóxico40. No modifica la citomorfología de los osteoblastos43, sino que provoca una reacción celular biológica en los osteoblastos44 y estimula la formación de tejido mineralizado2,35. El MTA es cubierto por cemento dentario35 si es introducido por ejemplo en la zona del ligamento periodontal durante el recubrimiento de una perforación.
Aeinehchi et al5 estudiaron el efecto de ProRoot MTA sobre la pulpa en humanos. El uso de ProRoot MTA se asoció a menos inflamación, menos hiperemia y menos necrosis, a un mayor grosor de la dentina neoformada y más frecuentemente a un cordón de osteoblastos cerrado en comparación con el grupo control (Dycal). Iwamoto et al37 comprobaron el efecto de ProRoot MTA sobre la pulpa en terceros molares humanos en comparación con Dycal. En 24 dientes de cada grupo se efectuó un recubrimiento directo de la pulpa y a continuación una obturación con composite después de la preparación previa de cavidades de clase I. No se observaron diferencias histológicas significativas en relación con la presencia de células inflamatorias, puentes dentinarios y la vitalidad pulpar después de un período de 112 a 161 días. Por lo tanto, los autores concluyeron que ProRoot MTA y el hidróxido de calcio muestran una eficacia similar para el recubrimiento directo.
En resumen, los estudios disponibles hasta el momento atribuyen a los MTA una buena biocompatibilidad40,44,57,59 y una estanqueidad excelente frente a la colonización bacteriana57,61,62. La ventaja de ProRoot MTA como material para el recubrimiento directo reside en su mayor resistencia mecánica, una menor solubilidad y una obturación más estanca en comparación con el hidróxido de calcio. Por lo tanto, el uso de ProRoot MTA permitiría evitar tres de las desventajas principales del hidróxido de calcio: los signos de reabsorción del material, su falta de resistencia mecánica y la falta de protección a largo plazo frente a las pérdidas de estanqueidad (microfiltraciones).
En resumen, se puede afirmar que, en los estudios disponibles hasta el momento, ProRoot MTA ha mostrado ser adecuado para el recubrimiento directo.
Moléculas bioactivas
La dentina primaria es considerablemente más eficaz para la protección de la pulpa frente a estímulos bacterianos que la dentina terciaria o la dentina reparadora que se forma después del recubrimiento directo con hidróxido de calcio. Por lo tanto, el objetivo final de un tratamiento regenerador debería ser la formación de dentina primaria. Pero esto sólo se puede conseguir con el uso de moléculas bioactivas y de métodos de «ingeniería tisular». No obstante, estas estrategias terapéuticas han proporcionado resultados poco prometedores hasta ahora, sobre todo en la pulpa infectada8. Se están investigando moléculas bioactivas, es decir, factores de crecimiento, moléculas de la matriz de la dentina o de la matriz del esmalte, así como moléculas de matriz extra-celular. Se pretende que estas moléculas provoquen una activación de células madre o de células progenitoras. Es probable que en este contexto el TGF-β-1 (factor de crecimiento transformador) desempeñe un papel esencial. Este factor actúa sobre los fibroblastos y los odontoblastos, dando lugar a la diferenciación de los progenitores, a una proliferación celular y a la síntesis de colágeno. Se pudo demostrar la producción de dentina reparadora homogénea en estudios en animales de experimentación30.
Una de las desventajas de las moléculas bioactivas podría ser su uso limitado exclusivamente a dientes con pulpa sin signos inflamatorios o con pulpa no contaminada por bacterias50, dado que estas moléculas, a diferencia del hidróxido de calcio, no poseen efecto antibacteriano. Queda pendiente la cuestión del control de la mineralización. Se describió la mineralización completa de todo el conducto radicular, lo que en realidad no es deseable después de un recubrimiento directo, dado que esto cierra la posibilidad a un tratamiento endodóntico posterior30.
Conclusión clínica
Además del hidróxido de calcio, se considera que Pro-Root MTA también es adecuado para el recubrimiento directo. No obstante, el uso de ProRoot MTA es considerablemente más caro. Actualmente no se pueden recomendar materiales como los adhesivos dentinarios para el recubrimiento directo.
Correspondencia:
Till Dammaschke.
Policlínica de Odontología Conservadora. Centro de Odontología, Medicina Oral y Maxilofacial del Hospital Clínico de la Universidad de Münster. Waldeyerstrasse 30, 48149 Münster, Alemania.
Correo electrónico: tillda@uni-muenster.de