Radiología mamaria: Nuevos horizontes en tiempos de pandemia
Más datosEl objetivo de este estudio fue determinar la capacidad del ultrasonido axilar para predecir el número de ganglios con metástasis encontrados en la cirugía axilar de ganglio centinela o linfadenectomía axilar, en pacientes con diagnóstico reciente de cáncer de mama efectuado por biopsia percutánea.
MétodosEstudio prospectivo que incluyó pacientes diagnosticadas con cáncer de mama infiltrante mediante biopsia percutánea, que fueron evaluadas con ultrasonido axilar, caracterizando los ganglios en no sospechosos o sospechosos, cuantificando estos últimos y comparando este número con el resultado patológico de la cirugía axilar.
Resultadosfueron incluidas 142 pacientes, cuatro de ellas con cáncer bilateral. Ciento treinta y tres de los 146 tumores se presentaron clínicamente como T1-T2 N0. La mediana de ganglios sospechosos en ultrasonido fue de 2 (1-6) y la mediana de ganglios sospechosos resultantes en la biopsia quirúrgica fue de 1 (1-16), sin diferencia significativa (p=0,1). La correlación entre el número de ganglios positivos encontrados por ultrasonido axilar y el número de ganglios axilares metastásicos hallados en cirugía fue del 72,7% (p=0,0002), y la concordancia del 79% (IC95% 62,4-95,6%; p=0,0001). La sensibilidad del ultrasonido axilar para diagnosticar alta carga tumoral axilar, con tres o más ganglios metastásicos versus baja carga tumoral, con 0, 1 o 2 ganglios metastásicos, fue del 86,6%; la especificidad, del 83,3%; el valor predictivo positivo, del 92%, y valor predictivo negativo del 71,4%.
ConclusiónNuestros resultados muestran que el ultrasonido axilar dirigido antes de la cirugía es capaz de diferenciar entre una axila de baja carga tumoral y una de alta carga tumoral, y puede ser usado como una herramienta para seleccionar qué tipo de tratamiento elegir, lo que debe ser demostrado en estudios aleatorizados multiinstitucionales.
This study aimed to determine the ability of axillary ultrasonography to predict the number of lymph nodes with metastases found in sentinel node axillary surgery or axillary lymph node resection in patients recently diagnosed with breast cancer after percutaneous biopsy.
MethodsThis prospective study included patients diagnosed with invasive breast cancer by percutaneous biopsy. Axillary lymph nodes were classified at ultrasound examination as suspicious or not suspicious, and the number of suspicious nodes was compared with the number classified as suspicious in the surgical specimen.
ResultsWe included 142 patients, 4 of whom had bilateral cancer; 133 of the 146 tumors were clinically classified as T1-T2 N0. The median number of suspicious lymph nodes at ultrasound was 2 (1–6), and the median number of suspicious lymph nodes in the surgical biopsy specimen was 1 (1–16); the difference was not significant (p=0.1). The correlation between the number of positive lymph nodes on axillary ultrasound and the number of metastatic lymph nodes in the surgical specimen was 72.7% p=0.0002 and the concordance was 79% (95%CI 62.4%–95.6%) p=0.0001. For diagnosing high axillary tumor load (≥3 metastatic lymph nodes) versus low axillary tumor load (<3 metastatic lymph nodes), axillary ultrasound had 86.6% sensitivity, 83.3% specificity, 92% PPV, and 71.4% NPV.
ConclusionOur results show that preoperative axillary ultrasound can differentiate between low and high tumor load and can be used as a tool to select the type of treatment. These results need to be confirmed in randomized multicenter studies.
El objetivo de este estudio es determinar la capacidad del ultrasonido axilar para predecir el número de ganglios con metástasis encontrados en la cirugía axilar de ganglio centinela o linfadenectomía axilar, en pacientes con diagnóstico reciente de cáncer de mama efectuado por biopsia percutánea.
IntroducciónLa evaluación de los ganglios axilares es una parte esencial en el manejo del cáncer de mama, considerado como un procedimiento de estadificación, para determinar el tratamiento de esta enfermedad. El manejo quirúrgico de la axila en el cáncer de mama se ha vuelto menos agresivo, sustituyendo en muchos casos la linfadenectomía axilar por la biopsia de ganglio centinela, y particularmente en las últimas dos décadas, después de la publicación del estudio ACOSOG Z0011 que demostró que en las pacientes con cánceres de mama infiltrantes T1 y T2 con metástasis axilar y sin adenopatías palpables no hubo beneficio en supervivencia de la disección axilar después de la biopsia de ganglio centinela positiva si solo 1 o 2 ganglios estaban comprometidos (baja carga tumoral axilar)1. El estudio Z0011 hizo necesario redefinir el rol del ultrasonido axilar, método no invasivo y de bajo costo, que sumado a la punción aspirativa con aguja fina (PAAF) o biopsia core se utilizaba para seleccionar los casos positivos que irían directamente a linfadenectomía axilar evitando el paso previo de la biopsia del ganglio centinela.
Desde entonces se ha discutido la necesidad de la evaluación preoperatoria de la axila con ultrasonido y eventualmente la realización de PAAF en las pacientes con cáncer de mama antes de la cirugía. Hay estudios que mostraron que las pacientes con ganglios sospechosos en la axila detectados con ultrasonido preoperatorio tuvieron finalmente un número de ganglios positivos mayor en la linfadenectomía axilar, comparado con aquellas con ganglios positivos identificados en la cirugía de ganglio centinela2–6. Así como hay estudios que se han enfocado en el uso del ultrasonido axilar para identificar a las pacientes con alta carga tumoral en la axila, es decir con tres o más ganglios comprometidos2,3,7, también hay estudios para identificar al grupo de pacientes con baja carga tumoral (uno, dos o ninguno)8–11.
El objetivo de este estudio fue correlacionar el número de ganglios patológicos detectados en la ecografía axilar preoperatoria con el número de ganglios patológicos detectados en el estudio patológico axilar definitivo; es decir, determinar la capacidad del ultrasonido axilar para distinguir entre axilas de baja y alta carga tumoral.
MetodologíaEstudio prospectivo de pruebas diagnósticas de pacientes con cáncer de mama infiltrante diagnosticados en Clínica Las Condes de Santiago entre abril de 2018 y abril de 2020. Se obtuvo el consentimiento informado de todas las pacientes incluidas en el estudio.
Fueron incluidas todas las pacientes consecutivas con cáncer de mama infiltrante de diagnóstico inicial en nuestra institución mediante biopsia percutánea y también las diagnosticadas con este procedimiento en centros externos y que fueron reevaluadas con imágenes y revisión del material histológico en nuestra institución antes de la cirugía. Se excluyó a las pacientes que recibieron quimioterapia neoadyuvante, pacientes en estadio T4, recurrencia local posterior a tratamiento, pacientes que habían tenido cirugía axilar previa por tratamiento de cáncer de mama, pacientes que fueron operadas en otra institución y pacientes que no tuvieron cirugía axilar.
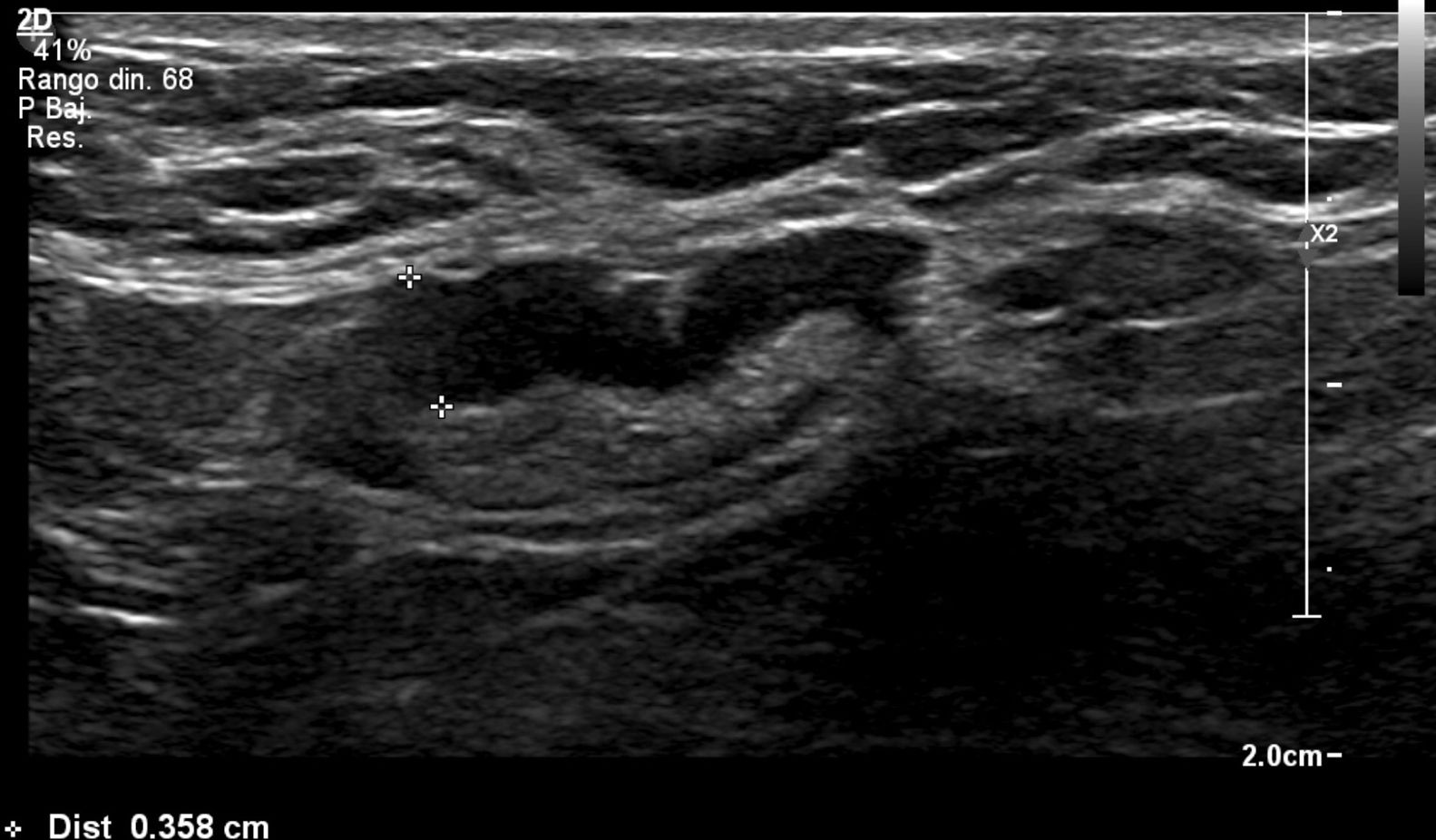
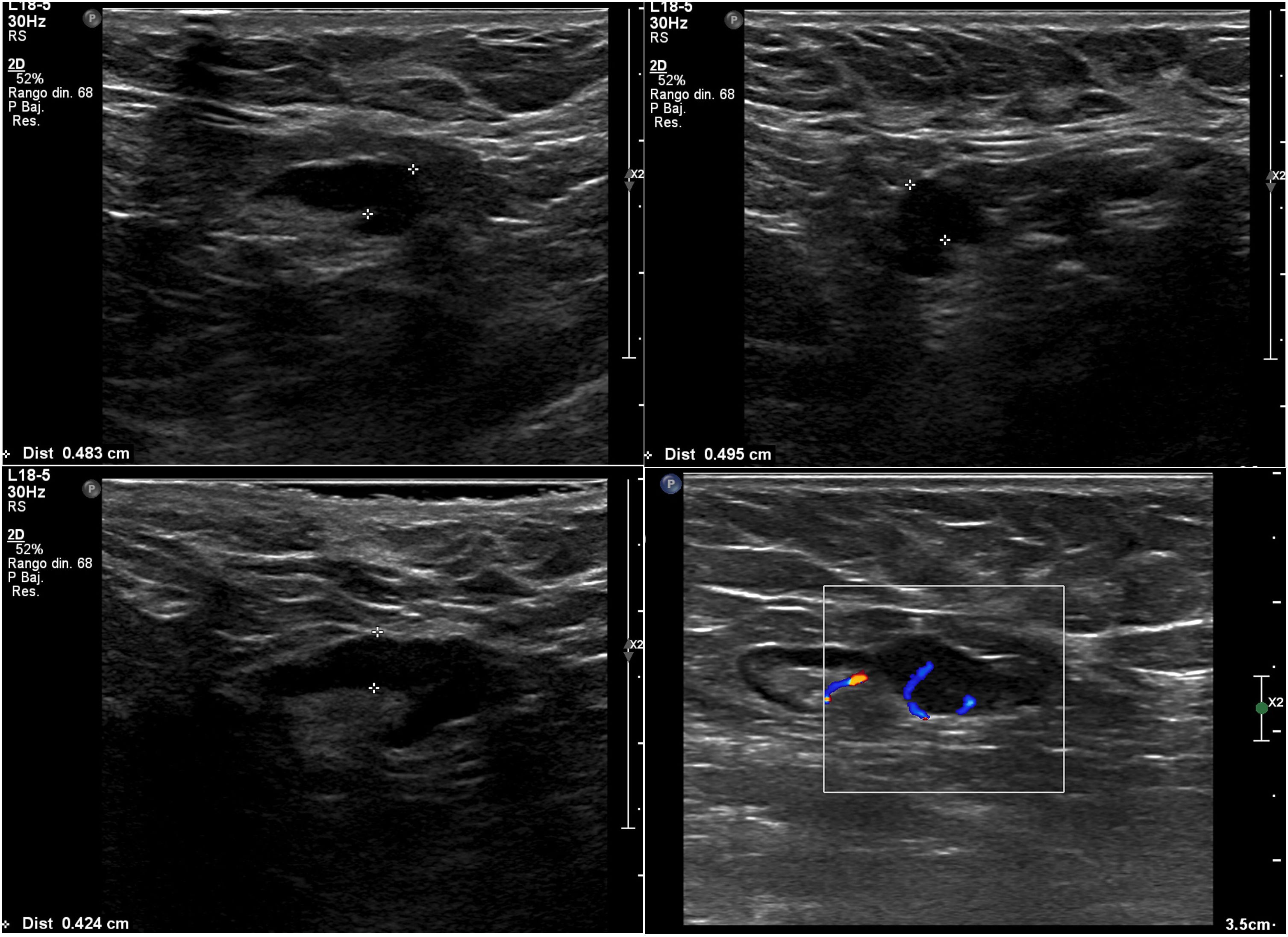
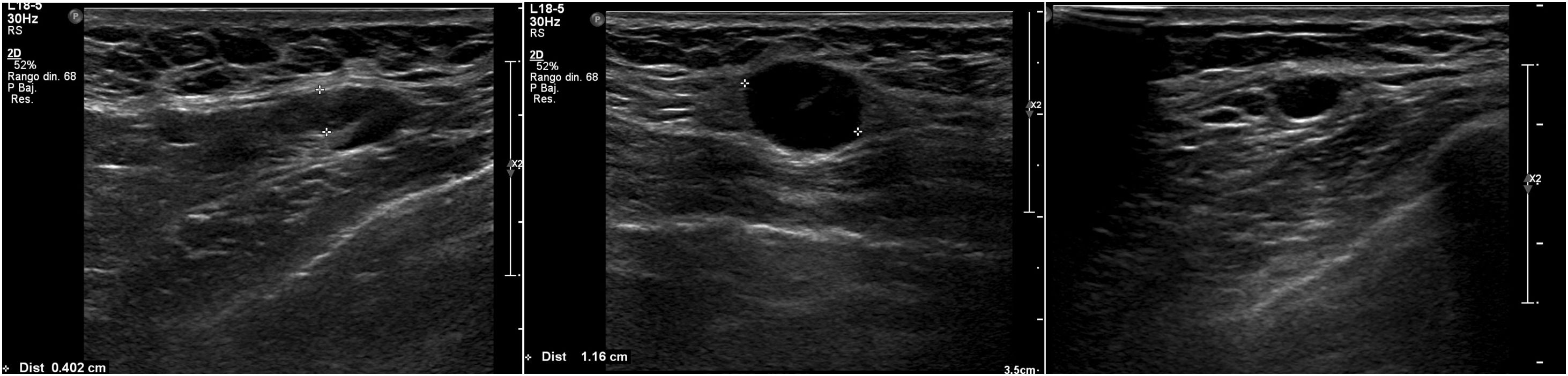
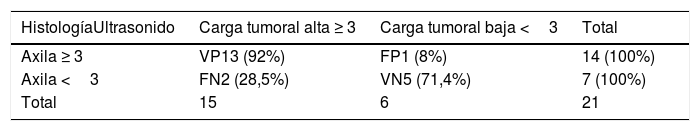
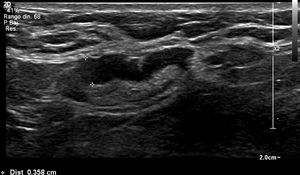
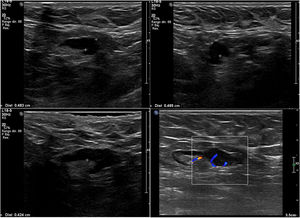
Todas las pacientes incluidas fueron evaluadas por médicos especialistas en radiología de mama mediante ultrasonido dirigido a la axila con un equipo Epiq Siemens con transductor de 18 MHZ. La evaluación de la axila con ultrasonido se realizó durante el examen diagnóstico de lesión mamaria altamente sospechosa o una vez obtenido el diagnóstico de cáncer de mama previo a la cirugía. Los ganglios se caracterizaron como no sospechosos o sospechosos y se contabilizaron los ganglios clasificados como sospechosos. Se consideró como signo sospechoso un ganglio con engrosamiento cortical excéntrico o difuso ≥ 3,5 mm (se subdividió en ≥3,5mm a <4 mm y ≥4 mm) o un ganglio con pérdida del hilio. Se clasificó como baja carga tumoral a las axilas con 0, 1 o 2 ganglios metastásicos y alta carga tumoral a aquellas con 3 o más ganglios metastásicos. Se registró a las pacientes a las que por petición de su médico tratante se les realizó PAAF de las adenopatías axilares sospechosas, lo que quedó a criterio del tratante.
El estudio quirúrgico de la axila incluyó biopsia de ganglio centinela, linfadenectomía axilar o ambas, y se llevó a cabo en un promedio de 33 días (0-95) después de realizado el ultrasonido axilar. En nuestra institución, la elección de proceder a la linfadenectomía axilar directamente puede ser por axila clínicamente positiva con imágenes sospechosas y con confirmación por PAAF. La biopsia de ganglio centinela se llevó a cabo con radioisótopo y azul de isozulfan y fue practicada por cirujanos especialistas en mama.
Tras la cirugía se registraron las características del tumor, incluyendo el tipo de tumor, el grado histológico, los marcadores tumorales, el tamaño, la multifocalidad y la bilateralidad, qué tipo de cirugía axilar se realizó, presencia de ganglios metastásicos y el número de ganglios comprometidos y las características de la metástasis tumoral en el ganglio.
El resultado patológico de los ganglios de la cirugía axilar (sea biopsia de ganglio centinela o linfadenectomía axilar si es que la hubo) fue considerado como el gold standard para el análisis.
Análisis estadísticoPara la descripción de las variables categóricas se usó frecuencia absoluta y porcentual, y para las variables continuas se usó mediana e intervalo mínimo-máximo, porque no distribuyeron de forma paramétrica. En las comparaciones se usaron prueba de la χ2 en variables categóricas y para las variables continuas, test de Wilcoxon.
En el rendimiento diagnóstico del ultrasonido se realizaron una serie de análisis estadísticos: primero una correlación de Spearman (Rho), segundo se determinó la asociación con una regresión logística (OR). Luego una curva ROC (%ABC) y el cálculo de la sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN).
Se consideró significativo un valor de p<0,05. Se usó el software Stata 13 y Excel.
ResultadosUn total de 142 pacientes, todas ellas mujeres, fueron incluidas en este estudio. Cuatro pacientes tenían cáncer bilateral, por lo que los tumores estudiados fueron 146. Las características clínicas de las pacientes y patológicas de los tumores están resumidas en la tabla 1. Ciento treinta y tres de los 146 tumores se presentaron clínicamente como T1-T2 N0.
Características clínicas y patológicas de las pacientes del estudio
| Características clínicas | n | % | |
|---|---|---|---|
| Edad (años) | |||
| Promedio (rango) | 55,1 (32-82) | 142 | 100 |
| Indice de masa corporal | |||
| Promedio (rango) | 24,9 (18-38) | 142 | 100 |
| Clasificación cTNM | 146 | 100 | |
| T1N0 | 116 | 79,5 | |
| T1N1 | 5 | 3,4 | |
| T2N0 | 17 | 11,6 | |
| T2N1 | 6 | 4,1 | |
| T2N2 | 1 | 0,7 | |
| T3N0 | 1 | 0,7 | |
| Tipo de cirugía mama | 146 | 100 | |
| Mastectomía parcial | 97 | 66 | |
| Mastectomía total | 49 | 34 | |
| Tipo de cirugía axila | 146 | 100 | |
| Ganglio centinela | 127 | 87 | |
| Linfadenectomía | 12 | 8 | |
| Ambas | 7 | 5 | |
| Características patológicas | |||
| Tipo histológico | 146 | 100 | |
| Carcinoma ductal infiltrante | 113 | 77 | |
| Carcinoma lobulillar infiltrante | 23 | 16 | |
| Otros | 10 | 7 | |
| Grado histológico | 144 | 100 | |
| 1 | 28 | 19,4 | |
| 2 | 91 | 63,2 | |
| 3 | 25 | 17,4 | |
| Invasión linfovascular | 144 | 100 | |
| Negativa | 125 | 87 | |
| Positiva | 19 | 13 | |
| Receptores de estrógenos | 145 | 100 | |
| Negativo | 12 | 8 | |
| Positivo | 133 | 92 | |
| Receptores de progesterona | 145 | 100 | |
| Negativo | 27 | 19 | |
| Positivo | 118 | 81 | |
| Human epidermal Receptor 2-neu | 143 | 100 | |
| Negativo | 135 | 94 | |
| Positivo | 8 | 6 | |
| Ki-67 | 143 | 100 | |
| ≤20% | 88 | 62 | |
| >20% | 55 | 38 | |
| Tipo molecular | 143 | 100 | |
| Luminal A | 85 | 60 | |
| Luminal B HER2 - | 42 | 29 | |
| Luminal B HER2+ | 5 | 3 | |
| HER2+ | 3 | 2 | |
| Triple negativo | 8 | 6 | |
| Multifocalidad | 146 | 100 | |
| Unifocal | 119 | 81,5 | |
| Multifocal | 27 | 18,5 | |
| Bilateralidad | 146 | 100 | |
| Unilateral | 142 | 97 | |
| Bilateral | 4 | 3 | |
| Clasificación pTNM | 146 | 100 | |
| pT | T1mic-T1a-T1b | 59 | 40 |
| T1c | 49 | 34 | |
| T2 | 35 | 24 | |
| T3 | 3 | 2 | |
| pN | 146 | 100 | |
| N0 | 109 | 75 | |
| N1mi | 8 | 5 | |
| N1a-b-c | 23 | 15 | |
| N2-N3 | 7 | 5 | |
La mayoría (122/146) de las evaluaciones de la axila con ultrasonido se hicieron antes de la biopsia percutánea del cáncer mamario. En 11 de las pacientes se realizó PAAF de adenopatía axilar, las cuales fueron solicitadas por su médico tratante por adenopatías palpables; en 9 de estas, la PAAF resultó positiva para malignidad.
Hubo 2 cánceres microinvasores. Un cáncer bilateral tuvo estudio de marcadores en uno solo de los cánceres.
La cirugía axilar correspondió en primera instancia en un 91,7% (134/146) a biopsia de ganglio centinela, con 7 pacientes en las que se convirtió a linfadenectomía axilar durante el acto quirúrgico por biopsia rápida positiva. La mediana de ganglios centinelas obtenidos fue de 2 (1-5). Hubo 12 pacientes en las que el cirujano decidió ir directamente a linfadenectomía por axila clínicamente sospechosa. Las características de la axila en el ultrasonido y cirugía están resumidas en la tabla 2.
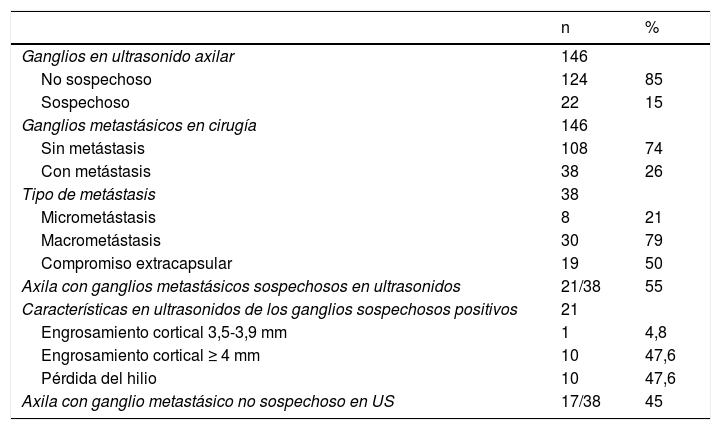
Características de la axila en ultrasonido y cirugía
| n | % | |
|---|---|---|
| Ganglios en ultrasonido axilar | 146 | |
| No sospechoso | 124 | 85 |
| Sospechoso | 22 | 15 |
| Ganglios metastásicos en cirugía | 146 | |
| Sin metástasis | 108 | 74 |
| Con metástasis | 38 | 26 |
| Tipo de metástasis | 38 | |
| Micrometástasis | 8 | 21 |
| Macrometástasis | 30 | 79 |
| Compromiso extracapsular | 19 | 50 |
| Axila con ganglios metastásicos sospechosos en ultrasonidos | 21/38 | 55 |
| Características en ultrasonidos de los ganglios sospechosos positivos | 21 | |
| Engrosamiento cortical 3,5-3,9 mm | 1 | 4,8 |
| Engrosamiento cortical ≥ 4 mm | 10 | 47,6 |
| Pérdida del hilio | 10 | 47,6 |
| Axila con ganglio metastásico no sospechoso en US | 17/38 | 45 |
La mediana de ganglios sospechosos en ultrasonido fue de 2 (1-6) y la mediana de ganglios sospechosos resultantes en la biopsia quirúrgica fue de 1 (1-16), sin diferencia significativa (p=0,1)
El área bajo la curva (ROC) del ultrasonido axilar versus biopsia de ganglio axilar fue de 0,9087.
La correlación entre el número de ganglios positivos encontrados por ultrasonido axilar y el número de ganglios axilares metastásicos encontrados en la cirugía fue del 72,7%, p=0,0002, y la concordancia del 79% [intervalo de confianza (IC)95% 62,4-95,6%; p=0,0001].
La sensibilidad del ultrasonido axilar para diagnosticar las axilas con alta carga tumoral versus las de baja carga tumoral fue del 86,6%, la especificidad del 83,3%, el VPP del 92% y VPN del 71,4% (tabla 3). No hubo diferencia significativa al comparar por tipo de procedimiento quirúrgico.
Capacidad del ultrasonido axilar de diferenciar las axilas de baja carga tumoral (0, 1 y 2 ganglios metastásicos) y las axilas de alta carga tumoral (≥3 ganglios metastásicos)
| HistologíaUltrasonido | Carga tumoral alta ≥ 3 | Carga tumoral baja <3 | Total |
|---|---|---|---|
| Axila ≥ 3 | VP13 (92%) | FP1 (8%) | 14 (100%) |
| Axila <3 | FN2 (28,5%) | VN5 (71,4%) | 7 (100%) |
| Total | 15 | 6 | 21 |
Especificidad: 83,3%; sensibilidad: 86,6%; VPP: 92%; VPN: 71,4%.
FN: falsos negativos; FP: falsos positivos; VN: verdaderos negativos; VP: verdaderos positivos.
En relación con el rendimiento diagnóstico global del ultrasonido axilar para detectar metástasis axilares, del total de pacientes hubo 1 falso positivo y 17 falsos negativos de ultrasonido sospechoso; de estos últimos, 6 fueron micrometástasis axilar. Por consiguiente, en nuestra serie obtuvimos una sensibilidad del 55%, una especificidad del 99%, un valor predictivo positivo del 95% y un valor predictivo negativo del 86%. Si consideramos que el ultrasonido es un método que se basa en cambios morfológicos, entonces el diagnóstico de micrometástasis queda fuera de su alcance. Así, los valores calculados sin considerar las micrometástasis fueron 63%, 99%, 95% y 91%, respectivamente (tablas 4 y 5).
Rendimiento diagnóstico del ultrasonido axilar con micrometástasis
| HistologíaUltrasonido | Axila positiva | Axila negativa | Total |
|---|---|---|---|
| Axila positiva | VP21 (95%) | FP1 (5%) | 22 (100%) |
| Axila negativa | FN17 (13,8%) | VN107 (86,2%) | 124 (100%) |
| Total | 38 | 108 | 146 |
Especificidad: 99%; sensibilidad: 55,2%; VPP: 95%; VPN: 86,2%.
FP:; FN:; VN:;VP:.
Rendimiento diagnóstico del ultrasonido axilar sin micrometástasis
| HistologíaUltrasonido | Axila positiva | Axila negativa | Total |
|---|---|---|---|
| Axila positiva | VP19 (95%) | FP1 (5%) | 20 (100%) |
| Axila negativa | FN11 (8,8%) | VN115 (91,2%) | 126 (100%) |
| Total | 30 | 116 | 146 |
Especificidad: 99%; sensibilidad: 63%; VPP: 95%; VPN: 91,3%.
FP:; FN:; VN:;VP:.
La mayoría de los ganglios axilares que resultaron con metástasis y que fueron sospechosos en ultrasonido tenían macrometástasis y compromiso extracapsular. Hubo 38 casos con ganglios metastásicos en la axila y 21 de 38 presentaron signos ecográficos de sospecha. De estos 21 casos, solo hubo uno que tenía como único signo sospechoso un engrosamiento cortical de menos de 4 mm (3,6 mm) y que fue micrometástasis. En 10 de 21 pacientes, el signo ecográfico sospechoso fue un engrosamiento cortical igual o superior a 4 mm. De estas diez, una tenía micrometástasis y nueve, macrometástasis, y de estas nueve, seis tenían compromiso extracapsular. Los otros 10 casos sospechosos en el ultrasonido tenían ganglio con pérdida de hilio, todos ellos con macrometástasis, y 6 de 10 con compromiso extracapsular.
DiscusiónLa evaluación de la axila con ultrasonido es parte del estudio preoperatorio de las pacientes con cáncer de mama y es ampliamente usado en la práctica clínica. Con los criterios actuales de manejo de la axila establecidos en el ACOSOG Z00111, la cuantificación de los ganglios axilares para diferenciar baja y alta carga tumoral en la axila son de gran importancia en el manejo de las pacientes diagnosticadas con cáncer de mama.
En este estudio no hubo diferencia significativa entre el número de ganglios sospechosos detectados con ultrasonido axilar y el número de ganglios metastásicos diagnosticados en la cirugía, en una muestra de pacientes predominantemente en estadio clínico temprano (T1-T2 N0). La sensibilidad del ultrasonido axilar para diagnosticar las axilas con alta carga tumoral (tres o más ganglios metastásicos) versus las de baja carga tumoral (0, 1 o 2 ganglios metastásicos) fue del 86,6%, la especificidad del 83,3%, el VPP del 92% y VPN del 71,4%.
En el estudio de Caudle, dos o menos ganglios anormales en el ultrasonido tuvieron un 45% de probabilidad de tener tres o más ganglios con histología positiva en cirugía3; en el de Farrell, un ganglio axilar sospechoso en el ultrasonido tuvo 5,2 ganglios positivos en histología definitiva4, y en el de Pilewskie más de un ganglio anormal en imágenes axilares se asoció significativamente a tres o más en histología final5. La mejor correlación y concordancia entre nuestro estudio y los antes mencionados puede estar en relación con que nuestra investigación es prospectiva, con un especialista que revisó la axila dirigidamente con criterios determinados y contó el número de ganglios axilares anormales mientras realizaba el examen y no retrospectivamente como en los otros estudios. También pueden haber influido los signos ecográficos de sospecha de metástasis axilar que utilizamos, ya que, en vez de elegir criterios morfológicos clásicos, como los de Bedi12, que tienen un bajo valor predictivo positivo, o los de Amonkar13 donde un 47% de los ganglios definidos como sospechosos tuvieron en la linfadenectomía axilar una baja carga tumoral, optamos por hacer una búsqueda en la bibliografía para criterios de sospecha que pudiesen predecir una alta carga tumoral axilar. Estos fueron engrosamiento cortical de más de 3,5 mm y pérdida del hilio, que fueron los que en el estudio de Zhu14 obtuvieron el mejor valor de sensibilidad y especificidad para diagnosticar tres o más ganglios metastásicos.
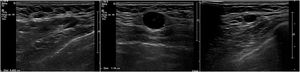
Nosotros subdividimos el engrosamiento cortical en dos grupos, el primero de 3,5mm a menos de 4mm y el segundo de 4mm o más, y en la serie solo hubo una paciente que en cirugía tuvo ganglios metastásicos y en la cual el único signo sospechoso en ultrasonido fue un ganglio con engrosamiento cortical de 3,6 mm. En todas las demás pacientes, los ganglios metastásicos se presentaron en ultrasonido con un engrosamiento cortical mayor o igual a 4mm y/o pérdida del hilio (figs. 1-3).
En el estudio retrospectivo de Rooney15, en que igualmente buscaron qué signos predicen mejor el compromiso axilar mayor o igual a 3 ganglios, también se incluyeron como ganglios sospechosos los que presentaron signo ecográfico de engrosamiento cortical mayor de 4 mm, aunque en este estudio debían tener además forma redondeada y/o pérdida del hilio. Lamentablemente, la mayoría de los estudios dirigidos a evaluar el ultrasonido axilar para detectar metástasis axilares son retrospectivos y no detallan qué signos ecográficos utilizaron, quedando a apreciación del especialista en imágenes si los catalogaba como sospechoso o no3,5,10,16.
La sensibilidad, especificidad, VPP y VPN del ultrasonido axilar para diagnosticar metástasis axilar en nuestro estudio fue del 55,2%, 99%, 95% y 86,2%, respectivamente, similares a otros estudios como el de Barco, en el que estos valores fueron del 48%, 94%, 83% y 74%10, y en el estudio de Farshid, que fueron del 39,8%, 94,6%, 79,8% y 78,1%16. Si no incluimos las micrometástasis, que están fuera del alcance de las imágenes actuales, y considerando que hay estudios que muestran que no tendrían impacto en la supervivencia17, en nuestro estudio estos valores fueron del 63%, 99%, 95% y 91,3%.
Entre las limitaciones de nuestro estudio se encuentra el número pequeño de pacientes con ganglios metastásicos y la muy poca representación de cánceres HER2 positivos y triples negativos, ya que la mayoría de estas pacientes fueron a quimioterapia neoadyuvante. Tuvimos un 91,7% de cirugía de ganglio centinela en primera instancia (134/146), con una obtención de ganglios con una mediana de 2 y con 35/134 casos con un solo ganglio centinela, por lo que puede ser que algunas pacientes tuviesen más de 2 ganglios metastásicos no diagnosticados en la cirugía axilar. Pero cabe notar que en las axilas con metástasis que tuvieron cirugía de ganglio centinela solo en tres se obtuvo un solo ganglio, con dos de ellas con linfadenectomía como segunda cirugía, y que en las pacientes con dos o más ganglios metastásicos en cirugía de ganglio centinela, solo tres no fueron a linfadenectomía posteriormente. De ellas, en una se obtuvieron 5 ganglios centinela con tres de ellos con micrometástasis, en otra se obtuvieron 2 ganglios centinela con 2 ganglios con micrometástasis y en la tercera se obtuvieron 5 ganglios centinela con 2 ganglios con macrometástsis. De este modo, parece poco probable que en nuestra serie haya habido una significativa subrepresentación del número de ganglios metastásicos en las pacientes que solo tuvieron cirugía de ganglio centinela. También se puede considerar como una limitación que es un estudio de una institución con radiólogos especialistas en mama, lo que puede influir en la reproducibilidad de sus resultados.
A pesar de estas limitaciones, los hallazgos de nuestro estudio demuestran una buena capacidad del ultrasonido para diferenciar entre una axila negativa o con baja carga tumoral y una con alta carga tumoral, lo que puede ser de gran utilidad para determinar la conducta quirúrgica. En este contexto cabe mencionar el estudio SOUND (Sentinel Node Vs Observation After Axillary Ultra-souND), que es una investigación en curso aleatorizada que compara biopsia de ganglio centinela versus ninguna cirugía axilar en pacientes con cáncer de mama de menos de 2 cm con axila clínicamente negativa y con ultrasonido axilar negativo preoperatorio.
El ultrasonido axilar, al ser capaz de detectar axilas con alta carga tumoral, permitiría seleccionar pacientes que pueden beneficiarse más con la indicación de quimioterapia neoadyuvante en vez de cirugía primaria.
ConclusiónEl ultrasonido axilar es capaz de diferenciar entre una axila de baja y alta carga tumoral y puede ser usado como una herramienta para seleccionar qué tipo de tratamiento elegir, lo que debe ser demostrado en estudios aleatorizados multiinstitucionales.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Autorías- 1.
Responsable de la integridad del estudio: PNV.
- 2.
Concepción del estudio: PNV.
- 3.
Diseño del estudio: PNV.
- 4.
Obtención de los datos: PNV, BAD, PAH, MJC, CBA.
- 5.
Análisis e interpretación de los datos: PNV, BAD, PAH, MJC, CBA.
- 6.
Tratamiento estadístico: MCC.
- 7.
Búsqueda bibliográfica: PNV, BAD, PAH, MJC, CBA.
- 8.
Redacción del trabajo: PNV, BAD, PAH, MJC, CBA.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: STC, AIV.
- 10.
Aprobación de la versión final: PNV.