La COVID-19 es una enfermedad con una gran semiología clínica, bioquímica y radiológica, que tiene una afectación preferente por el pulmón, probablemente debido a un mayor número de receptores ECA-2. La infección celular activa sustancias proinflamatorias y provoca un daño alveolar difuso, que es la base histopatológica del distrés respiratorio del adulto. La fase exudativa explicaría las imágenes “en vidrio deslustrado” y consolidación, mientras que la tendencia hacia una morfología más lineal representa la fase proliferativa. Tanto la tomografía computarizada (TC) como la tomografía por emisión de positrones/ tomografía computarizada (PET/TC) apoyan el carácter inflamatorio de las lesiones pulmonares cuando la enfermedad está en fase inicial o es leve-moderada.
Los casos graves muestran una hipoperfusión pulmonar que se explicaría por una alteración de la ventilación-perfusión alveolar (V/Q). Por otro lado, un estado protrombótico conlleva mayor probabilidad de enfermedad tromboembólica por la activación de la vía de la coagulación y plaquetaria, con la producción de sustancia de degradación de la fibrina (dímero D) así como el consumo de plaquetas.
COVID-19 is a disease with many clinical, biochemical, and radiological signs that has a predilection for the lungs, probably because of the high number of ACE-2 receptors in this organ. The infection of cells activates proinflammatory substances, causing diffuse alveolar damage, which is the histopathological basis of ARDS. The exudative phase would manifest as ground-glass opacities and consolidation, and the proliferative phase would manifest as a tendency toward a more linear morphology. Both CT and PET/CT findings support the inflammatory character of the lung lesions in the initial phase of the disease and in patients with mild-moderate disease.
Severe cases have pulmonary hypoperfusion that is likely due to abnormal alveolar ventilation and perfusion. On the other hand, a prothrombotic state increases the risk of thromboembolic disease through the activation of coagulation and platelet pathways with the production of fibrin degradation products (D-dimer) and consumption of platelets.
La enfermedad por el coronavirus SARS-CoV-2 se denomina COVID-19 y es actualmente una pandemia global. Entra dentro de las pandemias más activas a lo largo de los siglos con cerca de 1,4 mill de muertos en el mundo (en el momento de realizar este trabajo). España ha sido uno de los países con más fallecidos por millón de habitantes.
El 31 de diciembre de 2019, la Wuhan Health Commision notifica al Centro de control y prevención de enfermedades de China y a la Organización Mundial de la Salud (OMS) la existencia de un grupo de 27 pacientes con neumonía de origen desconocido. Se observa que el trazado epidemiológico de los pacientes tiene relación con el mercado de pescado de la ciudad (Huanan; Seafood Wholesale Market), donde se comercializa con animales vivos y muertos de múltiples especies como murciélagos, serpientes, pangolines, etc., y se interpreta el brote infeccioso como la mutación del virus desde una especie animal al hombre. La OMS lo declara el 30 de enero de 2020 como un brote de neumonía viral y el 11 de marzo como pandemia con el nombre de COVID-191,2.,
VirologíaEl 7 de enero de 2020 se descubre en China el origen de la infección que la OMS, el 11 de febrero, denomina coronavirus novel (nuevo) 2019 (2019-nCoV). De forma coloquial se denomina a la enfermedad “neumonía de Wuhan”, pero la OMS la renombra como COVID-19 para evitar estigmatizar una determinada zona geográfica. Prácticamente el mismo día, el “International Committee on Taxonomy of Viruses” denomina a este virus con el nombre de SARS-CoV-2 (severe acute respiratory syndrome coranaviruse-2) o SARS-2, para diferenciarlo del brote de SARS-1 que apareció en los años 2002-20033,4.
Los coronavirus pertenecen a la familia Coronaviridae y son un tipo de virus ARN monocatenario encapsulado. Se dividen en cuatro géneros: alfa, beta, gamma y delta. Hasta la fecha se han identificado siete coronavirus en humanos que están encuadrados en los géneros alfa y beta. En este último, se encuentran los coronavirus SARS-1, SARS-2 y MERS (Middle East Respiratory Syndrome –Síndrome respiratorio del Oriente medio–). Los alfacoronavirus producen normalmente una clínica de catarro común, mientras que los betacoronavirus en algunos casos pueden ocasionar un distrés respiratorio del adulto (SDRA)5,6. Estos virus surgen de la mutación de virus de animales como los murciélagos, que sirven de reservorios antes de contaminar o pasar al huésped (hombre). El SARS-2 se ha relacionado con el genoma de un virus encontrado en el “murciélago en herradura” (horseshoe bats), de la especie Rhinolophus, con una similitud del 96% y localizado en la provincia de Yunnan. En un primer momento se postuló la idea de que el huésped intermediario o incluso el primer reservorio fuese el pangolín (Pangolin-Cov), pero no se ha confirmado3,7.
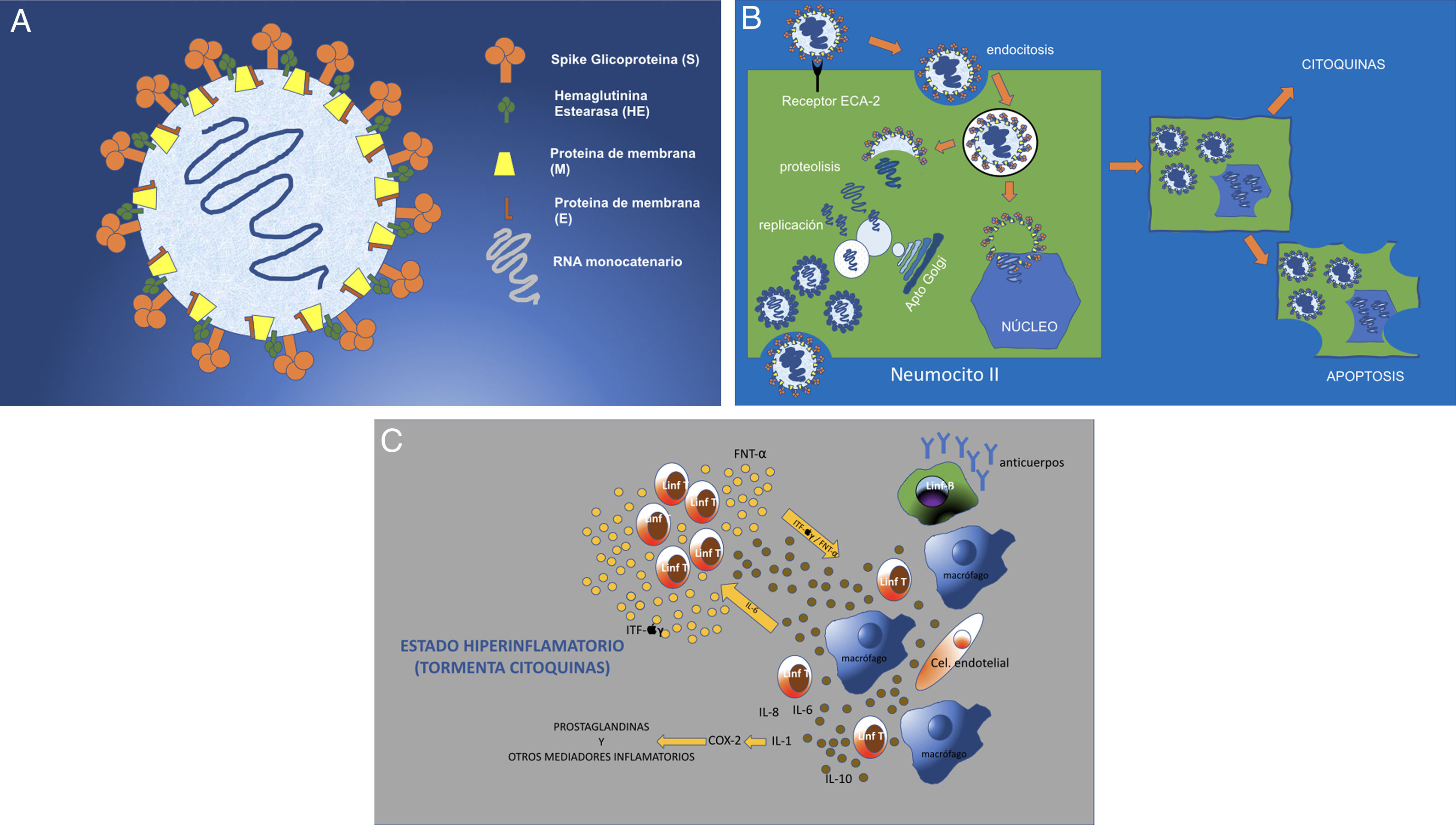
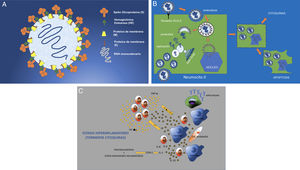
El SARS-CoV-2 (SARS-2 a partir de ahora) tiene un diámetro de 50-200 nm (fig. 1A). De sus proteínas de superficie, la glicoproteína Spike o “S” es la que se une a la célula del huésped a través de los receptores para la enzima convertidora de angiotensina II (ECA II)3. Estos receptores están presentes en los neumocitos tipo II del pulmón, aunque pueden encontrarse también en menor número en el riñón, intestino, corazón, útero, cerebro, paredes vasculares o suprarrenales (fig. 1B)8–10. Una vez el virus se une a la membrana celular por un mecanismo de endocitosis, el genoma viral de ARN se libera en el citoplasma para su replicación. El ARN genómico, actuando sobre el sistema endoplásmico y de Golgi, elabora nucleocápsides para formar virones intracelulares y nuevas partículas virales que se salen de la célula por exocitosis. La célula se altera funcional y estructuralmente, y llega a una muerte celular programada o apoptosis celular 11,12 (fig. 1C).
A) Estructura del SARS-CoV-2 (SARS-2). Virus ARN monocatenario y encapsulado con glicoproteínas de superficie. La proteína “S” (Spike) es la que le confiere la característica morfología en corona y la que establece la unión con los receptores celulares ECA II. B) Infección y replicación viral del SARS-2. El virus se une a los receptores ECA II de la célula huésped (en este caso del neumocito tipo II), para entrar en la célula por endocitosis a través de la membrana celular. La envoltura del virus se destruye por proteólisis quedando libre el ARN que se replica para posteriormente, a través de membranas, formadas por el aparato de Golgi y endoplásmico de la célula, formar virones completos (inclusiones virales en los tejidos de autopsias). Estos virones se eliminan por exocitosis a través de la membrana celular. Otras proteínas del virus permiten la entrada en el núcleo alterándolo estructural y funcionalmente y llevando a la célula a una muerte programada o apoptosis celular. C) La afectación celular del virus provoca la activación de macrófagos, células endoteliales, células dendríticas, etc. que producen citoquinas (IL-1, IL-6, IL-8) y la activación de linfocitos T como respuesta rápida de la inmunidad. Pero si esta respuesta no es rápida (respuesta tardía) o simplemente no está bien regulada, se produce una sobreproducción a través de ITF y TNF que provoca una mayor activación de macrófagos y otras células (tormenta de citoquinas). COX-2: ciclooxigenasa-2; TNF: factor de necrosis tumoral; IL: interleuquina; ITF: interferón.
Muy probablemente como consecuencia de la interacción de la proteína M del virus en el interior de la célula y el citosol nuclear se produce la liberacción de citoquinas, que a su vez activan células como los monocitos, linfocitos T, macrófagos, células endoteliales, epiteliales y dendríticas. Este mecanismo de inmunidad innata del huésped forma la primera defensa contra el virus. Posteriormente y a través de la activación de linfocitos B se generan anticuerpos para conseguir la destrucción y aclaramiento viral del organismo.
Se ha observado, basado en pacientes con coronavirus SARS y MERS, que el mecanismo inmunitario puede estar mal regulado, de tal manera que los macrófagos y linfocitos T tienen una sobreproducción o hiperregulación de citoquinas, lo que provoca un síndrome de respuesta inflamatoria sistémica (SIRS), también conocido como “tormenta de citoquinas”. Una respuesta inmunitaria innata rápida y bien coordinada contra la infección viral evitaría la replicación y efectos del virus, pero si esta respuesta inmunitaria está mal regulada o es excesiva podría causar daño celular13. Experimentos con células in vitro muestran que la liberación retardada de citoquinas y otras cininas ocurre en células epiteliales respiratorias, células dendríticas y macrófagos en una etapa temprana de la infección por SARS-2. Más tarde, las células secretan factores antivirales de tipo interferón (IFN) y altos niveles de citoquinas proinflamatorias como interleucinas (IL)-1, IL-6 y factor de necrosis tumoral (TNF). Esta liberación inducirá una nueva producción y liberación de citoquinas que provocarían daños celulares graves14,15.
Al igual que el SARS-1 y el MERS, el SARS-2 infecta las células epiteliales de las vías respiratorias humanas (neumocito tipo II), donde las células THP-1 (una línea celular de monocitos), macrófagos y células dendríticas inducen niveles retardados pero elevados de sustancias proinflamatorias. Los niveles séricos de citoquinas y quimiocinas son significativamente más altos en pacientes con enfermedad grave que los que desarrollan formas más leves de la enfermedad.
De estos estudios se desprende que una respuesta de citoquinas mal controlada y exagerada, por células infectadas con SARS-2, podría desempeñar un papel importante en la patogénesis de COVID-19 y la evolución hacia fases graves de un SDRA16.
ClínicaSe pueden establecer cinco grupos clínicos:
1. Asintomáticos.
2. Con enfermedad leve-moderada (80%).
3. Con enfermedad grave y hospitalización (13%).
4. Con enfermedad crítica y unidad de cuidados intensivos (UCI) (5%).
5. Muerte (2%).
Es difícil saber qué porcentaje representan los pacientes asintomáticos. Zhu et al. publican un metaanálisis de 38 trabajos que incluía una población de 3062 pacientes con COVID-19. De estos, el 12% estaba asintomático17. En el transatlántico “Diamond Princess”, sobre 634 pacientes con test RT-PCR positivo (del inglés: reverse transcription of polymerase chain reaction), el número de pacientes asintomáticos reales fue del 18%17,18. Afecta de forma parecida a hombres y mujeres, con una ligera mayor proporción de varones (50-62%)18.
El síntoma más común es la fiebre (80-98%), con curso vespertino, que llega a ser alta en muchos casos y acompañada de escalofríos y sudoración. La tos es el segundo síntoma más frecuente (63-70%) y es seca, aunque en un 30-40% se acompaña de expectoración. Es muy característica la asociación con mialgias (45%), gran debilidad o cansancio y astenia. La anorexia se ha observado en un 39% de los pacientes y suele ser la causa, junto a la ausencia de gusto y olfato, de pérdida de peso19–21. En la edad infantil, los signos suelen ser muy leves, incluso pasar desapercibidos, aunque se han asociado vasculitis como la enfermedad de Kawasaki o el síndrome inflamatorio multisistémico pediátrico22. También son más proclives a tener lesiones cutáneas como exantemas, lesiones urticariformes o acroisquemias parecidas a la perniosis23,24.
La disnea es el síntoma de alarma más importante (34-50%), que junto a una desaturación de O2 reflejaría una situación grave que motivaría en estos pacientes el ingreso hospitalario.
Entre los datos de laboratorio, es característica la linfopenia (57%) así como la elevación de reactantes de fase aguda (la PCR y la velocidad de sedimentación globular [VSG] están elevadas en el 74% y 66% de los pacientes, respectivamente) o la ferritina. La PO2 está disminuida en más de la mitad de los pacientes (64%) y no es infrecuente encontrar una alteración de las enzimas hepáticas de forma moderada (29%) sin elevación de la bilirrubina.
Una de las alteraciones más llamativa es la elevación del dímero D, en muchos casos asociándose trombocitopenia. Estas alteraciones han sugerido la hipótesis de una coagulopatía de consumo o coagulación intravascular diseminada (CID). La CID es una entidad que se produce como resultado de la activación y estimulación del sistema de coagulación y que ocasiona microangiopatía trombótica por depósito de fibrina y fibrinólisis secundaria, y es frecuente en muchos procesos, entre ellos los estados de infección y sepsis. Sin embargo, una manifestación clínica de la CID es la hemorragia, que no es un síntoma habitual en pacientes con COVID-1925,26.
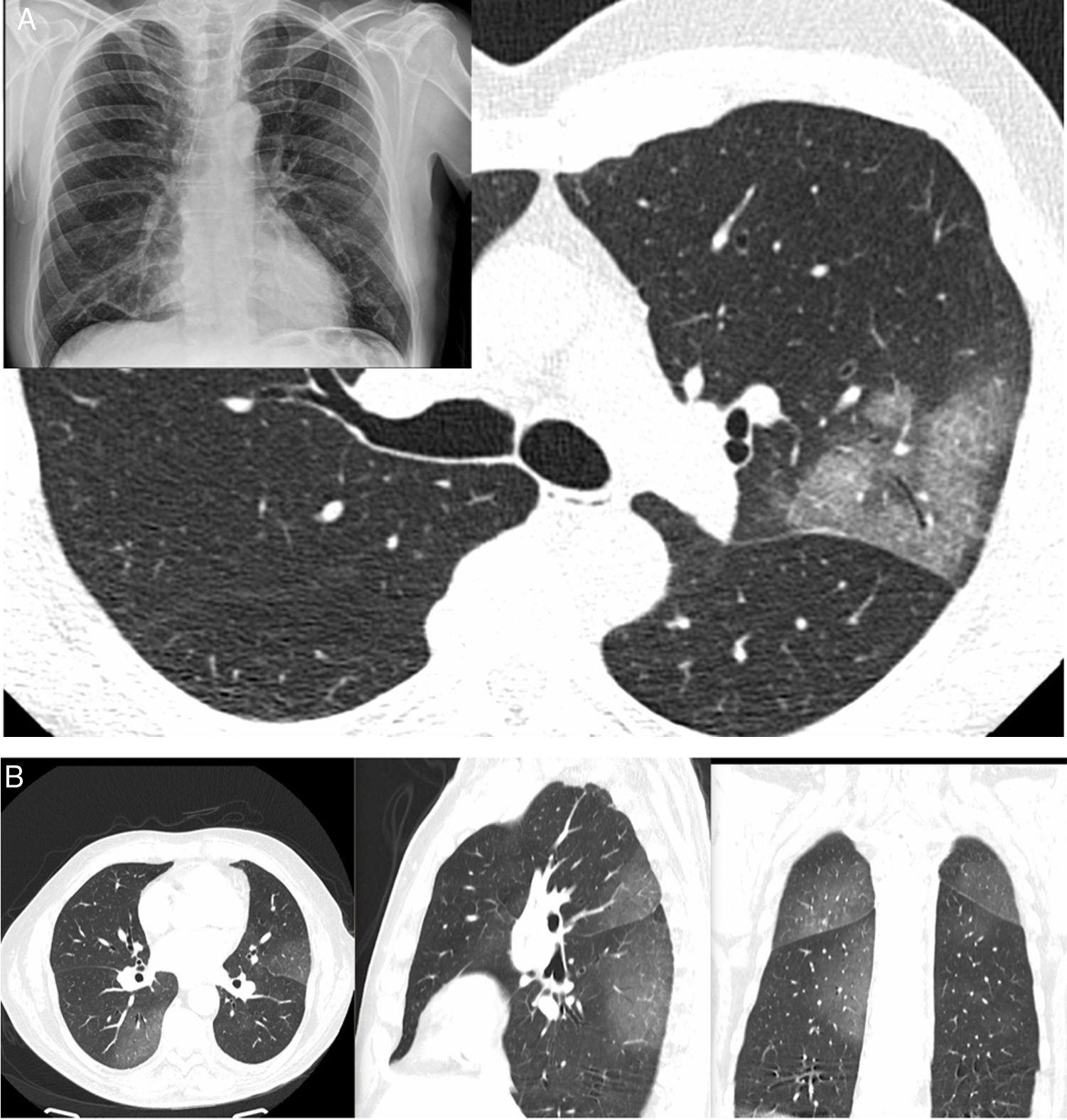
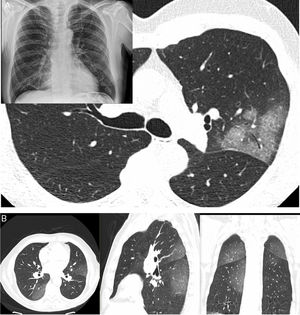
Diagnóstico radiológicoLas radiografías de tórax han sido de gran ayuda para el triaje de pacientes y de forma especial como criterio para evaluar el ingreso hospitalario cuando mostraban manifestaciones radiológicas extensas. Por otra parte, la TC representa una prueba con alta fiabilidad en el diagnóstico (sensibilidad del 98%) con posibilidad de evaluar criterios de gravedad y progresión de la enfermedad. Los estudios de alta resolución muestran aumentos de atenuación multifocales, que siguen patrones radiológicos “en vidrio deslustrado” y consolidación con una distribución periférica, bilateral y ligera predilección por los campos pulmonares inferiores y posteriores. Esta distribución se demostró desde los primeros artículos publicados. Es menos común encontrar lesiones únicas (25%) que solían verse en pacientes en estadios más iniciales de la enfermedad (fig. 2)27.
A) Varón de 61 años (sanitario). Presenta fiebre, astenia, mialgias y tos de 4 días de evolución (PCR positiva). Radiografía de tórax con borramiento de la silueta cardíaca derecha (el paciente tenía un pectus excavatum) y donde se apreciaba también un sutil aumento de densidad en el lóbulo superior izquierdo (LSI), motivo por el cual se realizó una tomografía computarizada (TC). La TC demostró una lesión con un patrón en empedrado y broncograma aéreo en el LSI, no apreciándose otras lesiones en el resto del pulmón. B) Varón de 66 años con clínica sospechosa de COVID-19 de 6 días de evolución. Fiebre y tos importantes sin expectoración llamativa. Ageusia y anosmia. No disnea. PCR negativa. La TC muestra aumentos de densidad bilaterales periféricos de predominio posterior, siguiendo un patrón “en vidrio deslustrado”.
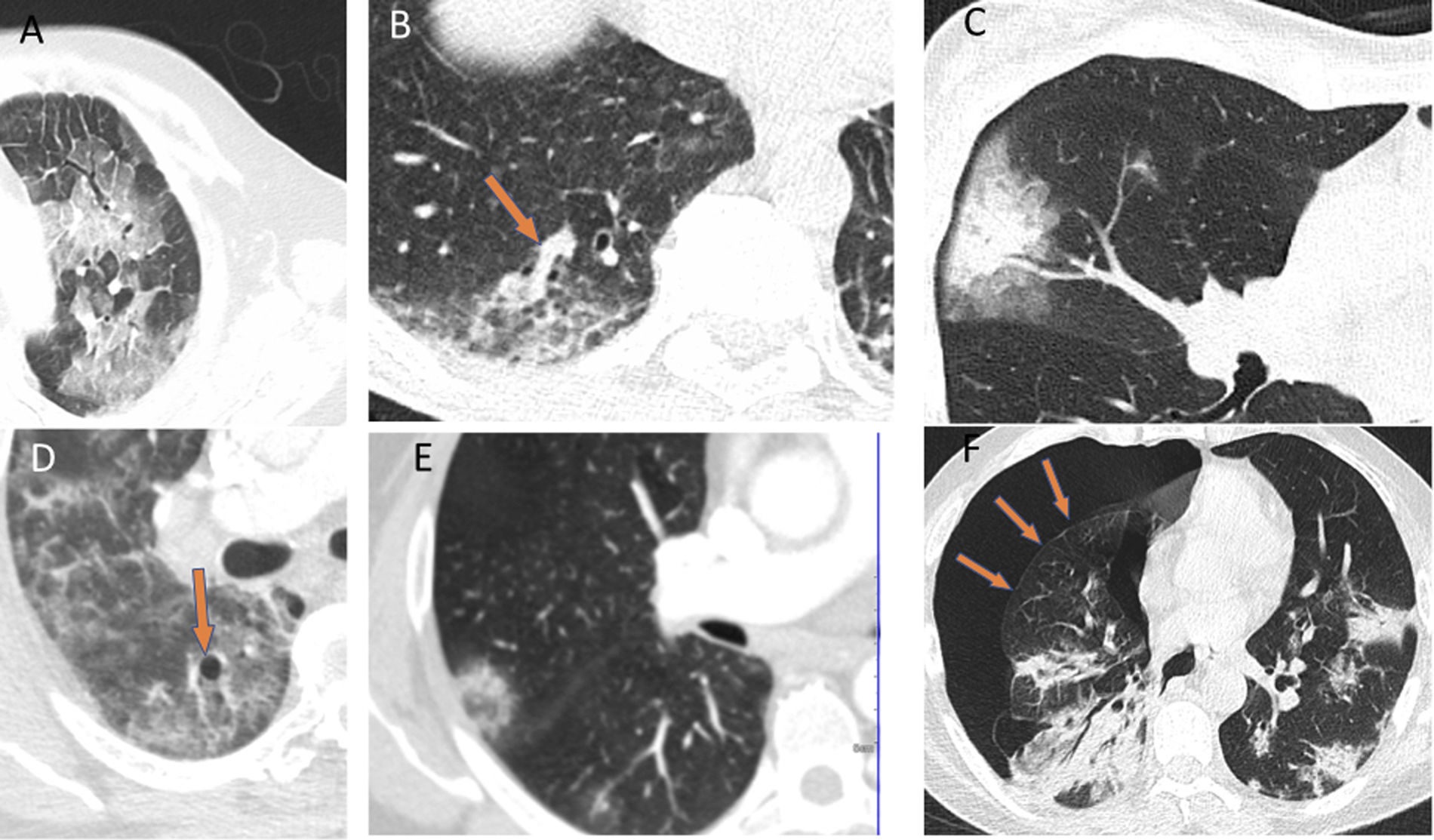
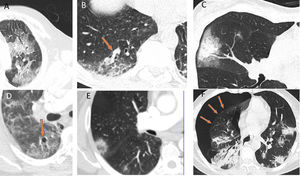
Dentro de los diferentes patrones radiológicos, el patrón “en vidrio deslustrado” fue el más frecuente (77%). No es habitual encontrar adenopatías ni derrame pleural o pericárdico, salvo en pacientes graves o en aquellos que están ingresados en la UCI, posiblemente con infecciones secundarias o insuficiencia cardiaca. Otros hallazgos que pueden encontrarse son: un patrón en empedrado (crazy paving), el signo del halo, el signo del halo invertido, un engrosamiento vascular, broncograma aéreo, quistes aéreos y en algunos casos neumotórax espontáneo. Sin embargo, estos últimos hallazgos son menos frecuentes y específicos de esta entidad (fig. 3)28–30.
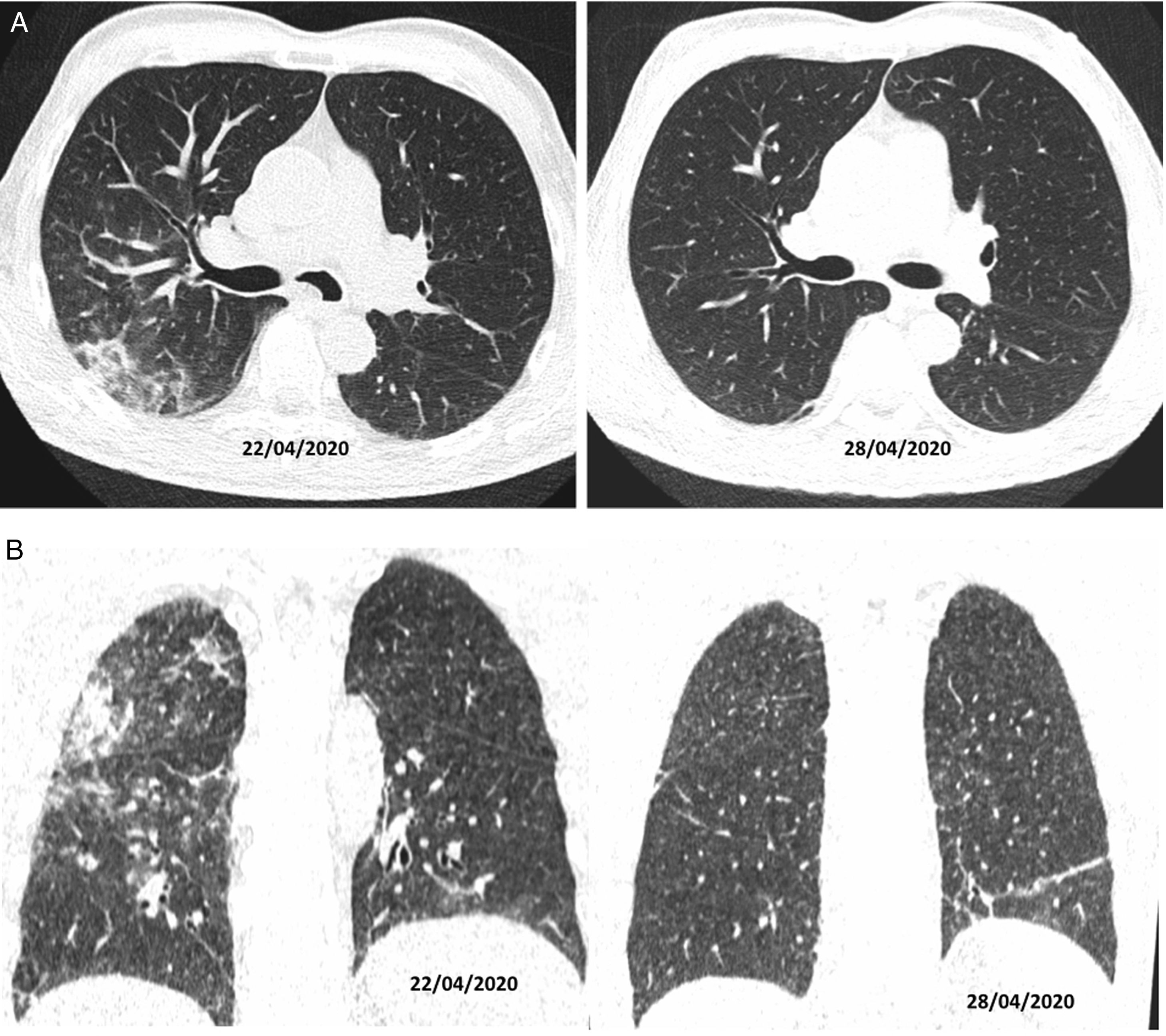
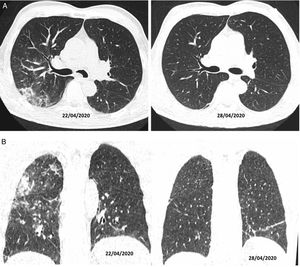
Autores como Duan et al. y Berheim et al. documentaron una evolución de estos patrones respecto al inicio de los síntomas, y clasificaron la enfermedad COVID-19 en una fase temprana (0-2 días), una fase intermedia (3-5 días) y una fase tardía (6-12 días)31,32. En los primeros días (media 4 ± 2 días) no era infrecuente encontrar estudios normales o con un patrón en vidrio deslustrado, bien de forma aislada (fig. 2A) o multifocal (fig. 2B). Pero, según evolucionaban, se superponía o asociaba un patrón en empedrado y consolidaciones que, en los casos graves, confluían para acabar mostrando un patrón radiológico de SDRA. Cuando la evolución clínica era favorable, estos aumentos de densidad disminuían progresivamente en las siguientes 2 semanas, dejando imágenes reticulares o lineales (fibrous stripe y bandas subpleurales). A partir de la tercera semana, la imagen radiológica mostraba una mejoría importante con mínimas lesiones residuales. En algunos casos con enfermedad leve-moderada y que recibían tratamiento con corticoides se podía apreciar un aclaramiento radiológico de las lesiones a los pocos días del tratamiento (fig. 4)33.
Tomografía computarizada en plano axial (A) y coronal (B). Varón de 56 años, diabético, con clínica de malestar y fiebre de 39°C, sin tos, de 10 días de evolución. Es tratado con hidroxicloroquina, ceftriaxona y azitromicina. Al sexto día del ingreso, dado que clínicamente no evolucionaba bien, se decidió tratamiento con corticoides (22/04/2020) con los que mostró mejoría clínica y radiológica a los 4 días del tratamiento (28/04/2020).
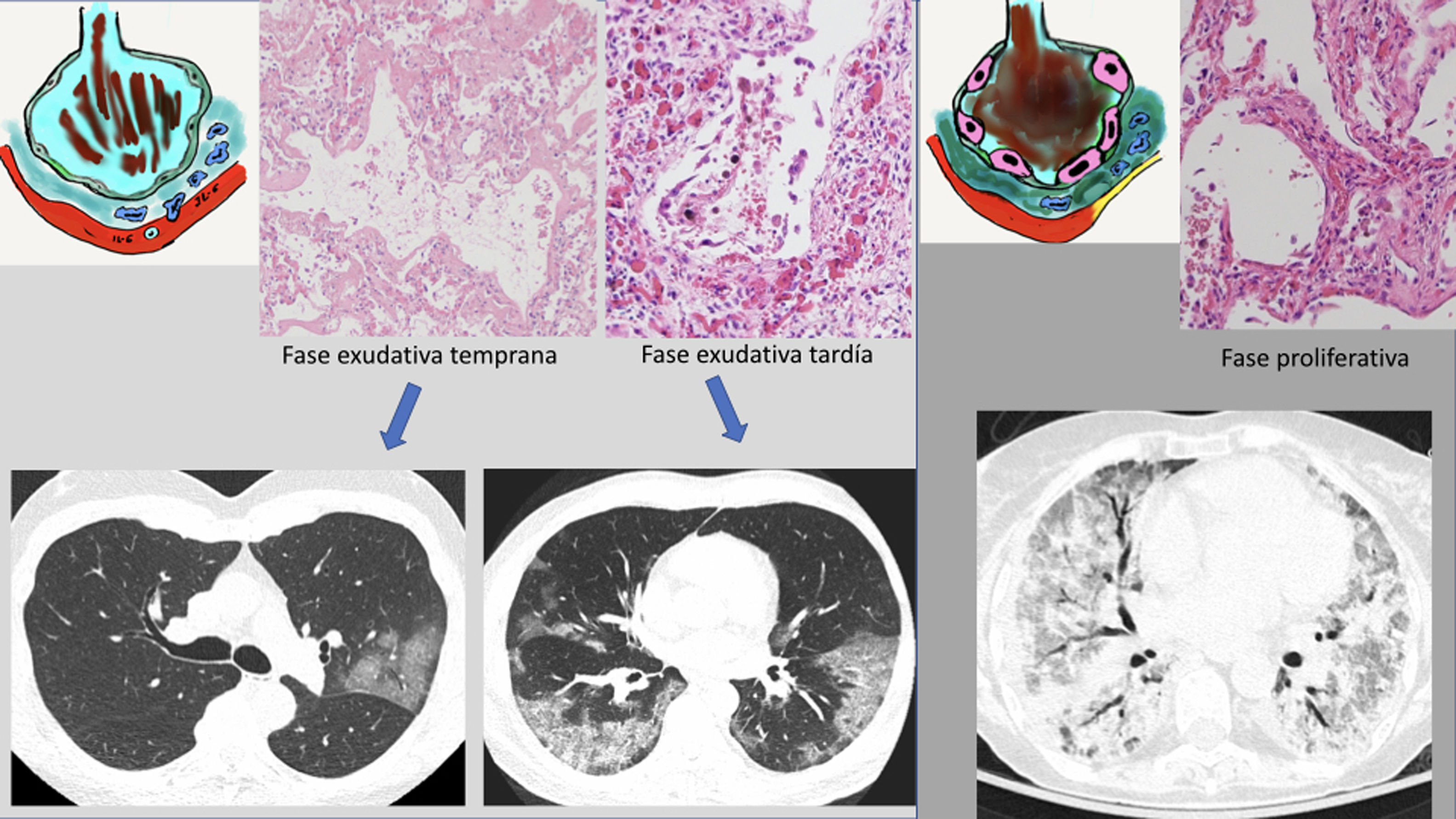
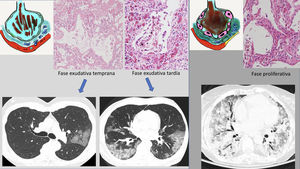
Estos cambios radiológicos reflejan el sustrato histológico descrito en las autopsias y biopsias realizadas en los pacientes con SARS-1 y COVID-19. El hallazgo histológico común es el “daño alveolar difuso” propio de un SDRA en sus distintas fases34–36. En los primeros días, existe una fase temprana o exudativa, caracterizada por un daño alveolar difuso con edema intersticial agudo, congestión capilar y exudados en el espacio aéreo compuestos por líquido, fibrina y hematíes. Estos cambios explican la aparición radiológica de los patrones “en vidrio deslustrado” y patrón “en empedrado”. La congestión vascular podría representar el signo de engrosamiento vascular visto en la TC y que ha sido descrito como característico de los pacientes con COVID-19 (59% en COVID-19 frente a 22% de otras neumonías víricas)37. En una fase más tardía (a partir de la primera semana), este exudado se hace más compacto y de apariencia eosinofílica, con mayor formación de membranas hialinas especialmente a lo largo de las paredes de los conductos alveolares y de los bronquiolos respiratorios distales38,39. Radiológicamente expresaría la evolución hacia la consolidación. La fase proliferativa (desde la segunda a la cuarta semana) muestra cambios con proliferación de fibroblastos en los espacios alveolares y en el intersticio, así como una hiperplasia del neumocito tipo II, que engruesan las paredes alveolares. Pueden aparecer células inflamatorias mononucleares, sobre todo macrófagos y linfocitos40,41. Radiológicamente, explicaría los hallazgos tardíos como la evolución de las consolidaciones pulmonares hacia un patrón más lineal. El resultado final de las dos primeras fases es el depósito de colágeno maduro, que condiciona una evolución hacia la fibrosis intersticial crónica. Sin embargo, en los pacientes con evolución favorable, la mayor parte de la proliferación fibroblástica se resuelve sin una fibrosis residual funcionalmente significativa42,43 (fig. 5).
Propuesta de correlación radiopatológica de las diferentes fases del síndrome de distrés respiratorio agudo en COVID-19. A) Fase exudativa o temprana, donde aparece edema alveolar con hemorragia y membrana hialina. Sustancias proinflamatorias (IL-6) con activación celular (macrófagos) que provocan daño endotelial con ingurgitación vascular. B) Fase más tardía, donde las alteraciones progresan (consolidaciones). C) Fase proliferativa, con gran número de membranas hialinas alveolares e hipertrofia de neumocitos tipo II. Aumento del colágeno que condiciona la formación de fibrosis intersticial. Formación de trombos de fibrina (trombosis microvascular). Ver texto.
Otro hallazgo histológico es la aparición de infartos en el parénquima pulmonar, hemorragia alveolar y trombos de fibrina44. Los infartos pulmonares (25% de los pacientes) y la hemorragia alveolar se han descrito en aquellos con un curso clínico mayor de 10 días. Los trombos de fibrina, que por otro lado son un hallazgo común en el daño alveolar difuso, característicamente afectan a arterias de pequeño calibre tanto en la fase temprana como tardía. Es evidente que los pacientes con COVID-19 tienen un estado protrombótico que podría explicarse por la existencia del SIRS, ya que el aumento de los niveles de IL-6 y TNF, así como la activación de las plaquetas y el daño en las células endoteliales, activan la vía extrínseca de la coagulación a través del factor tisular y la vía intrínseca por los factores de la coagulación. La trombina transforma el fibrinógeno en fibrina, la cual está presente en trombos de vasos de pequeño calibre y distales que pueden alterar funcionalmente diferentes órganos, por lo que se aconseja la anticoagulación sistémica de los pacientes con COVID-19. No hay que olvidar que la propia infección o sepsis puede llevar al paciente a situaciones de deshidratación, y junto a otros factores de riesgo protrombótico como la obesidad y el encamamiento explicarían la aparición relativamente frecuente de embolismo pulmonar45,46.
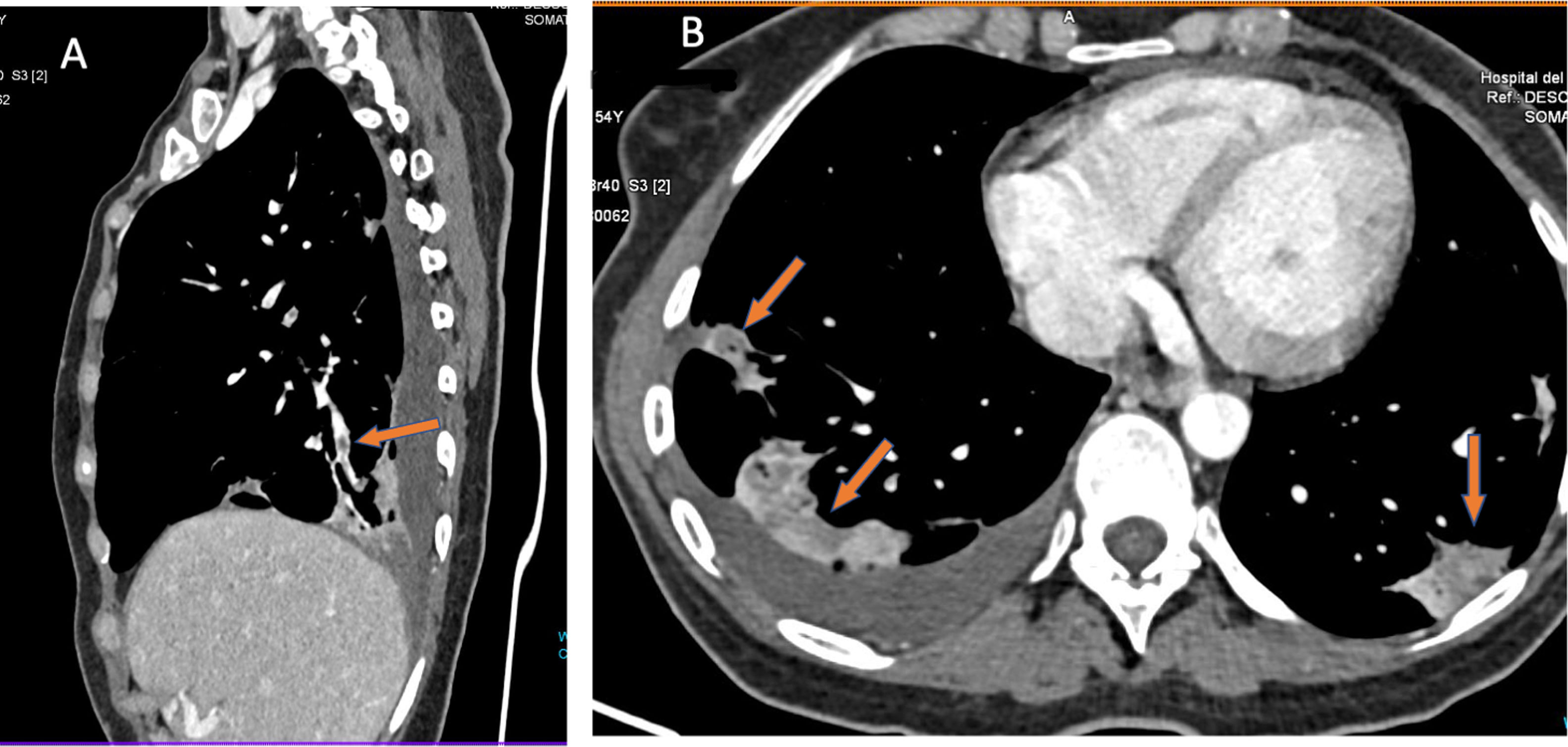
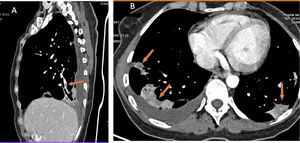
En los estudios de TC con evidencia de enfermedad tromboembólica, curiosamente, los trombos suelen ser pequeños, segmentarios o subsegmentarios (fig. 6). Se cuestionó entonces si la elevación del dímero D se debería a la existencia de trombos arteriales tan pequeños que no fueran visibles por la limitada resolución espacial de la TC47. Con este fin hemos estudiado pacientes con enfermedad COVID-19 y elevación del dímero D, realizando TC con contraste y adquisición de doble energía. En los casos que tenían tromboembolismo pulmonar (TEP) se observaban defectos de perfusión característicos asociados a consolidaciones pulmonares que mostraban zonas de baja atenuación bien delimitadas en territorios vasculares donde no se apreciaba trombo arterial. Este hallazgo podría explicarse por una obstrucción vascular en vasos pequeños y distales no visible en la TC (fig. 6).
Paciente con COVID-19 y tromboembolismo pulmonar. Dímero D de 12 556 ng/ml. Tomografía computarizada con contraste intravenoso. A) Muestra defectos de repleción en arterias pulmonares distales (segmentarias). B) Es llamativo, en la imagen axial, la existencia de zonas de menor densidad en las consolidaciones pulmonares, lo que sugiere zonas de infarto. Este signo, cuando se aprecia, debe alertar sobre la posibilidad de tromboembolismo pulmonar y volver a valorar su presencia en vasos distales y pequeños.
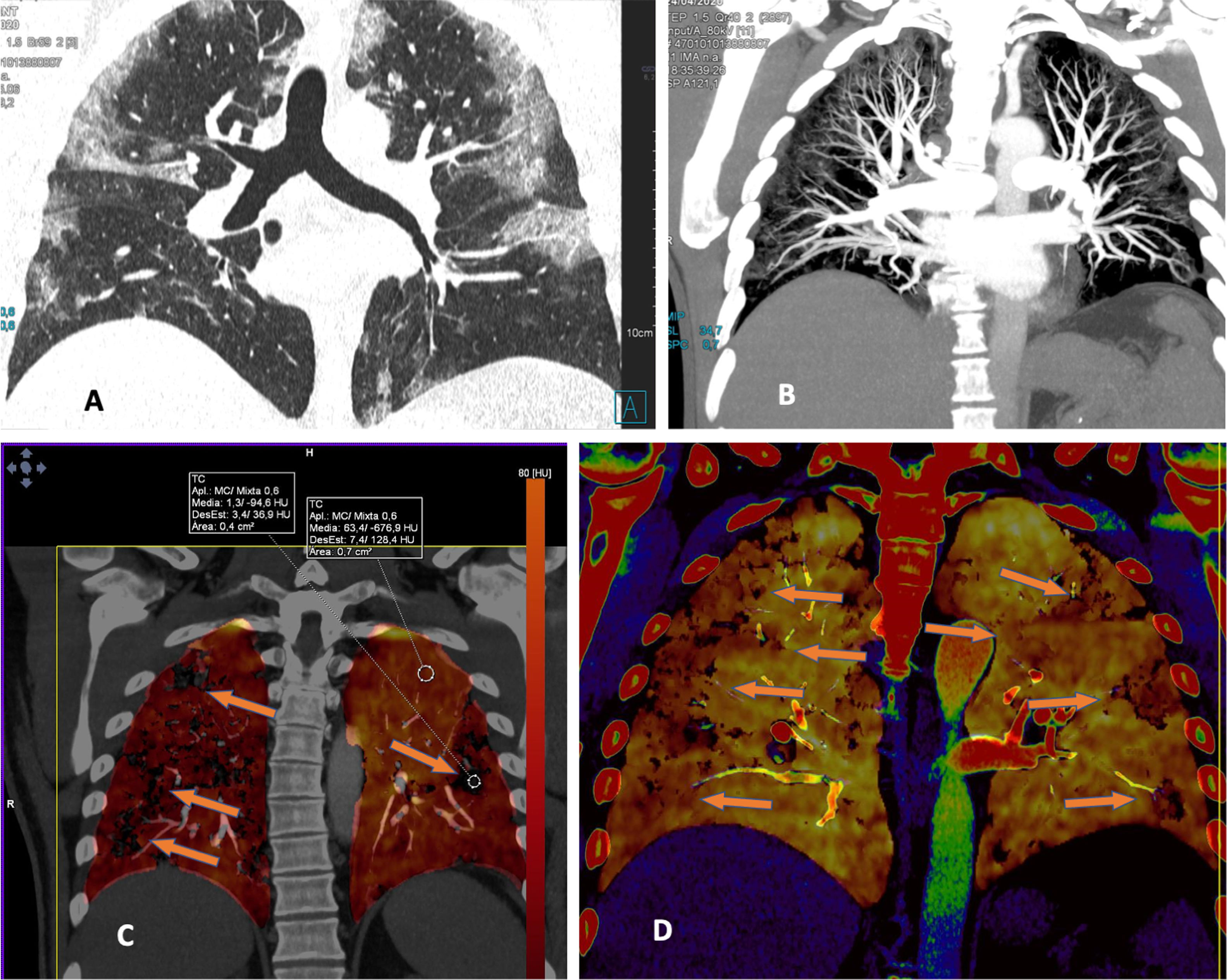
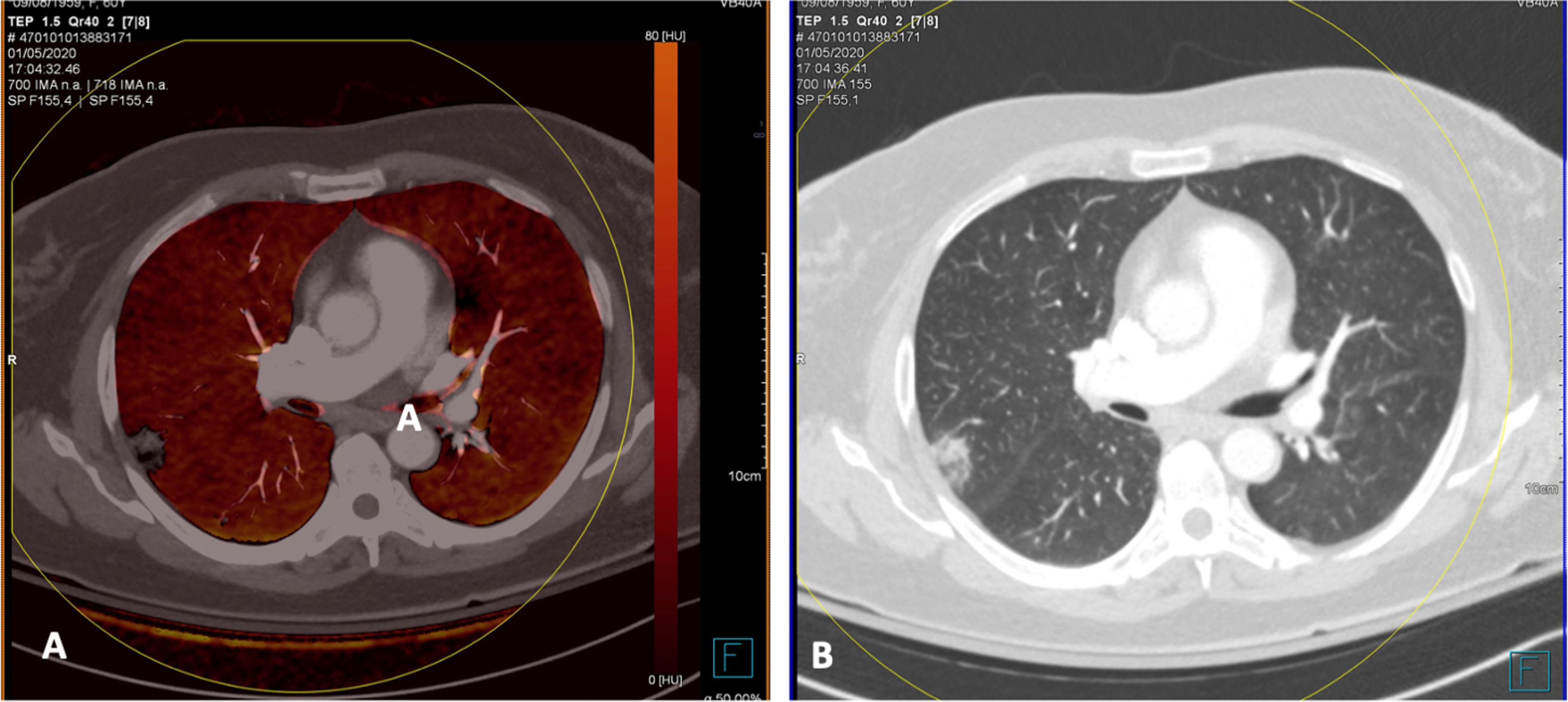
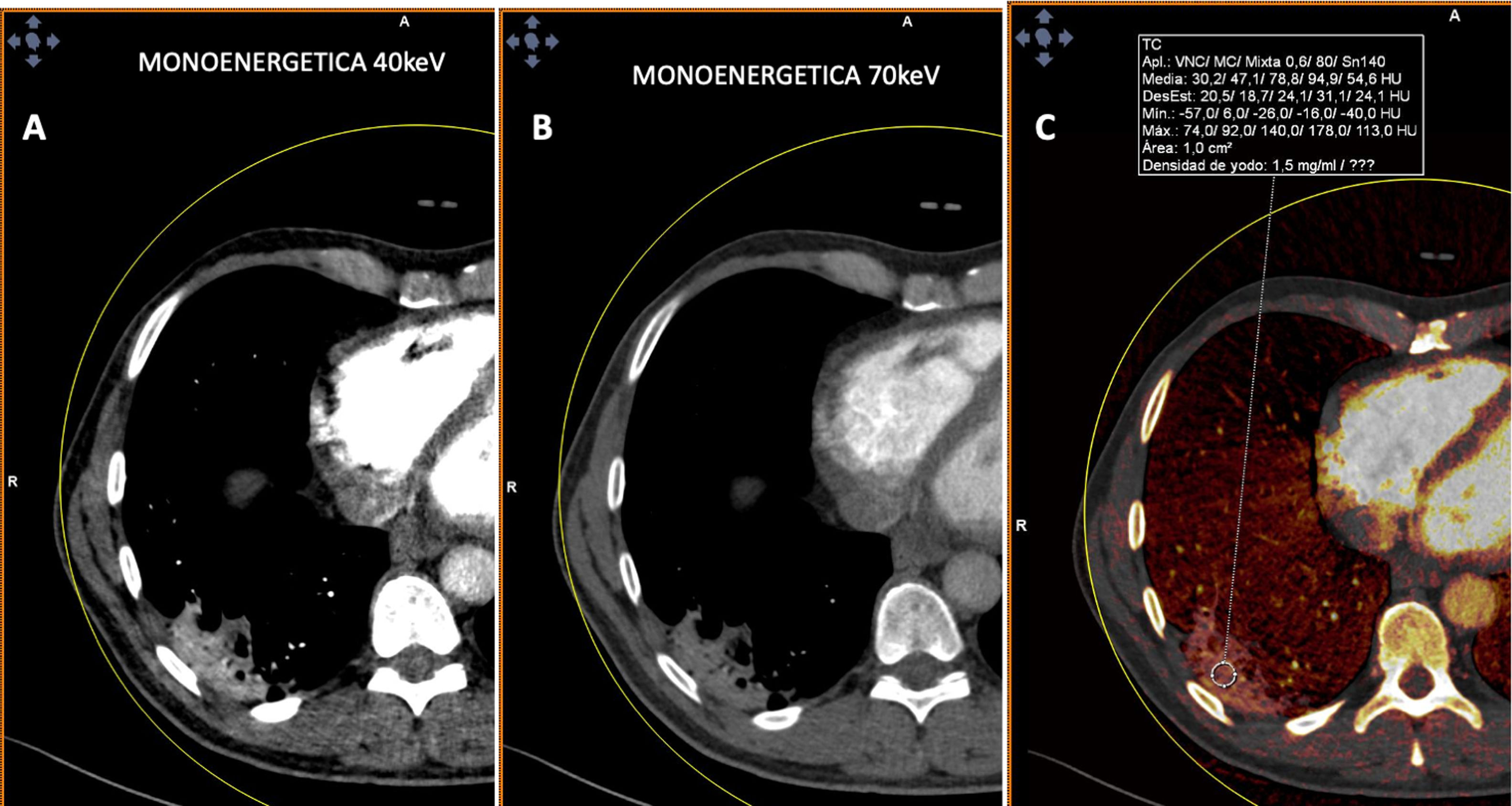
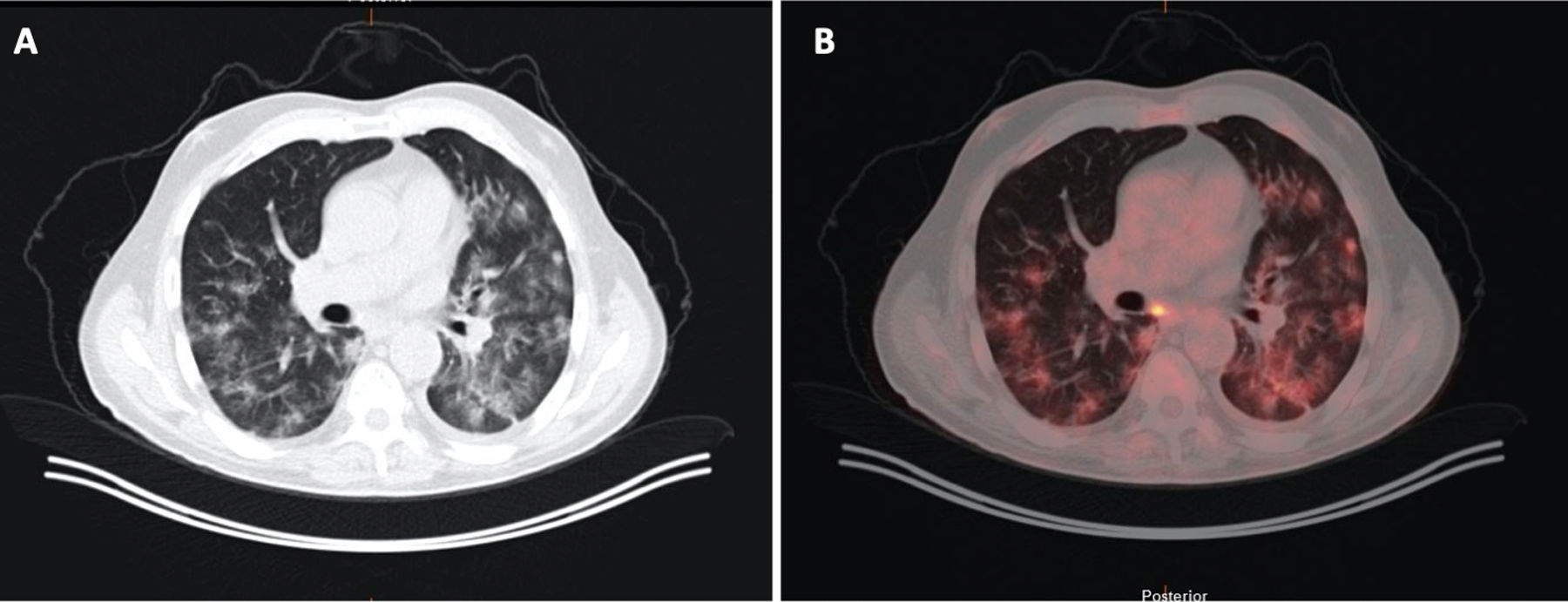
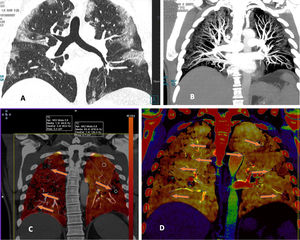
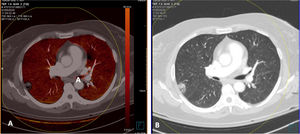
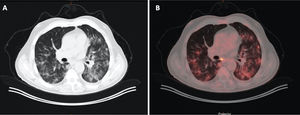
En cambio, en los pacientes que no mostraban TEP, cuando la enfermedad era extensa con múltiples lesiones pulmonares, se apreciaban zonas parcheadas de menor captación en las imágenes PBV (Pulmonary Blood Volume o mapa de perfusión pulmonar obtenido con energía dual). Posicionando una ROI (region of interest) en estas zonas, el realce de contraste era menor que en las zonas de pulmón sano. Construyendo mapas de color con dinteles de densidad más estrechos existían áreas de hipoperfusión pulmonar (fig. 7)48. Sin embargo, cuando las lesiones eran menores o la enfermedad más leve, no se observaban defectos de perfusión (fig. 8A) y las reconstrucciones e imágenes monoenergéticas de baja energía (40 KeV) permitían ver la permeabilidad de los vasos más distales. Además, las lesiones en vidrio deslustrado y sobre todo las consolidaciones podían captar contraste, lo que apoyaría, cuando la enfermedad es menos extensa y probablemente también en las fases iniciales, un origen inflamatorio (fig. 9). De forma similar, estudios de medicina nuclear realizados mediante 18FDG PET/TC muestran también un aumento de la actividad metabólica en las lesiones pulmonares, confirmando el componente inflamatorio como causa más probable de la afectación pulmonar (fig. 10)49. Como en muchos signos de esta enfermedad, no existe una clara explicación para estos hallazgos. Sin embargo, es planteable la hipótesis de que la infección vírica pulmonar en fases iniciales tiene un comportamiento inflamatorio; de hecho, en muchos casos se comporta, radiológicamente, como una neumonía organizativa criptogenética50, lo que explicaría la captación de las lesiones en las pruebas de imagen y resolución con tratamiento antiinflamatorio.
Mujer sanitaria con sospecha de infección. PCR positiva. Radiografía de tórax normal. Se instaura tratamiento con hidroxicloroquina y azitromicina. Durante los siguientes 4 días persiste la fiebre y un deterioro progresivo con disnea y desaturación. Aumento de los marcadores inflamatorios (IL-6). Elevación del dímero D desde 322 a más de 4000 ng/ml. A) Tomografía computarizada (TC), ventana de pulmón donde se aprecian extensas lesiones bilaterales y periféricas. B) Angio-TC (doble energía) en la que no se evidencia tromboembolismo pulmonar. Reconstrucción MIP que permite ver vasos distales incluso en el interior de las consolidaciones pulmonares. C) Imagen PBV de perfusión pulmonar (Pulmonary Blood Volume; software Lung Analysis; Siemens Healthineers) que muestra zonas parcheadas de defectos de perfusión que corresponden básicamente a las zonas de consolidación que muestran menor captación de contraste (captación de 1,3 UH), comparativamente con zonas de pulmón sano (captación 63,4 UH). D) Reconstrucción coronal con dinteles de densidad más estrechos, donde se puede observar una menor captación de las zonas periféricas del pulmón (hipoperfusión), más pronunciada en el lado derecho (ver texto).
Paciente con COVID-19, que presentaba varias lesiones de alta atenuación pulmonares. Tomografía computarizada de doble energía. Angio-TC (doble energía) donde no se apreciaron datos de tromboembolismo pulmonar (TEP). A) Imagen de mapa PBV (Pulmonary Blood Volume) donde no se aprecian defectos de perfusión que fueran característicos de TEP, mostrando una perfusión homogénea del parénquima pulmonar. B) Ventana de pulmón que muestra una de las lesiones pulmonares con signo de halo invertido.
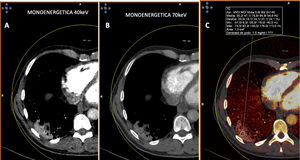
Paciente con COVID-19. Tomografía computarizada de doble energía. A y B) Imágenes monoenergéticas que muestran captación de la consolidación posterior y basal derecha, más evidente en la imagen monoenergética de baja energía (40 KeV). C) Imagen de mapa de yodo donde se aprecia captación de la lesión con aumento de densidad de 47 UH.
Varón de 71 años con antecedente de carcinoma de colon, donde en un control se apreció un nódulo pulmonar indeterminado. A) Imagen de tomografía computarizada (TC) con ventana de pulmón. B) Imagen de fusión PET/TC que muestra aumentos de densidad bilaterales característicos de COVID-19, los cuales muestran captación metabólica.
Si la enfermedad evoluciona, aumenta el daño alveolar y por tanto las zonas no ventiladas, y se altera la relación entre la ventilación y la perfusión (V/Q). Es decir, las zonas pulmonares mal ventiladas conllevan un reflejo de vasoconstricción arterial, denominado efecto “Von-Euler-Lijestrand”, fundamentalmente en los capilares alveolares, y explicaría las zonas de hipoperfusión pulmonar en las áreas en vidrio deslustrado y consolidación, así como en las zonas adyacentes. Se trataría de un compromiso de la ventilación-perfusión tipo shunt o de cortocircuito, y explicaría las alteraciones gasométricas con disminución de la PO2 y un aumento del gradiente alvéolo-arterial de oxígeno. Los pacientes hiperventilan para poder aumentar la saturación de oxígeno de la hemoglobina, pero en las zonas respetadas del pulmón, la hemoglobina está saturada (efecto de la curva de disociación de la hemoglobina), pero permite eliminar el CO2, ya que la difusibilidad del CO2 es 20 veces mayor que la del oxígeno. Este mecanismo explicaría cómo los pacientes muestran hipoxemia con normo- o hipocapnia. La administración de oxígeno al 100% puede mejorar esta situación, al reclutar parte de los alvéolos alterados51.
En conclusión, el virus SARS-2, perteneciente a la familia de los coronarvirus, infecta las células alveolares, por una afinidad de los receptores ECA II con la proteína “S” del virus, entrando en la célula por un mecanismo de endocitosis y replicándose intracelularmente. Este mecanismo activa la inmunidad innata o celular como primera respuesta inmunitaria y activa la producción de citoquinas. Una respuesta mal regulada conlleva un SIRS o “tormenta de citoquinas” causando daño celular. En el pulmón se produce el daño alveolar como respuesta inflamatoria, que explicaría las alteraciones radiológicas con los patrones en vidrio deslustrado y condensaciones. Una evolución grave de la enfermedad condiciona un mayor daño alveolar y provoca en muchos enfermos un patrón de SDRA en estadio final. El daño alveolar conlleva una alteración de la V/Q tipo shunt, produciéndose una vasoconstricción refleja de los capilares pulmonares que explicaría las zonas de hipoperfusión pulmonar que se muestran en los modelos de perfusión de los estudios de TC con doble energía, así como las alteraciones gasométricas de estos pacientes.
Autoría1. Responsable de la integridad del estudio: GCFP.
2. Concepción del estudio: GCFP, MOM, MVC, AFL, PFR.
3. Diseño del estudio: GCFP, PFR, MDB, ABL, MCC.
4. Obtención de datos: GCFP, MOM, MBD, PFR, JMOC, MCC.
5. Análisis e interpretación de los datos: MOM, PFR, MVC, GCFP, MDB, AFL, MCC.
6. Tratamiento estadístico: N/A.
7. Búsqueda bibliográfica: MOM, MVC, GCFP, MDB, JMOC, AFL, PFR.
8. Redacción del trabajo: GCFP, MVC, MOM, MCC, AFL, PFR.
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MVC, MOM, MCC, AFL, PFR, MCC, PFR.
10. Aprobación de la versión final: GCFP, MOM, PFR, MVC, MCC, MDB, AFL, JMOC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento especial a Lucía Fernández por su apoyo y diseño de los dibujos.