El coronavirus SARS-CoV-2, responsable de la pandemia actual, afecta preferentemente al tracto respiratorio, con un número creciente de publicaciones sobre su predisposición a fenómenos trombóticos.
ObjetivoConocer la prevalencia de tromboembolismo pulmonar (TEP) en pacientes con COVID-19; determinar su posible relación con la gravedad de la enfermedad pulmonar y los niveles de dímeros D, y analizar la localización del TEP en pacientes con COVID-19 comparándolos con los pacientes sin COVID-19.
MétodoEstudio retrospectivo de todas las angio-TC de arterias pulmonares realizadas por sospecha de TEP del 15 de marzo al 30 de abril de 2020. Se compara con las angio-TC realizadas durante el mismo periodo en 2019.
ResultadosSe incluyeron 492 angio-TC pulmonares, 342 (69,9%) de pacientes con COVID-19 y 147 (30,1%) de pacientes sin infección. La prevalencia de TEP fue del 26% en el grupo COVID-19 positivo y del 16,3% en el negativo (p=0,0197), con un riesgo relativo de 1,6 veces. La prevalencia de TEP en el mismo período del año 2019 fue del 13,2%, similar a la del grupo COVID-19 negativo del año 2020 (p=0,43). No hubo diferencias significativas en el nivel de dímeros D ni en la localización del TEP entre ambos grupos. El 78,7% de los pacientes con COVID-19 con TEP mostraron una extensión de la afectación pulmonar moderada o grave en la tomografía computarizada.
ConclusionesLos pacientes con COVID-19 tienen una prevalencia aumentada de TEP (26%) y la mayoría (78,7%) presentan una extensión moderada o grave de afectación pulmonar en la tomografía computarizada. No hay diferencias significativas en la localización del material embólico ni en el grado de elevación de dímero-D respecto a los pacientes sin COVID-19.
SARS-CoV-2, the virus responsible for the current pandemic, predominantly affects the respiratory tract, and a growing number of publications report the predisposition of patients with COVID-19 to develop thrombotic phenomena.
ObjectiveTo determine the prevalence of pulmonary embolism in patients with COVID-19; to determine the possible relationship between the severity of pulmonary involvement and D-dimer levels; to analyze the location of pulmonary embolisms in patients with COVID-19 and to compare it with the location in patients without COVID-19.
MethodsThis retrospective study analyzed all CT angiograms of the pulmonary arteries done in patients with suspected pulmonary embolisms between March 15 and April 30, 2020 and compared them with studies done in the same period one year earlier.
ResultsWe included 492 pulmonary CT angiograms (342 (69.9%) in patients with COVID-19 and 147 (30.1%) in patients without COVID-19). The prevalence of pulmonary embolisms was higher in patients with COVID-19 (26% vs. 16.3% in patients without COVID-19, p=0.0197; relative risk=1.6). The prevalence of pulmonary embolisms in the same period in 2019 was 13.2%, similar to that of the group of COVID-19-negative patients in 2020 (p=0.43). There were no significant differences in D-dimer levels or the location of pulmonary embolisms between the two groups. CT showed moderate or severe pulmonary involvement in 78.7% of the patients with COVID-19.
ConclusionsPatients with COVID-19 have an increased prevalence of pulmonary embolisms (26%), and most (78.7%) have moderate or severe lung involvement on CT studies. The location of pulmonary embolisms and the degree of elevation of D-dimer levels does not differ between patients with COVID-19 and those without.
El síndrome respiratorio agudo grave causado por el coronavirus 2 (SARS-CoV-2 por sus siglas en inglés) ha desencadenado una crisis económica y sanitaria sin precedentes, que obligó a la Organización Mundial de la Salud a declarar la existencia de una emergencia de salud pública de distribución mundial el 11 de marzo de 20201. Se trata del mayor desafío médico en décadas. Hasta la fecha de envío de este manuscrito había en España 236259 pacientes diagnosticados, de los cuales 123182 precisaron hospitalización. De ellos, 11364 requirieron ingreso en las unidades de cuidados intensivos. La letalidad estimada de la pandemia en nuestro país es del 11,5%2.
En la mayoría de los pacientes con COVID-19, la enfermedad se manifiesta con clínica respiratoria, fiebre, tos seca, disnea y mialgias. Entre el 17% y el 29% de los pacientes presentan distrés respiratorio y requieren soporte ventilatorio3. Otras características clínicas de estos pacientes son los estados inflamatorios sistémicos, disfunción endotelial, estados de hipercoagulabilidad y fallo multiorgánico4.
El diagnóstico de COVID-19 es microbiológico y se realiza habitualmente mediante identificación del SARS-CoV-2 mediante RT-PCR (reacción en cadena de la polimerasa con transcriptasa inversa), generalmente en muestras nasofaríngeas o de secciones respiratorias. Las pruebas de imagen tienen un papel importante en el diagnóstico y manejo de la enfermedad. La radiografía de tórax en sala convencional o portátil es el primer método de imagen, y en muchos casos, único, en estos pacientes, por su amplia disponibilidad. La tomografía computarizada (TC) torácica tiene una mayor sensibilidad que la radiografía de tórax y permite valorar tanto la afectación pulmonar como sus complicaciones, además de proporcionar diagnósticos alternativos5. La TC se emplea ante ciertas complicaciones que la radiografía de tórax no valora adecuadamente (p. ej., sobreinfección bacteriana con derrame pleural para descartar colecciones pleurales/empiema), ante la falta de disponibilidad de PCR en pacientes con alta sospecha de COVID-19 y con radiografía de tórax normal o en pacientes con mala evolución clínica, especialmente con sospecha de tromboembolismo pulmonar (TEP).
Cada vez son más las referencias bibliográficas que hacen alusión a la presencia de TEP en el contexto de enfermedad COVID-196–8 con elevación de biomarcadores como el dímero D9.
El objetivo de este artículo es conocer la prevalencia de TEP agudo en los pacientes diagnosticados de COVID-19 de un hospital terciario y compararla con la de TEP en aquellos pacientes sin la enfermedad. Entre los objetivos secundarios, analizamos la relación entre la gravedad de la afectación pulmonar y la presencia de TEP, así como la relación con los niveles de dímero-D en sangre en los pacientes con TEP, comparando los pacientes con COVID-19 respecto a aquellos sin COVID-19.
Material y métodosEl estudio se realizó siguiendo las guías éticas de la declaración de Helsinki. Ninguno de los autores tenía conflicto de intereses.
PacientesEstudio retrospectivo que incluye todos los pacientes adultos consecutivos con sospecha de TEP agudo a los que se ha realizado angio-TC de arterias pulmonares en el periodo comprendido entre el 15 de marzo y el 30 de abril de 2020 durante la pandemia por el virus SARS-CoV-2 en un hospital universitario terciario. La indicación de la realización de la angio-TC pulmonar fue por criterio médico, y los principales motivos de solicitud fueron la presencia de deterioro clínico con aparición de disnea o empeoramiento de la existente, desaturación, dolor torácico y elevación de los niveles de dímero-D.
Las características demográficas, clínicas y de laboratorio se obtuvieron de forma anonimizada de la historia clínica electrónica del paciente.
Se clasificaron como:
- 1.
Pacientes con COVID-19, aquellos con PCR positiva o en su defecto, aquellos con clínica compatible (síntomas respiratorios, fiebre, tos seca, disnea y mialgias) y lesiones parenquimatosas pulmonares características de infección COVID-19 en la TC torácica (opacidades en vidrio deslustrado o consolidaciones alveolares, de distribución bilateral y periférica)10.
- 2.
Se consideraron pacientes COVID-19 negativos aquellos sin PCR positiva y sin sospecha clínica ni radiológica mediante TC torácica de COVID-19.Aunque el diagnóstico de COVID-19 es microbiológico, se han incluido en el grupo COVID-19 además de los pacientes con PCR positiva (pacientes con COVID-19 confirmado), aquellos otros con clínica y hallazgos típicos de COVID-19 en la TC torácica con PCR negativa o no realizada (pacientes con COVID-19 probable), ya que la sensibilidad de la PCR es relativamente baja (60-70%), con una tasa de falsos negativos descrita del 30% en las muestras nasofaríngeas11, que varía según el tiempo transcurrido desde la exposición al SARS-CoV-2, con una tasa del 67% al 100% en el periodo presintomático y del 66% alrededor del día 21 del comienzo de los síntomas12. Por otro lado, se ha descrito que la TC torácica tiene una sensibilidad mayor del 90% para el diagnóstico de COVID-1913 y puede mostrar características típicas de la enfermedad incluso cuando la PCR es negativa o el paciente es asintomático14. Esto es especialmente útil en pacientes con alta sospecha clínica, bien por clínica sugestiva o historia de exposición, en los periodos de alta prevalencia de la enfermedad. Nuestro estudio se ha realizado en el pico de mayor prevalencia de la pandemia, en periodo de transmisión comunitaria.
En los pacientes con COVID-19 y TEP se registró el tiempo transcurrido desde el inicio de la clínica infecciosa hasta el evento embólico.
Se recogieron los valores de los dímeros D en los pacientes con TEP y se corrigieron según la edad del paciente15,16.
Por último, se analizaron de forma retrospectiva las angio-TC de arterias pulmonares solicitadas por sospecha de TEP agudo durante el mismo periodo del año 2019 para determinar su prevalencia en el mismo medio en ambiente no epidémico.
Angio-TC de arterias pulmonaresTodas las exploraciones de angio-TC de arterias pulmonares se realizaron en equipos de 64 o 16 detectores (Phillips Brilliance, Phillips Medical System, Eindhoven, Netherlands). Los parámetros de adquisición fueron: 120 kVp, 50-350mA, con modulación de dosis y una colimación de 64×̴0,625mm o 16×0,75mm, tiempo de rotación 0,8 s, con grosor de 2mm e intervalo de reconstrucción de 1mm. Las imágenes se reconstruyeron con algoritmo de partes blandas.
La exploración se realizó con el paciente en decúbito supino, en apnea o con respiración suave según la situación clínica del paciente, y cobertura desde el opérculo torácico hasta el diafragma.
Se administraron 50-90mL de contraste intravenoso iodado no iónico “Ioexol” (Omnipaque 350; GE Health Ireland), con una tasa de inyección de 4 mL/s mediante inyector (Medrad, Stellant, Pittsburgh, Pennsylvania, USA). Para conseguir la opacificación intravascular óptima se coloca un detector automático (ROI) en el tronco de la arteria pulmonar a nivel del cruce con la aorta, y se establece un umbral de 150 UH (unidades Hounsfield).
Análisis de imágenesTodos los estudios fueron evaluados por un residente de radiodiagnóstico de tercer o cuarto año y supervisados por al menos un radiólogo de la sección de urgencias o de la sección de tórax, con al menos 15 años de experiencia. Las discrepancias se resolvieron por consenso entre dos de los radiólogos de mayor experiencia.
Todas las angio-TC de arterias pulmonares fueron valoradas desde el punto de vista de la calidad de la imagen. Se considera un estudio de buena calidad aquel que presenta buena opacificación del árbol arterial pulmonar y que permite visualizar correctamente la anatomía vascular al menos hasta el nivel segmentario. Se considera un estudio de baja calidad aquel cuyas imágenes no son óptimas para la adecuada valoración de la anatomía del árbol arterial pulmonar. Las causas de la insuficiente calidad de la imagen son: presencia de artefactos de movimiento (artefactos de movimiento respiratorio por falta de tolerancia a la apnea), opacificación intravascular insuficiente y presencia de ruido, fundamentalmente en el caso de pacientes obesos.
El análisis de las imágenes se realizó en estaciones de trabajo diagnósticas (Philips Workstation), basadas en un grosor de corte efectivo de 1mm, empleando técnicas de posproceso de la imagen. Se empleó un grosor de corte fino para valorar la luz de las arterias pulmonares desde su origen, evitando el solapamiento con las venas pulmonares. Las imágenes se valoraron con ventana de pulmón (1500, -500 UH), con ventana de mediastino (350, 50 UH) y con ventana angiográfica (700, 100 UH). El posprocesado de la imagen se realizó con técnica MIP (proyección de máxima intensidad) y MPR (reconstrucción multiplanar).
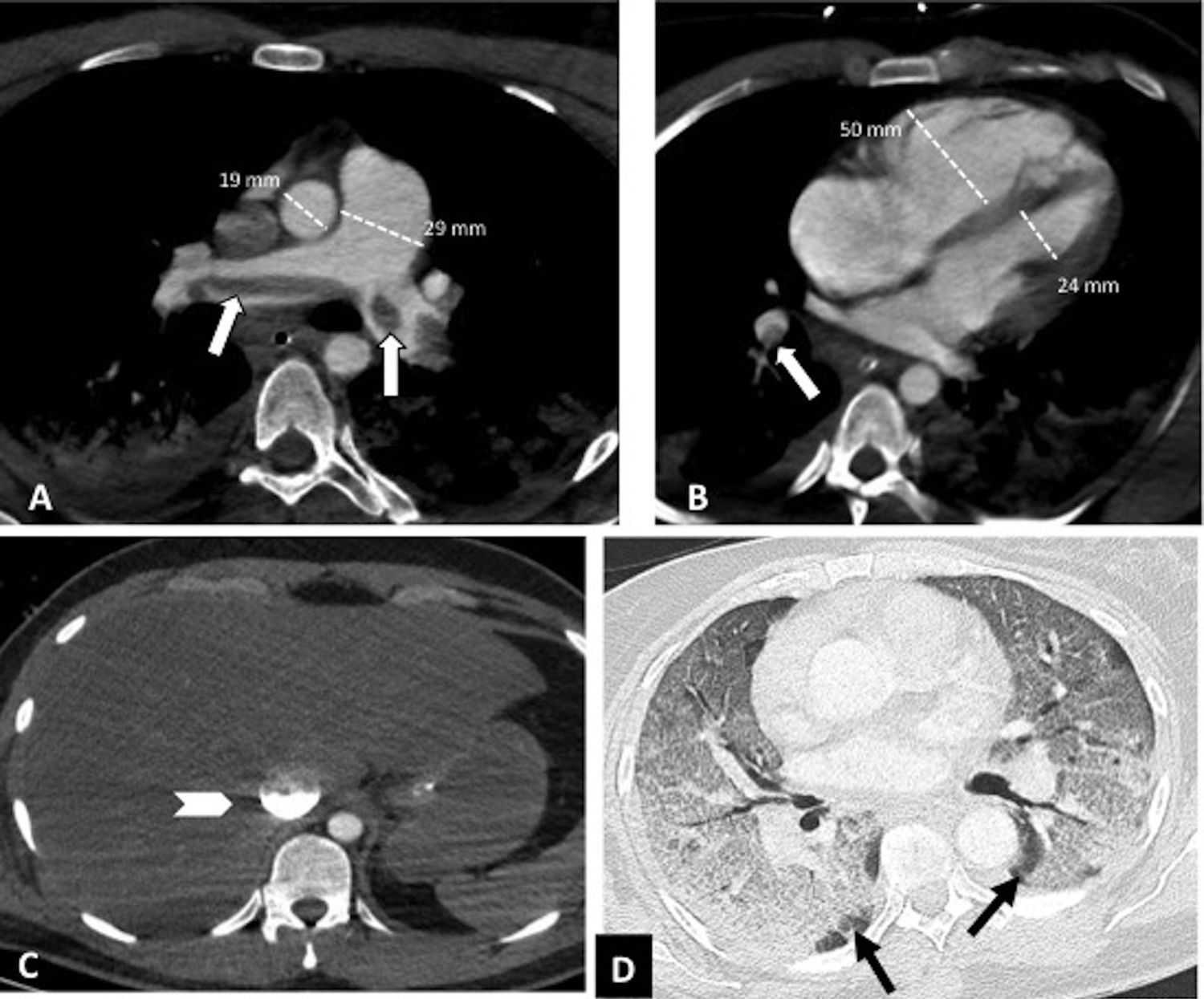
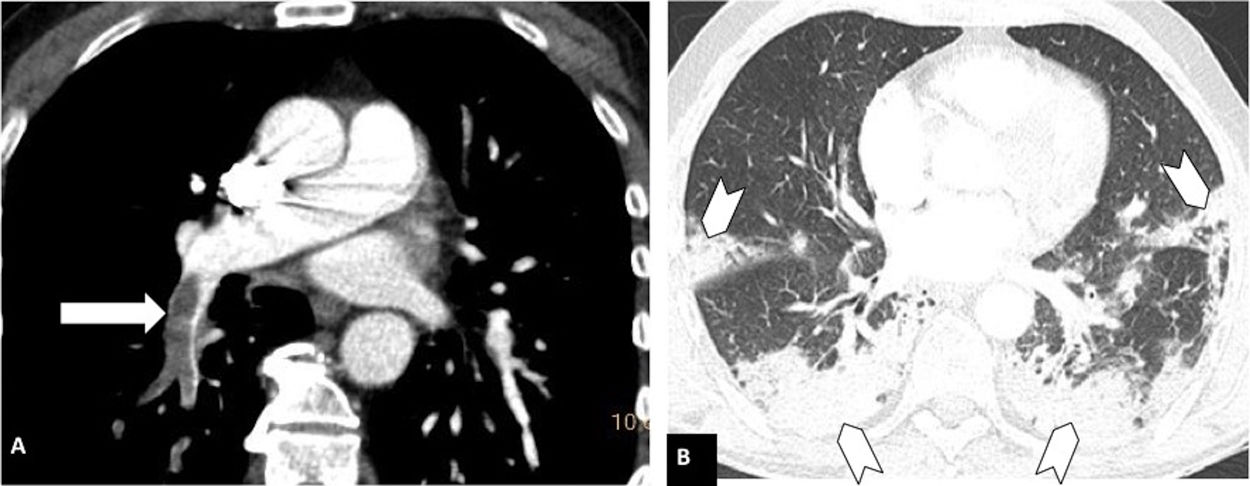
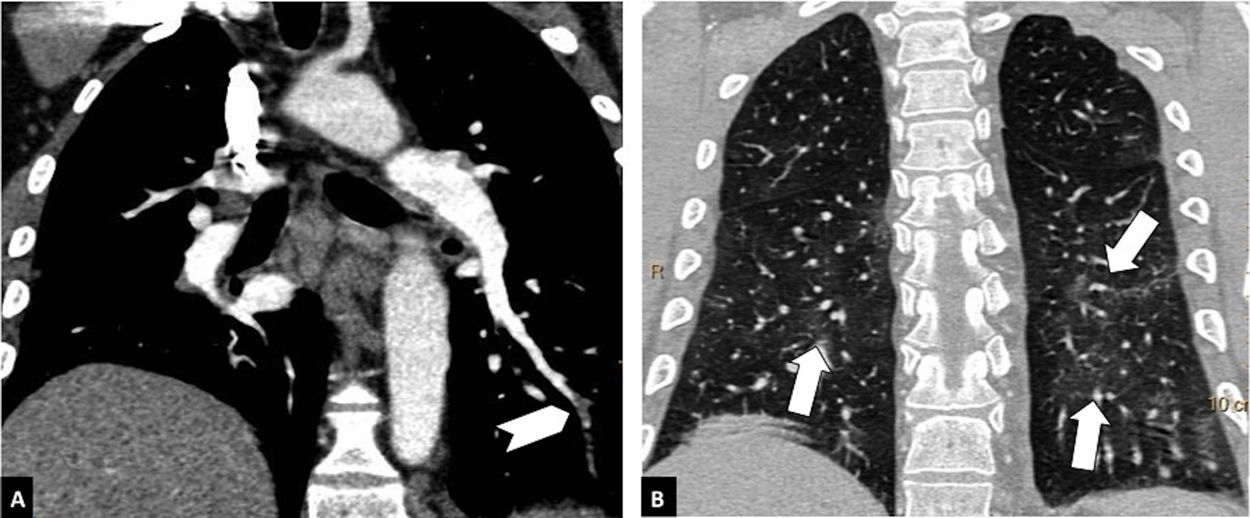
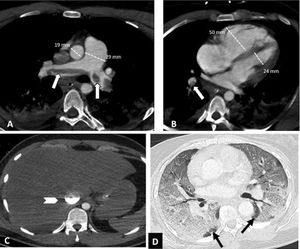
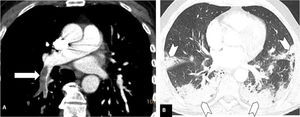
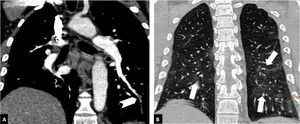
Según la ubicación del defecto de repleción más proximal, la afectación tromboembólica se clasificó en: a) proximal, si el trombo más proximal se localiza en el tronco de la arteria pulmonar o en las arterias pulmonares principales (fig. 1); b) media, si el material se localiza en las arterias lobares o segmentarias proximales (fig. 2), y c) distal, si la afectación es segmentaria distal o subsegmentaria (fig. 3)17.
Tromboembolismo pulmonar central con signos de sobrecarga cardíaca derecha en un paciente con afectación grave por COVID-19. Angio-TC de tórax. A-C) Trombo acabalgado en la bifurcación de las arterias pulmonares y en la arteria lobar del lóbulo inferior derecho (flechas blancas). Signos de sobrecarga cardíaca derecha: índice arteria pulmonar/aorta>1, aumento de cavidades cardiacas derechas con rectificación del tabique intraventricular y reflujo de contraste intravenoso a la vena cava inferior (cabeza de flecha). D) Afectación parenquimatosa grave por COVID-19. Patrón en vidrio deslustrado que afecta a más del 60% del parénquima pulmonar. Las flechas negras señalan el parénquima pulmonar respetado en ambos lóbulos inferiores.
Tromboembolismo pulmonar en localización media en un paciente con afectación parenquimatosa moderada por COVID-19. Angio-TC de tórax. A) Defecto de repleción en la arteria lobar inferior derecha (flecha blanca). B) Afectación parenquimatosa con consolidaciones periféricas en la región posterior de ambos lóbulos inferiores, del lóbulo medio y de la língula (cabezas de flecha), que afecta entre el 30-60% del parénquima pulmonar.
Tromboembolismo pulmonar en localización distal, en un paciente con afectación parenquimatosa leve por COVID-19. Angio-TC de tórax. A) Defecto de repleción en una arteria segmentaria distal basal del lóbulo inferior izquierdo (cabeza de flecha blanca). B) Afectación parenquimatosa en vidrio deslustrado en ambos lóbulos inferiores (flechas), que afecta a menos del 30% del parénquima pulmonar.
Se registró la distribución del material tromboembólico en izquierda, derecha o bilateral. Se valoró también la presencia de signos vasculares que pueden indicar sobrecarga cardíaca derecha (dilatación de cavidades cardiacas derechas, rectificación del septo interventricular, reflujo de contraste a la vena cava inferior)18 (fig. 1), presencia o ausencia de derrame pleural o pericárdico. La medida de las cavidades cardíacas derechas se realizó en un plano de 4 cámaras y se consideró dilatación del ventrículo derecho cuando la cavidad del ventrículo derecho es mayor que la del izquierdo, es decir, cuando el ratio ventrículo derecho/ventrículo izquierdo es mayor de 118. Se consideró rectificación del septo interventricular a la pérdida de la convexidad derecha normal del mismo18.
La afectación pulmonar en la TC torácica de los pacientes con COVID-19 se clasificó según el patrón dominante en 4 grupos: a) normal; b) con predominio de opacidades en vidrio deslustrado; c) predominio de consolidaciones, y d) predominio de consolidaciones con distorsión arquitectural. Siguiendo el glosario de términos de la Sociedad Fleischner, se definió opacidad en vidrio deslustrado como el aumento de la atenuación pulmonar que no borra los vasos sanguíneos ni la vía aérea, y consolidación como aquella opacidad pulmonar que borra los vasos sanguíneos y las paredes de la vía aérea19. Se consideró distorsión arquitectural a la asociación de engrosamiento de septos interlobulillares, bronquiectasias por tracción, pérdida de volumen, engrosamiento pleural, reticulación y bandas subpleurales. Estos hallazgos están descritos principalmente en las etapas tardías de la enfermedad20 y pueden estar asociados o no a las consolidaciones.
La gravedad de la afectación se clasificó según la extensión de las lesiones en el parénquima pulmonar en: a) normal: no hay afectación; b) leve: si la afectación es inferior al 30% del parénquima pulmonar (fig. 3); c) moderada: la afectación se encuentra entre el 30% y el 60% (fig. 2), o d) grave: si la extensión afecta a más del 60% del parénquima pulmonar (fig. 1)20–24.
Análisis estadísticoEl análisis estadístico se realizó con el software SPSS (IBM, Inc). Se empleó la prueba de la t de Student no pareada para la comparación de variables continuas de distribución normal y la prueba de χ2 en el caso de variables nominales. Se consideró estadísticamente significativo un valor de p < 0,05.
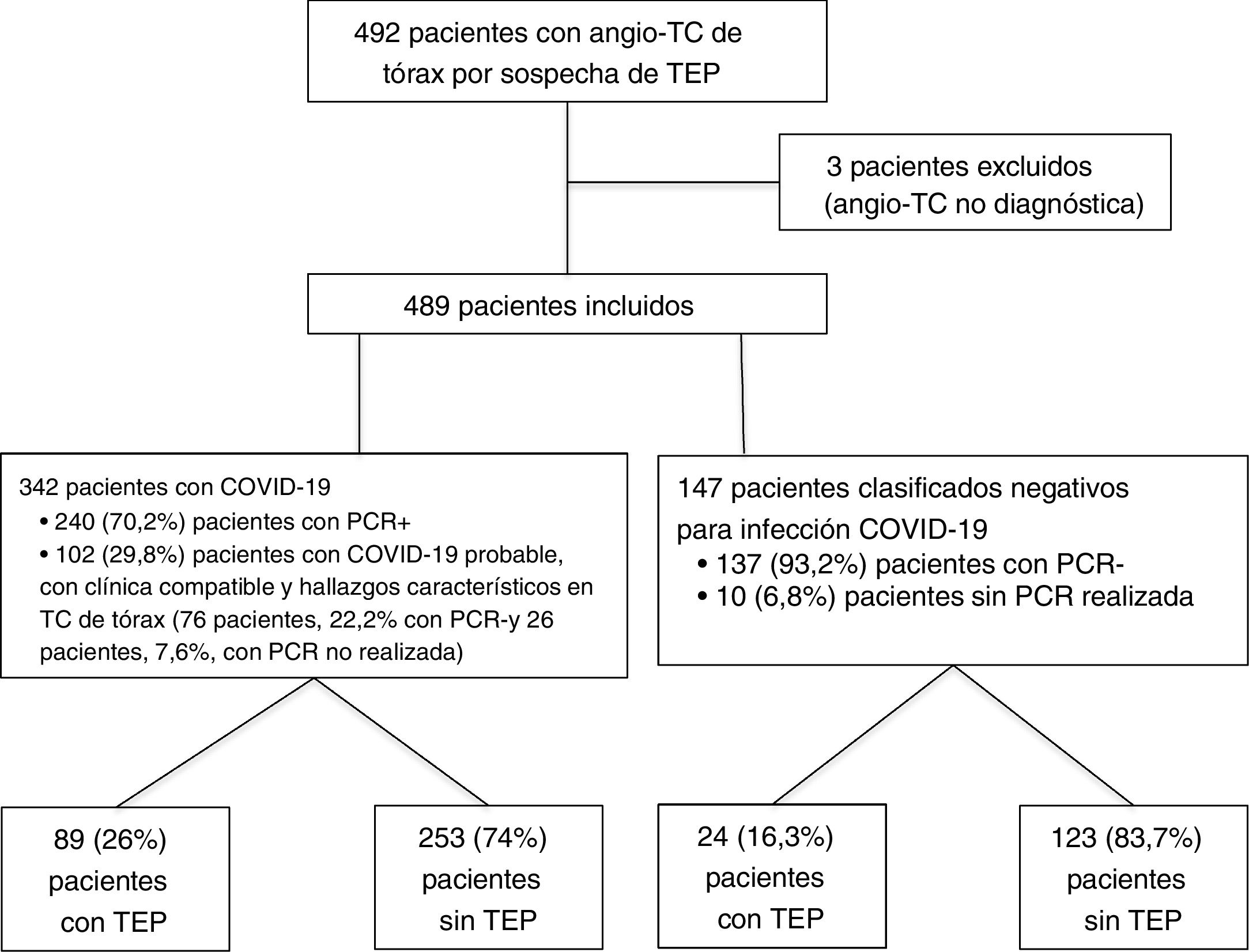
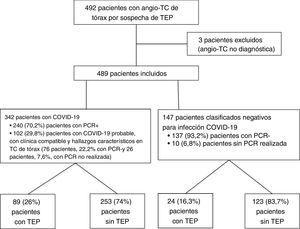
ResultadosSe realizaron un total de 492 angio-TC de arterias pulmonares por sospecha de TEP en 1,5 meses durante la pandemia de COVID-19, del 15 de marzo al 30 de abril de 2020; tres de ellas se excluyeron por no ser válidas para diagnóstico (dos por opacificación vascular subóptima y otra por importantes artefactos de movimiento). Del total de las 489 angio-TC incluidas en el estudio, 342 (69,9%) correspondieron a pacientes diagnosticados de COVID-19 y 147 (30,1%) a pacientes sin infección COVID-19. Dentro del grupo COVID-19, se clasificaron como pacientes con COVID-19 confirmado por positividad de la PCR 240 (70,2%) pacientes y como pacientes con COVID-19 probable, 102 (29,8%) pacientes, de los cuales 76 (22,2%) presentaron PCR negativa y 26 (7,6%) no tenían realizada la prueba. Dentro del grupo COVID-19 negativo, hubo 137 (93,2%) pacientes con PCR negativa y 10 (6,8%) con PCR no realizada. El diagrama de flujo de los pacientes incluidos se muestra en la figura 4.
Presentaron TEP agudo en la angio-TC pulmonar 89 de los 342 pacientes con COVID-19 (26%, intervalo de confianza [IC] al 95%, 21,7-30,1%) y 24 de 147 de los pacientes sin infección COVID-19 (16,3%, IC 95%, 11,2-23,1%), siendo esta diferencia estadísticamente significativa (p = 0,0197). De los 89 pacientes con TEP del grupo COVID-19, la PCR fue positiva en 68 (76,4%) pacientes, negativa en 17 pacientes y no se realizó en 4 (4,5%) pacientes. La PCR fue negativa en los 24 pacientes con TEP del grupo COVID-19 negativo.
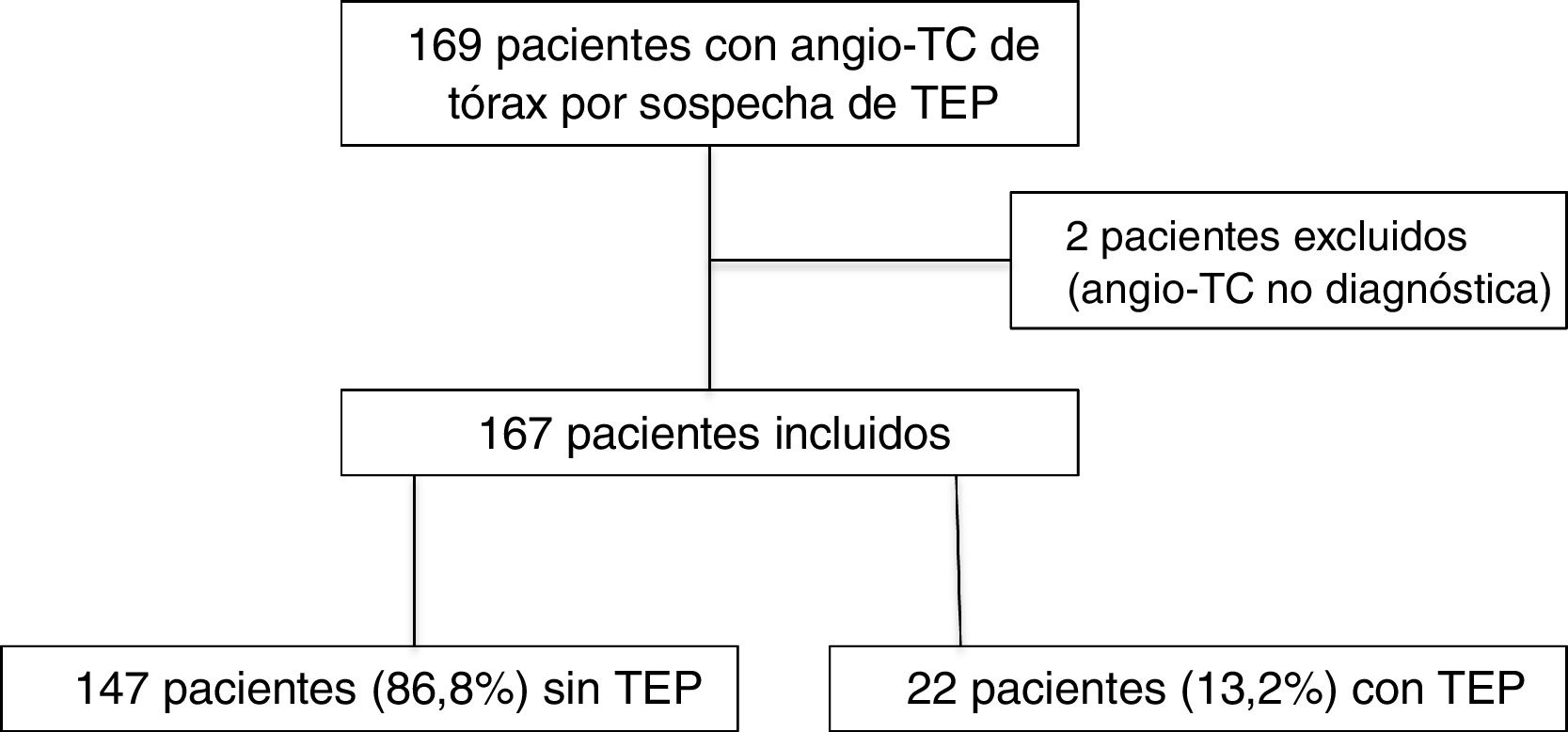
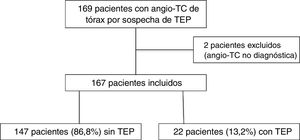
En el año 2019 se realizaron 169 angio-TC de arterias pulmonares por sospecha clínica de TEP durante el mismo periodo, de las cuales se excluyen dos por no ser concluyentes para el diagnóstico por opacificación vascular insuficiente (fig. 5). De las 167 angio-TC incluidas, 22 pacientes (13,2%, IC 95%, 9-19%) mostraron TEP. La diferencia en la prevalencia de TEP en el año 2019 (13,2%) y en el grupo COVID negativo del año 2020 (16,3%) no alcanzó la significación estadística (p = 0,43).
En los pacientes del año 2020, el TEP fue más frecuente en el sexo masculino, tanto en el grupo con COVID-19 (65,2%) como en el grupo COVID-19 negativo (58,3%) (p = 0,54). Los pacientes de ambos grupos mostraron una edad media similar (62,4±16, años frente a 67,2±17,9 años, respectivamente, p = 0,21) (tabla 1).
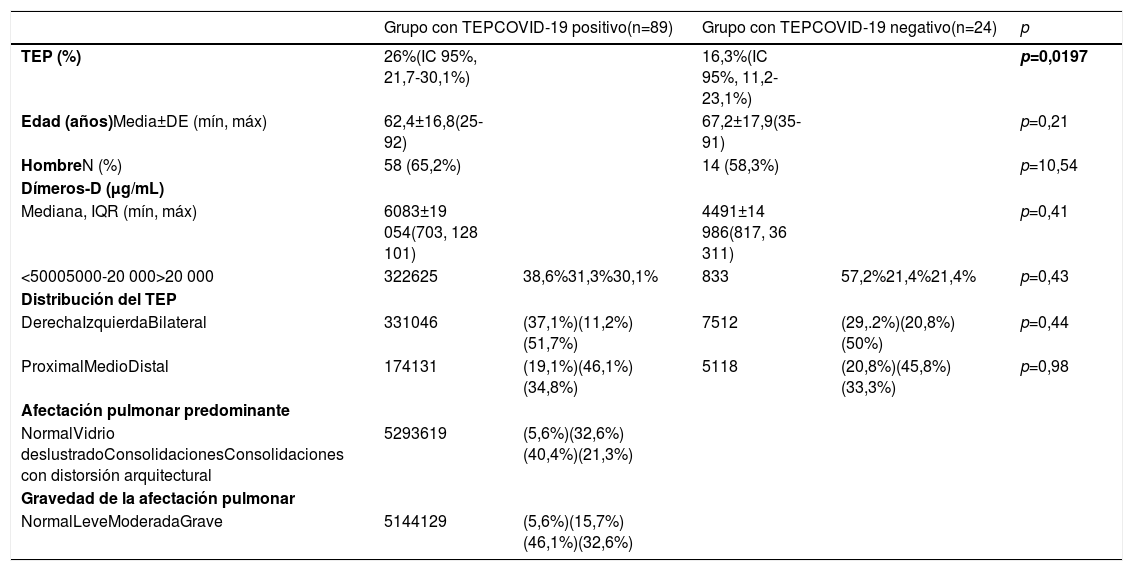
Características de los pacientes con tromboembolismo pulmonar agudo en la angio-TC pulmonar según grupos COVID-19 positivo y negativo
| Grupo con TEPCOVID-19 positivo(n=89) | Grupo con TEPCOVID-19 negativo(n=24) | p | |||
|---|---|---|---|---|---|
| TEP (%) | 26%(IC 95%, 21,7-30,1%) | 16,3%(IC 95%, 11,2-23,1%) | p=0,0197 | ||
| Edad (años)Media±DE (mín, máx) | 62,4±16,8(25-92) | 67,2±17,9(35-91) | p=0,21 | ||
| HombreN (%) | 58 (65,2%) | 14 (58,3%) | p=10,54 | ||
| Dímeros-D (μg/mL) | |||||
| Mediana, IQR (mín, máx) | 6083±19 054(703, 128 101) | 4491±14 986(817, 36 311) | p=0,41 | ||
| <50005000-20 000>20 000 | 322625 | 38,6%31,3%30,1% | 833 | 57,2%21,4%21,4% | p=0,43 |
| Distribución del TEP | |||||
| DerechaIzquierdaBilateral | 331046 | (37,1%)(11,2%)(51,7%) | 7512 | (29,.2%)(20,8%)(50%) | p=0,44 |
| ProximalMedioDistal | 174131 | (19,1%)(46,1%)(34,8%) | 5118 | (20,8%)(45,8%)(33,3%) | p=0,98 |
| Afectación pulmonar predominante | |||||
| NormalVidrio deslustradoConsolidacionesConsolidaciones con distorsión arquitectural | 5293619 | (5,6%)(32,6%)(40,4%)(21,3%) | |||
| Gravedad de la afectación pulmonar | |||||
| NormalLeveModeradaGrave | 5144129 | (5,6%)(15,7%)(46,1%)(32,6%) | |||
DE: desviación estándar; IC: intervalo de confianza; IQR: rango intercuartílico; máx: valor máximo; mín: valor mínimo.
Los émbolos pulmonares en los pacientes con COVID-19 mostraron una distribución bilateral en 46 (51,7%) pacientes, derecha en 33 (37,1%) pacientes e izquierda en 10 (11,2%) pacientes, y afectaron al árbol arterial pulmonar proximal en 17 (19,1%) pacientes, medio en 41 (46,1%) pacientes y distal en 31 (34,8%) pacientes. La distribución y localización de los émbolos pulmonares no mostraron diferencias significativas con la de los pacientes del grupo COVID-19 negativo (tabla 1).
Once pacientes (9,7%) mostraron signos de sobrecarga cardíaca derecha en la TC: 4 pacientes con COVID-19 confirmado (5,9%), 2 pacientes con COVID-19 probable (9,5%) y 5 pacientes del grupo sin COVID-19 (20,8%), aunque estas diferencias no alcanzaron la significación estadística (p = 0,26). La distribución fue bilateral en 9 (81,8%) pacientes y afectó al árbol arterial pulmonar proximal en 7 (63,6%) pacientes, medio en 3 (27,3%) pacientes y distal en 1 (9,1%) paciente. La extensión de la afectación pulmonar en el grupo COVID-19 fue grave en 1 paciente, moderada en 3 pacientes y leve en 2 pacientes.
Todos los pacientes con TEP de ambos grupos mostraron elevación de los niveles de dímeros D (mediana de 6083μg/mL en el grupo de enfermos COVID-19 y de 4491μg/mL en el grupo sin infección COVID-19), pero la diferencia en la elevación no fue significativa (p = 0,41) (tabla 1).
El tiempo medio trascurrido desde el inicio de la clínica hasta la aparición del TEP fue de 19,2±11,2 días en los pacientes con COVID-19.
La afectación parenquimatosa por COVID-19 en los pacientes con TEP se catalogó de normal en 5 (5,6%) pacientes, con predominio de las opacidades en vidrio deslustrado en 29 (32,6%) pacientes, de las consolidaciones alveolares en 36 (40,4%) y de las consolidaciones con distorsión arquitectural en 19 (21,3%) pacientes. La gravedad según la extensión de la afectación pulmonar se clasificó como normal en 5 (5,6%) pacientes, leve en 14 (15,7%), moderada en 41 (46,1%) pacientes y grave en 29 (32,6%) pacientes.
No se han encontrado diferencias estadísticamente significativas entre la distribución del TEP en el árbol pulmonar arterial proximal, medio o distal y la extensión de la afectación COVID-19 (normal, leve, moderada o grave) (p = 0,78) ni con el tipo de afectación parenquimatosa (normal, opacidades en vidrio deslustrado, consolidaciones o consolidaciones con distorsión arquitectural) (p = 0,06).
DiscusiónNuestro estudio confirma la alta prevalencia de embolismo pulmonar agudo en pacientes con COVID-19 (26%) (IC 95%, 21,7-30,1%), acorde con la literatura científica publicada4,6,25. La prevalencia de TEP en pacientes con COVID-19 es mayor que en aquellos pacientes que no presentaban la enfermedad (26% vs. 16%), lo que confirma los datos publicados en otras series4,26.
Se ha descrito en múltiples referencias científicas que los pacientes con COVID-19 se encuentran en un estatus inflamatorio en el que, entre otros mecanismos, se describe la activación de la coagulación y situaciones de disfunción endotelial, que condicionan un aumento del riesgo de eventos tromboembólicos4,27, a lo que se añaden otros factores de riesgo como el encamamiento, la ventilación mecánica o el ingreso en las unidades de cuidados intensivos (UCI)4,6,8,27–29. Probablemente en relación con la existencia de estos factores de riesgo conocidos, durante el periodo estudiado, coincidiendo con el periodo de mayor intensidad de la pandemia, la demanda de angio-TC de arterias pulmonares prácticamente se triplicó respecto al mismo periodo del año anterior (492 vs. 169 angio-TC).
Todos los pacientes incluidos en nuestro estudio mostraron elevación de los niveles de dímeros D corregidos según la edad (mediana de 6083 μg/mL en el grupo de enfermos COVID-19 y de 4491 μg/mL en el grupo sin infección con COVID-19), aunque la diferencia no fue significativa (p = 0,41). Algunos autores sugieren que la elevación de dímeros D puede ser un marcador pronóstico de la evolución de la enfermedad, dado que lo relacionan con la activación de la coagulación en respuesta a un síndrome de respuesta inflamatoria de los pacientes con COVID-19 o incluso como consecuencia directa del propio SARS-CoV-24,7,27,30.
El diagnóstico de TEP se hizo, de media, a los 19 días del inicio de los síntomas. Según diferentes autores, en aquellos pacientes con COVID-19 que evolucionan hacia el empeoramiento, este suele aparecer a partir de la segunda semana del inicio de la clínica27 y suele ser en forma de distrés, sepsis o shock séptico.
Cabe destacar que el 94% de los pacientes con COVID-19 y TEP tenían afectación pulmonar en la TC torácica. De ellos, el 32,6% presentaban vidrio deslustrado, el 40,4% consolidaciones y el 21,3%, consolidaciones y distorsión de la arquitectura pulmonar. Es decir, el 61,7% presentaba consolidaciones, descritas como hallazgo fundamental en la fase pico de la enfermedad, a partir de los 9-13 días del inicio de los síntomas20–24. Por otro lado, la mayor parte de los pacientes con COVID-19 y TEP (78,7%) presentaron una extensión moderada o grave de afectación pulmonar en la TC, es decir, con afectación de al menos el 30% del parénquima pulmonar. Sin embargo, otros autores no han encontrado diferencias significativas entre la presencia de TEP y la extensión de la afectación pulmonar31.
Todo lo anterior subraya la importancia de la valoración radiológica en el manejo de los pacientes con enfermedad COVID-19, tanto para evaluar el grado de afectación pulmonar como para descartar complicaciones sobreañadidas, como el TEP o incluso descartar otras patologías6,30,32,33. Algunos autores sugieren la indicación de angio-TC pulmonar en todos los pacientes con COVID-19 con elevación de los dímeros D31.
Nuestro estudio tiene limitaciones derivadas de su diseño retrospectivo, de la inclusión de pacientes con COVID-19 probable en el grupo COVID-19 confirmado con PCR positiva y de la heterogeneidad de la población incluida, que incluye pacientes procedentes de la urgencia, hospitalizados e ingresados en UCI. Un estudio pormenorizado de estos grupos podría aclarar si alguno de ellos tiene un riesgo mayor. Por otro lado, el cálculo del porcentaje de la afectación parenquimatosa pulmonar se ha realizado de forma aproximada y subjetiva, lo que podría limitar su reproducibilidad. Existen también dificultades en la valoración del árbol arterial pulmonar distal, especialmente en los pacientes con mayor afectación parenquimatosa, que suelen ser los más graves, con mayor insuficiencia respiratoria y, por tanto, con más artefactos de movimiento respiratorio. Por último, queremos mencionar que no hemos comparado la extensión de la afectación parenquimatosa pulmonar ni otras características semiológicas de la afectación pulmonar en la TC en los pacientes con infección por SARS-CoV-2 con y sin TEP.
ConclusiónLa prevalencia de TEP está aumentada en los pacientes con COVID-19. Esta mayor prevalencia puede tener relación con la gravedad de la extensión de la afectación del parénquima pulmonar. Sin embargo, no se han encontrado diferencias significativas en la localización del material embólico ni en el grado de la elevación de los dímeros D entre los pacientes con TEP e infección COVID-19 respecto a los pacientes con TEP sin COVID-19. Se requieren más estudios para determinar qué factores están asociados al TEP en los pacientes con COVID-19 y delimitar mejor las indicaciones de la angio-TC pulmonar.
Autoría- 1.
Responsable de la integridad del estudio: EMC, TYRO, LIS.
- 2.
Concepción del estudio: EMC, TYRO, MPN, LIS.
- 3.
Diseño del estudio: EMC, TYRO, MPN, SBN, LIS.
- 4.
Obtención de datos: EMC, TYRO, CCCRG, LIS.
- 5.
Análisis e interpretación de los datos: EMC, TYRO, MPN, SBN, CCCGR, LIS.
- 6.
Tratamiento estadístico: EMC, TYRO, CCCGR, LIS.
- 7.
Búsqueda bibliográfica: EMC, TYRO, SBN, LIS.
- 8.
Redacción del trabajo: EMC, TYRO, MPN, LIS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: EMC, TYRO, MPN, SBN, CCCGR, LIS.
- 10.
Aprobación de la versión final: EMC, TYRO, MPN, SBN, CCCGR, LIS.
Los autores declaran no tener ningún conflicto de intereses.