Hace ya algunos años, se extendió el uso de estrógenos en mujeres postmenopáusicas u ooforectomizadas con el fin de prevenir los síntomas secundarios a la deprivación hormonal, principalmente las manifestaciones vasomotoras y urogenitales, así como para disminuir el riesgo de fracturas por osteoporosis y la muerte por enfermedad cardiovascular1,2.
Desde entonces, el uso de estrógenos, asociados a progestágenos en el caso de mujeres con útero, se ha extendido en el mundo occidental. Sin embargo, el hecho de que este tratamiento hormonal sustitutivo (THS) lleve consigo una serie de efectos adversos importantes y que su acción beneficiosa esté discutida en determinadas situaciones, junto a la aparición de nuevos fármacos alternativos, nos hace plantearnos cuáles son las verdaderas indicaciones de su uso, explicando por otra parte, su falta de difusión y bajo cumplimiento en nuestro medio3.
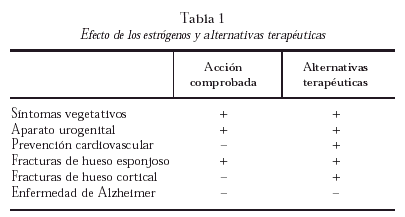
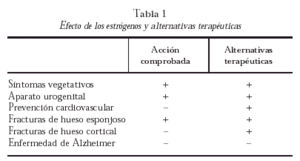
En el campo de la patología metabólica ósea, los estrógenos han desempeñado un papel crucial. Así, por ejemplo, en la osteoporosis, se ha implicado al déficit estrogénico ya desde la época de Albright hace más de 50 años4, quien hablaba de la osteoporosis postmenopáusica. En la actualidad, Eastell indica que el mecanismo más importante relacionado con la pérdida de masa ósea en la mujer es la deficiencia estrogénica5 y Riggs et al han postulado una hipótesis unitaria sobre la fisiopatología de la osteoporosis en la que el mecanismo básico sería dicho déficit estrogénico6. Precisamente la observación de que, epidemiológicamente, la incidencia de fracturas aumenta notablemente después de la menopausia se ha aceptado como una forma indirecta de relacionar al déficit de estrógenos con la osteoporosis y la aparición de fracturas7.
Por otra parte, en la década de los 70, los estudios de Lindsay y otros autores8-10 demostraron que la administración de estrógenos producía un enlentecimiento en la pérdida de masa ósea, determinando ésta por muy diversos métodos y que tras la suspensión de dicho tratamiento se observaba una rápida pérdida de hueso, especialmente en los dos primeros años11 que en algunas ocasiones llegaba a ser incluso superior al ritmo de pérdida inicial. Todo ello reafirmó la relación existente entre estrógenos, pérdida de masa ósea y osteoporosis, indicándose en el Primer on Bone Metabolic Diseases12 que la administración de estrógenos y progestágenos previenen la pérdida de masa ósea en la mujer postmenopáusica5, pero también obligó a plantearse qué hacer cuando llegase el momento de suspender el THS, pues el mismo tampoco se puede mantener indefinidamente, por una parte, por el riesgo de cáncer de mama, sobre el que se discutirá más adelante y por otra, porque muchas pacientes abandonan el tratamiento estrogénico al poco tiempo de haberlo iniciado, incluso después de haber sido adecuadamente instruidas y aleccionadas para que no lo hicieran13. Aun aceptando todo lo anteriormente expuesto, todavía nos quedaría conocer cuál es el mecanismo de acción de los estrógenos sobre el hueso, el cual se desconoce5.
En los últimos años se ha desarrollado la Medicina Basada en la Evidencia y de ella se deduce que en el campo de la osteoporosis los estudios deben reunir una serie de requisitos mínimos para poder considerarlos como «trascendentes» y que el objetivo fundamental es que cualquier fármaco que se administre para esta enfermedad debe mostrar una eficacia probada en la reducción de nuevas fracturas osteoporóticas14. Y aquí es donde nos damos cuenta de que una gran cantidad de estudios efectuados con estrógenos sobre la osteoporosis no reúnen los requisitos necesarios para ser considerados como «evidentes» por razones de diferente índole, principalmente metodológicos, y que en muy pocos de ellos existen datos concluyentes sobre la eficacia de los estrógenos en la reducción de nuevas fracturas. Así, en un reciente metaanálisis publicado por Grady y Cummings15 se indica que el efecto del THS en la reducción global de las fracturas osteoporóticas es débil, y en otro metaanálisis publicado en la misma revista16 se observa una reducción estadísticamente significativa de las fracturas no vertebrales, efecto que parece verse atenuado en las mujeres de más edad.
Los síntomas vegetativos, principalmente los sofocos, calores, cefalea e hiperhidrosis, son los primeros en aparecer tras la deprivación hormonal y son el principal motivo de consulta. En ellos, el THS ha demostrado ser eficaz, en ciclo corto (< 3 años), sin aumentar significativamente el riesgo de cáncer de mama1.
Sin embargo, numerosos estudios recalcan el papel de los fitoestrógenos (isoflavonoides y lignanos, derivados de la soja y otros vegetales) en el control de estos síntomas17, así como en la conservación de masa ósea y disminución del riesgo cardiovascular y del cáncer de mama18. La utilización de agonistas-adrenérgicos centrales (clonidina, metildopa), antidopaminérgicos (veralipide), propanolol y plantas naturales se ha probado con efectos desiguales19.
La acción de los estrógenos en el aparato urogenital también se ha demostrado, siendo la vía tópica la más utilizada para combatir la atrofia vaginal.
El aumento de muerte por enfermedad cardiovascular tras la menopausia ha sido uno de los motivos fundamentales que ha impulsado el uso de estrógenos en estas mujeres. Tres estudios prospectivos y multicéntricos llevados a cabo en los últimos años han arrojado resultados dispares y no ciertamente tan optimistas como se esperaban en un principio. En el Nurse's Health Study se produjo una disminución del riesgo cardiovascular en mujeres con uno o más factores de riesgo (tabaco, diabetes, dislipidemia, hipertensión, obesidad, historia familiar de enfermedad coronaria) frente a aquéllas sin factores de riesgo asociados20,21. El estudio PEPI (Postmenopausal Estrogen/Progestin Interventions) se asoció a una elevación del colesterol ligado a lipoproteínas de alta densidad (HDL) (mayor si estrógenos solos frente a estrógenos más progesterona) y disminución de los niveles de fibrinógeno en mujeres postmenopáusicas, sin cambios en la presión arterial ni en los niveles de insulina22.
Sin embargo, en el estudio HERS (Heart and Estrogen/Progestin Replacement Study), el THS en mujeres postmenopáusicas con enfermedad coronaria establecida (prevención secundaria) no demostró reducción de eventos cardíacos tras cuatro años. Al contrario, supuso un aumento de fenómenos tromboembólicos y de litiasis biliar23. Si bien, este mismo estudio halló una relación inversa entre el uso de estrógenos y los niveles de lipoproteína a [Lp (a)], siendo ésta un factor independiente de riesgo coronario en mujeres postmenopáusicas24.
La asociación de acetato de medroxiprogesterona parece atenuar los efectos beneficiosos de los estrógenos sobre la vasodilatación dependiente del endotelio25. La vía de administración de los estrógenos influye en sus efectos cardiovasculares, siendo la vía oral y no la transdérmica la que incrementa los marcadores de fibrinólisis, disminuye los niveles de selectina E e induce cambios antiaterogénicos en los lípidos y lipoproteínas, favoreciendo por otro lado la hipercoagulabilidad y el aumento de la proteína C reactiva26, lo que contribuiría a producir los fenómenos tromboembólicos comentados aparte.
Otro evento vascular es el cerebrovascular, donde el THS no ha demostrado ningún beneficio en mujeres postmenopáusicas con enfermedad coronaria previa27. Ello concuerda con los resultados de un metaanálisis reciente publicado en el que se demuestra que la incidencia de accidentes cerebrovasculares está aumentada en mujeres que toman anticonceptivos orales, incluso con dosis bajas de estrógenos28.
Un aspecto muy comentado en los últimos años es el posible efecto beneficioso de los estrógenos en la prevención de la enfermedad de Alzheimer (EA). Frente a la euforia inicial, los datos que aportan los últimos estudios prospectivos y randomizados (Rotterdam Study29 y Alzheimer's Cooperative Study30 así como los resultados recogidos en metaanálisis publicados indican que el THS no influye en la progresión de la EA, aunque podría tener algún efecto en el retraso de la aparición y en la mejoría de ciertos aspectos mentales como la memoria verbal, el razonamiento, la velocidad motora y el nivel de vigilancia, en mujeres sintomáticas, pero no en las asintomáticas31.
La asociación de estrógenos y aumento de densidad mamaria en las mujeres postmenopáusicas con THS es un factor a considerar como posible marcador de riesgo de padecer cáncer de mama, sobre todo si se combina con progestágenos32,33. Si bien este cambio en la densidad es dinámico y desaparece tras la discontinuación de la terapia, la hiperdensidad mamaria está directamente asociada a una disminución en la sensibilidad y especificidad de la mamografía, la prueba estándar para el cribado del cáncer de mama, y esta relación es más fuerte en mujeres de edad avanzada, donde la prevalencia del cáncer de mama es mayor34.
El THS no sólo se ha asociado clásicamente con el aumento del cáncer de mama y de endometrio (si no se añaden progestágenos en una mujer con útero), sino también con el aumento en la incidencia de cáncer ovárico, cuyo riesgo se ha demostrado que persiste incluso hasta 29 años después de suspender el THS35.
Otros aspectos negativos, aparte del coste económico del control periódico de este tratamiento36, son los fenómenos venosos tromboembólicos asociados al THS e incluso con el raloxifeno37.
Frente a ello, no podemos olvidar otros efectos beneficiosos demostrados por el THS como es la reducción de la mortalidad en general38, su acción sobre las alteraciones dérmicas39 y la disfunción sexual en la mujer menopáusica40, la prevención de atrofia muscular41, factor tan importante en la prevención de caídas o su posible acción sobre el cartílago en la prevención de la artrosis42.
MEDITERRANEAN SOCIETY FOR OSTEOPOROSIS AND OTHER SKELETAL DISEASES POSTGRADUATE COURSE ON METABOLIC BONE DISEASES
11-13 de abril 2002
PADOVA - ABBAZIA DI PRAGLIA (ITALIA)
Información:
Prof. Gaetano Crepaldi M.D.
Clínica Médica I
Departamento de Ciencias Médicas y Quirúrgicas
Universidad de Padova
Via Giustiniani, 2
35128 Padova, I