years, bone mineral indez [BMI] 27.7 ± 3.8 kg/m 2) were studied; 81.8% had mild to moderate spine OA (sOA) and 51.9% mild to moderate kOA (Kellgren-Lawrence scale, KLs). Ten women without OA were used to calculate local tibial Z scores. Results. Control and OA groups were comparable. Local tibial BMD was increased in kOA patients (Z score; TS: 0.73 ± 1.14 g/cm 2, p = 0.001; IC: 0.79 ± 2.17 g/cm 2, p = 0.027), correlating with radiographic rating scale of OA and with axial BMD. 44.1% of patients had densitometric OP. Patients with kOA were older (62 ± 5 vs 60 ± 5 years; p = 0.02) and heavier (71.4 ± 10.9 vs 66.0 ± 8.9 kg; p = 0.02) versus non-kOA patients. Conclusions.Local tibial BMD is increased in menopausal women with mild kOA and this increase is related to radiological score. Local tibial and axial BMD are closely related. The prevalence of OP in these women is very high.
INTRODUCCION
La osteoporosis (OP) y la artrosis (A) son dos enfermedades comunes musculoesqueléticas asociadas al envejecimiento que producen morbilidad y mortalidad considerables. La artrosis de rodilla (AR) es una patología articular muy prevalente, especialmente entre los ancianos. Ciertos factores de riesgo para la AR, como la edad y la obesidad, están bien establecidos, especialmente en mujeres1,2. Por otra parte, la OP es también más común en personas de edad, fundamentalmente en mujeres. Los factores de riesgo de OP, como la edad o la delgadez, también están bien documentados3,4.
El contraste entre los valores de densidad mineral ósea (DMO) en la OP y la A fueron puestos de manifiesto hace más de 30 años5. Desde entonces, un gran número de estudios han mostrado que la OP y la A raramente suceden de forma conjunta, habiéndose propuesto incluso una relación inversa entre la OP y la A generalizada6-9. Más recientemente diferentes publicaciones han demostrado valores elevados de DMO medida por densitometría dual de rayos-X (DXA) en pacientes con A10,12, aunque la influencia de la mayor DMO sobre la tasa de fracturas en pacientes con A es controvertida13-16.
Desde un punto de vista patogénico se han implicado en el inicio de la A elevaciones del contenido esquelético de factores de crecimiento (por ejemplo, IGF-I), reducción en la síntesis ósea de CSF-1 o, entre otros, la alteración en las concentraciones de estrógenos o vitamina D. Estos factores iniciarían el fenómeno artrósico mediante una reducción en la osteoclastogénesis y el aumento de la densidad ósea subcondral17-20.
En nuestro estudio pretendemos evaluar las relaciones entre la DMO axial y local de la tibia en mujeres ambulatorias posmenopáusicas sanas (salvo por artrosis leve a moderada).
MATERIALES Y MÉTODOS
PACIENTES
Más de 150 pacientes consecutivos fueron referidos por dolor crónico de origen articular a nuestra consulta ambulatoria de Reumatología en Madrid por sus médicos generales (desde octubre de 1999 hasta enero de 2000), 77 mujeres posmenopáusicas cumplieron los criterios de entrada y dieron su consentimiento informado. La edad media fue 61±5 años y el índice de masa corporal (IMC) fue de 27,7 ± 3,8 kg/m2. Los criterios de entrada preespecificados exigían la inclusión de mujeres posmenopáusicas (con más de un año de amenorrea), caucásicas, ambulatorias, con buena salud salvo por A leve a moderada y valores normales de calcio y fósforo séricos. Los criterios de exclusión incluían la existencia de enfermedades severas renales, hepáticas, gastrointestinales o tiroideas, entre otras, así como el uso de suplementos dietéticos de calcio o vitamina D o de medicaciones que pudieran afectar al metabolismo óseo como la terapia hormonal sustitutiva, antirresortivos, tiazidas o esteroides.
Las radiografías de rodilla (anteroposteriores en carga) y de columna fueron puntuadas por un único investigador (JMP) de acuerdo al método clásico de Kellgren y Lawrence21 (grado 0 = normal; grado 1 = sólo posibles osteofitos; grado 2 = osteofitos y posible estrechamiento del espacio articular; grado 3 = osteofitosis moderada y/o reducción del espacio articular, y grado 4 = osteofitosis o reducción del espacio articular severa y/o esclerosis ósea). Diez mujeres sin A se emplearon como controles y para calcular Z scores de la DMO local de la tibia.
MEDIDA DE DENSIDAD MINERAL OSEA
La DMO axial fue valorada mediante DXA (Hologic QDR1000w; Hologic, Inc., Waltham, MA, EE.UU.) en la columna lumbar (CL) y el cuello femoral (CF). El coeficiente de variación para la medida de DMO lumbar en nuestro centro es del 1,31%22. Los valores de DMO ajustados por edad y sexo se calcularon a partir de una muestra de 1.331 mujeres sanas españolas, estableciéndose los score T (número de desviación estándar [DE] del valor del paciente de la media de controles jóvenes) y Z (número de DE del valor del paciente de la media de la población en bandas de 5 años de edad)23. Se empleó la definición de osteoporosis de la Organización Mundial de la Salud (OMS)24 (score T ¾ 2,5). Las posibles fracturas vertebrales, calcificaciones o cambios degenerativos fueron valorados por rayos-X y corregidos según el método de Orwoll25.
La DMO local de la tibia proximal fue medida por DXA. Los scan PA se obtuvieron mediante el programa de adquisición de datos de antebrazo que permite detectar aire además de tejidos blandos. Se seleccionaron para análisis en la tibia proximal dos subregiones de interés de 2 * 2 cm situadas en la espina tibial (ET) y adyacente al cóndilo interno (CI). Se calcularon
Z scores locales de los pacientes a partir de 10 mujeres sanas. El coeficiente de variación de la determinación de DMO para las medidas locales de la tibia fue del 3% y del 2% (CI y ET, respectivamente).
ANALISIS ESTADISTICO
Los resultados se expresaron como media ± DE, salvo cuando se indica expresamente. Se realizó «t» de Student (para comparar los valores de Z score obtenidos frente al valor esperado (0) y para comparar grupos), así como correlaciones bivariadas. Se consideraron estadísticamente significativos los valores de p < 0,05. Los análisis estadísticos se realizaron con el programa SPSS-PC (versión 11.0; SPSS Inc. Chicago, IL).
RESULTADOS
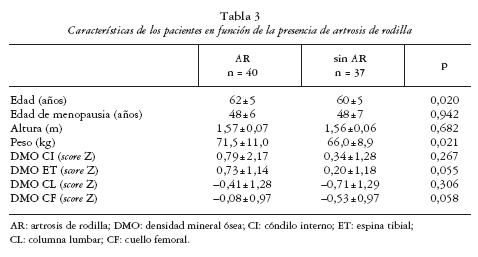
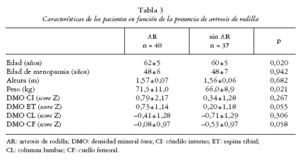
Las características clínicas generales y los valores de DMO de nuestros pacientes se muestran en la tabla 1. De acuerdo con la escala radiográfica de Kellgren-Lawrence (eKL), 63/77 pacientes (81,8%) tenían artrosis de columna (AC) leve a moderada mientras que 40/77 (51,9%) tenían AR leve a moderada. Diez sujetos sin artrosis se emplearon como controles para las medidas de DMO local en la tibia. Las características generales de los sujetos controles y con A fueron similares (edad, edad de menopausia, peso y altura; p > 0,1). Los valores de DMO local del extremo proximal de la tibia fueron mayores de lo esperado en pacientes con AR (ET: 0,73 ± 1,14 g/cm2, p = 0,001 frente a 0; CI: 0,79 ± 2,17 g/cm2, p = 0,027 frente a 0), pero no en pacientes con AC (ET: 0,24 ± 1,29 g/cm2, p = 0,34 frente a 0; CI: 0,46 ± 1,37 g/cm2, p = 0,91 frente a 0).
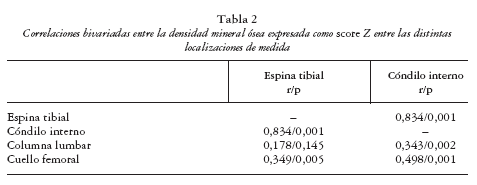
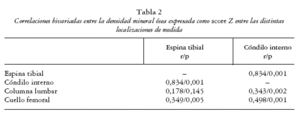
En el análisis de correlación lineal la DMO en ET (score Z) correlacionó con la puntuación radiográfica (eKL) en el cóndilo interno (r Spearman = 0,257; p = 0,032) y en la región femoropatelar (r = 0,335; p = 0,005). Las correlaciones (Pearson) entre las distintas localizaciones de medida de DMO se muestran en la tabla 2.
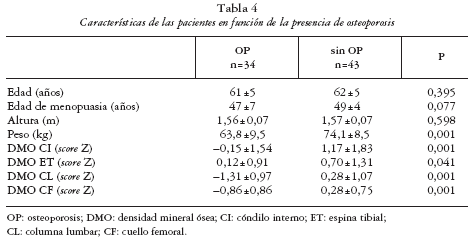
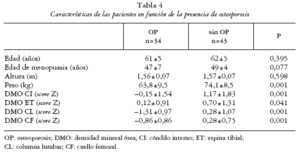
Los pacientes con AR fueron mayores y de mayor peso (tabla 3). Por otra parte, 34/77 pacientes (44,1%) cumplían criterios densitométricos de osteoporosis(36,4% en CL y el 22,1% en CF). Las pacientes con OP resultaron más delgadas que las pacientes sin OP (tabla 4).
DISCUSIÓN
Este estudio muestra que mujeres ambulatorias sanas, salvo por AR leve a moderada, tienen una DMO local en la tibia incrementada, y que este aumento de DMO correlaciona con la escala radiográfica de puntuación y, más intensamente, con la DMO axial lumbar y femoral. Por otra parte, la prevalencia de OP en esta población es muy alta, a pesar de los valores locales tibiales elevados.
La medida local tibial o femoral ha sido recientemente propuesta como una herramienta útil y precisa en la valoración de la DMO periarticular o periprotésica26-30, aunque sorprendentemente no se han publicado correlaciones entre medidas locales y axiales excepto en el trabajo de Wada et al30 que, como en nuestro trabajo, encuentran correlaciones de 0,34 a 0,51 entre la DMO local de la tibia y la CL.
Como podía anticiparse por la bien conocida influencia de los factores genéticos sobre la DMO31, así como por las relaciones entre los distintos sitios de medida axiales y pendiculares32, las medidas de DMO axiales y locales de la tibia correlacionaron. No obstante, la magnitud de esta asociación fue baja, lo que puede deberse a la baja precisión en los sitios de medida locales de la tibia o, alternativamente, a la influencia en esos sitios locales de medida del proceso artrósico en sí mismo.
La artrosis se ha puesto en relación con defectos en la matriz cartilaginosa incapaz de soportar cargas articulares normales33 y/o con fuerzas físicas anormales que dañan una matriz cartilaginosa articular normal34. La aparición de rigidez ósea subcondral ha sido propuesta como consecuencia, o incluso como causa, del incremento en la transmisión de cargas con el consiguiente daño sobre el cartílago subyacente35. En nuestro estudio, como ya había sido mostrado30, la masa ósea local de la tibia (subcondral) se encontró aumentada en pacientes con AR leve a moderada, lo que concuerda con la hipótesis de que la AR primaria se debe a una mayor densidad ósea subcondral inducida por traumatismos.
Nuestros pacientes con AR tienen una DMO lumbar y femoral mayor que las mujeres sin AR, como ya había sido publicado10-12,36-38, aunque lo que resulta más interesante es que una gran proporción de estas pacientes (> 40%) también cumplían criterios diagnósticos de osteoporosis. De hecho, Naitou et al12 han encontrado fracturas vertebrales en 17/88 (19,3%) mujeres menopáusicas con AR. Por tanto, el propuesto efecto protector de la AR sobre el desarrollo de OP6-9 debe ser tomado con cautela, al menos en las fases iniciales de la AR. Por último, las mujeres con AR fueron mayores y de más peso, dos factores de riesgo bien conocidos de AR1,2,36.
La validez de nuestro estudio se ve limitada por su diseño transversal. Todas las pacientes fueron referidas para evaluación de artrosis, por lo que nuestra muestra no puede considerarse representativa de la población general.
En conclusión, las mujeres menopáusicas sanas, salvo por artrosis leve de rodillas, tienen valores aumentados de DMO axial y local tibial. Sin embargo, una elevada proporción de estas pacientes tienen osteoporosis.
AGRADECIMIENTOS
Este trabajo ha sido parcialmente financiado por la Fundación para la Investigación de las Enfermedades Endocrinológicas y Óseas (FIOE).