INTRODUCCION
Se ha realizado una búsqueda bibliográfica de los estudios recogidos en la base de datos Medline entre 1995 y 2000, que relacionen ejercicio y hueso, y se han clasificado según los aspectos que tocan. Se comienza con sendos epígrafes que recogen nociones de la biomecánica de los efectos de las fuerzas o movimientos sobre el tejido óseo, y de los principales cambios metabólicos que producen. Se sigue con la parte fundamental, que son el conjunto de ensayos clínicos que presentan los resultados de la influencia de la actividad física en la masa ósea, a lo largo de las edades biológicas. Termina la revisión presentando algunos estudios de la influencia de los estrógenos y el calcio sobre el hueso, en relación con el ejercicio.
BIOMECANICA
Utilizar cargas funcionales para influir en la masa ósea y su arquitectura tiene un amplio fundamento, ya que hay evidencia de que el efecto mecánico es uno de los principales factores osteogénicos. Las tensiones dinámicas que recaen sobre el hueso influyen sobre la respuesta biológica del mismo. El estrés óseo actúa sobre la microarquitectura, geometría y composición de la matriz. El estímulo más importante ocurre cuando las cargas exceden las habituales, siendo más importante la intensidad que la duración. Sobre todo las cargas de distribución inusual, en alta proporción y magnitud, parecen ser particularmente estimulantes de la osteogénesis. Esta respuesta puede condicionarse por numerosos factores e incluso saturarse, después de determinadas repeticiones, por mecanismos de adaptación. Una consecuencia práctica de ello sería que cada sesión de ejercicios, destinada a influir positivamente sobre la masa ósea, no habría de ser muy prolongada, sino que más bien debería incluir tantas tensiones de nueva distribución u orientación como fuese posible, preferentemente de considerable fuerza y frecuencia. Para mantener cualquier nivel de masa ósea en un indivíduo se requiere que los estímulos sean continuados, realizados en carga y de una frecuencia preferentemente diaria o alterna1.
Diferentes estudios experimentales, realizados en animales, muestran que el hueso aumenta su competencia física y mecánica tras períodos de aumento de fuerzas incidentes sobre el mismo. Tensiones altas en proporción y magnitud y de distribución variable, aunque no sean necesariamente largas de duración, son las mejores para inducir formación de tejido óseo, resultando en un refuerzo del hueso paralelo con aumento de su densidad. Las pequeñas deformaciones del hueso que se suceden durante las cargas pueden causar un mayor nivel de osteoformación, sea por una inhibición de reabsorción dentro del ciclo normal del remodelado óseo, sea por una activación directa de la formación osteoblástica superior a la del estado de reposo. Se han propuesto varios mecanismos para explicar la transformación de las tensiones mecánicas incidentes en estímulos biológicos para aumentar la osteogénesis. Estos incluyen factores locales tales como liberación de prostaglandinas, generación de potenciales y corrientes piezoeléctricas, aumento del flujo sanguíneo, microlesiones que habría que reparar con resultado positivo y factores generales como mecanismos hormonales inducidos a distancia, derivados de la aplicación de fuerzas no sólo al hueso concreto sino al propio organismo. Cada uno de estos estímulos podría actuar por sí mismo o en relación con otros, dependiendo de la situación de carga y las características de cada hueso2.
METABOLISMO
Se recogen aquí los trabajos recientes encontrados sobre cambios metabólicos que se producen en sujetos sometidos a diferentes ejercicios (tabla 1).
Un estudio comparó lo que sucedía en 15 mujeres, 7 de ellas cerca del pico de masa ósea al estar entre 21 y 27 años y 8 postmenopáusicas. Cuando estas últimas se entrenaron al límite, se encontraron elevaciones en las fracciones de la fosfatasa alcalina B1 y B2. Cuando las jóvenes corrieron aumentaron los niveles de B2 y PTH. Todos los cambios se normalizaron a los 20 minutos3.
Sin embargo, en otro estudio se apreció que la marcha viva en pista estimuló la reabsorción ósea dentro de las 32 horas siguientes, pero no produjo un efecto mensurable sobre la formación ósea4.
En un ensayo clínico5 se recogió, después de ejercicio de fuerza, aumento de PTH y pronunciado descenso del telopétido carboxiterminal I (ICTP), junto con relativo incremento de osteocalcina, lo que tradujo el efecto positivo sobre el tejido óseo en 8 jóvenes varones estudiados al practicar ciclismo seguido de pesos, respecto a controles, tras un esfuerzo agudo.
En 17 varones jóvenes, entre 23 y 31 años, se midieron marcadores de formación y reabsorción6. Un grupo hizo ejercicios con pesos 3 veces por semana durante 4 meses, aumentando significativamente en éstos la osteocalcina y la fosfatasa alcalina, desde los primeros meses del ejercicio de resistencia, y permaneciendo altas durante todo el tiempo del entrenamiento, mientras que no se encontraron cambios plasmáticos en el ICPT ni en la hidroxiprolinuria. Estos datos parecen demostrar que el aumento de formación no se precede de reabsorción. Tampoco durante el tiempo del estudio se objetivaron cambios en la masa ósea, lo que puede significar que los cambios metabólicos preceden a aquéllos.
Mujeres jóvenes atletas presentaron, tras una carrera de moderada resistencia de 45 minutos, signos de aumento del recambio colágeno y de la homestasis del calcio que bajó, mientras subía la PTH7.
En cambio, en otro grupo etario, en este caso mujeres mayores de 60 a 72 años, que siguieron incialmente un programa de ejercicios, de baja intensidad, durante 2 meses, seguidos de 9 meses de ejercicio más vigoroso durante 45 minutos al día, 3 días por semana, al 65%-85% de la máxima frecuencia cardíaca, se recogió un significativo aumento de la densidad mineral ósea (DMO) lumbar, femoral proximal y total, en respuesta a dicha actividad física y a la terapia hormonal sustitutiva (TSH) añadida, coincidiendo con un descenso de osteocalcina y del recambio óseo metabólico, lo que traduce no un aumento de formación, sino disminución de la reabsorción8.
En resumen, aunque la población y las condiciones en las que se realizaron los ejercicios no fueron homogéneas,en conjunto, de los estudios presentados parece recogerse un aumento de marcadores de formación y un descenso de reabsorción.
Finalmente, al revisar otro trabajo reciente9 sobre metabolismo óseo y entrenamiento deportivo se obtiene evidencia de que los cambios metabólicos y el consiguiente incremento de DMO se produce principalmente en niños y en adultos jóvenes pero no tanto en ancianos, en los que más bien se reduce la pérdida mediante ejercicios con peso. En todos los casos están aún poco precisados los niveles de esfuerzo que son necesarios para obtener un efecto positivo sobre la DMO.
EJERCICIO Y MASA ÓSEA EN EDAD PREPUBERAL
Según datos apuntados9, y teniendo en cuenta las distintas características del organismo a lo largo de la vida, en especial en lo que se refiere al crecimiento y declinación somáticos, a la distinta producción hormonal y a la fisiología de la nutrición, parece necesario presentar separadamente la influencia de la actividad física sobre el hueso en cada una de las etapas biológicas.
Una visión general extractada del efecto del ejercicio en la masa ósea de sujetos prepuberales recogida de ensayos clínicos publicados en los últimos 5 años aparece en la tabla 2.
Algunos trabajos han estudiado la importancia del ejercicio y de la ingesta cálcica en estas edades.
Así, el ejercicio moderado durante el crecimiento en 20 varones prepúberes, con edad media de 10 años, realizado durante 8 meses, 30 minutos, 3 veces por semana, proporcionó doble incremento de DMO que los controles a nivel de columna lumbar, piernas y general, a la par que mayor grosor cortical en fémures. Por lo tanto, el esqueleto en crecimiento parece ser sensible al ejercicio moderado, fácilmente asequible10.
Un programa que duró 10 meses, aplicado en 71 niñas de 9 a 10 años, inicialmente sin significativos cambios antropométricos entre ellas ni de ingesta de calcio ni de actividad física, permitió a las adicionalmente ejercitantes ganar masa magra, fuerza y masa ósea, respecto a sus controles no ejercitadas, a partir de un momento determinado. Por lo tanto, el ejercicio en la premenarquía tiene efectos positivos sobre el hueso y el músculo, pudiendo formar parte de una estrategia preventiva contra la osteoporosis cuando es de fuerza y alto impacto11.
Finalmente, en un estudio transversal con 1.359 chicos holandeses de ambos sexos, de 7 a 11 años, aunque inicialmente no se correspondió en los varones el ejercicio con DMO, en las chicas lo hizo a nivel de metáfisis. Sin embargo, cuando se compararon los grupos extremos, se halló que el contenido mineral óseo (CMO) fue superior en los de mejor condición física, aunque con significación estadística sólo en varones. También se pudo encontrar relación entre forma física y contenido mineral óseo en el subgrupo de individuos más maduros en ambos sexos. En cambio, no se encontró en este estudio relación entre ingesta de calcio y CMO12.
Se ha seguido prospectivamente el efecto sobre el CMO en hueso trabecular y cortical del antebrazo en relación con la ingesta, la actividad física y la exposición a la luz solar, en 470 varones y mujeres de 8 a 16 años, concluyéndose que la actividad física y la ingesta de calcio deben ser estimulados en la edad prepuberal para aumentar la DMO13.
También se ha visto14 que el ejercicio realizado antes de la pubertad puede otorgar beneficios residuales y persistentes en la DMO, evidentes en edades avanzadas, incluso hasta 20 años después del retiro de gimnastas, que ulteriormente practicaron con menor frecuencia e intensidad, lo cual puede contribuir a reducir el riesgo de fracturas.
EJERCICIO Y MASA ÓSEA EN ADOLESCENTES
Se ha encontrado que adolescentes que practican ejercicio físico continuado consiguen valores más altos de masa ósea que sus controles homólogos15. Un estudio en jóvenes varones ha recogido que el ejercicio aeróbico produjo reducción de la reabsorción ósea, mientras que el anaerobio dio lugar a una aceleración del metabolismo óseo16. También se ha señalado que el ejercicio excéntrico produce más masa ósea que el concéntrico.
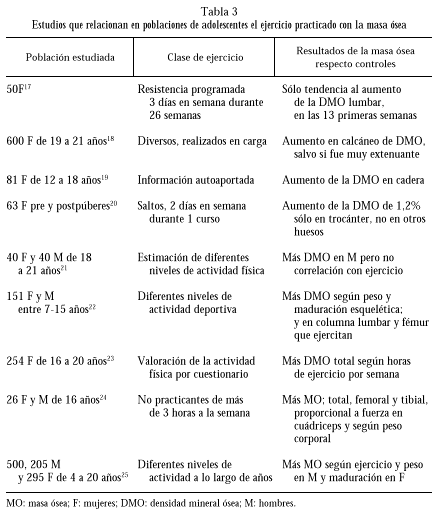
Los principales datos de varios ensayos clínicos que relacionan el ejercicio con la masa ósea a esta edad aparecen en la tabla 3.
Adolescentes postmenárquicas realizaron entrenamiento de resistencia durante 26 semanas a base de 4 series de 13 ejercicios de progresiva intensidad, 3 veces por semana, en máquinas de resistencia hidráulica. Sólo se recogió una tendencia hacia el incremento de DMO lumbar durante las 13 primeras semanas pero no en otros huesos, a pesar de que ganasen fuerza17.
En cambio, en 600 mujeres de 19 a 21 años se encontró, directamente proporcional, más DMO en el calcáneo de las ejercitantes, aunque paradójicamente las que dijeron hacer ejercicio muy extenuante tenían menos DMO en dicho hueso. En hombres sanos sometidos a impactos fuertes también se recogió mayor densidad ósea en el calcaneo. Sin embargo, mujeres postmenopáusicas que se ejercitaron dejándose caer 50 veces al día sobre los talones no tuvieron ganacia de masa ósea respecto a sus controles18. Estos datos denotan la importancia de los factores etario, sexual y hormonal en la ganancia de densidad mineral ósea con el mismo tipo de ejercicios sobre el mismo hueso.
Otro estudio óseo local, en este caso sobre la DMO de cadera, recogió que ésta reflejaba el patrón de ejercicio pero no la ingesta de calcio en 81 mujeres adolescentes de 12 a 18 años19. Estos datos son similares a los recogidos en escolares pre-púberes y púberes que saltaron durante un curso, 2 veces a la semana, en clases de educación física y que mostraron más DMO en trocánter pero no en otros sitios20.
Sin embargo, cuando se siguió a 40 jóvenes de cada sexo, con edades entre los 18 y 21 años, al acabar el crecimiento en altura, se vio que inicialmente el CMO fue significativamente superior en los varones en todos los huesos medidos. Se encontraron efectos positivos de la delgadez sobre la DMO en mujeres pero no en varones. El calcio de la dieta, la ingesta de nutrientes y los niveles de actividad física no fueron determinantes del CMO a ningún nivel21.
Diferentes resultados, al menos en algunos parámetros, se encontraron en 151 chicos de 7 a 15 años, de ambos sexos. A estos se les midió, con densitometría de doble emisión (DEXA), la DMO lumbar y femoral proximal, valorándose también la ingesta de calcio. Se encontró que el peso corporal y la prueba de maduración esquelética fueron los principales determinantes de la DMO. Influyó también la actividad deportiva semanal, tanto a nivel vertebral como femoral, especialmente en las chicas durante la pubertad. Además la ingesta de calcio, sobre todo prepuberal, fue condicionante de la masa ósea, tanto en sentido positivo como negativo22.
La masa magra y la actividad física como predictores de la DMO se estudiaron en 254 mujeres islandesas de 16 a 20 años, distribuidas aleatoriamente, en las que se midieron el CMO y la DMO en columna, cadera, antebrazo y total, así como las masas magra y grasa. Se encontró una correlación fuerte entre masa magra y CMO y DMO, mayor que el peso, altura y masa grasa. La DMO total fue logarítmicamente más alta según las horas de ejercicio por semana. Por lo tanto, en este estudio la actividad física y tener más masa muscular fueron determinantes para alcanzar un pico de masa ósea superior23.
Resultados semejantes se apreciaron en un nuevo estudio24 practicado sobre 26 adolescentes sanos, con edad media de 16 años, que no hacían más de 3 horas de ejercicio cada semana. Se les midió la DMO en diferentes huesos y se correlacionó con diferentes parámetros antropométricos y de fuerza muscular en cuádriceps y flexores de rodilla. Se encontró que la fuerza del cuádriceps y la masa corporal magra mostraron significativa correlación con la DMO total y de cada uno de los sitios medidos, sobre todo con fémur y tibia, más que con húmero y cráneo. La fuerza de los flexores de rodilla se correlacionó con la masa ósea de tibia, peroné y columna. La masa grasa, el índice de masa corporal y el peso se correlacionaron significativa e independientemente con la DMO de todos los sitios salvo fémur.
Finalmente, en 500 sujetos de 4 a 20 años, 205 varones y 295 mujeres, se midió la DMO con DEXA y se encontró que aumentaba con la edad, sobre todo en la pubertad. En varones se correlacionó con la ingesta de calcio y el ejercicio, así como el peso. En mujeres el mayor determinante independiente fue el estadio de Tanner25.
EJERCICIO Y MASA ÓSEA EN ADULTOS JÓVENES
En un estudio realizado sobre soldados suizos, con diferentes destinos y niveles de actividad física, se recogió que a las 15 semanas el CMO de la diáfisis tibial aumentó, con diferencias significativas según los puestos. En cambio, a nivel lumbar disminuyó significativamente en conductores de carros de combate y , paradójicamente, sobre todo en infantes, que eran los que tenían una actividad más dura, lo que no sucedió en otros soldados. A los 3 años la DMO lumbar se normalizó, siguiendo la anchura de las tibias aumentadas26.
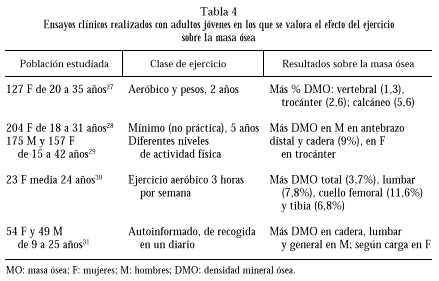
Los principales resultados sobre la masa ósea de ensayos clínicos con diferentes enfoques aparecen extractados en la tabla 4.
En 127 mujeres de 20 a 35 años, un programa de 2 años de ejercicio aeróbico y entrenamiento con peso aumentó la DMO, según se dedujo de comparar con controles aleatorizados que sólo hacían estiramientos, de modo que todos los parámetros medidos fueron superiores en el primer grupo, con diferencias significativas a nivel vertebral, femoral y calcáneo. Por el contrario, la administración de calcio no mostró efecto positivo en ningún parámetro en este estudio27.
El ejercicio físico fue también valorado en 204 mujeres de 18 a 31 años, mínimamente activas. Se midió el CMO, la DMO total, femoral y vertebral por DEXA. Se cuantificó la ocupación y el ocio durante los 5 años previos al estudio, así como la participación en la escuela y en el instituto en deportes, y se les asignaron valores según el trabajo físico desarrollado, distribuyéndose en 3 categorías que se correlacionaron con la DMO. Se dedujo del estudio que la actividad física previa se correspondía con la medida de masa mineral ósea en estas mujeres jóvenes28.
En población general, incluyendo 175 hombres y 157 mujeres de 15 a 42 años, se cuantificó con DEXA la DMO en varios huesos, encontrándose una correlación positiva entre actividad física y CMO en varones en el antebrazo distal, y en mujeres de 15 a 16 años en trocánter. Los hombres activos de 21 a 42 años tenían un 9% más de CMO en cadera respecto a los menos activos. La fuerza del cuádriceps no fue un predictor independiente de la DMO29.
Mujeres de 24 años que realizaron ejercicio aeróbico 3 horas por semana, comparadas con inactivas, presentaron más DMO total, lumbar, femoral y en triángulo de Ward y región intertrocanterea, tibia proximal y distal30.
Finalmente, en un estudio con jóvenes de ambos sexos, en los varones la actividad física se pudo correlacionar con la DMO en cadera, columna y general. En las mujeres la correlación fue sólo con las actividades de carga31.
EJERCICIO Y MASA ÓSEA EN MUJERES ATLETAS
Aunque la edad, casi siempre juvenil, y el realizar ejercicio físico podrían asemejar a este grupo con otros aparentemente afines, el sexo, la alteración de la producción estrogénica y la actividad física llevada al límite confieren particularidades muy especiales a las atletas, que merecen este epígrafe aparte.
En mujeres jóvenes se ha estudiado la relación entre el peso corporal y su composición, la fuerza muscular, la actividad física y la DMO. Las atletas mostraron una significativa mayor DMO lumbar, femoral y total respecto a las de bajo peso corporal y sedentarias. De hecho se encontró correlación entre DMO y masa corporal magra, aunque también con la masa grasa en sedentarias eumenorreicas32.
Sin embargo, es bien sabido que las atletas amenorreicas tienen menos DMO que las eumenorreicas, e incluso que las mujeres no atletas bien regladas. El principal factor es la influencia estrogénica, especialmente sobre el hueso trabecular. La pérdida de DMO puede ser reversible si se recobran las reglas disminuyendo el entrenamiento33.
Así, comparando atletas eumenorreicas con distintos regímenes de entrenamiento, se encontraron valores más altos en DMO en las que hacían más horas de trabajo y éste era más duro. En las que presentan reglas irregulares el ejercicio puede compensar los déficits de masa ósea34.
Sin embargo, otro estudio35 discrepa, refiriendo que no es probable que el ejercicio en carga pueda compensar los efectos deletéreos de la oligomenorrea, al menos si ésta dura más de 40 meses. De hecho se encontró correlación negativa entre DMO y duración de la oligomenorrea, tanto en sitios de carga como de no carga. En bailarinas con oligomenorrrea de menos de 40 meses de duración la DMO fue más alta que la media predecible en los sitios de carga, salvo a nivel lumbar. Con oligomenorrea de más de 40 meses no fue mayor en los sitios de carga y fue menor en los sitios de no carga.
Por consiguiente, las mujeres con amenorrea asociada al ejercicio tienen mayor frecuencia de osteoporosis (OP) que las corredoras eumenorreicas e incluso que las mujeres sedentarias. Cuando se dio terapia hormonal sustitutiva (THS) a 8 corredoras amenorreicas, y se compararó con otras 5 que la rechazaron, al seguirlas de 24 a 30 meses se vio que aumentaba notablemente la masa ósea en las tratadas, mientras que en las otras se comprobó un descenso no significativo36.
En conclusión, el ejercicio físico intenso produce trastornos del remodelado óseo e induce pérdida de densidad ósea en mujeres atletas al producirse un desequilibrio hormonal con descenso de producción de hormonas sexuales, lo cual puede causar OP irreversible y prematuramente, a pesar del estímulo positivo de la carga ósea.
Se han estudiado también mujeres exatletas de 42 a 50 años, con historia de más de 20 años de ejercicio competitivo, distribuyéndose a 4 grupos: a) ejercicios de alto impacto como el baloncesto o balón y red; b) intermedios como carrera y hockey sobre hierba; c) sin impacto, como nadadores y d) controles. Las del grupo a tenían una significativa mayor DMO total y regional en piernas, que las de los grupos c y d. Las del grupo b tenían más que las del d. La DMO en brazo fue superior en todas las ejercitantes respecto a los controles, pero no entre ellas. Por lo tanto, las exatletas conservan más masa ósea que la que tienen los controles37.
Otro estudio con 83 exatletas de elite de 40 a 65 años, que incluía 67 corredoras de medio y gran fondo y 16 tenistas, las comparó con 585 controles, midiendo con DEXA la DMO lumbar en cuello femoral y antebrazo. Según la actividad se dividieron en 4 grupos: a) exatletas; b) controles activas con más de 1 hora de ejercicio al día; c) controles con poca actividad y d) controles inactivas con menos de 15 minutos de ejercicio a la semana. Después de los ajustes por edad, peso, altura y hábito de fumar se encontró que las atletas tenían más DMO que los controles, ascendiendo a 8,7% en columna lumbar y al 12% en cuello femoral. En consecuencia, los efectos del ejercicio persisten después del cese de la actividad deportiva. Las controles activas tenían más DMO que las inactivas, con diferencias algo menores. Las controles de baja actividad tenían valores intermedios de DMO. Las tenistas tenían 12% en región lumbar y 6,5% en la femoral más que las corredoras y superior en su antebrazo dominante respecto al contralateral. En conclusión, el ejercicio vigoroso cargando peso 1 hora o más a la semana se asocia con incremento de DMO también en población normal38.
EJERCICIO FISICO EN ATLETAS JOVENES MASCULINOS
Se han medido los cambios en la DMO y el CMO por DEXA en 17 remeros que practicaban 8 horas a la semana y además hacían una hora de carrera y otra de ejercicios con pesas. A los 7 meses la DMO lumbar aumentó significativamente un 3% y el CMO un 4,2% respecto a los controles, en los que no se registraron cambios. Ningún grupo los tuvo tampoco a nivel femoral39.
Se han hecho varios estudios en jugadores de hockey sobre hielo. Uno de ellos comparó 20 miembros de un equipo con edad media de 15 años, con 24 voluntarios no entrenados más de 3 horas por semana. Se encontró que la fuerza del cuádriceps fue el principal predictor de la DMO en la tuberosidad tibial entre los controles pero no en los deportistas, no habiendo diferencias significativas entre ambos grupos hasta que no se excluyeron los que padecieron apofisitis del tubérculo superior de la tibia, denominada enfermedad de Osgood-Schlatter. Estos datos parecen demostrar una correlación sitio-específica relacionada con las fuertes contracciones40.
En otro equipo de hockey sobre hielo con 20 jugadores de 23,4 años de media, que entrenaban 10 horas por semana, se hizo una comparación de DMO y fuerza muscular con adultos jóvenes de diferente nivel de práctica de ejercicio. En los deportistas la DMO fue significativamente mayor en un 8% en todo el cuerpo, en un 11,4% en el húmero, en 12,7% en columna, en 12% en pelvis, en 10,3% en cuello femoral y así sucesivamente en otros huesos . Sin embargo, como era de esperar, la masa grasa fue significativamente menor en un 18,7%, mientras que la masa magra fue superior en un 5,4%, tal como la fuerza del cuádriceps. En los controles se encontró correlación entre la fuerza del muslo y la DMO en todos los sitios, salvo cabeza y tibia, así como entre el índice de masa corporal y la DMO en pelvis. En cambio, en los deportistas había menos correlación entre fuerza muscular y DMO41.
Otro estudio investigó 15 familias, de padres sedentarios, con 44 años de media en las mujeres y 47 en los hombres, que tenían hijos jugando hockey, concluyendo que la herencia es un principal determinante de la DMO en varones jóvenes, pudiendo influir también en la masa magra y fuerza, resaltando la importancia de la actividad física en el desarrollo y mantenimiento de la DMO42.
EJERCICIO Y MASA ÓSEA EN LA PRE Y PERIMENOPAUSIA
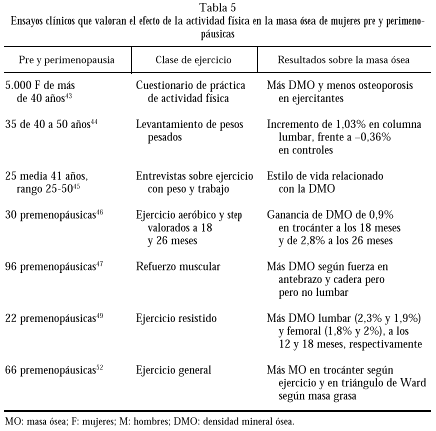
De forma sintética el lector puede encontrar resumidamente el efecto del ejercicio sobre la masa ósea en el extracto de ensayos clínicos presentado en la tabla 5.
En un estudio realizado en 5.000 mujeres de 40 años o más, en 14 centros de Japón, mediante un cuestionario de práctica de actividad física, se encontró más DMO y menos OP en las ejercitantes que en controles inactivas43.
En 35 mujeres de 40 a 50 años, que practicaron ejercicio de levantamiento de pesos pesados durante 6 meses, 3 días por semana, se encontró incremento de 1,03% de DMO, mientras que las controles perdían 0,36% en la columna. No se observaron diferencias en radio ni en cuello femoral44.
El estilo de vida, en su parte de actividad física, estaba asociado positivamente con la DMO en 25 mujeres de 41 años de media, con un rango desde 25 a 50 años, según se dedujo de entrevistas estructuradas, preguntando sobre ejercicio con peso, trabajos domésticos y laborales45.
El mantenimiento de la DMO ganada en un programa de 2 días a la semana, durante 18 meses, de ejercicios aeróbicos de fuerte impacto y step (ejercicio que incluye subir y bajar peldaños), se comprobó después de 8 meses en 30 mujeres premenopáusicas46.
En 96 premenopáusicas se midió la DMO lumbar en trocánter, cuello femoral, triángulo de Ward y radio medio; la fuerza muscular en cadera, espinales, prensión manual y en hombro. Se encontró correlación significativa linear entre la fuerza y la masa ósea en radio y cadera, pero no con los músculos de tronco y la DMO lumbar, que se correlacionó con el trabajo global. Los autores deducen que en este grupo el fortalecimiento muscular ejerce un efecto más sistémico que sitio-específico47.
También se ha encontrado en mujeres premenopáusicas que caminaban o bailaban más masa ósea que en sedentarias48.
Un estudio más completo se hizo para valorar los efectos de 18 meses de ejercicio resistido sobre la DMO regional y general, y sobre el tejido magro en premenopáusicas previamente inactivas de 28 a 39 años, siendo asignadas 22 a ejercicio y 34 a control. Se valoraron a los 5, 12 y 18 meses y todas tomaron 500 mg/d de calcio suplementario a la ingesta previa, que era de 1.000 mg/d. El ejercicio aumentó la fuerza hasta el 58% del 1RM (fuerza de resistencia máxima que puede elevarse una sola vez) y el 34% de la fuerza isocinética a los 18 meses, respecto al inicio. La DMO aumentó significativamente a nivel lumbar en el grupo de ejercitantes a los 5,12 y 18 meses y la del fémur a los 12 y 18 meses, respecto a las controles. No se encontraron cambios en la DMO total ni en brazos ni en piernas. La masa no grasa aumentó significativamente en total en brazos y piernas a los 5,12 y 18 meses en las ejercitantes49.
Un estudio para identificar correlaciones entre crecimiento, estilo de vida y pico de masa ósea en 150 mujeres encontró que la actividad física fue el mayor determinante de la DMO, superior a los parámetros antropométricos. El crecimiento o desarrollo determinan el tamaño de la envoltura esquelética, mientras que la actividad física influye sobre la DMO interior y consolida el hueso al terminar el crecimiento linear50.
No obstante, el papel de la masa grasa en mujeres premenopáusicas, separadas por niveles de actividad física, tiene relación con la DMO en las sedentarias. En cambio, en las ejercitantes la DMO femoral estaba relacionada con la masa magra, posiblemente por el efecto del ejercicio cargando peso51.
Este hecho se confirmó en otro estudio en 66 premenopáusicas en las que se midió la composición grasa, magra y la DMO a los 5,12 y 18 meses. La cantidad de grasa se correlacionó con la DMO en el triángulo de Ward y la de ejercicio con la del trocánter52.
La DMO en el triángulo de Ward se encontró también relacionada positivamente con la fuerza de los flexores de columna y la fuerza de empuñadura, pero no se encontraron otros cambios en mujeres premenopáusicas que trabajaban con pesas, comparadas con otras físicamente activas, en un ensayo clínico diseñado para valorar los efectos de la carga y el refuerzo muscular en la DMO vertebral y lumbar53.
Tampoco se encontraron efectos óseos del entrenamiento mediante un programa de ejercicio unilateral de alta resistencia, seguido de 8 meses sin entreno, sobre el CMO y la DMO en miembros superiores en 13 mujeres de 23,8 años de media, que ejercitaron el miembro superior izquierdo con mancuernas, una media de 2,8 veces por semana, durante 3 meses, seguidos de 8 sin entreno, comparadas con 19 controles. Aunque aquéllas aumentaron la fuerza no se recogieron cambios óseos ni con el ejercicio ni al dejarlo54.
EJERCICIO Y MASA ÓSEA EN LA POSTMENOPAUSIA
Numerosos estudios presentan resultados del efecto de la actividad física sobre el capital óseo en mujeres que han iniciado la característica disminución estrogénica de esta época de la vida. Presentamos seguidamente algunos de los más relevantes que hemos localizado, más extractados en la tabla 6.
La práctica de ejercicio resistido 3 días por semana, durante 16 semanas, mantuvo la DMO y aumentó la fuerza muscular, lo cual denota un efecto preventivo de las pérdidas esperadas por el paso de los años y la pérdida de niveles hormonales55.
Un estudio transversal con 580 mujeres de 45 a 61 años, mediante un cuestionario que valoraba las horas semanales de actividad física, incluyendo tareas domésticas, caminar, jardinería y deportes, encontró que la asociación más fuerte de la DMO, tanto en trocánter como general, estaba relacionada con subir escaleras y con el ritmo de marcha, pero no con las otras actividades56.
Un estudio hecho en postmenopáusicas que realizaban ejercicios de muñeca mostró un escaso efecto local, aunque remodeló los contornos del hueso cortical y aportó más resistencia a la flexión57.
La DMO del antebrazo se midió en 146 postmenopáusicas no entrenadas, de las cuales 82, con una media de 61,5 años, participaron en un programa de ejercicios, mientras que 64, con 59 años de media, sirvieron de control. Perdieron menos DMO las que siguieron el entrenamiento, aunque el cumplimiento fue escaso en muchas pacientes58.
Que los efectos del ejercicio sobre la masa ósea en postmenopáusicas son sitio-específicos y dependientes de la carga es lo que parece derivarse de un estudio realizado con 56 mujeres sometidas a entrenamiento con resistencia durante un año en un lado del cuerpo. Se midió la DMO cada 3 meses en el radio y en 4 sitios de la cadera. En ésta, el incremento fue aún significativamente mayor que en el radio. También se encontró que el peso era más importante que el mayor número de repeticiones con menor carga59.
El efecto del ejercicio físico sobre algunos parámetros del metabolismo óseo en 19 postmenopáusicas, durante 5 meses de moderada actividad física, se correlacionó con un paralelo aumento de la fuerza y flexibilidad, a la par que permitió preservar la masa ósea60.
Un trabajo sobre 57 mujeres de 60 años de media, practicantes de ejercicio regular durante más de 2 años, comparadas con 130 controles sedentarias, concluyó que el ejercicio tiene efecto benéfico sobre la DMO, la distribución grasa y la disminución de ésta61.
Otro reciente estudio, con 76 mujeres de 42 a 65 años, valoró la actividad y la forma física, concluyendo que éstas pueden jugar un papel considerable en la DMO62.
El ejercicio en el agua mejoró la forma física y el bienestar psicológico, aunque no produjo efecto en el esqueleto en osteopénicas postmenopáusicas63.
Mujeres pre y postmenopáusicas demostraron diferentes respuestas de DMO a ejercicios de alto impacto como practicar 50 saltos verticales de altura media de 8,5 cm, 6 días por semana. En las premenopáusicas hubo una ganancia significativa del 2,8% de DMO en fémur a los 5 meses, respecto a controles. En las postmenopáusicas no hubo diferencias ni a los 12 ni a los 18 meses y la THS no varió el efecto64.
En 62 postmenopáusicas que rechazaron la THS, el peso corporal demostró la más fuerte asociación con la DMO lumbar, mientras que la masa magra lo hacía con la DMO femoral. La forma física se correlacionó con la DMO femoral antes pero no después del ajuste de masa corporal, la masa magra y los años desde la menopausia y la toma de té. Estos 2 últimos factores y el peso corporal se correlacionaban con la DMO lumbar65.
Algunos estudios han analizado personas de ambos sexos. Uno de ellos incluyó 6 varones y 9 mujeres entre 50 y 73 años y comprobó que la DMO de cadera se mejoraba con el ejercicio aeróbico de alto impacto, comparados con 15 controles. Las clases, 2 días a la semana, incluían step y salto, específicamente dirigidos a cargar el fémur proximal y la columna. La DMO mejoró no significativamente en cuello femoral y en triángulo de Ward y significativamente en trocánter mayor. No hubo cambios en la DMO lumbar y la general se mantuvo en ejercitantes y bajó en controles, tal como sucedió en la fuerza femoral66.
Análogamente se concluyó que regímenes de entrenamiento de alta intensidad producían ganancia en DMO lumbar en 28 varones de 54 años de media, pero no en 26 mujeres de 52 años, mientras que los de moderada intensidad no producían cambios en ningún sexo sobre la columna. En varones, con ejercicios de mediana intensidad hubo ganancia en el trocánter, pero no en las mujeres. No hubo cambios por el entreno ni en el IGF-1 ni en el IGFBP3, aunque sí mejoraron la fuerza y la masa magra tanto en varones como en mujeres67.
En la tabla 7 se resumen los principales datos de varias revisiones sistemáticas de ensayos clínicos que recopilan el efecto de la actividad física en mujeres premenopáusicas y sobre todo postmenopáusicas. Seguidamente se comentan más detalladamente.
Una revisión de 18 estudios transversales y 29 prospectivos aportó evidencia de que la actividad física regular aumenta el contenido mineral óseo, o al menos lo preserva en mujeres premenopáusicas y postmenopáusicas, tanto si tenían masa ósea normal como baja. No encontraron los autores de esta revisión datos que demostraran menos fracturas pero creen probable la correlación68.
Un metaanálisis sobre el efecto del ejercicio y la densidad regional mineral ósea en postmenopáusicas, basado en 11 ensayos clínicos publicados entre 1975 y 1995, deduce que el ejercicio puede hacer más lenta la pérdida de masa ósea, aunque no se pudieron extraer conclusiones firmes sobre el efecto óseo local69.Otro metaanálisis de los mismos autores encontró que el ejercicio aeróbico ayudaba a mantener la DMO lumbar en postmenopáusicas y que en la cadera ejercía un moderado efecto positivo local70.
Un nuevo metaanálisis sobre la eficacia de la actividad física sobre la masa ósea en mujeres postmenopáusicas incluyó todos los estudios publicados en francés o en inglés, entre 1966 y 1996, con grupos de control, en mujeres sin síntomas osteoporóticos. De 217 estudios seleccionaron 18 que analizaban ejercicios de moderada intensidad como caminar, correr, acondicionamiento físico y aerobic. Se detectó un efecto significativo de la actividad física en la DMO entre las vértebras L-2 y L-4, aunque no se encontraron efectos en el antebrazo ni en el fémur, lo que demuestra una acción preventiva sobre las pérdidas lumbares71.
Otros autores también hicieron un metaanálisis de los ensayos clínicos publicados entre 1966 y 1996, que valoraban los efectos de programas de ejercicios sobre la masa ósea en mujeres premenopáusicas y postmenopáusicas. Encontraron 62 y admitieron 25 que cumplían los criterios de inclusión. Concluyeron que los programas de ejercicios previnieron o repusieron casi el 1% de pérdida ósea por año, tanto en columna como en fémur en premenopáusicas y en postmenopáusicas. Dos estudios no encontraron correlación entre la intensidad del ejercicio y la masa ósea72.
Las siguientes conclusiones sobre el tema son las que el Colegio Americano de Medicina Deportiva refiere en un editorial de síntesis73. Los efectos del ejercicio sobre la masa ósea varían según la edad, estado hormonal, nutrición y prescripción de ejercicio, pareciendo superiores en los estudios transversales que en los prospectivos, lo cual puede ser debido a sesgos o a diferencia de programas. Mucho más evidente es que la inactividad produce un efecto deletéreo en espiral. En postmenopáusicas no hay seguridad de que el ejercicio, aún añadiendo calcio, pueda prevenir la pérdida de masa ósea, pero tiene otros efectos seguros y debe ser recomendado. La actividad física en carga es esencial para el normal desarrollo y mantenimiento de un esqueleto sano, mientras que los ejercicios resistidos, de fuerza, pueden ser beneficiosos para los huesos que no cargan. Las mujeres sedentarias pueden evitar la pérdida de masa ósea con el ejercicio, aunque éste no puede reemplazar a la THS. En mujeres mayores lo óptimo sería aumentar la fuerza, la flexibilidad y la coordinación para evitar caídas .
EJERCICIO Y MASA ÓSEA EN ANCIANOS
La mayoría de los ensayos clínicos revisados en personas de edad avanzada (tabla 8) incluyen mujeres unos 10 años mayores de la edad media de la menopausia, frecuentemente con algunos pacientes menores de 65 años, y estudian, además de la masa ósea, otros factores relacionados. En todo caso, además del incremento de DMO, que se recoge en algunos, un beneficio sería sólo conservarla. De todos modos, el incremento de la buena forma física, la calidad de vida, el equilibrio corporal y la fuerza contribuyen a prevenir las caídas. Por todo ello, el ejercicio debe ser considerado, también a estas edades, como una estrategia de tratamiento.
El efecto del ejercicio sobre la estabilidad dinámica se estudió en 112 mujeres de 60 a 85 años, incluidas en un ensayo clínico aleatorizado que transcurrió en 12 meses. De ellas 48 recibieron 58 clases, resultando que éstas mejoraron el equilibrio y la coordinación y la fuerza en los miembros inferiores, mientras que no hubo cambios en los controles74.
Otro estudio incluyó 163 mujeres sedentarias a las que se le valoró la DMO a los 11 meses. Se dividieron en 3 grupos: a) las que hicieron ejercicios que provocan estrés en el esqueleto, mediante fuerzas de reacción contra el suelo, tales como caminar, subir escaleras, saltar; b) las que hicieron ejercicios que provocaban reacciones articulares, como levantar peso o remar; y c) controles, que no se ejercitaban. En las personas de los grupos a y b se detectaron similares incrementos de DMO en cuerpo total, columna lumbar y triángulo de Ward. Sin embargo, en el cuello femoral sólo se incrementó en las del primer grupo75.
En un ensayo clínico con 170 mujeres de 60 a 85 años, con una media de 71,6, aleatoriamente asignadas, para determinar si un programa de ejercicios de 2 días a la semana rendía beneficios sobre 3 factores asociados a fracturas osteoporóticas, como la fuerza del cuádriceps, el equilibrio postural y la DMO, encontró que los 2 primeros, pero no la masa ósea, mejoraron, siendo el índice de fracturas también más favorable en las personas activas76.
Un trabajo con 56 mujeres de 42 a 73 años, que habían sido corredoras de competición, de 20 a 25 años antes, las clasificó según su entrenamiento en años recientes en muy, medio y no entrenadas y midió la DMO de todas, no encontrando diferencias en región lumbar ni de cadera, no presentando tampoco más masa ósea que las personas de control77.
En 143 ancianos frágiles, de 78 años de edad media, el grupo de entrenados mantuvo la masa magra y el grupo con alimentación enriquecida aumentó el CMO78.
Otro estudio contó con 44 mujeres sedentarias de 68 años de edad media, que entrenaron durante un año, una hora, 3 veces por semana, mediante 3 series de ejercicios sobre músculos grandes, recogiéndose ganancia de fuerza y paralelamente de DMO, con una correlación moderada79.
Con 15 personas de cada sexo de 40 a 70 años, todas ellas con baja masa ósea en el radio distal, se hizo un programa de entrenamiento de un año con 2 sesiones de 60 minutos por semana, encontrándose al final un significativo incremento de masa ósea en trocánter mayor, de equilibrio y capacidad de captación de oxígeno, en tanto que en los controles hubo aumento de DMO lumbar, que los autores sugieren podría deberse a reacción artrósica80.
Se ha valorado el efecto sobre la fuerza de 42 semanas de levantamiento progresivo de pesos del 50% al 80% del 1RM, 2 días cada semana, en personas de ambos sexos de 60 a 80 años. A los 10 meses había ganancia de hasta un 65% de fuerza y en volumen de cuádriceps en los ejercitantes pero no hubo diferencias en la DMO respecto al grupo control81.
En general, podría decirse que el efecto del ejercicio, especialmente en carga y con pesos, aunque no siempre o menos en ancianos, parece que cuenta sobre la masa ósea, como las hormonas y la nutrición. Dejarlo produce rápidos cambios metabólicos óseos, por lo que los pacientes inmovilizados deben reemprender un programa de actividades de la vida diaria, con ejercicios supervisados, tan pronto como sea posible82.
Existe relación dosis-respuesta entre cargas físicas y competencia mecánica del hueso, que se aprecian proporcionales in vitro y en animales, aunque en los seres humanos la valoración directa está dificultada. No obstante, en la mayor parte de la literatura revisada se estima un aumento de la competencia ósea para resistir la fractura con la actividad física, manteniendo, al menos, el CMO y también la coordinación neuromuscular, disminuyendo la fragilidad y el riesgo de caídas83.
OTROS FACTORES INFLUYENTES SOBRE EL EJERCICIO Y LA MASA ÓSEA
HORMONAS
Ya se ha anticipado que el efecto del descenso de estrógenos en atletas, primeramente manifestado sintomáticamente por amenorrea y oligomenorrea, puede causar osteoporosis prematuramente, a pesar del excepcional estímulo óseo mecánico que reciben estas personas84. Los ejercicios en carga parecen compensar, al menos parcialmente, los efectos del bajo nivel de hormonas sexuales sobre el hueso85.
No hubo diferencias en atletas entrenadas, en sus respectivas masas óseas, entre eumenorreicas e irregulares. De hecho las gimnastas ganaron más que las corredoras, a nivel lumbar y femoral, y más destacadamente que las nadadoras, que perdieron en ambos sitios. Se deduce que los fuertes impactos son particularmente osteotropos en jóvenes bien entrenadas, siempre que no sean amenorreicas86.
En 188 mujeres de 20 a 35 años se estudió la influencia del ejercicio y los anovulatorios. Se encontró un mayor CMO en las que tenían una larga historia de ejercicios y corta de toma de anovulatorios. No hubo beneficios en la DMO si llevaban largo tiempo con ejercicio y anovulatorios. Con historia corta de ejercicios y anovulatorios no hubo cambios respecto a controles homólogos87.
En lo que atañe a la THS, en postmenopáusicas se ha comprobado su efecto positivo sobre la DMO y la fuerza88.
En una revisión general de la repercusión favorable de diferentes ejercicios de fuerza y de resistencia sobre la DMO, a varios niveles, se recoge que la THS y el ejercicio se potencian, y además se concluye que éste, al mejorar el equilibrio y reforzar la musculatura, aunque el efecto sobre la masa ósea en adultos sea pequeño, contribuye a disminuir las fracturas88.
CALCIO
También se ha mencionado antes someramente su relación como cofactor con el ejercicio en algunos trabajos previos. Un ensayo clínico aleatorizado, de 2 años de duración, para ver los efectos del aumento dietético de calcio y el ejercicio, reclutó 168 mujeres que llevaban más de 10 años de postmenopáusia y las dividió en 4 grupos. Éstos eran placebo, leche en polvo de 1 g de calcio, tabletas de 1 g de calcio por la noche y 1 g de calcio más ejercicio en carga 4 h/semana durante 2 años. Se midió la DMO en 3 sitios del fémur, en región lumbar y en tibia, con 3 meses de intervalo. Los suplementos de calcio, en tabletas o leche, dieron lugar a un cese de pérdida de masa ósea en región intertrocanterea respecto a placebo. Los suplementos más ejercicio determinaron menos pérdidas en cuello femoral, comparadas con los de suplemento solo o placebo89.
Un efecto protector del ejercicio regular recreativo y de la ingesta de leche fue apreciado en hombres japoneses sanos, sobre la DMO lumbar y de cuello femoral, siendo el de la leche en particular sobre columna y radio90.
Se dedujo de un estudio de DMO con madres e hijas que los suplementos de calcio y estrógenos exógenos influencian la masa ósea en postmenopáusicas, así como el ejercicio físico, como medios de prevención de la OP, por encima de la afinidad familiar, pudiendo compensar el condicionante genético91.
Hay correlación entre disponibilidad de nutrientes, especialmente calcio, y masa ósea, en postmenopáusicas cuando se acompaña de ejercicio. En sentido contrario, durante la inmovilización disminuye la absorción intestinal de calcio92.
NOTICIAS
LA FUNDACIÓN HISPANA DE OSTEOPOROSIS Y ENFERMEDADES METABÓLICAS ÓSEAS
Convoca el VIII PREMIO CIENTÍFICO FHOEMO 2001 de acuerdo con las siguientes BASES
1. Este Premio, con una dotación de 250.000 pesetas, tiene como objetivo premiar al mejor trabajo sobre Osteoporosis y Enfermedades Metabólicas Óseas.
2. El trabajo, para la presente edición, deberá haber sido desarrollado en España o Iberoamérica y publicado durante el año 2000 en cualquier revista de habla hispana.
3. La fecha límite para la recepción de los trabajos será el 15 de enero de 2002.
4. El Jurado estará compuesto por cuatro miembros del Comité Científico de la FHOEMO, actuando como secretaria del Jurado, con voz pero sin voto, la Secretaria de la misma.
5. La decisión del Jurado será inapelable y el Premio podrá ser declarado desierto si, a juicio del Jurado, se estimase que los trabajos presentados no reúnen el nivel profesional médico y técnico adecuados.
6. La FHOEMO se reserva la disponibilidad del trabajo una vez publicado para su difusión, si lo considera oportuno. Los trabajos concursantes no serán devueltos a sus autores.
7. Los aspirantes aceptarán las presentes bases por el mero hecho de concurrir a esta convocatoria.
8. Las solicitudes se enviarán, junto con seis copias del trabajo objeto de consideración, a:
VII PREMIO CIENTÍFICO - FHOEMO
Gil de Santivañes, 6 - 2.º D
28001 - Madrid
Tel/Fax.: 91 578 35 10