Introducción
El endotelio es actualmente reconocido como un órgano dinámico con importantes funciones autocrinas y paracrinas, que le permiten mantener la homeostasis vascular a través de múltiples y complejas interacciones entre las células endoteliales y la luz de vaso. Las principales funciones homeostáticas del endotelio involucran: a) la regulación del tono vascular a través de una producción balanceada de factores vasodilatadores y vasoconstrictores; b) el mantenimiento de la fluidez y la coagulación de la sangre mediante la producción de factores que regulan la actividad plaquetaria, la cascada de coagulación y el sistema fibrinolítico; y c) la producción de citocinas y moléculas de adhesión que regulan la función inflamatoria vascular1.
El término "función endotelial" (FE) se refiere específicamente a la conservación de esta amplia variedad de funciones, lo que desde un punto de vista fisiológico y clínico se expresa a través de la óptima dilatación del tejido vascular y la capacidad de prevenir la vasoconstricción anormal. Esta condición resulta en un fenotipo endotelial normal, capaz de evitar el desarrollo y expresión clínica de patologías como la arteriosclerosis2. Entre los compuestos responsables de la capacidad vasodilatadora del endotelio, el óxido nítrico (NO) es probablemente el principal factor relajante producido por la isoforma endotelial de la enzima óxido-nítrico sintetasa (eNOS). El NO se opone además a la lesión vascular y al desarrollo de patologías como la arteriosclerosis a través de su efecto antiagregante, antiproliferativo e inhibitorio de los fenómenos inflamatorios3. Por el contrario, las anormalidades de una o varias de las vías metabólicas que regulan la FE, como la producción y/o biodisponibilidad del NO, conducen a la disfunción endotelial. Esta última es característica de la enfermedad cardiovascular y frecuentemente se presenta de forma conjunta con los diferentes factores de riesgo cardiovascular (hipertensión arterial, obesidad, diabetes hipercolesterolemia etc.), siendo un importante factor pronóstico sobre la morbilidad y mortalidad cardiovascular4.
El ejercicio físico fue asociado primeramente a la mejora de la FE a partir de que Delp et al5 publicaran a principios de los años noventa que 12 semanas de entrenamiento físico en ratas mejoraban la relajación endotelial en respuesta a la infusión de acetilcolina, un vasodilatador dependiente del endotelio. A partir de ello, una creciente cantidad de evidencias científicas continuaron mostrando el ejercicio como una potencial estrategia para la mejora de la FE. Por ello, este artículo tiene como objetivo realizar una revisión acerca de los efectos agudos y crónicos del ejercicio físico sobre la mejora o restitución de la FE, tanto en sujetos sanos como en aquellos con manifiesta disfunción endotelial, intentando ayudar en la clarificación del papel que tiene el tipo de ejercicio sobre la producción y/o biodisponibilidad del NO. Asimismo, pretende analizar de forma crítica las recientes evidencias experimentales sobre los efectos del ejercicio físico en la capacidad regenerativa del endotelio y por consiguiente sobre la mejora de la disfunción endotelial.
El NO como factor vasodilatador dependiente del endotelio
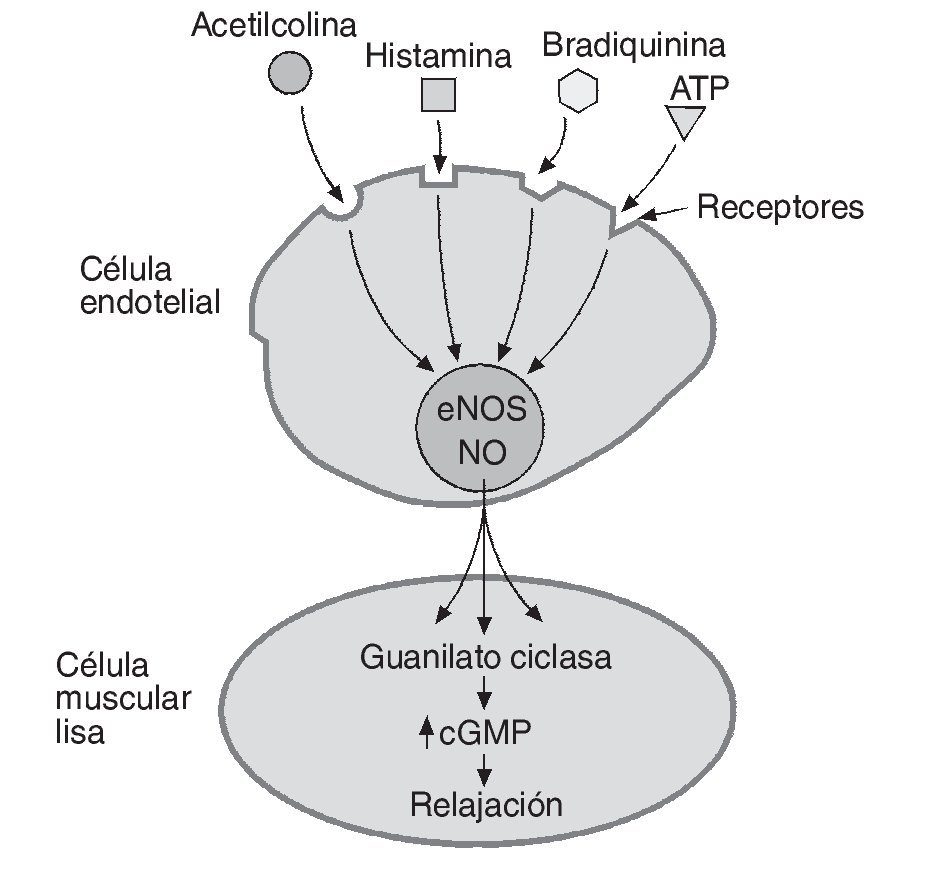
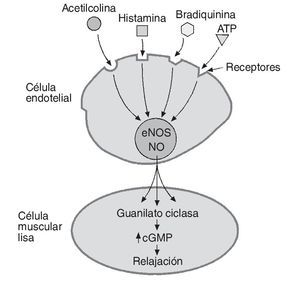
El NO es un radical libre de naturaleza lipofílica sintetizado por las células del endotelio vascular que actúa como principal factor vasodilatador derivado de endotelio y regulador de un amplio número de procesos homeostáticos locales. Como vasodilatador, su mecanismo de acción se basa en la relajación directa de la célula muscular lisa a nivel local, a través de un incremento en la actividad de la guanilato ciclasa y en la concentración de guanosin monofosfato cíclico (cGMP) (fig. 1). El NO además actúa como inhibidor de la adhesión y agregación plaquetaria, inhibidor de la proliferación de las células musculares lisas, inhibidor de la expresión de moléculas de adhesión e incluso como un antioxidante al compensar los efectos del anión superóxido6.
Fig. 1. Relajación del endotelio provocada por el óxido nítrico (NO). El NO sintetizado por la enzima óxido-nítrico sintetasa (eNOS) en la célula endotelial es liberado tras el estímulo generado enteramente, o al menos en parte, por diferentes sustancias vasoactivas. El NO difunde dentro de la célula muscular lisa donde incrementa la actividad de la guanilato ciclasa y la concentración de guanosin monofosfato cíclico (cGMP) generando relajación celular y dilatación del vaso afectado.
Aunque el endotelio posee una producción constitutiva de NO por actividad de la eNOS, ciertas condiciones como la inflamación activan vías paralelas y el NO puede ser sintetizado también a partir de la regulación positiva de la isoforma inducible de NOS7. Además, la síntesis constitutiva de NO está regulada en condiciones normales por diferentes factores ambientales como el ejercicio físico y la disponibilidad de nutrientes aportados por la dieta8. Estudios realizados con cultivos de células intactas demostraron que la síntesis de NO es altamente dependiente de la disponibilidad de glucosa9 y que una deficiencia de esta última y/o proteínas provoca una reducción de la síntesis de NO a nivel del endotelio y en otras líneas celulares8, 10. En consecuencia, la regulación de la NOS y la biodisponibilidad de su producto son aspectos críticos para la homeostasis de la FE, y pueden prevenir o favorecer la ocurrencia de lesiones endoteliales.
Estudio de la FE a través de la dilatación arterial
El método de referencia para la evaluación de la FE consiste en medir la vasodilatación de las arterias coronarias a través de la infusión intracoronaria de un agonista como la acetilcolina. Este compuesto actúa sobre las células endoteliales provocando la liberación de NO y la dilatación de las arterias11. Sin embargo, existen importantes limitaciones en el uso de este método que vienen determinadas por su costo, el nivel de especialización que requiere para su realización y, sobre todo, por la naturaleza invasiva de la técnica12.
Una posible alternativa a la coronariografía surgió de la idea de que la respuesta vasodilatadora estimulada por el incremento en el flujo sanguíneo de una arteria periférica es mediada por su endotelio13. Tomando como base este concepto y con el objetivo de estandarizar una técnica más sencilla para valorar de forma indirecta la FE, Celermajer14 creó la prueba de la hiperemia reactiva posisquemia (IRH), que permite medir la vasodilatación dependiente del endotelio en arterias periféricas (braquial, radial y femoral). La mencionada prueba consiste en el incremento de la irrigación sanguínea de un órgano o tejido por restitución del flujo tras liberar la oclusión transitoria de una arteria. En estas condiciones, la repercusión ocasiona un aumento agudo de las fuerzas de cizalla sobre la pared vascular que conduce a la apertura de los canales de potasio y por consiguiente a la hiperpolarización de la célula endotelial15. Esta modificación del gradiente eléctrico provoca la entrada de calcio a la célula endotelial, incrementando la actividad de la NOS y la producción de NO, lo cual termina por inducir una respuesta vasodilatadora aguda16, 17. Si bien otros factores también han sido involucrados en la vasodilatación mediada por el flujo, como es el caso de la regulación neuronal del tono vasomotor y la liberación de prostaglandinas18, es el estrés mecánico provocado por la restitución del flujo sanguíneo el principal responsable de la respuesta dilatadora dependiente del NO15.
La prueba de IRH puede ser realizada con el soporte de diferentes tecnologías, como la ultrasonografía de alta resolución o la flujometría por láser doppler. La ultrasonografía de la arteria braquial es una técnica ampliamente usada en investigación clínica que permite medir la FE periférica19; observándose correlación de esta medida con la FE de las arterias coronarias20. Sin embargo, la realización de ultrasonografía aún conserva dos importantes limitaciones (la disponibilidad de un equipo tecnológico de alto costo, junto con la necesidad de radiólogos o ultrasonografistas especializados12, 21), además de ser una técnica que requiere de al menos 30 minutos para su realización, con la consecuente dificultad para el estudio de la FE aguda tras una intervención dietética, farmacológica o de ejercicio físico.
Por otra parte, el láser doppler usado para determinar el grado de dilatación arterial a través de flujometría es una opción relativamente sencilla, que requiere personal menos especializado y cuya técnica de realización no requiere más de 10 minutos. Si bien hasta la fecha no se ha demostrado una correlación directa con la FE medida en las arterias coronarias, diferentes estudios han demostrado que el láser doppler tiene una aceptable sensibilidad para el estudio de la respuesta endotelial periférica22-24. Esta variable se relaciona además con diferentes factores que modulan la respuesta dilatadora del endotelio, como la biodisponibilidad del NO y la activación endotelial (ICAM, VICAM) afectadas por la ingesta dietética22. Por último, el láser doppler ha mostrado tener una aceptable reproducibilidad en la medida de la respuesta vasodilatadora, con una variabilidad interestudio de 8,8% entre intervalos de medición de 3 semanas24, 25 y una variabilidad intraestudio de 8,7% sobre un total de 10 mediciones realizadas en sujetos sanos en el mismo día de estudio26.
FE y estrés oxidativo
La reducción en la bioactividad y/o biodisponibilidad del NO ha sido relacionada con el deterioro de la FE en pacientes con diferentes factores de riesgo cardiovascular (hipertrigliceridemia, hiperglucemia, hipertensión arterial etc.) arteriosclerosis y síndrome metabólico27. En estas patologías, el estrés oxidativo es la condición común capaz de explicar este deterioro de la función vascular mediada por alteraciones en el sistema del NO28, 29. Durante el desequilibrio redox, el anión superóxido (O2*-) rápidamente reacciona con el NO inactivándolo y reduciendo la capacidad vasodilatadora del endotelio. Esta reacción bioquímica conduce además a la producción de peroxinitrito, un intermediario altamente reactivo que favorece la nitración de proteínas y el daño oxidativo de los lípidos circulantes, por lo que guarda una relación directa con la modificación oxidativa de las lipoproteínas de baja densidad (LDL) y la progresión del daño endotelial30. Por otra parte, la sobreproducción de O2*- podría provocar la depleción de los sistemas antioxidantes endógenos, contribuyendo al deterioro de la FE y al proceso arteriosclerótico31, 32.
Existen distintas fuentes de producción de O2*- a nivel endotelial, entre las que se encuentran principalmente: a) la actividad de células inmunitarias y las reacciones inflamatorias7, b) el complejo enzimático NAD(P)H oxidasa que cataliza la reducción del oxígeno molecular usando NAD(P)H33, y c) el sistema enzimático de la xantino oxidasa que cataliza la reducción de la hipoxantina a xantina durante el metabolismo de las purinas34. Además, diferentes hábitos de vida, como el tabaquismo y modelos dietéticos pobres en antioxidantes alimentarios o ricos en carbohidratos y/o grasas saturadas, pueden incrementar la producción de radicales libres provocando estrés oxidativo y deterioro de la FE30. La hipertrigliceridemia posprandial es uno de los principales fenómenos asociados al estrés oxidativo y a la reducción de la FE tras la ingesta aguda de comidas ricas en grasa saturada, tanto en sujetos sanos22, 35, como en pacientes con respuesta lipémica posprandial incrementada (como es el caso de pacientes diabéticos o con síndrome metabólico)36, 37. La hiperglucemia posprandial ocasionada por la ingesta aguda de alimentos ricos en hidratos de carbono, así como aquella que ocurre crónicamente en la diabetes mellitus, es otro fenómeno asociado a la sobreproducción de O2*- y a la disminución de la actividad de la eNOS y/o a la destrucción del NO disponible38. La reducción en la actividad de la eNOS bajo condiciones de hiperglucemia conduce al deterioro de la FE39; y en animales knockout para eNOS se ha observado una progresión acelerada hacia la retinopatía diabética40, lo que evidencia la importancia de la producción de NO en la patogénesis vascular.
Ejercicio físico y FE
Durante el reposo, los aproximadamente 5 litro de sangre que se distribuyen por el organismo en un minuto se reparten principalmente hacia las vísceras como el hígado, cerebro y riñones; mientras que sólo una quinta parte de ese volumen sanguíneo se destina al músculo esquelético. Contrariamente, en condiciones de ejercicio físico, la irrigación sanguínea de los tejidos se modifica según su nivel de actividad metabólica, por lo que el incremento de la intensidad de la contracción muscular se acompaña también de un aumento en la proporción del gasto cardiaco dirigido hacia las masas musculares41. Esta redistribución sistémica del flujo sanguíneo está determinada por la estimulación simpaticoadrenal dependiente de la intensidad del ejercicio y del tamaño de la masa muscular implicada42. Los riñones y las vísceras esplácnicas experimentan una importante reducción de 4 o 5 veces menor cantidad de sangre que la que reciben en condiciones de reposo. Esta reducción del flujo sanguíneo ocurre incluso ante una baja intensidad relativa del ejercicio (90 lpm de frecuencia cardiaca)43.
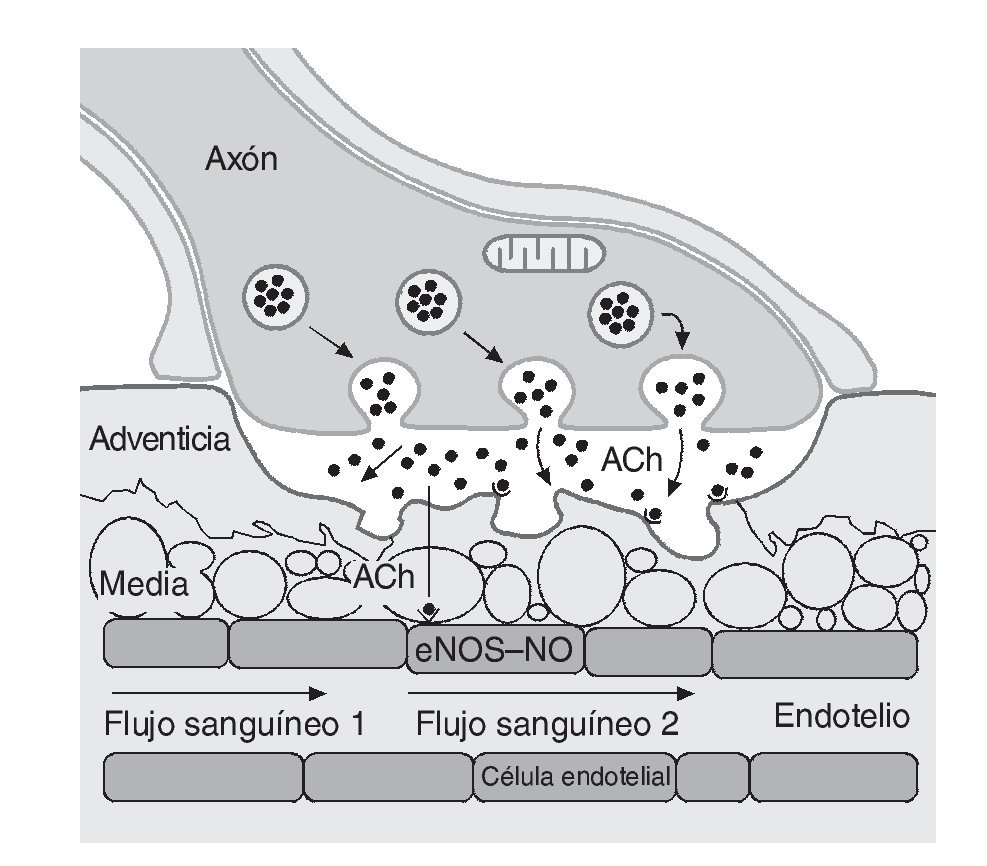
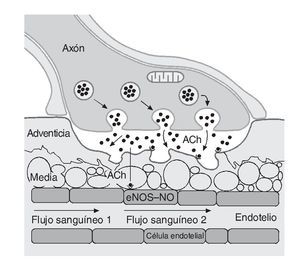
Dos factores contribuyen a la reducción del flujo sanguíneo en los tejidos no activos: a) la activación simpaticoadrenal específica y b) las sustancias locales que estimulan la vasoconstricción o potencian el efecto de otros vasoconstrictores44. Por el contrario, a nivel de los tejidos que precisan un incremento del flujo sanguíneo, es decir los músculos activos, la contracción repetida de las fibras conduce a un fenómeno denominado "simpaticolisis funcional", donde la vasoconstricción simpática es superada por las demandas metabólicas de los miocitos, provocando la vasodilatación de los vasos circundantes45. Esta simpaticolisis permite la distribución de nutrientes hacia el músculo activo previa atenuación adrenérgica, lo que da paso a una incrementada dilatación mediada principalmente por el NO46, 47. Para ello, los nervios motores aumentan la liberación de acetilcolina estimulando la producción y liberación de NO (fig. 2). Además, de forma antagónica ambas sustancias pueden inhibir la liberación de adrenalina y noradrenalina48.
Fig. 2. Estimulación de la síntesis y liberación de óxido nítrico (NO) durante el ejercicio. ACh: acetilcolina; eNOS: enzima óxido-nítrico sintetasa.
Efectos agudos del ejercicio sobre la FE
Se ha observado, tanto en jóvenes sedentarios como en aquellos físicamente entrenados, que una sesión única de ejercicio físico (5 series de 5 minutos de trote al 90% Vo2max) es suficiente para provocar un significativo incremento de la vasodilatación mediada por el flujo y de la biodisponibilidad de NO durante las siguientes 48 horas después de finalizado el esfuerzo49. Un efecto semejante sobre la capacidad vasodilatadora del endotelio también fue descrito en pacientes con insuficiencia cardiaca crónica, quienes mostraron un incremento de la IRH tras una sesión aguda de ejercicio físico (25 minutos de pedaleo continuo)50.
Este incremento en la respuesta dilatadora del endotelio parece estar determinado por dos efectos diferentes del ejercicio pero estrechamente relacionados entre si: por un lado, estaría el potente estímulo mecánico que provoca el ejercicio sobre la pared vascular, por otro, el incremento de las necesidades metabólicas en los músculos activos que precisan de la captación de sustratos energéticos para mantener la contracción de las fibras. En ambos fenómenos, el NO parece tener el papel principal para determinar la respuesta endotelial frente al ejercicio, tal como fue demostrado a partir del incremento agudo en la síntesis y utilización de NO durante e inmediatamente después del ejercicio físico51, 52.
Efecto mecánico o físico provocado por el ejercicio
Durante el ejercicio se produce un incremento en la velocidad del flujo sanguíneo a través de los vasos, lo cual provoca un aumento de las fuerzas de fricción sobre la pared vascular. El estrés mecánico resultante de este fenómeno está directamente relacionado con la velocidad y viscosidad de la sangre53 y se constituye como el principal estímulo para la producción endotelial aguda de NO que tiene como objetivo incrementar proporcionalmente el diámetro del vaso. A nivel molecular, el estrés mecánico provoca un incremento en la transcripción del ARNm y proteína de la eNOS modulado por apertura de los canales de K+ en la célula endotelial. Este fenómeno junto con la acumulación de nitrito (un compuesto estable que resulta de la degradación del NO) incrementan la capacidad que tiene la célula expuesta al estímulo de producir NO y subsiguientemente la dilatación del vaso54.
La intensidad del estrés mecánico generado es, por lo tanto, proporcional a la duración e intensidad del ejercicio físico realizado, así como a la masa muscular involucrada en el esfuerzo55. Además, el tipo de ejercicio también modula de forma directa la intensidad de las fuerzas de fricción y por consiguiente la producción del NO56, 57. Esta particularidad dependiente del tipo de ejercicio se debe a las diferencias provocadas en el comportamiento del flujo sanguíneo y particularmente a la oscilación entre un flujo sistólico anterógrado y el diastólico retrogrado provocado en cada tipo de ejercicio físico. Una mayor oscilación entre estos flujos determina un incremento en las fuerzas de fricción; lo cual explica los hallazgos de una mayor vasodilatación mediada por el NO en los miembros superiores inactivos, tras la realización de ejercicios del miembro inferior, como es el caso del ciclismo, trote y caminata58, 59, donde el flujo total es incluso menor que en los ejercicios del miembro superior, pero con un mayor componente retrógrado en el flujo60.
Efecto metabólico provocado por el ejercicio
Durante el ejercicio el NO es también un potencial modulador del metabolismo del músculo esquelético que favorece la captación celular de combustibles como la glucosa. En este sentido, diferentes estudios en modelos animales habían observado que el incremento en la síntesis de NO durante el ejercicio respondía a la necesidad del músculo de preservar las reservas energéticas favoreciendo la entrada de glucosa al músculo61, 62. Sin embargo, esta evidencia fue confirmada recientemente en seres humanos a través de un estudio realizado por Bradley et al en el que un inhibidor de la NOS (L-NMMA) infundido en la arteria femoral durante un ejercicio aeróbico en cicloergómetro, redujo la captación de glucosa en un 48% comparado con la infusión de una solución salina de control63. En este sentido, los mecanismos exactos que explican la captación de glucosa mediada por el NO son aún parcialmente comprendidos, aunque se sabe que actúan de forma independiente y paralela a los mecanismos inducidos por la insulina (como la activación de los GLUT4) y que no resultan significativamente afectados cuando se inhibe experimentalmente la NOS64.
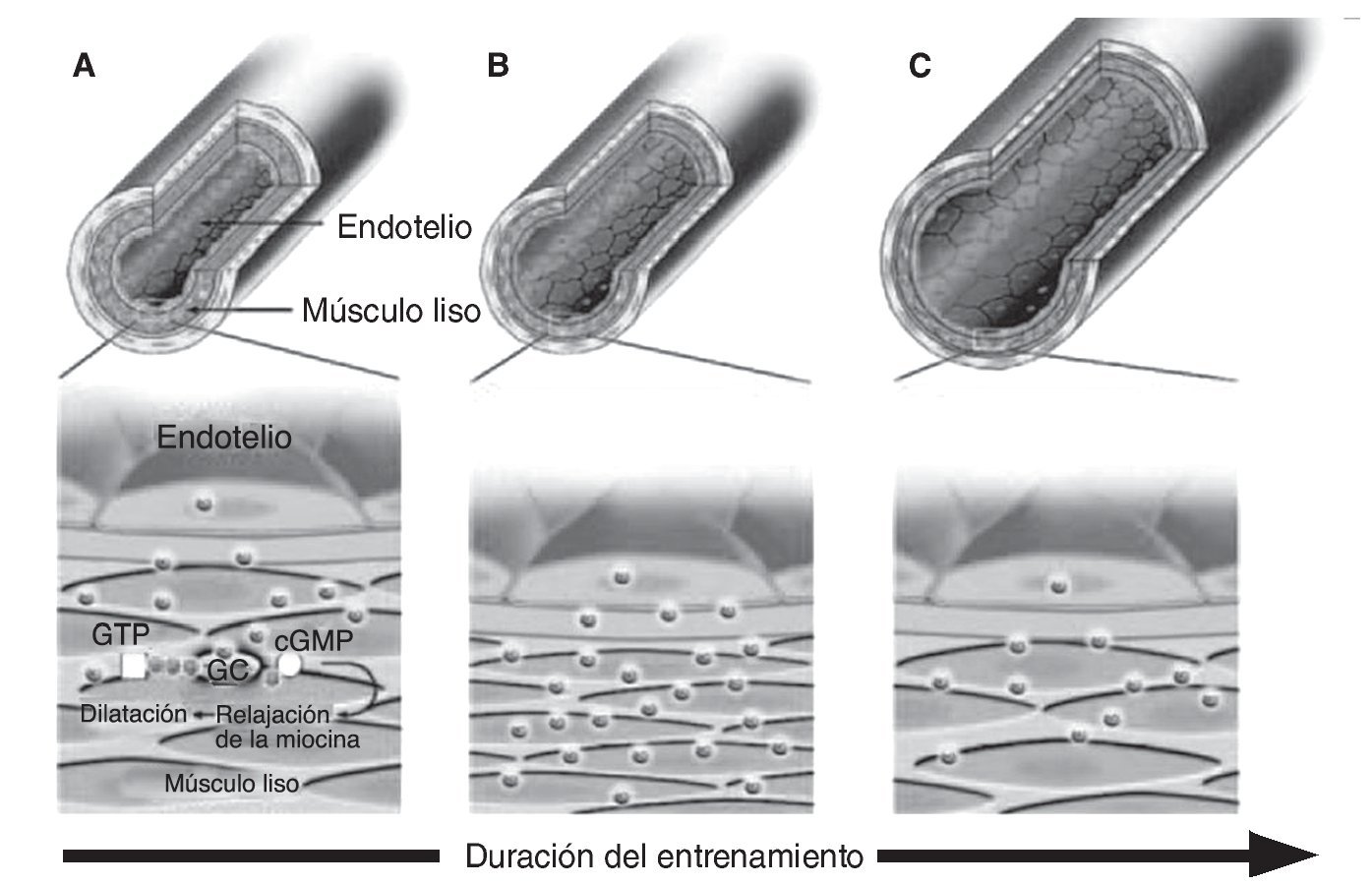
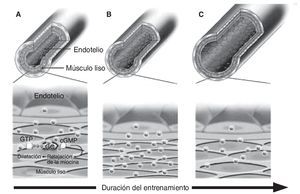
Por otra parte, diferentes estudios sobre el comportamiento de la vasculatura coronaria y periférica en animales sugieren que un corto periodo de ejercicio físico incrementa la actividad de la NOS, así como la producción y bioactividad del NO provocando un efecto que compensa el incremento del estrés mecánico inducido por el esfuerzo55. Sin embargo, transcurridas las primeras semanas, la estructura de la pared vascular podría ser remodelada por efecto del NO y posiblemente otros mediadores, cuyo resultado es un incremento crónico de la luz del vaso65, 66. Por consiguiente, el estrés mecánico resultaría estructuralmente normalizado y la actividad del sistema vasodilatador del NO retornaría a niveles previos al inicio del programa de ejercicio (fig. 3). Esta hipótesis ha sido fundamentada también por estudios que no hallaron modificaciones en la producción basal de NO y en la vasodilatación en deportistas altamente entrenados68. Sin embargo, aunque parece lógico esperar una adaptación vascular al estrés mecánico inducido por el ejercicio sistemático, esta hipótesis no contempla otras variables que constantemente pueden incrementar la necesidad de síntesis de NO. Éste sería el caso de la hora del día en la que se realiza el ejercicio físico, lo cual puede incrementar sustancialmente el grado de estrés mecánico sobre la pared vascular69; también las constantes variaciones en las necesidades metabólicas de la musculatura que derivan de la progresión de cargas e intensidades del entrenamiento; el entrenamiento de nuevos grupos musculares y de los periodos de reposo-entrenamiento que forman parte de la historia natural de la vida deportiva de los atletas. Incluso, otros factores externos, como la suplementación dietética antes, durante o después del esfuerzo, podrían modificar la respuesta vasodilatadora generada por el ejercicio.
Fig. 3. Respuesta hipotética de las arterias sobre la producción de NO y diámetro arterial como adaptación frente al estrés mecánico inducido por un entrenamiento sistemático. A. En un vaso no entrenado, la liberación basal de NO provoca vasodilatación de las células del músculo liso regulando homeostáticamente el estrés de la pared vascular. B. En respuesta a un periodo medio de entrenamiento el incremento del estrés mecánico asociado al aumento agudo en el flujo provocado repetidamente por cada sesión de ejercicio, estimula el incremento en la producción de NO y la consecuente vasodilatación. C. Tras un periodo largo de entrenamiento con ejercicio físico ocurriría una adaptación estructural causada por una remodelación mediada por el NO, que resultaría en un incremento crónico en el calibre del vaso normalizando el estrés mecánico y el NO retornaría a niveles previos. Adaptado de Maiorana et al (2003)67.
Efectos crónicos del ejercicio sobre la FE
El incremento de los niveles de actividad física y de la capacidad cardiorrespiratoria inducida por el ejercicio está directamente relacionado con la reducción de la morbilidad y mortalidad por enfermedad coronaria. Entre los posibles mecanismos que determinan estos beneficios del ejercicio en la población general se encuentra la mejora de la FE70. En este sentido, Clarkson et al71 observaron un significativo incremento de la vasodilatación dependiente del endotelio en la arteria braquial de individuos jóvenes y saludables tras realizar un programa de 10 semanas de entrenamiento de moderada intensidad que incluyó ejercicios aeróbicos (4,8 km de trote por día) y anaeróbicos (ejercicios de fuerza del hemicuerpo superior). Esta observación en una población saludable fue posteriormente reforzada por el hallazgo de una significativamente mayor vasodilatación mediada por el endotelio en adultos mayores (entre 61 a 83 años) con un alto nivel de entrenamiento físico (> 40 ml·kg-1 min-1 de VO2max) con relación a sus pares sedentarios (≤ 27 ml·kg-1 min-1 de VO2max)72, 73. Resulta relevante destacar que en estos estudios el tipo de ejercicio analizado siempre condicionaba un significativo esfuerzo de los miembros inferiores, con un efecto vasodilatador que evidentemente no se limitó solamente a los vasos próximos a la masa muscular activa. Estas evidencias sugieren por lo tanto que la actividad local de grupos musculares del hemicuerpo inferior constituye un potente estímulo NO a nivel del cuerpo entero; y en consecuencia demuestra la importancia de las fuerzas físicas (como la elevación de la frecuencia cardiaca, presión sanguínea, viscosidad de la sangre etc.) que este tipo de deportes inducen sobre el lecho vascular en tejidos no necesariamente activos.
Sin embargo, otros estudios también han demostrado que algunos tipos de ejercicio físico localizado, por ejemplo aquellos que usan el hemicuerpo superior y en particular un solo brazo, no resultan suficientes para modificar la función endotelial periférica en sujetos sanos74,75. Esta ausencia de beneficios podría tener diferentes explicaciones, como un insuficiente estímulo mecánico derivado de la pequeña masa muscular reclutada y por consiguiente de la ocurrencia de fenómenos hemodinámicas de menor intensidad55. Además, la duración del programa de entrenamiento experimental y la trayectoria deportiva de los sujetos estudiados también podrían provocar una normalización estructural del estrés mecánico que induce el ejercicio y producir la ausencia de beneficios en términos de FE. Hasta la fecha, este fenómeno ha sido solamente demostrado con un diseño longitudinal de investigación en individuos sanos con un programa de entrenamiento de 3 meses con 3 sesiones semanales que incluían diferentes ejercicios de fuerza del hemicuerpo superior e inferior76, pero podría ocurrir en otros tipos de ejercicios aún no estudiados.
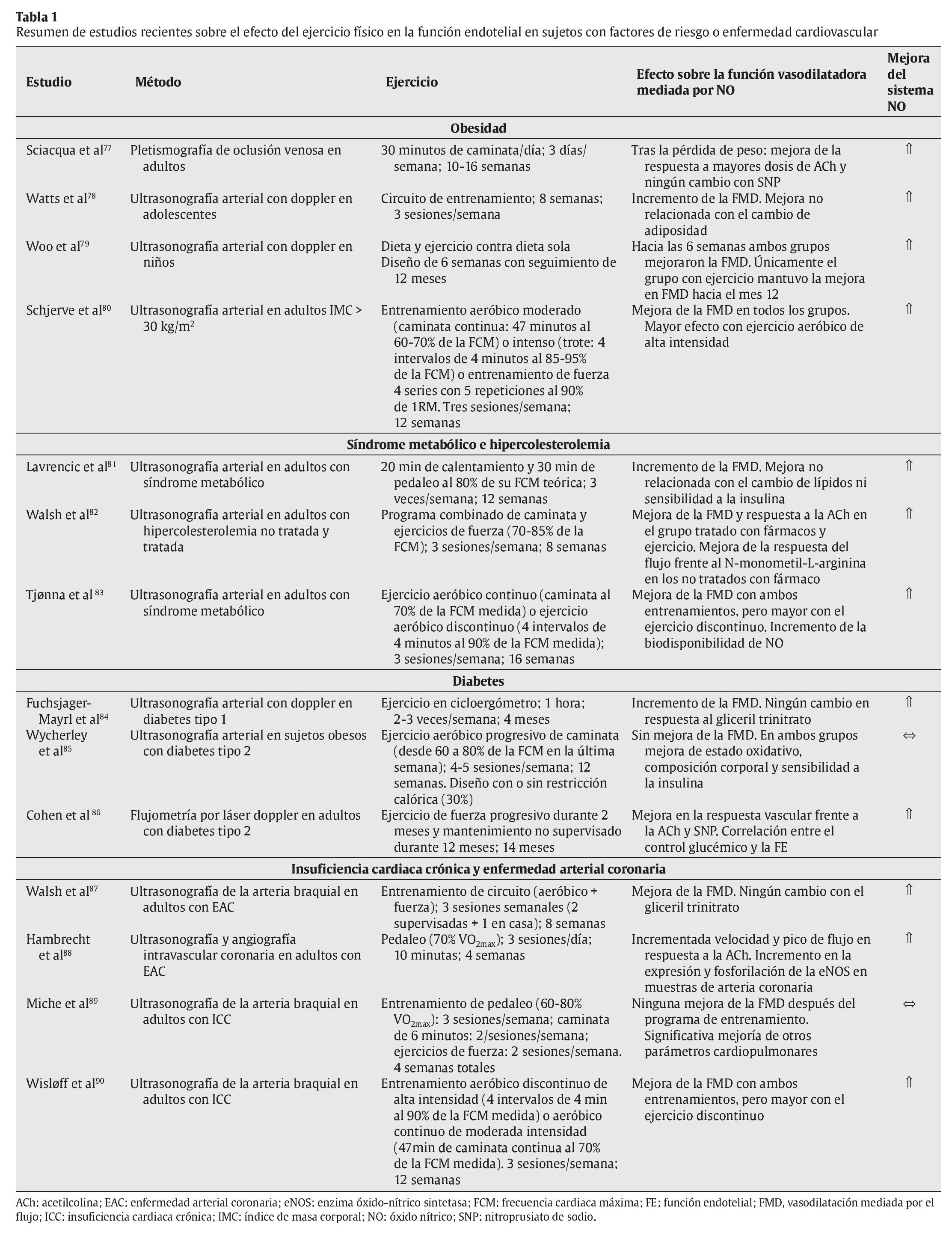
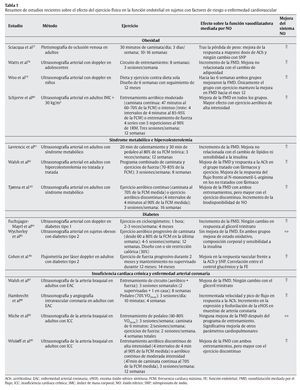
En otro sentido, hay evidencia científica suficiente que demuestra que la práctica regular de un programa de ejercicio físico mejora significativamente la FE en individuos con disfunción endotelial y diferentes patologías como obesidad, síndrome metabólico, diabetes y enfermedad cardiovascular (tabla 1). En estas condiciones, hay dos mecanismos principalmente que podrían explicar la mejora de FE mediada por el ejercicio de forma independiente al cambio de los factores de riesgo cardiovascular; por un lado, el ejercicio produciría una mejora en la síntesis y biodisponibilidad del NO91 y, por otro, una significativa reducción de la lipemia posprandial, lo que favorecería no sólo una disminución de la disfunción endotelial posprandial, sino también de aquella que ocurre incluso varias horas después de haber sido realizada la ingesta de una comida rica en grasas y carbohidratos92. En este sentido, Silvestre et al93 demostraron que una sesión aguda de ejercicio físico (6 ejercicios de fuerza y 30 minutos de trote) reduce significativamente el área incremental de lipemia posprandial en individuos jóvenes y sanos, cuando el esfuerzo es realizado incluso 16 horas antes de la ingesta grasa. Además, el efecto del ejercicio sobre la lipemia posprandial, y en especial sobre la clarificación de los triglicéridos en plasma, ha sido observado tanto tras la realización de ejercicios aeróbicos94 como después de diferentes ejercicios de fuerza95.
Ejercicio, células progenitoras del endotelio, angiogénesis y FE
La mejora de la FE no depende solamente de las células que residen en la pared de los vasos sanguíneos, sino también de las células progenitoras del endotelio (CPE) derivadas de la médula ósea96. En este sentido, se ha demostrado recientemente la importancia de las CPE en el potencial regenerativo del endotelio, debido a que tras su producción en la médula ósea migran a través de la circulación sistémica hacia los sitios de lesión o recambio tisular para reemplazar a las células agudamente dañadas o muertas del endotelio vascular97. Además, las CPE tienen la capacidad de modular diferentes procesos complejos de regeneración endotelial y miocárdica, como la angiogénesis, miogénesis y apoptosis de cardiomiocitos98. Por ello, el potencial regenerativo de las CPE no solo funciona para restituir el daño celular agudo, sino también como un mecanismo dinámico de protección vascular a largo plazo, favoreciendo la FE y previniendo la arteriosclerosis y las enfermedades cardiovasculares97.
En un paciente con una acumulación de factores de riesgo cardiovascular se ha observado una significativa disminución en el nivel de CPE circulantes99 que resulta en parte de una reducción en la movilización de CPE desde la médula ósea (disponibilidad de CPE), junto con el incremento del área vascular sometida a lesiones (necesidad de CPE) y una reducción en la vida media de las CPE circulantes. Además, la disminución global de CPE en la sangre de los pacientes se correlaciona de forma directa con un mayor empeoramiento de la FE y un incremento aún mayor del riesgo cardiovascular100. En este sentido, el ejercicio físico es una modificación en el hábito de vida de estos pacientes capaz de incrementar los niveles de CPE. Paralelamente, en varios estudios realizados en seres humanos se ha observado que la mejora del estado oxidativo101, 102, así como la reducción del peso corporal103 y la mejora del perfil lipídico104, pueden incrementar significativamente el nivel de CPE en este tipo de pacientes. Si bien estos estudios han investigado el comportamiento de los niveles de CPE tras diferentes estrategias dietéticas o fármacos, resulta lógico pensar que los mismos estímulos, pero provocados por el ejercicio, pueden ser los responsables del efecto sobre la liberación de las CPE. Además, determinados fenómenos metabólicos específicos provocados por cada sesión de ejercicio físico, como la isquemia fisiológica de algunos tejidos105 y el incremento en la producción de NO tras el esfuerzo, tienen un demostrado efecto positivo sobre los niveles circulantes de CPE106.
Conclusiones
La función endotelial y específicamente los mecanismos vasodilatadores relacionados con el NO tienen una importancia clave en el mantenimiento de la salud vascular y en el pronóstico de los pacientes con riesgo o padecimiento de enfermedad cardiovascular. Con relación al ejercicio, resulta evidente que la mejora aguda y crónica de la vasodilatación dependiente del endotelio en las arterias periféricas es altamente sensible a la naturaleza del estrés mecánico, modulado por las propias características del esfuerzo (modalidad, intensidad, duración del esfuerzo agudo y del entrenamiento sistemático, grupos musculares que involucra etc.), por lo que resulta fundamental la realización de más investigaciones con protocolos estandarizados de ejercicio. El NO parece ser, además, un mediador metabólico entre la circulación sanguínea y la masa muscular, permitiendo la entrega de sustratos energéticos a los músculos implicados en el esfuerzo y constituyéndose así en otro mecanismo que explica el incremento de la vasodilatación periférica inducida por el ejercicio. En este sentido existen suficientes evidencias que sustentan al ejercicio físico sistemático como una estrategia de importante efectividad, tanto en la mejora de la función dilatadora del endotelio sano, como en la de aquel que resulta lesionado por diferentes factores de riesgo cardiometabólico o enfermedad vascular manifiesta. Por otro lado, aunque recientes estudios hayan observado un efecto positivo del ejercicio físico sobre los niveles de células precursoras del endotelio, un recurso fundamental en la capacidad regenerativa del endotelio y en la mejora de la disfunción endotelial, futuras investigaciones sistemáticas deberán confirmar estos hallazgos y especialmente analizar los potenciales mecanismos que explican la influencia del esfuerzo sobre la liberación y diferenciación de este tipo de células.
Correspondencia:
J. M. Fernández.
Unidad de Lípidos y Arteriosclerosis. Servicio de Medicina Interna. Hospital Universitario Reina Sofía. Avda. Menéndez Pidal, s/n.
14004 Córdoba. España.
Correo electrónico: juf_nutryinves@yahoo.com
Historia del artículo:
Recibido el 2 de junio de 2009.
Aceptado el 2 de junio de 2009.