El hongo Macrophomina phaseolina (Tassi) Goid., agente causal de la enfermedad denominada «pudrición carbonosa», provoca pérdidas significativas en la producción de cultivos como maíz, sorgo, soya y frijol en México. Este hongo, parásito facultativo, muestra amplia capacidad de adaptación a ambientes estresantes, donde existen altas temperaturas y deficiencia hídrica, condiciones frecuentes en gran parte de la agricultura de dicho país. En este trabajo se describen algunos aspectos básicos de la etiología y la epidemiología de M. phaseolina. Asimismo, se revisa la importancia que guardan las respuestas de este hongo a ambientes estresantes, particularmente la deficiencia hídrica, de acuerdo con caracteres morfológicos y del crecimiento, así como fisiológicos, bioquímicos y de patogenicidad. Finalmente, se presentan algunas perspectivas de estudio del género, que enfatizan la necesidad de mejorar su conocimiento, con base en la aplicación de herramientas tradicionales y de biotecnología, y de dilucidar mecanismos de tolerancia al estrés ambiental, extrapolables a otros microorganismos útiles al hombre.
Fungus Macrophomina phaseolina (Tassi) Goid. is the causative agent of charcoal rot disease which causes significant yield losses in major crops such as maize, sorghum, soybean and common beans in Mexico. This fungus is a facultative parasite which shows broad ability to adapt itself to stressed environments where water deficits and/or high temperature stresses commonly occur. These environmental conditions are common for most cultivable lands throughout Mexico. Here we describe some basic facts related to the etiology and epidemiology of the fungus as well as to the importance of responses to stressed environments, particularly to water deficits, based on morphology and growth traits, as well as on physiology, biochemistry and pathogenicity of fungus M. phaseolina. To conclude, we show some perspectives related to future research into the genus, which emphasize the increasing need to improve the knowledge based on the application of both traditional and biotechnological tools in order to elucidate the mechanisms of resistance to environmental stress which can be extrapolated to other useful organisms to man.
El hongo imperfecto Macrophomina phaseolina (Tassi) Goid. por lo general es un saprófito que, bajo ciertas condiciones, también es un fitopatógeno facultativo no específico. Este hongo es el agente causal de la enfermedad denominada pudrición carbonosa del tallo. La pudrición carbonosa ataca a más de 500 especies de plantas entre las que se encuentran cultivos alimentarios de interés económico en México, como frijol (Phaseolus vulgaris L.), maíz (Zea mays L.), soya (Glycine max [L.] Merr.) y sorgo (Sorghum bicolor [L.] Moench). En estos cultivos ocasiona pérdidas que oscilan entre el 10% y el 15% de cada cosecha al año22. Como patógeno, M. phaseolina progresa fácilmente en condiciones de sequía y altas temperaturas, y se encuentra en la mayoría de las áreas cultivables cálidas o templadas de los trópicos y subtrópicos, desde el nivel del mar hasta más de 2000 msnm. En México tiene alta prevalencia en la zona norte, aunque se encuentra distribuido en diversas regiones, tanto en climas tropicales, subtropicales o templados como en climas áridos, semiáridos o húmedos43,44.
Actualmente existen algunas medidas de manejo integrado del hongo, entre las que destacan el manejo cultural (riegos, fertilización química, densidad de siembra) y el control biológico (hongos biocontroladores) o químico1; estas, sin embargo, no son tan eficaces debido a los mecanismos de amplia adaptabilidad al ambiente cambiante, además de la resistencia al estrés osmótico y a las altas temperaturas que presenta este hongo59,76.
Dos factores tienen un papel fundamental en el desarrollo y los daños por pudrición carbonosa en cultivos: 1) la considerable variabilidad morfológica, patogénica y genética de su agente causal, que lo faculta para adaptarse y atacar hospedantes susceptibles y, frecuentemente, predispuestos por estrés abiótico o biótico, y 2) la presentación en el ciclo de vida del hongo de 2 subfases: una subfase «saprofítica» bajo el nombre de Rhizoctonia bataticola, en la que se producen principalmente microesclerocios y micelio, y otra subfase «patogénica» (M. phaseolina), en la que principalmente se producen microesclerocios y picnidios. Ambas subfases se presentan durante el ciclo parasítico del hongo en plantas susceptibles22,43,61.
Los mecanismos de tolerancia al estrés ambiental de M. phaseolina no han sido caracterizados en profundidad, como sí se ha hecho en el caso de otros microorganismos53,60,79,84,86. Los estudios de genética y biología celular en organismos modelo tales como Saccharomyces cerevisiae, Schizosaccharomyces pombae, Aspergillus nidulans o Neurospora crassa han permitido dilucidar reguladores globales del estrés, así como los mecanismos que confieren resistencia a ambientes adversos32. Por ello, consideramos necesario realizar más investigación sobre la biología y la genética de la adaptabilidad de organismos fitopatógenos a ambientes estresantes, lo que generará información que podrá servir en el desarrollo de estrategias para el manejo y control integrales, eficaces y sustentables de hongos fitopatógenos. Por otra parte, esta información también será útil, por ejemplo, en la identificación de hongos biocontroladores de plagas de cultivos u otras especies útiles al hombre38,53,63. En este sentido, los avances en M. phaseolina son aún incipientes.
M. phaseolina es un hongo altamente tolerante al estrés hídrico15,52,59,76. La evaluación de la respuesta a la deficiencia hídrica se basa en la medición de la respuesta al estrés osmótico in vitro mediante la evaluación del crecimiento del hongo en medios artificiales con potencial osmótico ajustado con azúcares o sales22; estas condiciones reducen el crecimiento del hongo en medio papa-dextrosa-agar y su patogenicidad en semillas de frijol. No se ha comprobado asociación entre tolerancia al déficit hídrico o al estrés osmótico y virulencia15,76. El estrés osmótico por NaCl favorece la producción de glucosa, mientras que reduce la patogenicidad y la síntesis de osmolitos como el arabitol. El crecimiento y la patogenicidad de M. phaseolina están asociados negativamente con la síntesis de osmolitos59,76.
El objetivo de este trabajo es revisar los avances sobre el estudio del hongo fitopatógeno M. phaseolina en cuanto a las bases de sus mecanismos bioquímicos de tolerancia al estrés ambiental, de modo de ofrecer un panorama actualizado al respecto, que a la vez señale cuáles son los estudios que en el futuro contribuirán al diseño de estrategias de manejo integrado del hongo en plantas cultivadas.
El hongo Macrophomina phaseolina (Tassi) Goid.El hongo M. phaseolina causa chancros en el tallo, con una coloración negra —característica de los tejidos infectados en plantas—, marchitez de plántulas, ahogamiento pre y postemergente, además de producir la pudrición del tallo y la raíz. En la naturaleza se encuentra principalmente en el suelo y es un patógeno que puede transmitirse por semillas27. Los síntomas en la postemergencia incluyen lesiones fusiformes con bordes negros y centro grisáceo, cubiertas por microesclerocios y, en ocasiones, picnidios. Los microesclerocios permiten que el hongo sobreviva en el suelo durante largos períodos9. Además de comportarse como un patógeno oportunista de plantas, también es un patógeno intermitente en humanos, dado que ocasiona numerosas infecciones cutáneas en virtud de que posee la habilidad para neutralizar el sistema inmunitario de individuos inmunosuprimidos, a pesar de estar bajo tratamiento antifúngico profiláctico6.
La pudrición carbonosa tiene una vasta distribución geográfica y es especialmente problemática en países tropicales y subtropicales, con climas áridos a semiáridos61. Los microesclerocios producidos en la raíz y en el tallo de los hospedantes sirven como principal fuente de inóculo y pueden permanecer viables en el suelo durante aproximadamente 15 años, ya que están adaptados para sobrevivir bajo condiciones adversas, tales como niveles bajos de nutrimentos, deficiencia hídrica y temperaturas superiores a 35-40°C9,80.
Para infectar a un hospedante, los microesclerocios deben germinar, esto sucede a una temperatura de entre 28 y 35°C22, luego ocurre la penetración directa de los tubos germinativos a través de la epidermis del huésped o puede haber penetración indirecta por aberturas naturales44. En el caso de la penetración directa, el hongo utiliza diversas enzimas degradadoras de la pared celular del hospedante11,22. La ramificación del micelio coloniza el tejido vascular creciendo a través de la corteza y penetrando los vasos del xilema, una vez dentro de los tejidos vasculares se propaga hacia la raíz, donde obstruye los vasos, lo que al final provoca que la marchitez de la planta27,44.
La población de M. phaseolina en suelo infestado se constituye principalmente por microesclerocios y puede llegar a ser tan alta como de 1000 o más propágulos por gramo de suelo. Los microesclerocios se encuentran tanto en estado libre como en los tejidos de la planta colonizada durante la fase parasítica del hongo. La densidad del inóculo y la susceptibilidad del hospedante aumentan cuando se realiza monocultivo27,37. Asimismo, la elevada temperatura provoca que las plantas se debiliten, lo que también favorece el desarrollo de la enfermedad, cuya intensidad aumenta con temperaturas que van de 28 a 40°C. Las altas temperaturas asociadas con la baja humedad del suelo duplican la severidad de la enfermedad; la infección más severa ocurre, entonces, cuando la humedad es baja y la temperatura alta, o bien cuando la planta se encuentra en floración o llenado del grano42,44.
Una característica distintiva de M. phaseolina es su amplia variabilidad genética, de acuerdo con características morfológicas, fisiológicas, bioquímicas, patogénicas y del genotipo. Rasgos preponderantes de la especie son la mayor capacidad patogénica de aislamientos provenientes de regiones húmedas o tropicales en comparación con aquellos de regiones áridas y secas, así como la mayor patogenicidad de aislamientos de México en comparación con aquellos de países de Europa (Italia), de Asia y Oceanía (Japón, Australia) o de América (Brasil, Argentina, Estados Unidos). Aparentemente, la mayor capacidad patogénica de aislamientos de regiones húmedas se debe a la necesidad del hongo de infectar hospedantes no predispuestos a su ataque en virtud de que se desarrollan en condiciones óptimas de crecimiento. También es notable no encontrar especialización patogénica en la especie, de modo que no se han propuesto otras especies, subespecies, razas patogénicas o patotipos. Esto podría deberse a esa doble naturaleza que presenta el hongo, de saprófito y de parásito facultativo11,43,48,61. Las especies Debaryomyces hansenii, Hortaea wemeckii y Wallemia ichthyophaga se han propuesto como modelos de estudio de las bases de la halotolerancia de hongos a ambientes hipersalinos, con las ventajas de que pertenecen a grupos taxonómicos distantes y distintos, y a que han desarrollado estrategias diferentes para enfrentar el estrés ambiental derivado de la escasez de agua20. Del mismo modo, consideramos que la condición ambivalente de M. phaseolina por su capacidad parasítica y saprofítica, la extensa capacidad de variación que le permite la adaptación a ambientes variables y particularmente estresantes, y la notable tolerancia a condiciones ambientales adversas, indican que podría constituirse en un modelo de estudio de las interacciones hongo-planta bajo condiciones de estrés como la salinidad, la deficiencia hídrica, las altas temperaturas o el cambio climático22,26,27,83, cada vez más frecuentes en la producción agrícola de México y del mundo4.
El agua en los hongosLas células se encuentran encapsuladas por una membrana, lo que facilita la ocurrencia del fenómeno de la ósmosis debido a sus propiedades semipermeables y la presencia de un equilibrio hídrico termodinámico de la célula con su ambiente. Ya que los procesos celulares activos se llevan a cabo en soluciones acuosas, la fisiología de la célula está ligada al fenómeno osmótico y, por tanto, debe ajustarse a las condiciones imperantes para sobrevivir y desarrollarse12. En este caso, los solutos de la solución acuosa se clasifican en cosmótrofos («hacedores del orden» o estabilizadores) y caótrofos («hacedores del desorden» o desestabilizadores). Los caótrofos desordenan proteínas, desestabilizan agregados hidrofóbicos e incrementan la solubilidad de hidrófobos; mientras que los cosmótrofos estabilizan proteínas y agregados hidrofóbicos en solución y reducen la solubilidad de los hidrófobos. Solutos cosmótrofos pueden ser pequeñas moléculas como la glicina, la betaína y la trehalosa, que estabilizan las proteínas celulares y evitan su desnaturalización10.
La actividad del agua es un factor importante que gobierna la vida en general. En la naturaleza, el agua se asocia con moléculas del soluto disuelto, lo que modifica el agua termodinámicamente disponible para los organismos vivos. El estado del agua se describe sobre la base de parámetros como el potencial hídrico, la presión osmótica o la osmolaridad, en virtud de que todos ellos se encuentran íntimamente relacionados25.
La capacidad de las moléculas del agua para moverse en un sistema particular depende de su energía libre, medida con base en el potencial hídrico (Ψ), que se expresa en unidades de energía por unidades de masa o volumen; en este caso, la unidad más utilizada es el megapascal (MPa). El movimiento del agua ocurre a través de gradientes de energía libre, desde regiones donde el agua es abundante y con alta energía libre por unidad de volumen (mayor Ψ) a zonas donde la energía libre del agua es baja (menor Ψ). El agua pura tiene una energía libre muy alta debido a que todas las moléculas pueden moverse libremente. Este es el estado de referencia del potencial hídrico, a una masa de agua pura, libre, sin interacciones con otros cuerpos y a presión normal, le corresponde un Ψ igual a cero62.
El Ψ se determina fundamentalmente por el efecto osmótico asociado con la presencia de solutos que adsorben o retienen agua en matrices sólidas o coloidales, por el efecto de la altura y por presiones positivas o negativas, tensiones presentes en los recipientes o conductos donde se encuentra dicha agua. El potencial osmótico (Ψo) indica la disminución de la capacidad de desplazamiento de agua debido a la presencia de solutos, tales como sales orgánicas, vitaminas y minerales70.
El potencial osmótico es un factor importante para el desarrollo de los hongos, pues su disminución reduce su crecimiento dado que aumenta la tasa de respiración y la energía se gasta para mantener la turgencia de las células hifales. Los hongos habitantes del suelo muestran diversas respuestas metabólicas, patrones de crecimiento y estrategias reproductivas en respuesta a las condiciones hídricas variables. La determinación del incremento en la dimensión lineal del crecimiento en medio de cultivo es el método más simple para medir el efecto en el crecimiento fúngico36.
La medición del crecimiento radial de la colonia de un hongo cultivado en cajas de Petri, con medios específicos y a intervalos de tiempo definidos, es el parámetro más confiable para la medición del efecto de una variable ambiental en su crecimiento, sin tomar en cuenta los cambios en la densidad de las hifas y la capacidad de germinación de las esporas15,22,41.
Tolerancia al estrés hídrico en los hongos: osmorregulaciónLa osmorregulación es la respuesta directa que restaura y mantiene el volumen, la presión y la actividad biológica normal de la célula. En los hongos es el mecanismo encargado de regular la cantidad de agua y la concentración de iones y solutos del organismo; para ello, regula la síntesis de solutos en respuesta al estrés osmótico, dado que su acumulación favorece la resistencia a ambientes extremos. La síntesis de osmolitos activos u orgánicos intracelulares en respuesta al estrés osmótico incrementa la turgencia celular y mantiene el metabolismo enzimático. Entre los osmolitos destacan aquellos con naturaleza polialcohólica derivados de azúcares, denominados polioles59,76, así como las poliaminas, compuestos nitrogenados que también participan en la regulación genética64, aminoácidos libres y sus derivados y combinaciones de urea y metilaminas82. Otros metabolitos como las proteínas acuaporinas (acuaporinas ortodoxas y acuagliceroporinas) también se han vinculado con la resistencia al estrés osmótico de los hongos; en este caso, la tolerancia al parecer se asocia con el estrés osmótico vía el transporte de agua y la transferencia de solutos a nivel celular35,49,57,58.
La ventaja evolutiva de los sistemas basados en la producción de osmolitos orgánicos consiste en su compatibilidad con la estructura macromolecular, así como su funcionamiento a concentraciones altas y variables, sin modificar las proteínas celulares. La compatibilidad de los osmolitos resulta de efectos no perturbadores o favorables en las interacciones macromolécula-solvente81. La capacidad para controlar el balance de solutos y de agua durante el estrés osmótico es un requisito esencial en la vida de una célula. La homeostasis osmótica celular se mantiene con la acumulación y pérdida regulada de los solutos inorgánicos y orgánicos30,65.
El estrés osmótico promueve la acumulación de polioles. En células eucarióticas, el contenido de polioles es directamente proporcional a la concentración de los solutos e inversamente proporcional a la actividad del agua. Aunque el movimiento del agua contribuye a la concentración final de polioles internos, la variable más importante es la proporción actual de polioles en la masa celular seca. Esto se ha demostrado, por ejemplo, en el alga Dunaliella sp. en crecimiento a concentraciones salinas extremas23. Bajo condiciones de estrés osmótico, el poliol más comúnmente producido en altas concentraciones por S. cerevisiae es el glicerol, aunque también se producen, pero en menores cantidades, sorbitol, manitol y xilitol71. En diversos géneros fúngicos (Aspergillus, Fusarium, Alternaria, Stagonospora) se acumulan principalmente glicerol, eritritol, arabitol y manitol, así como bajas concentraciones de trehalosa y glucosa14,39,45,59.
En el nematodo Caenorhabditis elegans se incrementó de 15 a 20 veces el nivel del glicerol cuando se hizo crecer en medio de cultivo con 200mM de NaCl. La acumulación se inició a las 3 h de la exposición al estrés hipertónico y el máximo se observó a las 24h. La acumulación de glicerol es mediada por la síntesis de sus precursores metabólicos, como el glicerol 3-fosfato deshidrogenasa77. Por su parte, en S. cerevisiae, Zygosaccharomyces rouxii y Pichia sorbitophila es casi exclusivo el uso de glicerol como osmolito, aunque también se detecta la acumulación de trehalosa y de glicerofosfocolina en niveles muy bajos. En otras especies de hongos y levaduras se han detectado trazas de eritritol, ribitol, arabitol, xilitol, sorbitol, manitol y galactitol25,28,73,74,85. Quizás el glicerol se produce con mayor frecuencia debido a su masa molecular baja, lo que le da la capacidad para permear la membrana plasmática, probablemente por difusión pasiva28.
Los efectos protectores de los osmolitos orgánicos en las células expuestas a hipertonicidad se agrupan en 2 mecanismos complementarios. El primero es el de «solutos perturbadores vs. solutos compatibles». En este caso, aunque muchas funciones bioquímicas requieren de iones orgánicos específicos, el incremento en concentraciones por encima de lo típicamente observado en células perturba la función de las proteínas. En contraste, los osmolitos orgánicos tienen menor efecto de modo que son compatibles. La hipertonicidad como resultado del incremento del NaCl causa flujo osmótico del agua fuera de las células, por lo que se eleva la concentración de todos los constituyentes celulares incluyendo las sales orgánicas. Aunque las células pueden restaurar rápidamente su volumen por la entrada de sales orgánicas seguida de la asimilación osmótica del agua, la concentración intracelular de iones inorgánicos permanece alta. Los osmolitos orgánicos se acumulan asociados con una disminución en la concentración de sales inorgánicas intracelulares. De esta forma, los iones inorgánicos perturbadores se reemplazan por osmolitos compatibles81.
El segundo mecanismo se denomina de «estabilización de la estructura proteínica nativa». Aquí, las altas concentraciones de osmolitos orgánicos protectores estabilizan la estructura de las proteínas. Este mecanismo involucra la exclusión fuerte de los osmolitos protectores de la superficie de las proteínas, mientras que los osmolitos desnaturalizados se acumulan en la superficie de las proteínas. Los osmolitos protectores empujan el equilibrio de la proteína hacia su forma nativa plegada, mientras que los osmolitos desnaturalizados empujan hacia la forma no plegada13,81.
Los mecanismos responsables de la acumulación y pérdida de solutos osmorreguladores son, en general, bien entendidos en bacterias y levaduras, aunque con algunos huecos para el caso de los hongos y las algas31,66. En células animales, poco se conoce de las señales y las vías de señalización para detectar perturbaciones en el volumen y para activar mecanismos reguladores, así como sobre los mecanismos mediante los que las células perciben y reparan el daño celular y molecular inducido osmóticamente25,75,77.
En S. cerevisiae25,30 y otras especies, como Botrytis cinerea79, Trichoderma harzianum16 y Fusarium proliferatum3, se ha demostrado que la acumulación de osmolitos orgánicos en condiciones de hipertonicidad producida por sustancias tales como glicerol o trehalosa se controla mediante la activación de 2 rutas metabólicas celulares independientes, denominadas «del glicerol de alta osmolaridad» (HOG, por sus siglas en inglés) y «de la integridad de la pared celular» (CWI), así como sus sucesivas cascadas de señales de proteínas quinasas activadas por mitógeno (MAPK, MAPKK y MAPKKK)8,67.
La ruta HOG ocurre con mayor frecuencia en los organismos estudiados a la fecha y es la más conocida; se activa por 2 rutas de señalización también independientes entre sí, Sho1 y Sln1, cuyo objetivo final es encender la transcripción de la enzima Gpd1p, necesaria para sintetizar glicerol. El glicerol se encarga de generar un cambio en la osmolaridad intracelular que conducirá a la adaptación de las células al estrés, al mantener un ambiente bioquímico óptimo para el funcionamiento celular, así como la recuperación apropiada en ambientes subóptimos, que, de otra manera, afectarían la supervivencia de la célula. Ambas rutas de señalización robustecen la respuesta al estrés por parte de la célula, de modo que son complementarias7,8,24,56,69,84.
En levaduras (S. cerevisiae, S. pombae) y hongos (Candida albicans, Cryptococcus neoformans, N. crassa, Magnaporthe oryzae, Bauveria, Metarhizium), las rutas de transducción de señales en respuesta al estrés osmótico incluyen sensores HK (histidina-quinasa) proteína-autofosforilada de 2 componentes, una proteína fosfotransferible que contiene histidina (Hpt), un regulador de la respuesta con dominio receptor, 3 cascadas MAPK (MAPKKK, MAPKK, MAPK), y al final, la respuesta7,24,33,34,69,75,84.
Se han observado rutas de señalización similares a las detectadas y caracterizadas en levaduras y bacterias en hongos fitopatógenos como M. oryzae34, Bipolaris oryzae47 o Aspergillus sp.17, así como en hongos entomopatógenos como Metarhizium38 y Bauveria53. Pese a ello, la respuesta de adaptación al estrés osmótico está conservada entre géneros y especies, no es idéntica y, además, está ligada a otros procesos celulares como la respuesta al estrés por luz ultravioleta o por peróxido de hidrógeno47, la morfogénesis y las rutas de biosíntesis de productos naturales del metabolismo secundario, tales como las micotoxinas17,50,51. También existe una expresión genética coordinada para enfrentar el estrés osmótico; la respuesta será específica o global dependiendo del grado de estrés osmótico al que la célula sea expuesta68,84.
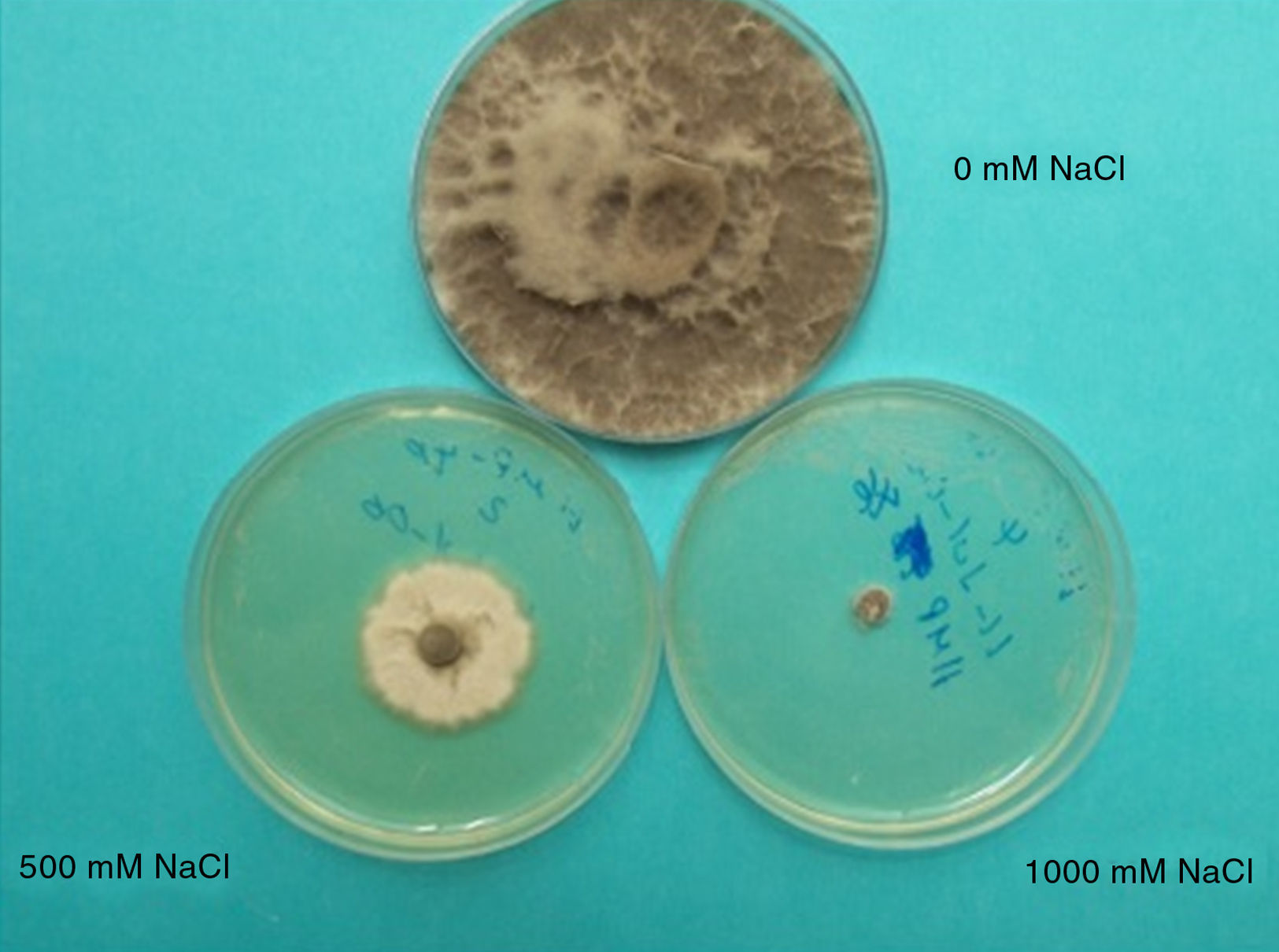
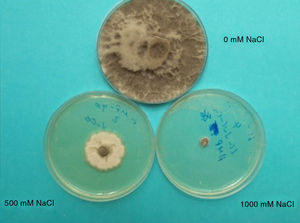
Efectos del déficit hídrico en los hongos, con énfasis en M. phaseolinaCrecimiento y desarrolloLa reducción del potencial osmótico en hongos incrementa la concentración de los solutos y, en consecuencia, se reducen el potencial hídrico y el agua libre disponible para su desarrollo21. En M. phaseolina, la reducción del potencial osmótico in vitro reduce la proporción de microesclerocios germinados y la velocidad de germinación de estos. También modifica el color de la colonia, pues de una coloración gris o negra se decolora a color café, gris claro o incluso blanco, debido a la inhibición de la síntesis de melanina (figura 1). También se reducen sensiblemente la tasa de crecimiento de las colonias, la producción de micelio aéreo y el número de microesclerocios, su tamaño y su forma, así como su capacidad de germinación9,15,18,27,52,76. El agua en el medio es atrapada por los solutos y no queda fácilmente disponible para el hongo, de modo que este debe gastar más energía para obtenerla, debiendo reducir su crecimiento. Efectos similares se observan en otros géneros fúngicos, como Sclerotinia2 y Cochliobolus sativus5.
El crecimiento de M. phaseolina en tejidos del hospedante a un amplio rango de Ψ indica que este organismo ha desarrollado mecanismos de adaptación para sobrevivir a dichas condiciones52. La adaptación a rangos de Ψ amplios puede ser una estrategia que capacita al saprófito o patógeno latente a sobrevivir en los tejidos del hospedante. El hongo puede ser capaz de continuar el desarrollo vegetativo y crecer bajo condiciones de baja humedad, que, por otra parte, sí afectan al hospedante15. Los hongos muestran patrones de crecimiento diversos en respuesta a las condiciones hídricas variables. El efecto del potencial osmótico en el crecimiento de micelio del hongo es negativo bajo presencia de NaCl, ya que a concentraciones de 1M se reduce significativamente en casi un 90% el desarrollo de M. phaseolina in vitro76.
Bioquímica y fisiologíaEl contenido de lípidos varía considerablemente en el micelio y en los microesclerocios. Los lípidos ayudan a mantener niveles bajos de respiración en condiciones adversas durante largos períodos, mientras que proveen energía para la germinación de los microesclerocios. El ácido fosfatídico y el fosfatidil glicerol son los componentes mayoritarios de los microesclerocios, mientras que la fosfatidil etanolamina y el fosfatidil glicerol son más abundantes en el micelio72.
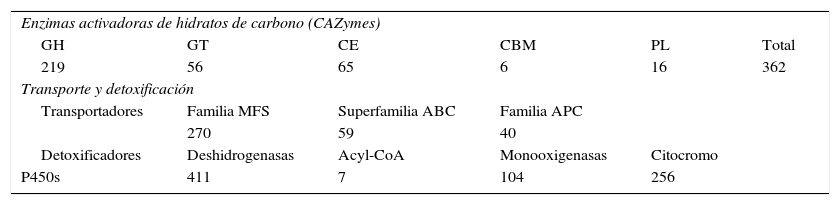
La condición parásita y saprófita de M. phaseolina le permite colonizar tanto tejidos vivos como muertos78. Para ello cuenta con gran cantidad de estrategias para obtener el carbono de las plantas hospedantes o colonizadas; esto también le permite contrarrestar la respuesta defensiva de la planta. El hongo codifica 839 genes transportadores agrupados en 106 familias. De ellos, 270 pertenecen a la familia MFS, 59 a la superfamilia ABC y 40 están representados en la familia APC. También, M. phaseolina tiene más transportadores de aminoácidos (54) que otros hongos fitopatógenos —lo que demuestra su amplio rango de degradación de productos de los hospedantes—, así como gran cantidad de genes involucrados en la detoxificación26 (tabla 1). Por su parte, la secuenciación del hongo xerofílico Wallemia sebi indicó la presencia de 93 proteínas de estrés osmótico putativas y una ruta HOG altamente conservada; además de un alto número de transportadores (549)55.
Genes detectados en Macrophomina phaseolina
| Enzimas activadoras de hidratos de carbono (CAZymes) | |||||
| GH | GT | CE | CBM | PL | Total |
| 219 | 56 | 65 | 6 | 16 | 362 |
| Transporte y detoxificación | |||||
| Transportadores | Familia MFS | Superfamilia ABC | Familia APC | ||
| 270 | 59 | 40 | |||
| Detoxificadores | Deshidrogenasas | Acyl-CoA | Monooxigenasas | Citocromo | |
| P450s | 411 | 7 | 104 | 256 | |
GH: glucósido hidrolasas; GT: glicosiltransferasas; CE: carbohidrato esterasas; CBM: módulos de unión a hidratos de carbono; PL: polisacárido liasas (PL); MFS: superfamilia facilitadora mayor; ABC: transportadores ABC (ATP binding cassette); APC: amino ácido-poliamina-organocatión; Acyl-CoA; superfamilia Acyl-CoA N-acetiltransferasas.
El análisis con microarreglos de M. phaseolina contra 960 diferentes fuentes de carbono, nitrógeno, fósforo, azufre, suplementos nutritivos, nitrógeno peptídico y osmolitos indicó que la adaptabilidad a un amplio rango osmótico es un factor que contribuye a la naturaleza parasítica amplia de este organismo, debido a que el hongo es capaz de crecer bajo concentraciones del 1 al 8% de NaCl, con máximo crecimiento del 2 al 4%19,26 (tabla 2).
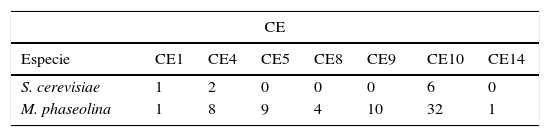
Comparación de genes detectados en Macrophomina phaseolina y otros hongos
| CE | |||||||
|---|---|---|---|---|---|---|---|
| Especie | CE1 | CE4 | CE5 | CE8 | CE9 | CE10 | CE14 |
| S. cerevisiae | 1 | 2 | 0 | 0 | 0 | 6 | 0 |
| M. phaseolina | 1 | 8 | 9 | 4 | 10 | 32 | 1 |
| Transducción de señal | Genoma putativo | ||||
|---|---|---|---|---|---|
| Especie | PTH11a | Quinasas | Ortólogosb | SubFc | SubU αd |
| M. phaseolina | 44 | 140 | 134/140 | 7 | 3 |
| Otros hongos patógenos | 34 | 131 | – | – | – |
| Respuesta fenotípica al desarrollo | ||
|---|---|---|
| Especie | NaCle | Capacidad de crecer |
| M. phaseolina | 1-8 | 2-4 óptimo |
| S. cerevisiae | 3 | Tóxico |
| H. werneckii | Cerca del óptimo | El más tolerante |
| Comparación entre especies del número de genes patógenosf | |
|---|---|
| Especie | Genes putativos |
| M. phaseolina | 75 |
| M. grisea | 32 |
| B. cinerea | 37 |
| S. sclerotiorum | 29 |
| F. graminearum | 37 |
CE: carbohidrato esterasas.
Genes relacionados con la producción de metabolitos secundarios que favorecen la patogenicidad del hongo.
Modificado de Islam et al.26.
El análisis del genoma de M. phaseolina mostró que hasta en un 12% es distinto del de otros hongos fitopatógenos conocidos, en virtud de que posee un gran repertorio de enzimas hidrolíticas que degradan la pared celular de la planta, entre cuyos componentes se incluyen celulosa, hemicelulosa, pectina, lignina y cutina. La gran cantidad de enzimas activadoras de hidratos de carbono es particularmente alta, debido básicamente a la abundancia de las glicosil hidrolasas26. La comparación con genomas de otros hongos fitopatógenos revela un grupo distinto de carbohidrato esterasas (CE) en el hongo, con una expansión significativa de las familias CE9 y CE10. Las CE se consideran la primera línea de ataque durante la invasión al hospedante y desempeñan una función clave en su patogenicidad54.
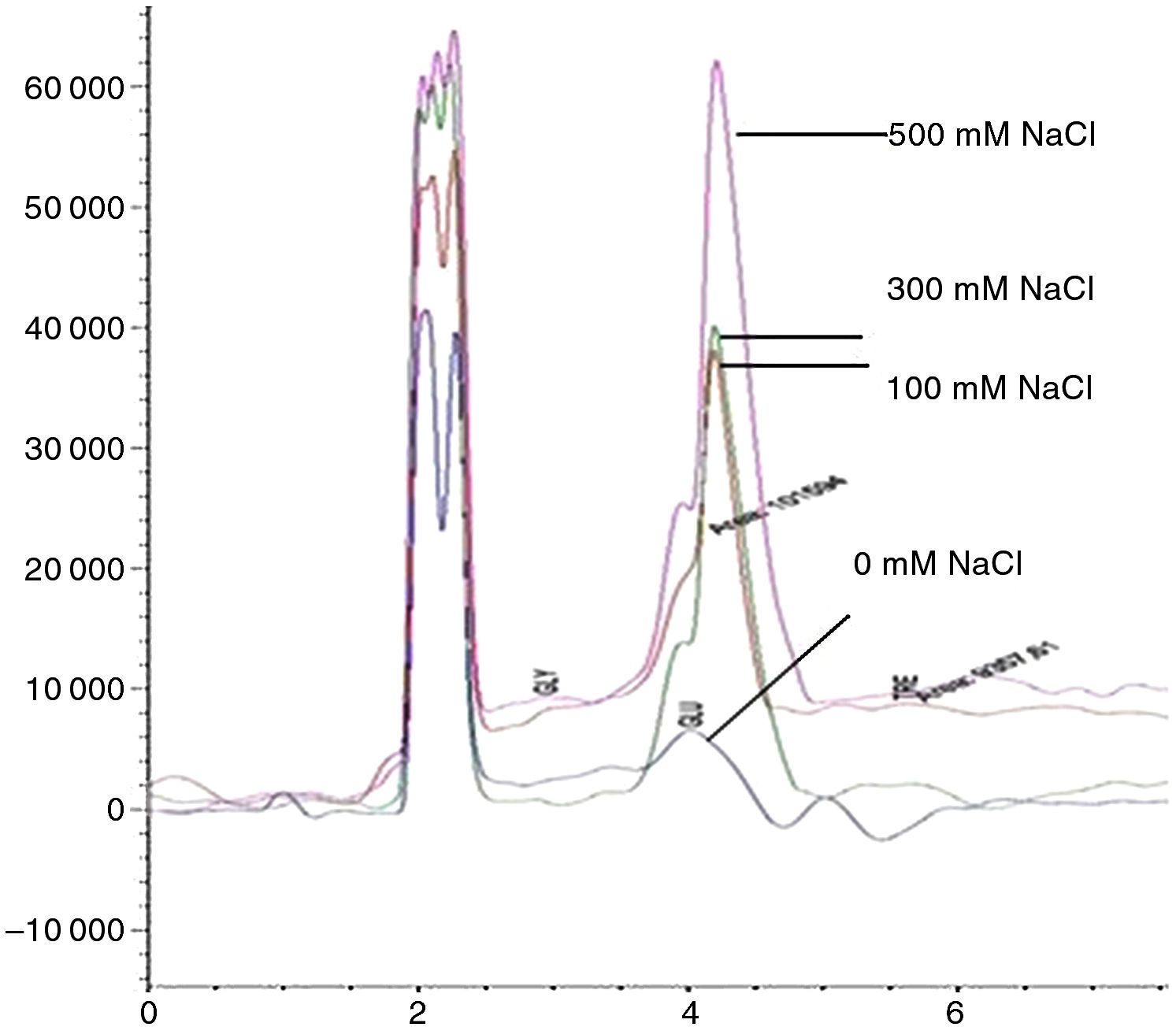
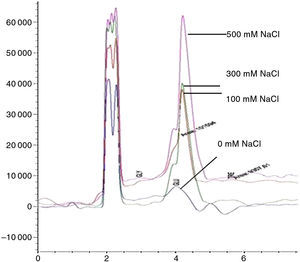
La intensificación del estrés osmótico favorece el incremento de la producción de osmolitos como el glicerol y la trehalosa (figura 2). Los aislamientos de maíz fueron más tolerantes al estrés que los originarios de otras especies; también los aislamientos obtenidos de regiones tropicales de México fueron más tolerantes59. Asimismo, los aislamientos de regiones tropicales exhiben mayor patogenicidad en semillas de frijol43. El estrés osmótico causado por el NaCl reduce en algunos aislamientos de M. phaseolina el crecimiento y desarrollo in vitro76.
PatogenicidadEl estrés osmótico reduce la patogenicidad de M. phaseolina en frijol15,59,76. La reducción en la patogenicidad también se ha observado en aislamientos de Sclerotinia sp.2 y C. sativus5. Se considera que el hongo utiliza una mayor cantidad de energía para equilibrar el potencial hídrico del citoplasma respecto del ambiente exterior; esto altera la fisiología del organismo, que se refleja en la disminución del metabolismo y del crecimiento y de su capacidad patogénica.
Discusión y perspectivasUn rasgo esencial y distintivo de la biología de M. phaseolina es su amplia capacidad de adaptación a ambientes estresantes, particularmente aquellos donde son comunes las altas temperaturas y la sequía. Aun bajo dichas condiciones, en la mayoría de los aislamientos evaluados no se afectan significativamente el crecimiento y el desarrollo, ni la capacidad parasítica del hongo, o bien sus efectos son menores que en otros géneros fitopatógenos, como Fusarium36. Por el contrario, ambos factores afectan al desarrollo de la mayoría de sus hospedantes; además, los predisponen a la infección y colonización del patógeno al reducir la energía disponible para accionar los mecanismos de defensa al estrés ambiental de la planta, preformados o inducidos (ceras epicuticulares, apertura y cierre estomático, ajuste osmótico, síntesis de metabolitos secundarios, ajuste de la tasa transpiratoria, etc.)44.
Las características distintivas de M. phaseolina permiten indicar que puede constituirse en un modelo de estudio ideal para entender los mecanismos de tolerancia ante un ambiente de estrés causado por condiciones ambientales, como las altas temperaturas, la salinidad o la sequía. Esto reviste gran importancia en virtud de que al menos en México, cada vez se agudiza más el problema del estrés ambiental en la producción agrícola. Por ejemplo, en México más del 80% de la producción de frijol se obtiene en regiones de temporal o secano, donde el régimen de lluvias es frecuentemente irregular o pobre, y no alcanza a cubrir las necesidades hídricas del cultivo. Asociadas con dichas condiciones son frecuentes las altas temperaturas o los suelos pobres y/o salinos4.
Así, para entender y aprovechar dicho conocimiento en el diseño de estrategias de control o manejo del patógeno, será conveniente estudiar la biología, la epidemiología y la patogénesis de M. phaseolina en cultivos sometidos a estrés, vía estudios tradicionales que podrán enriquecerse con herramientas biotecnológicas como el análisis del genoma desde los enfoques estructural y/o funcional. Incluso, estos estudios serán útiles para extrapolar los mecanismos de tolerancia a las plantas hospedantes y de esta forma aplicarlos en el mejoramiento genético de cultivos (tradicional o asistido por biotecnología), o bien para introducir modificaciones en el manejo agronómico de cada caso.
Recientemente se demostró que el herbicida glifosato inhibe el crecimiento de M. phaseolina de manera dependiente de la dosis a una tasa lineal; sin embargo, el crecimiento se inhibe de manera dependiente de la dosis a una tasa exponencial al utilizarse la sal potasio-glifosato (Gly-K-salt, por sus siglas en inglés). Entonces, una sustancia que se puede utilizar en el manejo agronómico de un cultivo susceptible, a la vez puede tener efectos nocivos para hongos fitopatógenos como M. phaseolina. Deberá probarse esta relación nociva entre herbicidas y otros fitopatógenos de la raíz y, quizás, esto estimule el desarrollo de variedades de frijol genéticamente modificadas con resistencia a herbicidas que, a la vez, controlen la incidencia y los daños por dichos fitopatógenos del suelo, como ocurre en especies como el maíz, la soja o el algodonero. La hormona auxina es capaz de proporcionar resistencia parcial a la planta contra el fitopatógeno in vivo e in vitro40,46.
De hecho, nuestra propuesta apunta al estudio, con la aplicación de nuevas estrategias y biotecnologías, de las bases genómicas de la tolerancia al estrés osmótico en el hongo, la planta hospedante y su interacción con el uso de las nuevas tecnologías biotecnológicas. Los primeros intentos se han hecho en el caso de M. phaseolina y alfalfa, empezando a generar conocimiento e ideas sobre la interacción molecular entre el patógeno y su hospedante40. También se ha estudiado a nivel genómico la interacción del frijol-M. phaseolina-salinidad, y esta ha confirmado la predisposición a la enfermedad en condiciones de salinidad del suelo83. El mejor entendimiento de la interacción molecular entre el patógeno y el hospedante permitirá encontrar la manera de mejorar la resistencia de la planta en el corto o mediano plazo40.
Los resultados de trabajos previos indican que en M. phaseolina, la síntesis de novo de osmolitos activos tales como el glicerol en condiciones de estrés osmótico podría favorecer la supervivencia del hongo en condiciones adversas, incluso tóxicas para otros hongos, sin afectar sensiblemente a su habilidad parasítica9. Especial énfasis deberá ponerse, por lo tanto, en el estudio de dichos osmolitos para confirmar su participación en la supervivencia del hongo bajo estrés osmótico27, así como la de otros posibles metabolitos que igualmente se produzcan o reconcentren a nivel celular tales como aminoácidos, vitaminas, minerales, sales, etc. Futuras investigaciones podrán ofrecer evidencias sobre la naturaleza de los osmolitos producidos o concentrados, la ontogenia de su síntesis y, particularmente, los mecanismos celulares y moleculares que se operan para su puesta en marcha y defensa frente al estrés del hongo. Asimismo, deberá profundizarse en el estudio de M. phaseolina para combatir su capacidad patogénica, dado que los niveles de daño que causa a las plantas afectan significativamente a la productividad agrícola de las especies atacadas.
Un avance significativo para el desarrollo de las propuestas antes descritas se basa en el desciframiento del genoma del hongo. Con esto se amplían las posibilidades de investigación básica y aplicada relativa al hongo y su interacción con sus hospedantes (patosistemas). El conocimiento del genoma de M. phaseolina permitirá entender en detalle la genética, la fisiología y la bioquímica de este hongo, y todos o la mayor parte de los mecanismos que le permiten ser un parásito con amplio rango de hospedantes y amplio rango de adaptación a ambientes variables y estresantes, para así buscar contrarrestar su crecimiento, desarrollo o habilidad parasítica.
Como microorganismo, M. phaseolina es altamente competitivo, pues tiene el 12% de sus genes comprometidos para facilitar la penetración del hospedante mediante la producción de enzimas hidrolíticas, que le permiten degradar gran variedad de paredes celulares de plantas útiles al hombre, con al menos 75 genes putativos de patogenicidad comparados con los 35 reportados en Magnaporthe grisea26.
Consideramos que se vislumbra un mejor futuro para la agricultura, porque al continuar indagando en los mecanismos y las estrategias de expresión genética de M. phaseolina se conseguirá un mejor entendimiento de su capacidad patogénica, de tal manera que se podrían contrarrestar eficientemente sus efectos; además, una vez entendidos sus mecanismos metabólicos especializados subsecuentes a la expresión génica (metabolómica, proteómica, etc.)32 y, partiendo del conocimiento pleno del genoma secuenciado de la especie, será posible aprovechar dicha información para su manejo y control, incluso sería posible su extrapolación a otros organismos útiles para el hombre, sean vegetales o animales u otras plagas y enfermedades de importancia para el hombre.
Estos avances ya se tienen en otros géneros y especies fúngicas de importancia económica o que son modelos de estudio29,32,86, para identificar enzimas capaces de sintetizar osmolitos activos útiles en la tolerancia al estrés osmótico, como el arabitol en Stagonospora nodorum39, o patrones de expresión de proteínas involucradas en las rutas de señalización de Aspergillus flavus86.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los primeros autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) (becas n.° 587640 y 260782) y al programa PIFI del Instituto Politécnico Nacional el financiamiento de sus estudios de posgrado. Los autores agradecen el financiamiento de este trabajo al CONACYT-Formación de Estudiantes de Licenciatura (proyecto 103159), Instituto Politécnico Nacional (proyecto multidisciplinario 2011-2012 no. 1350, NMP es becario del S.N.I. y de los programas EDI y COFAA del IPN, y JMGP del CONACYT-Ciencia Básica.