Blastocystis spp. es el protista intracelular que se detecta con mayor frecuencia en muestras de materia fecal humana; las tasas de infección pueden superar el 20% en países en vías de desarrollo. El hallazgo de este parásito en heces de diversas especies animales sugiere su potencial zoonótico.
La relevancia clínica y el papel patógeno de Blastocystis spp. en el tracto intestinal son inciertos. Varias son las publicaciones que lo reconocen como agente etiológico de desórdenes intestinales como diarrea, enfermedad inflamatoria intestinal y colitis ulcerosa, aunque la patogenicidad de este parásito no ha sido probada. Este amplio rango de respuestas a la infección podría estar relacionado con la diversidad genética de los aislamientos provenientes de hospedadores infectados.
Blastocystis spp. is the most common protozoan detected in human stool samples. In developing countries, infection rates are higher than 20%. The presence of this parasite in the feces of several host species suggests its zoonotic potential.
The clinical relevance and the pathogenic role of Blastocystis spp. in the intestinal tract remain unclear. There are several clinical reports that recognize it as the etiologic agent of several intestinal disorders such as diarrhea, inflammatory bowel disease and ulcerative colitis, although the pathogenicity of this parasite has not been proved yet. This wide range of clinical manifestations could be related to the genetic diversity exhibited by this parasite.
Blastocystis spp. es un parásito intestinal cosmopolita que habita en el tracto intestinal de humanos y de numerosos animales, tanto homeotermos como poiquilotermos. Se estima que Blastocystis spp. infecta a más de 1.000 millones de personas en el mundo y es más alta la prevalencia en las zonas tropicales y subtropicales de países en desarrollo73–75. La infección humana se asocia con la falta de higiene personal, un saneamiento deficiente, el contacto con animales y el consumo de alimentos o agua contaminados5,15,34,75.
Blastocystis spp. es pleomórfico y presenta 6 morfotipos diferentes, su papel como patógeno continúa siendo motivo de controversia, aún hoy en día, 100 años después de su descripción. Estos parásitos son reconocidos como agentes etiológicos de numerosos desórdenes intestinales (diarrea, enfermedad inflamatoria intestinal, síndrome de intestino irritable, colitis ulcerosa) y extraintestinales (urticaria y anemia ferropénica). Sin embargo, diversos investigadores indicaron la ausencia de asociación entre el parásito y la enfermedad clínica7,9,27,74,75,81,84.
El objetivo de este artículo es brindar una descripción actualizada sobre la biología y la inmunopatogenia de Blastocystis spp., así como de la presentación clínica, la epidemiología, el diagnóstico y el tratamiento de las afecciones que este parásito puede ocasionar.
Clasificación y genéticaLa clasificación taxonómica de Blastocystis spp. se encuentra en revisión. Las primeras descripciones fueron realizadas por Alexeieff y Brumpt en 1912. Con anterioridad, este parásito había sido considerado un hongo imperfecto, una levadura y un protista intracelular. Sobre la base de estudios de filogenia molecular del gen de la pequeña subunidad del ARN ribosomal (o SSU-rRNA, por sus siglas en inglés), Blastocystis spp. ha sido clasificado dentro de Stramenopiles, un grupo evolutivo heterogéneo, sin categoría taxonómica, que incluye protistas uni y pluricelulares9,61,75.
Blastocystis spp. es un parásito con una amplia diversidad genética, que presenta numerosos subtipos moleculares (ST) diferentes con características morfológicas similares. Según consenso taxonómico, todas las especies del género Blastocystis, independientemente del hospedador animal, reciben la misma denominación, por lo que la especie antes considerada propia del hombre denominada Blastocystis hominis es conocida en la actualidad como Blastocystis spp.70,71.
Este parásito presenta al menos 17 subtipos designados como ST1 a ST17, 9 de los cuales (ST1 a ST9) colonizan al humano, otros mamíferos y aves, mientras que 8 (ST10 a ST17) han sido hallados solo en hospedadores no humanos46,52,70,72,74,75.
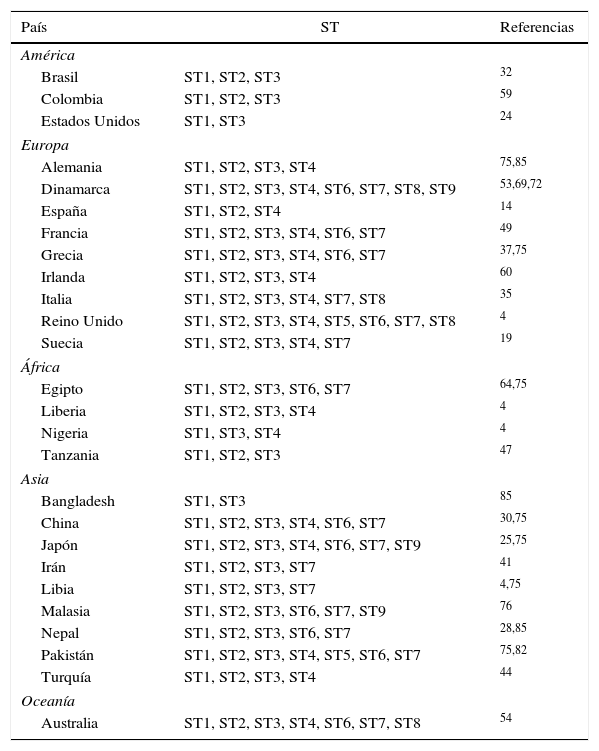
Una extensa revisión publicada en 2013 reveló que los subtipos ST1 a ST4 de Blastocystis spp. produjeron más del 90% de los casos en humanos, el subtipo ST3 se detectó como el más prevalente5,52,72. Diversos estudios recientes han demostrado que la distribución geográfica de los ST no es homogénea (tabla 1).
Subtipos (ST) de Blastocystis spp. de origen humano según país del aislamiento
| País | ST | Referencias |
|---|---|---|
| América | ||
| Brasil | ST1, ST2, ST3 | 32 |
| Colombia | ST1, ST2, ST3 | 59 |
| Estados Unidos | ST1, ST3 | 24 |
| Europa | ||
| Alemania | ST1, ST2, ST3, ST4 | 75,85 |
| Dinamarca | ST1, ST2, ST3, ST4, ST6, ST7, ST8, ST9 | 53,69,72 |
| España | ST1, ST2, ST4 | 14 |
| Francia | ST1, ST2, ST3, ST4, ST6, ST7 | 49 |
| Grecia | ST1, ST2, ST3, ST4, ST6, ST7 | 37,75 |
| Irlanda | ST1, ST2, ST3, ST4 | 60 |
| Italia | ST1, ST2, ST3, ST4, ST7, ST8 | 35 |
| Reino Unido | ST1, ST2, ST3, ST4, ST5, ST6, ST7, ST8 | 4 |
| Suecia | ST1, ST2, ST3, ST4, ST7 | 19 |
| África | ||
| Egipto | ST1, ST2, ST3, ST6, ST7 | 64,75 |
| Liberia | ST1, ST2, ST3, ST4 | 4 |
| Nigeria | ST1, ST3, ST4 | 4 |
| Tanzania | ST1, ST2, ST3 | 47 |
| Asia | ||
| Bangladesh | ST1, ST3 | 85 |
| China | ST1, ST2, ST3, ST4, ST6, ST7 | 30,75 |
| Japón | ST1, ST2, ST3, ST4, ST6, ST7, ST9 | 25,75 |
| Irán | ST1, ST2, ST3, ST7 | 41 |
| Libia | ST1, ST2, ST3, ST7 | 4,75 |
| Malasia | ST1, ST2, ST3, ST6, ST7, ST9 | 76 |
| Nepal | ST1, ST2, ST3, ST6, ST7 | 28,85 |
| Pakistán | ST1, ST2, ST3, ST4, ST5, ST6, ST7 | 75,82 |
| Turquía | ST1, ST2, ST3, ST4 | 44 |
| Oceanía | ||
| Australia | ST1, ST2, ST3, ST4, ST6, ST7, ST8 | 54 |
Blastocystis spp. posee un citoplasma que contiene las organelas típicas de organismos eucariotas, como ribosomas, retículo endoplasmático rugoso, aparato de Golgi, microtúbulos y vacuolas. El parásito contiene estructuras intracelulares de doble membrana denominadas organelas tipo-mitocondria. El genoma mitocondrial está compuesto por una molécula de ADN circular, altamente conservado entre los distintos ST. Este ADN codifica diversas proteínas mitocondriales, pero carece de los genes de las enzimas citocromo-oxidasa y ATP sintasa. La función de estas organelas no está totalmente esclarecida, se postula que intervienen en el metabolismo energético del parásito11,15,75.
Blastocystis spp. se encuentra recubierto por una cápsula de espesor variable con funciones de adherencia y nutrición celular74,75. El número de núcleos es variable, las formas parasitarias pequeñas poseen uno o 2 núcleos localizados en los extremos opuestos de la célula, mientras que las células más grandes pueden presentar hasta 4 núcleos. El genoma de Blastocystis spp. ST7ha sido secuenciado recientemente; dicho genoma presenta 15 cromosomas, mide 18,8 Mb y contiene alrededor de 6.000 genes11.
Blastocystis spp. es un parásito pleomórfico que presenta 6 formas parasitarias variables en tamaño, estructura y lugar de ocurrencia. Las 4 formas principales son la vacuolar, la granular, la ameboide y la quística. También presenta 2 formas menos frecuentes: multivacuolar y avacuolar46,75,88,89.
- -
Forma vacuolar: es la forma que se halla con mayor frecuencia en las heces de pacientes infectados. Los núcleos y organelas como Golgi, vacuolas endosomales y mitocondrias se encuentran dispuestos en la periferia. La posición central es ocupada por una gran vacuola que contiene hidratos de carbono o lípidos, con funciones de reserva o de multiplicación celular. Esta forma mide de 5 a 15μm, pero puede alcanzar 200μm de diámetro, posee 1 a 4 núcleos y una cubierta fibrilar de espesor variable, similar a una cápsula, que contiene manosa, glucosa, fucosa, N-acetilglucosamina, quitina y ácido siálico46,74,75.
- -
Forma granular: esta forma mide entre 6 y 8μm, posee 1 a 4 núcleos y presenta gran cantidad de gránulos en el citoplasma y dentro de la vacuola. Estas granulaciones tienen varias funciones en la célula y se clasifican en 3 grupos funcionales: metabólicos, reproductivos y lipídicos46,74,75. Diversos autores han sugerido que la forma granular podría surgir de la forma vacuolar ante determinados estímulos en el cultivo in vitro, como la concentración de suero fetal o la adición de ciertos antibióticos46,77,78.
- -
Forma ameboide: esta forma muestra una morfología irregular, con 1 o 2 seudópodos. El citoplasma puede albergar a una o a múltiples vacuolas, contiene 1 a 2 núcleos y mide entre 3 y 8μm. La presencia de partículas ingeridas (bacterias o detritos celulares) sugiere un papel en la nutrición parasitaria. Esta forma ha sido detectada en cultivos viejos o tratados con antibióticos y, ocasionalmente, en muestras fecales75,77.
- -
Forma quística: los quistes son esféricos u ovoides, miden de 3 a 10μm y están rodeados por una pared celular multilaminar. El contenido celular incluye múltiples vacuolas y depósitos de glucógeno y lípidos. El número de núcleos puede variar de 1 a 4, sin embargo, los quistes aislados son con frecuencia binucleados75,77.
- -
Formas multivacuolar y avacuolar: estas formas miden alrededor de 8μm, tienen 1 a 2 núcleos y carecen de cápsula. El tamaño y la morfología podrían deberse a variaciones en las cepas o constituir distintos estados de enquistamiento o desenquistamiento parasitario75,77. Se han detectado ambas formas en heces frescas y observaciones recientes han sugerido que son las formas predominantes in vivo46,78.
El ciclo de vida de Blastocystis spp. no ha sido completamente elucidado, sin embargo, se ha demostrado que el quiste es la forma infectiva del parásito. Los quistes son capaces de sobrevivir durante un mes a temperatura ambiente y 2 meses a 4°C; no obstante, esta forma es sensible a las temperaturas extremas y a los desinfectantes comunes15,75,77.
La infección se adquiere por la vía fecal-oral, por consumo de agua o alimentos contaminados, manos sucias o contacto con animales infectados. El desenquistamiento se produce en el intestino grueso del hospedador; en este proceso se libera la forma vacuolar, que se divide por fisión binaria y posee la capacidad de transformarse en cualquiera de las otras formas parasitarias. En el colon, la forma vacuolar da origen al quiste, que se elimina con las heces. La presencia frecuente de las formas ameboide, avacuolar y multivacuolar en pacientes con diarrea indicaría que estas podrían desempeñar un papel importante en la patogénesis46,75.
InmunopatogeniaLa investigación sobre Blastocystis spp. se ha incrementado en la última década, no obstante, su papel patogénico continúa siendo controvertido. El parásito ha sido recuperado de individuos sintomáticos y asintomáticos. No se han identificado factores de virulencia, tales como flagelos o lectinas, y la mayoría de los estudios de patogenicidad se realizaron in vitro. La explicación más convincente sobre su patogenicidad es la que correlaciona el ST de Blastocystis spp. con la virulencia. El ST3 es el subtipo que se halla con mayor frecuencia en pacientes sintomáticos, seguido por los subtipos ST1 y ST2. Sin embargo, se ha visto que no todas las cepas de un subtipo particular son patógenas. Estas observaciones sugieren que el subtipo en sí mismo no es el único factor involucrado en la patogenicidad15,56,81.
Diversos autores han indicado que Blastocystis spp. es capaz de alterar la permeabilidad intestinal, causar modificaciones en el citoesqueleto y provocar la apoptosis celular39,50,51. Experimentos in vitro sobre líneas celulares han revelado que este parásito puede producir un incremento de la permeabilidad celular. El cultivo de Blastocystis spp. ST4 con células IEC-6ha evidenciado la disminución de la resistencia transepitelial intestinal, la modificación de la actina-F, la rotura de las uniones estrechas y la apoptosis celular. Un estudio similar con células Caco-2 demostró que las cisteín-proteasas de Blastocystis spp. fueron las responsables de la rotura de las uniones estrechas entre las células, con un mecanismo sensible a las estatinas34,39,55.
La actividad IgA proteasa ha sido ampliamente documentada en parásitos luminales como Blastocystis spp., Trichomonas vaginalis y Entamoeba hystolitica55. Un estudio in vitro documentó el clivaje de dicha inmunoglobulina por los subtipos ST4 y ST7 de Blastocystis spp., lo que indica que la IgA proteasa posee un papel crítico para la supervivencia parasitaria y la colonización intestinal39,63.
Las cisteín-proteasas están presentes en numerosos parásitos, como Trypanosoma spp., Plasmodium spp., Cryptosporidium spp., Toxoplasma gondii y Blastocystis spp. Estas enzimas cumplen un papel activo en la infección, interviniendo en procesos de daño tisular, evasión inmunitaria e inmunomodulación39,50,51,58. La cisteín-proteasa de Blastocystis spp. estimula la producción de IL-8 por las células epiteliales del colon a través de un mecanismo dependiente del factor nuclear kB. Dicho mecanismo sería el responsable de la pérdida de fluidos y la inflamación intestinal en los individuos afectados. Asimismo, esta enzima induce hiperplasia de células caliciformes y aumento del interferón γ, IL-12 y factor de necrosis tumoral alfa en la mucosa cecal de ratas infectadas. Esto sugiere que la infección por Blastocystis spp. estimula la respuesta específica local e involucra a los linfocitos T, los monocitos/macrófagos y las células NK34,55,56.
Blastocystis spp. es un parásito pleomórfico. Sin embargo, se desconoce el mecanismo subyacente y los factores genéticos y ambientales que favorecen la transición entre los diferentes fenotipos. La forma ameboide es el fenotipo más virulento del parásito61,75. Este fenómeno podría estar involucrado en la patogenia parasitaria; no obstante, se requieren estudios in vivo para confirmar esta hipótesis61.
Un obstáculo importante en el estudio de la patogénesis de Blastocystis spp. es la falta de un modelo animal apropiado. En la actualidad se considera la rata como el animal más adecuado para las investigaciones histopatológicas de esta parasitosis39,50,51.
Se han realizado experimentos de laboratorio con ratones infectados con Blastocystis spp. ST7, que demostraron la infiltración de células inflamatorias con edema importante de la lámina propia. A diferencia de ello, la infección de ratas con Blastocystis spp. ST4 demostró una hiperplasia de células caliciformes con una respuesta inflamatoria insuficiente para producir daño tisular15,61,67. Sin embargo, estos 2 estudios difieren tanto en el modelo animal como en el ST parasitario, de modo que se requieren investigaciones que analicen el mismo ST en distintos modelos animales para poder comparar los cambios histopatológicos provocados por Blastocystis spp.
El microbioma intestinal es esencial para diversas funciones del metabolismo y de la inmunidad innata y adquirida. Hay estudios preliminares que indican una potencial relación entre el parásito y las comunidades microbianas intestinales específicas (enterotipos intestinales). Un análisis reciente reveló que Blastocystis spp. es frecuente en los pacientes con predominio intestinal de Prevotella spp. y Ruminococcus spp., mientras que es poco común en pacientes con predominio de Bacteroides61. El significado de esta asociación es desconocido y se ha postulado que la modificación del microbioma intestinal podría ser un factor condicionante en la presentación clínica de la infección parasitaria61.
Presentación clínicaEl significado clínico de la infección por Blastocystis spp. aún es materia de debate. Este parásito ha sido detectado en las heces de individuos asintomáticos y sintomáticos con prevalencias similares. La infección se ha asociado a signos y síntomas como diarrea, estreñimiento, dolor abdominal, náuseas, anorexia, vómitos, fatiga, flatulencia, distensión abdominal, proctosigmoiditis hemorrágica, urticaria crónica, artritis infecciosa y prurito palmo-plantar9,15,17,30,68,72,75. Sin embargo, otros autores han encontrado falta de correlación entre infección y presentación clínica7,9,34,74.
Se ha evaluado la relación entre el ST de Blastocystis spp. y la presentación clínica de la infección en numerosos estudios. Varios trabajos indicaron que los subtipos ST1 y ST3 se han detectado con mayor frecuencia en infecciones crónicas y en individuos sintomáticos monoparasitados, mientras que el ST2 se ha observado en heces de pacientes asintomáticos y en adultos mayores4,5. Según estudios realizados en España y Dinamarca, el subtipo ST4 presenta una alta incidencia en pacientes europeos con diarrea grave3,14,67,72. Un trabajo realizado en Turquía halló asociación significativa entre el ST2 y la población asintomática, tanto en niños como en adultos13.
Otro estudio realizado en Colombia con 70 sujetos parasitados con Blastocystis spp. mostró una asociación significativa entre el subtipo y la presentación clínica. Ese trabajo demostró que todos los individuos asintomáticos estaban infectados con el subtipo ST1, todos los que presentaban diarrea tenían el ST2 y todos los pacientes con síndrome de intestino irritable estaban parasitados con el ST352,56,83. En contraposición con el trabajo anterior, un estudio desarrollado en Egipto encontró asociación entre el ST3 y los pacientes asintomáticos, mientras que el ST1 estuvo relacionado con individuos asintomáticos17. Los subtipos ST1, ST3 y ST4 de Blastocystis spp. mostraron asociación con el síndrome de intestino irritable34,52,65.
En algunos estudios realizados en Europa no se encontró correlación entre el subtipo y la presentación clínica; se halló que los subtipos ST1 a ST3 presentaron la misma prevalencia en los pacientes con diarrea que en los que no la presentaban3,5,77. En Turquía se encontraron resultados similares83. Estos estudios ponen de relieve la necesidad de profundizar la investigación sobre la relación entre el subtipo y la presentación clínica de la infección4.
Detección y pruebas diagnósticasLa anamnesis clínico-epidemiológica es fundamental para la orientación diagnóstica. Debido a que los signos y síntomas de la infección no son patognomónicos, es necesario efectuar el diagnóstico diferencial con enfermedades similares de otra etiología. Si se sospecha de diarrea de causa infecciosa es necesario efectuar el diagnóstico diferencial para determinar su origen bacteriano, viral o parasitario.
El diagnóstico parasitológico de rutina se basa en la observación de los elementos parasitarios en las heces. Los preparados microscópicos pueden ser visualizados en forma directa, con agregado de lugol, o bien teñidos con Giemsa o coloración tricrómica. El pleomorfismo que demuestra este parásito puede dificultar su identificación microscópica36.
En la actualidad, el cultivo en medio axénico es considerado el «estándar de oro» para la detección de Blastocystis spp. Este método es más sensible que la microscopia, pero insume tiempo y no está disponible en la mayoría de los laboratorios de diagnóstico.
En contraste, la PCR ha demostrado ser una herramienta rápida y altamente sensible para la identificación del parásito y la detección de variantes genéticas. Los métodos disponibles para la identificación de Blastocystis spp. incluyen la amplificación por PCR del gen SSUrRNA combinada con secuenciación para la identificación de subtipos15,48,58,66,70.
Epidemiología y profilaxisBlastocystis spp. es uno de los parásitos intestinales hallados con mayor frecuencia en el tracto intestinal humano. El parásito puede transmitirse por contacto directo con otros humanos o animales, o por contacto indirecto, a través de alimentos y agua contaminados. El mecanismo de infección es fecal-oral y el reservorio de infección incluye al hombre y a numerosas especies animales que integran las categorías de ganado y aves de corral; también perros, roedores, cerdos, primates y animales de cría y silvestres cuyas heces contienen quistes18,75.
La distribución y la frecuencia de eliminación de quistes parasitarios en heces son desconocidas. Un estudio transversal reportó que solo el 21% de los infectados eliminó quistes de Blastocystis spp. en las heces. Los autores de ese estudio sugirieron que las formas quísticas serían eliminadas en forma intermitente o no serían producidas por todos los subtipos del parásito3,70,71.
La información reciente indica que alrededor de 1.000 millones de personas están colonizadas por Blastocystis spp. La infección se halla distribuida en todo el mundo, con alta prevalencia en países en desarrollo de las zonas tropicales y subtropicales. La prevalencia de Blastocystis spp. en humanos muestra una gran variabilidad: Japón y Singapur presentaron bajas tasas de infección (menores del 5%), Estados Unidos ha reportado valores cercanos al 10%, mientras que numerosos países como Argentina, Brasil, Cuba, Egipto, Emiratos Árabes, Indonesia, Irak, Líbano, Malasia, México, Tailandia y Venezuela indicaron frecuencias superiores al 20%2,3,7,15,20,75. La mayor frecuencia de infección con Blastocystis spp. en la población infantil (100%) ha sido reportada en un estudio de Senegal16.
En Argentina se efectuaron estudios que identificaron a Blastocystis spp. como uno de los parásitos intestinales más frecuentes. Una extensa revisión bibliográfica sobre Blastocystis spp. permitió relevar la situación parasitaria de 125000 habitantes: se encontraron valores de frecuencia del 42 y de 33% en áreas urbanas y rurales, respectivamente, mientras que en zonas periféricas y en asentamientos precarios del país la prevalencia parasitaria alcanzó el 35%20,40. La variabilidad puede reflejar las diferencias no solo en el nivel socioeconómico, sino también en las costumbres locales y las condiciones de vida.
En nuestro país, la infección por Blastocystis spp. fue prevalente en la población infantil, con valores entre el 23 y el 51%, mientras que la población adulta no superó el 20% de infección20,40. Esta información difiere de la publicada en otros estudios, donde se indicó una mayor presencia del parásito en la población adulta, tal es el caso de Brasil y de Libia34,75.
La distribución de este parásito en el territorio argentino presenta heterogeneidad geográfica y poblacional. Los relevamientos epidemiológicos de Blastocystis spp. publicados durante los últimos 25 años han mostrado una tendencia ascendente durante dicho período, lo cual indica que Blastocystis spp. podría considerarse un parásito emergente en Argentina20.
Las condiciones socioeconómicas, el compromiso inmunitario, los viajes, la calidad del agua de bebida, la exposición a los alimentos contaminados y la higiene personal deficiente son los principales factores de riesgo asociados a la infección en países en vías de desarrollo. Asimismo, los individuos que se encuentran en estrecho contacto con animales también constituyen una población de riesgo6,23,37.
Los individuos inmunocomprometidos, en particular las personas que conviven con virus de la inmunodeficiencia humana/sida y los trasplantados, presentan mayor riesgo de desarrollar síntomas asociados a Blastocystis spp.33.
Este parásito ocupa un papel preponderante en los estudios parasitarios efectuados en inmigrantes y refugiados. Un relevamiento llevado a cabo en Estados Unidos reveló que Blastocystis spp. estuvo presente en el 20 al 40% de los viajeros de África, Oriente Medio, Sudeste Asiático, Europa Oriental y Latinoamérica79. Se obtuvieron resultados similares en Grecia y Taiwán, en donde se reportaron frecuencias entre el 18 y el 26%31,45. En un estudio efectuado en Italia se halló Blastocystis spp. en un 49% de los inmigrantes de África, Asia y Europa del Este21.
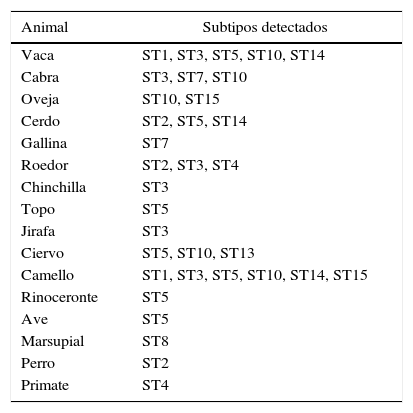
En cuanto a la epidemiología molecular de Blastocystis spp., este parásito presenta cierta especificidad de hospedador. Los subtipos ST 1-9 pueden infectar a humanos y otros hospedadores, mientras que los ST 10-17 son exclusivos de animales34.
La diversidad genética de Blastocystis spp. en animales de cría ha sido analizada por diversos investigadores18,75. Un estudio multicéntrico reciente ha detectado el predominio del ST10 en bovinos de Estados Unidos, Dinamarca, Libia y Reino Unido. Por el contrario, el ST5 fue prevalente en bovinos de Japón5. De igual modo, en Libia hallaron 6 subtipos (ST1, ST3, ST5, ST10, ST14 y ST15) en granjas de cría de camellos, con predominio del ST5 en estos animales. En Malasia estudiaron los subtipos parasitarios en granjas de cría de cabras y encontraron solamente el subtipo ST1 en 4 de ellas, pero identificaron 4 subtipos (ST1, ST3, ST6 y ST7) en la quinta granja3,5,75,77. A la fecha, en Argentina no existen datos de subtipos en especies animales. La frecuencia de los distintos subtipos de Blastocystis spp. en animales, recopilada de la bibliografía internacional, se muestra en la tabla 2.
Subtipos (ST) de Blastocystis spp. en animales
| Animal | Subtipos detectados |
|---|---|
| Vaca | ST1, ST3, ST5, ST10, ST14 |
| Cabra | ST3, ST7, ST10 |
| Oveja | ST10, ST15 |
| Cerdo | ST2, ST5, ST14 |
| Gallina | ST7 |
| Roedor | ST2, ST3, ST4 |
| Chinchilla | ST3 |
| Topo | ST5 |
| Jirafa | ST3 |
| Ciervo | ST5, ST10, ST13 |
| Camello | ST1, ST3, ST5, ST10, ST14, ST15 |
| Rinoceronte | ST5 |
| Ave | ST5 |
| Marsupial | ST8 |
| Perro | ST2 |
| Primate | ST4 |
Las medidas de control deben incluir buena higiene personal, adecuadas instalaciones sanitarias en la comunidad y educación sanitaria de la población para prevenir la contaminación fecal del ambiente y la ingestión de agua o alimentos contaminados.
TratamientoLa mayoría de los estudios coinciden con el tratamiento antiparasitario únicamente en los pacientes sintomáticos monoparasitados con Blastocystis spp.10,26,62. Un tratamiento antiparasitario exitoso se define como la resolución completa de los síntomas y la desaparición del parásito en las heces. Los fármacos de elección contra este parásito deben cumplir con 2 requisitos: concentrarse en el colon y no ser degradados por la flora intestinal. Los fármacos más utilizados contra la infección con Blastocystis spp. son metronidazol, trimetoprima-sulfametoxazol, nitazoxanida y paromomicina. Otros agentes efectivos podrían ser tinidazol, ornidazol y ketoconazol, entre otros26,38,55.
El fracaso terapéutico a causa de aislamientos resistentes ha sido publicado en la literatura. Diversos estudios de sensibilidad in vitro indicaron que el efecto antiparasitario podría ser dependiente de la concentración del fármaco y del subtipo parasitario8,22,38,43,54-56,87. El Centers for Disease Control and Prevention recomienda para el tratamiento la paromomicina; sin embargo, algunos estudios han indicado un efecto antiparasitario muy pobre con este fármaco. En la actualidad, se ha postulado el uso de trimetoprima-sulfametoxazol como alternativa terapéutica26,43,55,56.
Un ensayo clínico reciente comparó el uso de un fármaco clásico, como el metronidazol, con un agente probiótico: Saccharomyces boulardii; se halló una mejor respuesta en este último caso12. Estos estudios ponen de manifiesto la necesidad de establecer un criterio que avale la decisión de cuándo aplicar tratamiento y de determinar qué antiparasitario es el más adecuado para tratar la infección con Blastocystis spp.
Conclusión y perspectivas futurasLa evidencia acumulada sobre el parásito en los últimos años ha destacado la importancia de Blastocystis spp. en la salud humana. La infección se distribuye en todo el mundo, con alta prevalencia en países en desarrollo de las zonas tropicales y subtropicales. El parásito también ha sido hallado en ganado, aves de corral, perros, roedores, cerdos, primates y animales de cría y silvestres, lo que indicaría su amplio potencial zoonótico.
El papel patogénico de Blastocystis spp. continúa en debate. Estandarizar el cultivo in vitro, desarrollar nuevas herramientas para el diagnóstico molecular y la identificación de los factores de virulencia, definir el modelo animal más adecuado y realizar estudios que permitan reconocer los factores de riesgo y la relación entre la presentación clínica y la infección con Blastocystis spp. son algunos de los desafíos que se deberán superar para avanzar en este debate.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.