Se informa un caso autóctono de rickettsiosis por Rickettsia parkeri, ocurrido en junio del 2018 en la zona selvática del Parque Provincial Urugua-í, Misiones, Argentina, región sin registros previos de esta enfermedad en humanos. Se describen los aspectos epidemiológicos, ecológicos, clínicos y de laboratorio necesarios para el diagnóstico oportuno y el tratamiento adecuado. Se resalta el hecho de considerar a las rickettsiosis como diagnóstico diferencial ante un paciente con síndrome febril agudo exantemático; el antecedente epidemiológico de exposición al vector característico de la región, garrapatas del género Amblyomma, es un elemento fundamental.
We report an autochthonous case of Rickettsia parkeri rickettsiosis occurred in June 2018 in a forested area of the Urugua-í Provincial Park, Misiones, Argentina. No previous records of this disease in humans have been previously reported in this region. The epidemiological, ecological, clinical, and laboratory features required for a proper diagnosis and adequate treatment are described here. The fact of considering rickettsiosis as a differential diagnosis in a patient with exanthematic acute febrile syndrome is highlighted, being the epidemiological history of exposure to the vector (ticks of the genus Amblyomma) an essential element.
Las rickettsiosis son un conjunto de enfermedades zoonóticas emergentes y reemergentes a nivel mundial. Son distinguidas por una serie de manifestaciones clínicas, desde leves hasta letales. En el continente americano, aunque existen casos bien documentados, la situación real de las rickettsiosis permanece aún poco conocida1. Los agentes infecciosos causantes de estas enfermedades son bacterias patógenas intracelulares del género Rickettsia, que se transmiten por vectores artrópodos hematófagos, como las garrapatas, los piojos, las pulgas y los ácaros. Las garrapatas son los principales vectores de importancia para la salud pública. En la Argentina, las rickettsiosis se encuentran dentro de los eventos de notificación obligatoria2.
Las rickettsias se mantienen en la naturaleza en un ciclo que abarca distintos vertebrados mamíferos, que actúan como reservorios, y distintos artrópodos, que actúan como vectores o reservorios; el ser humano es un hospedador accidental en este ciclo7.
Sobre la base de diferencias antigénicas, clínicas y epidemiológicas, las especies patógenas del género Rickettsia se han clasificado en 3grupos principales: el grupo de las fiebres manchadas (GFM), que incluye más de 20 especies y cuyos principales vectores son las garrapatas duras (familia Ixodidae); el grupo tifus (GT), que incluye a Rickettsia typhi y Rickettsia prowazekii, y cuyos vectores son pulgas y piojos, respectivamente; y el grupo transicional (Gtr), que incluye especies como Rickettsia akari y Rickettsia australis, cuyos vectores son ácaros y garrapatas, respectivamente7.
La incidencia de las rickettsiosis del GFM está directamente relacionada con la distribución de las garrapatas vectores y de los posibles hospedadores amplificadores7. Otros factores importantes son la afinidad de cada especie de garrapata por parasitar al ser humano y la frecuencia con la que este entra en contacto con el hábitat del artrópodo. La distribución geográfica de estas garrapatas está determinada, en parte, por elementos bióticos, como la vegetación, y abióticos, como la temperatura y la humedad relativa, entre otros. Por último, la aparición de la enfermedad también depende de la susceptibilidad de cada persona7.
En Argentina, se han descrito hasta la fecha 2escenarios epidemiológicos principales. El primero está representado por una rickettsiosis de alta letalidad, presente en la región de las Yungas (Salta y Jujuy), así como en el Chaco Húmedo y en la región Chaqueña Seca. Esta rickettsiosis involucra a Rickettsia rickettsii, la especie más patógena del género, y está asociada a garrapatas Amblyomma sculptum y Amblyomma tonelliae, ambas pertenecientes al complejo Amblyomma cajennense sensu lato2. De esta forma, toda el área del norte argentino donde se encuentren distribuidas estas garrapatas debe considerarse zona de riesgo epidemiológico. El segundo escenario epidemiológico comprende las provincias de Buenos Aires, Entre Ríos, Córdoba, La Rioja, La Pampa y San Luis, e involucra a Rickettsia parkeri sensu stricto como agente etiológico de una rickettsiosis de curso benigno, asociada a garrapatas Amblyomma triste y Amblyomma tigrinum como sus vectores2,15.
Por otra parte, aunque aún no está definida su importancia en la etiología de las rickettsiosis en Argentina, vale la pena destacar la presencia de Rickettsia massiliae en garrapatas Rhipicephalus sanguineus sensu lato en la Ciudad Autónoma de Buenos Aires5 y su papel como agente etiológico de una rickettsiosis exantemática ocurrida en una mujer de dicha ciudad, cuyo diagnóstico se llevó a cabo en España8. Finalmente, cabe señalar la detección reciente de la especie Rickettsia parkeri cepa Atlantic rainforest en garrapatas Amblyomma ovale en la provincia de Misiones10.
El diagnóstico de las rickettsiosis, además de basarse en una aproximación serológica o molecular, es fundamentalmente clínico y epidemiológico; sin embargo, estas enfermedades suelen presentarse como un síndrome febril agudo exantemático y el antecedente epidemiológico de exposición al vector constituye un elemento fundamental7.
La rickettsiosis por R. rickettsii se presenta como un síndrome febril agudo exantemático, con compromiso sistémico y de carácter grave. Sin tratamiento, la tasa de mortalidad puede superar el 40%, pero se reduce hasta el 5% con una terapia antibiótica efectiva y oportuna2,7. La rickettsiosis producida por R. parkeri se caracteriza por un cuadro clínico febril agudo asociado a manifestaciones inespecíficas, como astenia, mialgias, artralgias y cefalea. En algunos casos, se observa exantema generalizado maculopapular o vesículo-papular y, en más del 80% de los casos, se comprueba la presencia de escara de inoculación única o múltiple en el sitio de la picadura de la garrapata; esta se presenta como una lesión costrosa-necrótica, sin signos de flogosis y no dolorosa, que puede estar acompañada de linfadenopatía regional. Contrariamente al cuadro clínico causado por R. rickettsi, la evolución de esta última rickettsiosis suele ser benigna y autolimitada, con bajas tasas de hospitalización o complicaciones2,15.
En virtud de lo descrito, se torna imprescindible incluir las rickettsiosis como parte de los diagnósticos diferenciales en la Argentina, principalmente en zonas endémicas para arbovirosis como el dengue, considerando que la clínica de ambas afecciones puede ser similar (p. ej., fiebre con o sin exantema), y que, en algunos casos, la confusión o un retraso en el diagnóstico puede resultar fatal2. Así, es sumamente necesario que los clínicos posean los conocimientos esenciales para distinguir una rickettsiosis de otras entidades.
En el presente trabajo se describe un caso autóctono de rickettsiosis por R. parkeri ocurrido en Misiones, provincia en la que no existen registros previos de esta enfermedad en humanos. Se describen los aspectos epidemiológicos, ecológicos, clínicos y de laboratorio necesarios para el diagnóstico.
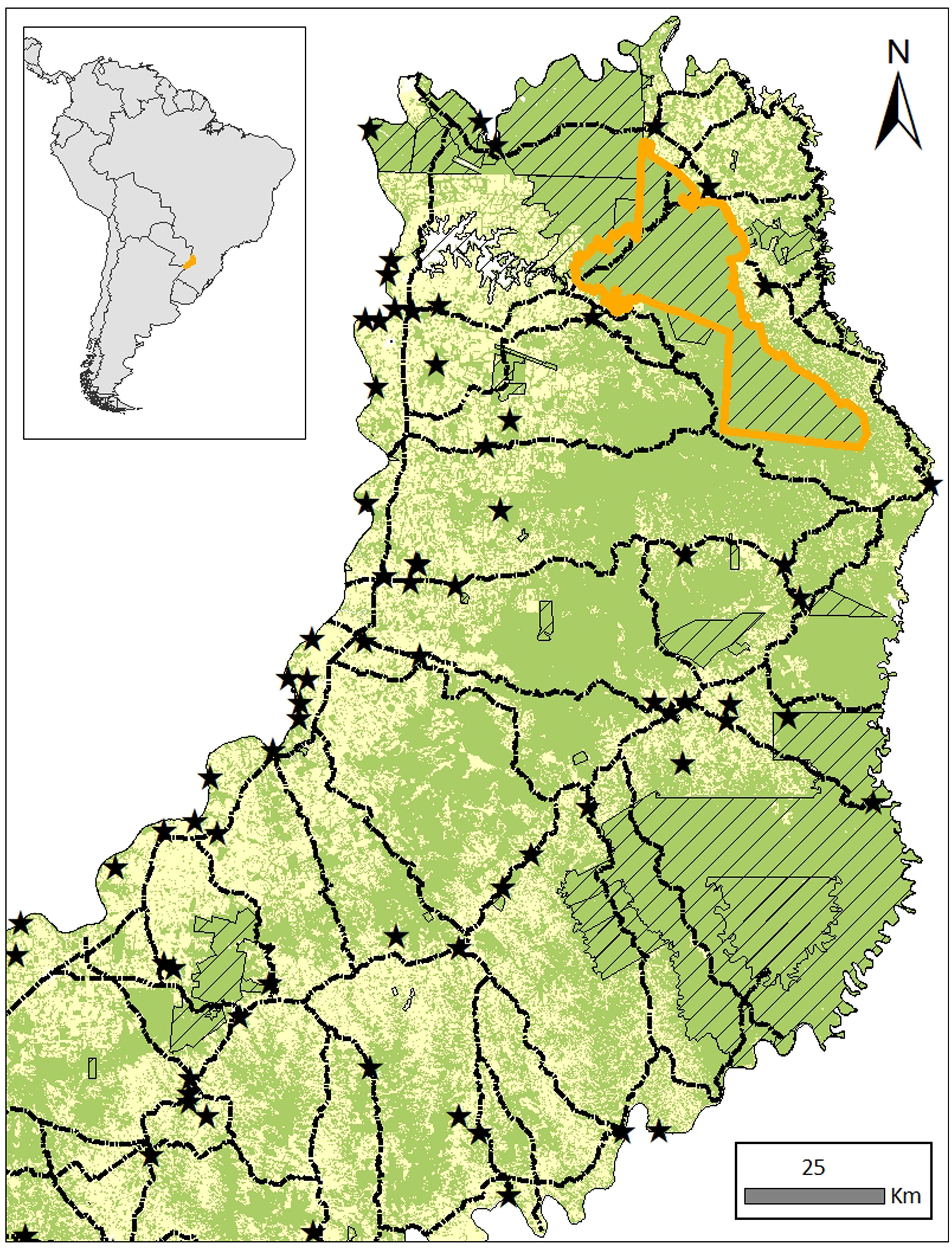
El caso ocurrió en junio del 2018, en una persona que estuvo en zonas selváticas del Parque Provincial Urugua-í (PP-Urugua-í). Este parque está localizado en el extremo nordeste de Misiones y protege uno de los biomas más amenazados (hotspots) a escala mundial: la Selva Paranaense de Misiones, un relicto de bosque húmedo tropical que se extiende desde Serra do Mar en Brasil hasta el este de Paraguay y el noreste de Misiones, Argentina (25° 50′ 34″ S, 54° 06′ 08″ O) (fig. 1). La Selva Paranaense alberga un conjunto intacto de vertebrados, incluyendo aves, muchos carnívoros medianos y grandes (p. ej., yaguareté, puma y ocelote), grandes herbívoros (p. ej., tapir, venado y pecarí) y una vegetación exclusiva de esta área. Presenta un clima subtropical, con una temperatura media anual de 16-22°C y una variación anual relativamente alta. Las precipitaciones oscilan entre los 1.000 y 2.200mm por año4,12.
Zona geográfica de exposición a garrapatas durante la actividad laboral de la paciente; junio de 2018. De las áreas protegidas (trampilla simple), se destaca el Parque Provincial Urugua-í (contorno naranja). Como referencia, se muestran pueblos-ciudades (estrellas negras) y rutas principales (líneas punteadas). Si bien las áreas protegidas se componen principalmente de monte atlántico (verde), se encuentran en una matriz de hábitat alterado fragmentado (amarillo).
El trabajo cuenta con el consentimiento informado de la paciente y cumple la Ley 25326 de Protección de los Datos Personales.
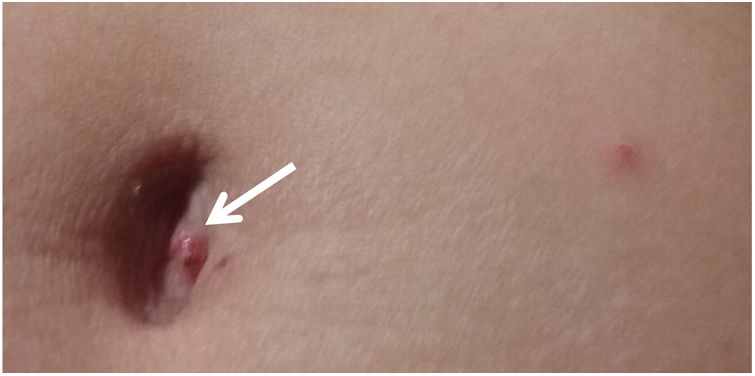
Caso clínico. Una mujer de 45 años, profesional de la salud, con antecedente de enfermedad de von Willebrand, realizó actividad laboral en el PP-Urugua-í de Misiones (fig. 1) durante una semana de junio del 2018, con exposición a múltiples mordeduras de garrapatas. Al cuarto día de sus actividades laborales, la paciente inició con malestar general y cefalea intensa. A las 48 h, se le agregó fiebre y prurito en región costal derecha, abdomen y tobillo. Al día siguiente, apareció un exantema maculopapular en el miembro inferior derecho, en la región del tobillo y pie. Al sexto día del inicio de los síntomas, fue evaluada por un infectólogo del hospital local, quien, en el examen físico, constató exantema maculopapular a predominio de miembros inferiores, pequeñas escaras necróticas en abdomen y miembros inferiores y adenopatía inguinal derecha (fig. 2).
Los paraclínicos bioquímicos y hematológicos no demostraron alteraciones relevantes. Ante la posibilidad de tratarse de una rickettsiosis del GFM, se tomaron muestras de sangre para realizar estudios serológicos al sexto día de iniciados los síntomas. También se tomó muestra de las escaras de inoculación (ombligo y flanco derecho inferior) con un hisopo de algodón estéril, y se la colocó en tubo seco estéril para la detección de Rickettsia spp. mediante la reacción en cadena de la polimerasa (PCR). Por otra parte, las serologías para dengue y brucelosis fueron negativas, al igual que exámenes de gota gruesa seriados y raspado de lesiones, lo cual descartó paludismo y escabiosis. Las muestras de suero e hisopado, acompañadas de la ficha epidemiológica, fueron enviadas desde Misiones al Servicio de Bacteriología Especial, INEI-ANLIS «Dr. Carlos G. Malbrán», CABA, a través de la Red de Laboratorios Nacionales, según las recomendaciones establecidas.
La paciente fue sometida a tratamiento antibacteriano con doxiciclina 200mg/día, por 7 días, con respuesta favorable.
La determinación de anticuerpos IgM e IgG frente Rickettsia spp. se realizó mediante el kit comercial para inmunofluorescencia indirecta (IFI) (Focus Diagnostics, Cypress, California, EE. UU.), utilizando antígenos inactivados de R. rickettsii y R. typhi, según las indicaciones del fabricante. Se consideró como punto de corte una dilución inicial de 1:64.
La extracción de ADN de la muestra de hisopado se realizó con el kit comercial DNAeasy Blood and Tissue (Qiagen, Hilden, Alemania), siguiendo las instrucciones del fabricante. La amplificación parcial de un fragmento del gen rickettsial ompB se realizó según el protocolo descrito14. Se utilizó ADN genómico de Rickettsia conorii como control positivo en la amplificación por PCR. El fragmento amplificado fue secuenciado utilizando el kit comercial BigDye Terminator Cycle Sequencing (Applied Biosystems, Waltham, Massachusetts, EE. UU.) en un secuenciador ABI PRISM® 377 Genetic Analyzer (Applied Biosystems, Waltham, Massachusetts, EE. UU). El producto final de la secuenciación se comparó con aquellas secuencias depositadas en la base de datos del GenBank del National Center for Biotechnology Information (NCBI) mediante la base de datos de colección de nucleótidos (nr/nt) BLASTn (NCBI, https://blast.ncbi.nlm.nih.gov/).
El diagnóstico de rickettsiosis del GFM se confirmó por conversión serológica de 4veces el título de IgG frente al antígeno de R. rickettsii. La primera muestra, frente al GFM, produjo resultado positivo tanto para IgM (dilución 1/64) como para IgG (dilución 1/128). Nuevas muestras de suero, colectadas los días 28 y 69 a partir del inicio de los síntomas, evidenciaron IgG positiva frente al GFM con diluciones>1/512 en ambas muestras. Tanto las muestras de fase aguda como de fase convaleciente fueron negativas frente al antígeno de R. typhi. Se resalta que la prueba de IFI no permite un diagnóstico especie específico, de modo que los resultados obtenidos simplemente indican exposición al GFM, al cual pertenece R. parkeri14.
La secuenciación parcial del gen ompB a partir del hisopado de la lesión presentó una similitud del 99% con R. parkeri cepa Atlantic rainforest, número de acceso en el GenBank KY113111. Desafortunadamente, el material genético extraído fue insuficiente para evaluar otros genes rickettsiales; ante esta limitación, y siendo conservadores frente a la identidad genética, reconocemos la caracterización como «R. parkeri sensu lato», sin asignar una cepa específica.
El caso fue notificado y cargado en el Sistema Nacional de Vigilancia (SNVS 2.0) del Ministerio de Salud de la Nación11. La importancia del caso se desprende de los siguientes puntos significativos:
- 1.
Es el primer caso autóctono de rickettsiosis por R. parkeri en Misiones, y, posiblemente, en las demás provincias del noreste argentino.
- 2.
La epidemiología, la clínica y la confirmación tanto serológica como molecular concuerdan con los casos asociados a dicha especie de Rickettsia, reportados en el bioma de bosque húmedo tropical («Mata Atlántica») de Brasil6.
- 3.
Este hallazgo aporta a la epidemiología y el conocimiento médico regional de una zoonosis vectorial causada por el género Rickettsia.
- 4.
Es probable que las rickettsiosis, en la provincia de Misiones, estén con frecuencia incorrectamente diagnosticadas y que las infecciones en las poblaciones rurales estén subdiagnosticadas por el bajo índice de sospecha, por superposición con patógenos con hallazgos clínicos similares y debido al acceso restringido al sistema de salud.
- 5.
Animales silvestres de la Selva Paranaense de Misiones podrían ser hospederos amplificadores de R. parkeri9,10.
- 6.
El diagnóstico molecular se logró gracias a la obtención de una muestra de hisopado a partir de la escara de inoculación, lo que representa un método no invasivo, de fácil procesamiento y respaldado por la literatura científica, para el diagnóstico de rickettsiosis asociadas a escara de inoculación3,13.
- 7.
Es fundamental la capacitación integral en rickettsiosis, lo que debe incluir una mayor concientización sobre el tema y mejores conocimientos de la clínica y la epidemiología de esta afección, ya que es indudable que los profesionales médicos y veterinarios de la región aún no están familiarizados con esta enfermedad.
Como consideraciones finales, creemos importante resaltar las consecuencias epidemiológicas de morbilidad asociadas a la presencia de R. parkeri en zonas selváticas de Misiones, debido a factores antrópicos que alteran los ecosistemas y a la ecología y hábitat natural del vector y sus hospedadores, lo cual continuará siendo motivo de estudios en Misiones y la región, desde el enfoque integral de «Una Salud».
FinanciaciónEste trabajo no recibió ninguna subvención específica de agencias de financiación en los sectores público, comercial o sin fines de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Al Servicio de Bacteriología Especial, INEI-ANLIS «Dr. Carlos G. Malbrán», Ministerio de Salud de la Nación; Dr. Daniel Salomón (INMeT-ANLIS «Dr. Carlos G. Malbrán», Ministerio de Salud de la Nación); Laboratorio de Análisis Clínicos Elizabeth Husulak, Apóstoles, Misiones y a los Ministerio de Ecología y Recursos Naturales Renovables y Ministerio de Salud de la provincia de Misiones, Argentina.