Los objetivos de este trabajo fueron estudiar la sensibilidad antibiótica de aislamientos de Corynebacterium pseudotuberculosis procedentes de pequeños rumiantes e investigar la presencia de integrones que contienen genes de resistencia. Se estudiaron 15 aislamientos de diferentes fuentes por los métodos de difusión y dilución. Por el método de difusión, amoxicilina-clavulánico, ampicilina, cefotaxima, cefoxitina, ciprofloxacina, cloranfenicol, eritromicina, estreptomicina, gentamicina, imipenem, kanamicina, norfloxacina, penicilina, rifampicina, tetraciclina, trimetroprima-sulfametoxazol y vancomicina fueron activos frente al 100% de los aislamientos, mientras que amicacina presentó resultados variables. En los aislamientos que desarrollaron frente a amicacina se investigó la presencia de integrones de clase1. El resultado fue negativo, sugiriendo la ausencia del integrón. Utilizando el método de dilución, los antibióticos más activos correspondieron a los grupos de cefalosporinas, glucopéptidos, macrólidos, quinolonas y tetraciclinas. Se demostró menor actividad de β-lactámicos y aminoglucósidos. No se registró variabilidad en los perfiles antibióticos en los aislamientos procedentes de diferentes fuentes.
The aims of this work were to study the antibiotic susceptibility in Corynebacterium pseudotuberculosis isolated from small ruminants and to determine the presence of integrons that contain resistance genes. Fifteen isolates of different sources were analysed using the diffusion and the dilution methods. When the diffusion method was performed, amoxicillin-clavulanic, ampicillin, cefotaxime, cefoxitin, ciprofloxacin, chloramphenicol, erythromycin, streptomycin, gentamicin, imipenem, kanamycin, norfloxacin, penicillin, rifampicin, tetracycline, trimethoprim-sulfamethoxazole and vancomycin were effective against the 100% of isolates, while amikacin showed variable results. The isolates that were able to grow with amikacin, were studied in relation to the presence of integron class1. The result was negative, suggesting the absence of integron. Using dilution method, the antibiotics belonging to the cephalosporin, glycopeptide, macrolide, quinolone, and tetracycline groups were the most active ones for the C.pseudotuberculosis biovar ovis isolates. Less activity of β-lactam and aminoglycosides were observed. There was no observation of variability in the antibiotic patterns in the strains coming from different sources.
La linfoadenitis caseosa (LAC) es una enfermedad bacteriana supurativa de evolución crónica que afecta principalmente a ovinos y caprinos. El agente etiológico de la LAC es Corynebacterium pseudotuberculosis, un bacilo gram positivo irregular, corineforme, no lipofílico, que pertenece al grupo Corynebacterium diphteriae conjuntamente con las especies Corynebacteriumdiphteriae y Corynebacteriumulcerans. La LAC en animales adultos se presenta en forma cutánea y/o visceral. La primera se caracteriza por la formación de abscesos en el sistema linfático subcutáneo y afecta los ganglios linfáticos superficiales. En la forma visceral los abscesos se manifiestan en órganos como pulmones, hígado y riñón, causando deterioro en la condición orgánica del animal hacia estados caquécticos de curso crónico6.
Una posible alternativa para disminuir los efectos adversos de la enfermedad, en animales de alto valor genético y reproductivo, es la administración de antibióticos cuando se diagnostica la infección en la fase temprana. El éxito del tratamiento dependerá de la selección del antibiótico apropiado, considerando la farmacocinética, la farmacodinamia y el sitio de la infección14. Reportes de sensibilidad in vitro de cepas provenientes de diferentes especies animales mostraron que antibióticos de los grupos macrólidos, tetraciclinas, cefalosporinas, cloranfenicol y rifampicina fueron los más activos7,14. Existen informes previos sobre patrones de sensibilidad antibiótica en C.pseudotuberculosis aislados de ovinos de la Patagonia argentina, zona endémica de LAC6. Sin embargo, debido a la aparición de cepas resistentes, en los últimos años se establecieron nuevos criterios y categorías interpretativas para Corynebacterium spp. por el método de dilución2. Por ello, es importante mantener la información actualizada sobre el perfil de sensibilidad y resistencia, para una mejor selección de antibióticos frente a esta patología de impacto productivo.
Los objetivos de este trabajo fueron estudiar la sensibilidad antibiótica de C.pseudotuberculosis aislados de pequeños rumiantes e investigar la presencia de integrones que contienen genes de resistencia.
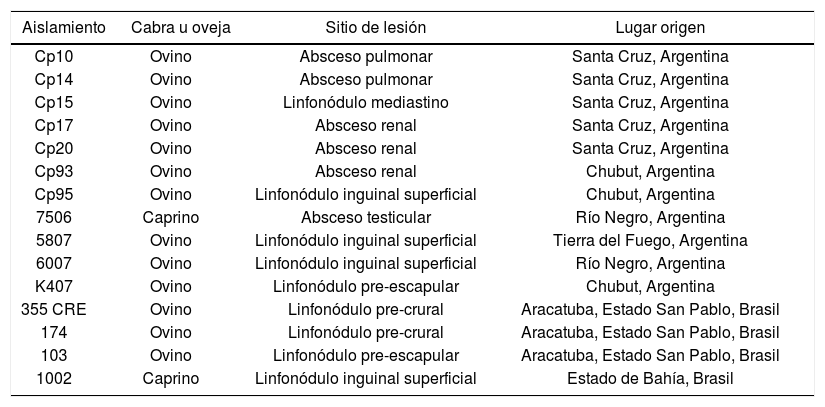
Se estudiaron 15 aislamientos de C.pseudotuberculosis de muestras de pequeños rumiantes de diferentes fuentes y localizaciones geográficas (tabla 1). Se cultivaron en agar tripteína soya suplementado con 5% de sangre ovina y se identificaron mediante el sistema comercial API® Coryne (bioMérieux, Francia), de acuerdo con las instrucciones del fabricante, previa coloración de Gram. Además se realizaron pruebas de lipofilismo, oxidasa, catalasa, pirazinamidasa, CAMP y CAMP reversa6.
Descripción de los aislamientos estudiados
| Aislamiento | Cabra u oveja | Sitio de lesión | Lugar origen |
|---|---|---|---|
| Cp10 | Ovino | Absceso pulmonar | Santa Cruz, Argentina |
| Cp14 | Ovino | Absceso pulmonar | Santa Cruz, Argentina |
| Cp15 | Ovino | Linfonódulo mediastino | Santa Cruz, Argentina |
| Cp17 | Ovino | Absceso renal | Santa Cruz, Argentina |
| Cp20 | Ovino | Absceso renal | Santa Cruz, Argentina |
| Cp93 | Ovino | Absceso renal | Chubut, Argentina |
| Cp95 | Ovino | Linfonódulo inguinal superficial | Chubut, Argentina |
| 7506 | Caprino | Absceso testicular | Río Negro, Argentina |
| 5807 | Ovino | Linfonódulo inguinal superficial | Tierra del Fuego, Argentina |
| 6007 | Ovino | Linfonódulo inguinal superficial | Río Negro, Argentina |
| K407 | Ovino | Linfonódulo pre-escapular | Chubut, Argentina |
| 355 CRE | Ovino | Linfonódulo pre-crural | Aracatuba, Estado San Pablo, Brasil |
| 174 | Ovino | Linfonódulo pre-crural | Aracatuba, Estado San Pablo, Brasil |
| 103 | Ovino | Linfonódulo pre-escapular | Aracatuba, Estado San Pablo, Brasil |
| 1002 | Caprino | Linfonódulo inguinal superficial | Estado de Bahía, Brasil |
Se empleó agar Mueller-Hinton suplementado con 5% de sangre de ovino, las placas se incubaron a 37°C en atmósfera normal y las lecturas de los halos de inhibición se evaluaron a las 24h y se reconfirmaron a las 48h6,7. Se ensayaron los siguientes antibióticos: amicacina (30μg), amoxicilina-clavulánico (20/10μg), ampicilina (10μg), cefotaxima (30μg), cefoxitina (30μg), ciprofloxacina (5μg), cloranfenicol (30μg), eritromicina (30μg), estreptomicina (300μg), gentamicina (10μg), imipenem (10μg), kanamicina (120μg), norfloxacina (10μg), penicilinaG (10U), rifampicina (5μg), tetraciclina (30μg), trimetroprima-sulfametoxazol (25μg) y vancomicina (30μg). Para la interpretación de los resultados se utilizaron los valores recomendados por el Clinical and Laboratory Standards Institute (CLSI) para Staphylococcus spp., que fueron validados por estudios previos debido a que no hay valores de corte que asignen categorías interpretativas para corinebacterias por este método3,4,7. Como cepa de control de calidad de la metodología se utilizó Staphylococcus aureus ATCC 25923.
Método de diluciónLa concentración inhibitoria mínima (CIM) se estudió por el método epsilométrico (Oxoid M.I.C. Evaluator™ Strip-Thermo Fisher Scientific, Basingstoke, Reino Unido), basado en el uso de tiras inertes impregnadas con gradientes de los antibióticos: cefotaxima (0,015-256μg/ml), ciprofloxacina (0,002-32μg/ml), eritromicina (0,015-256μg/ml), gentamicina (0,06-1.024μg/ml), imipenem (0,002-32μg/ml), penicilina (0,015-256μg/ml), tetraciclina (0,015-256μg/ml) y vancomicina (0,015-256μg/ml). Para el ensayo se empleó agar Mueller-Hinton suplementado con 5% de sangre de ovino. Los resultados fueron registrados a las 24h y reconfirmados a las 48h. Se interpretó el valor de la CIM en μg/ml, obtenido de la intersección entre la concentración dada por la tira reactiva y el crecimiento bacteriano que forma una elipse. Los datos se analizaron de acuerdo con los criterios establecidos en CLSI para Corynebacterium spp.2. Como cepa de control de calidad de la metodología se utilizó S.aureus ATCC 29213.
Extracción de ADNA partir de una suspensión en 300μl de agua destilada estéril de un cultivo bacteriano, se realizó la extracción de ADN mediante la lisis por ebullición (5min). Luego de la centrifugación (11.000×g a 4°C por 3min) se separó el sobrenadante para ser utilizado en la PCR.
Detección de integronesEn la PCR se emplearon cebadores específicos para detectar los genes de la integrasa intI1 de acuerdo al método descripto por Orman et al.12 con modificaciones: la reacción de PCR se desarrolló en un volumen total de 25μl conteniendo: 5μl de ADN templado, los cebadores respectivos en concentración 1μM, 1μM dNTP (Promega, Madison, EE.UU.), 1X Green GoTaq Reaction Buffer (1,5μM MgCl2, pH8,5); 1,5μM MgCl2 y 0,2U de Go Taq DNA polymerase (Promega, Madison, EE.UU.). La reacción de amplificación de ADN se realizó en las siguientes condiciones: desnaturalización inicial 3min a 95°C; 30 ciclos de 1min a 94°C (desnaturalización), 30s a 52°C (apareamiento) y 2min a 72°C (extensión); extensión final 5min a 72°C. Los productos de amplificación se observaron en geles de agarosa al 1,8% (p/v) (Biodynamics SRL, Argentina) en buffer TAE 1X y se revelaron con colorante SYBR Safe. Se utilizó la cepa control Enterobacter cloacae E702.
Los aislamientos se caracterizaron como bacilos gram positivos agrupados en empalizada, no lipofílicos, con reacción positiva para las pruebas de catalasa, oxidasa, CAMP, CAMP reversa y negativa para pirazinamidasa y reducción de nitrato. Por los resultados de estas pruebas bioquímicas y los del sistema API® Coryne (bioMérieux, Francia), fueron identificados como C.pseudotuberculosis biovar ovis.
En las pruebas de difusión en agar, aplicando los criterios de CLSI para Staphylococcus spp., amicacina mostró resultados variables y el resto de los antibióticos fueron activos frente al 100% de los aislamientos, coincidiendo con otros autores3,4,6,7. De los aminoglucósidos, amicacina no fue activa frente al 73% de los aislamientos, a diferencia de gentamicina, kanamicina y estreptomicina, que inhibieron el desarrollo de todos.
Por otra parte, los resultados de penicilina, eritromicina, gentamicina y ciprofloxacina fueron evaluados según los puntos de corte propuestos por Barberis et al.1 para Corynebacterium spp. La interpretación para penicilina y ciprofloxacina no se modificó, pero sin embargo para eritromicina y gentamicina surgieron aislamientos con actividad intermedia: 27 y 33%, respectivamente.
Trabajos realizados con cepas de esta especie, de distintas fuentes, mostraron patrones de actividad antibacteriana variables. Aislamientos procedentes de ovinos y caprinos en Venezuela fueron informados resistentes para penicilina y trimetroprima-sulfametoxazol5. En dos aislamientos de C.pseudotuberculosis biovar ovis procedentes de huemules de la región de Aysen (Chile), uno de ellos fue inhibido por estreptomicina mientras que el otro resultó resistente a este antibiótico y a ciprofloxacina10. En la misma biovariedad aislada de camello (Camelus dromedarius) los antibióticos ampicilina, eritromicina, penicilina, tetraciclina y estreptomicina resultaron total o parcialmente ineficaces8.
La resistencia a antibióticos aminoglucósidos ha sido comunicada para las corinebacterias1,11,15. Algunos autores sugieren que el biotipo que infecta a ovinos y caprinos sería resistente a los aminoglucósidos debido a mecanismos de impermeabilidad y relacionados con la incapacidad de producir la enzima nitrato reductasa9. Además, para el género Corynebacterium la adquisición y diseminación de resistencias a aminoglucósidos fue relacionada a la presencia de integrones. En particular, en Corynebacteriumresistens DSM 45100 y Corynebacteriumglutamicum se han identificado integrones plasmídicos clase111,15. En los aislamientos que desarrollaron frente a aminoglucósidos se investigó la presencia de integrones de clase1. El resultado fue negativo, sugiriendo la ausencia del integrón.
Con respecto a las pruebas de dilución, los métodos epsilométricos resultan una alternativa útil para la determinación de la sensibilidad, especialmente por su sencillez y la facilidad de interpretación. Además, muestran buena correlación con las CIM obtenidas por microdilución y dilución en agar para analizar la sensibilidad de corinebacterias7. La determinación de CIM a través de M.I.C. Evaluator™ es una alternativa a los métodos de microdilución. Trabajos previos demuestran que las CIM obtenidas por esta metodología se correlacionan con las categorías interpretativas de los métodos de dilución y con las de otros epsilométricos13.
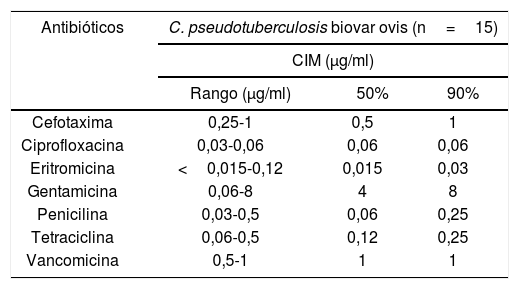
Los valores de las CIM se expresan en la tabla 2. Cefotaxima, ciprofloxacina, eritromicina, tetraciclina y vancomicina fueron activos en el 100% de los aislamientos. Considerando los valores de CIM90, los compuestos más eficaces fueron ciprofloxacina y eritromicina (0,06 y 0,03μg/ml, respectivamente), seguidos por tetraciclina, con valores menores o iguales a 0,25μg/ml. El 90% de los aislamientos fueron inhibidos por concentraciones ≤1μg/ml de cefotaxima y vancomicina. De acuerdo con los valores de CIM90, los aislamientos mostraron sensibilidad intermedia para gentamicina y penicilina.
Concentración inhibitoria mínima de 7 antimicrobianos
| Antibióticos | C. pseudotuberculosis biovar ovis (n=15) | ||
|---|---|---|---|
| CIM (μg/ml) | |||
| Rango (μg/ml) | 50% | 90% | |
| Cefotaxima | 0,25-1 | 0,5 | 1 |
| Ciprofloxacina | 0,03-0,06 | 0,06 | 0,06 |
| Eritromicina | <0,015-0,12 | 0,015 | 0,03 |
| Gentamicina | 0,06-8 | 4 | 8 |
| Penicilina | 0,03-0,5 | 0,06 | 0,25 |
| Tetraciclina | 0,06-0,5 | 0,12 | 0,25 |
| Vancomicina | 0,5-1 | 1 | 1 |
La penicilina es uno de los antibióticos de primera línea utilizado en el tratamiento de LAC actualmente, y a pesar de que se notificaron cepas resistentes, aún no está claro el mecanismo de resistencia1,5,14. Por otra parte, el punto de corte de sensibilidad establecido por CLSI para la penicilina fue reducido: de 1 a 0,125μg/ml, recientemente2.
Si bien la mayoría de los antimicrobianos fueron eficaces frente a C.pseudotuberculosisin vitro, sería probable que la mejor actividad in vivo se limitase a fármacos con buena solubilidad lipídica y actividad intracelular, como por ejemplo macrólidos y fluoroquinolonas. La eritromicina es un antibiótico eficaz que presenta alta solubilidad en lípidos, buena penetración en los tejidos y actividad en ambientes ácidos característicos de las lesiones granulomatosas de la LAC.
Dado que C.pseudotuberculosis puede afectar a distintas especies animales, es importante conocer el perfil de actividad de antibióticos por la gran variabilidad que presentan las poblaciones bacterianas. En este trabajo los antibióticos pertenecientes a los grupos de cefalosporinas, glucopéptidos, macrólidos, quinolonas y tetraciclinas fueron los más activos para los aislamientos de C.pseudotuberculosis biovar ovis. Se demostró menor actividad de β-lactámicos y aminoglucósidos. No se registró variabilidad en los perfiles antibióticos en los aislamientos procedentes de diferentes fuentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Secretaría de Ciencia y Técnica de la Universidad Nacional de la Patagonia San Juan Bosco y al Laboratorio de Bacteriología, Unidad Integrada Balcarce, Instituto Nacional de Tecnología Agropecuaria (INTA), por su apoyo económico y técnico.