El manejo clínico y epidemiológico de los pacientes con fibrosis quística (FQ) con exacerbaciones pulmonares agudas o infecciones pulmonares crónicas demanda una actualización permanente de procedimientos médicos y microbiológicos, estos se asocian con la constante evolución de los agentes patógenos durante la colonización de su hospedador. Para poder monitorear la dinámica de estos procesos es fundamental disponer de sistemas expertos que permitan almacenar, extraer y utilizar la información generada a partir de estudios realizados sobre el paciente y los microorganismos aislados de aquel. En este trabajo hemos diseñado y desarrollado una base de datos on-line basada en un sistema informático que permite el almacenamiento, el manejo y la visualización de la información proveniente de estudios clínicos y de análisis microbiológicos de bacterias obtenidas del tracto respiratorio del paciente con FQ. Este sistema informático fue designado como Cystic Fibrosis Cloud database (CFC database) y está disponible en el sitio http://servoy.infocomsa.com/cfc_database. Está compuesto por una base de datos principal y una interfaz on-line, la cual emplea la arquitectura de productos Servoy basada en tecnología Java. Si bien el sistema CFC database puede ser implementado como un programa local de uso privado en los centros de asistencia a pacientes con FQ, admite también la posibilidad de ser empleado, actualizado y compartido por diferentes usuarios, quienes pueden acceder a la información almacenada de manera ordenada, práctica y segura. La implementación del CFC database podría tener una gran impacto en la monitorización de las infecciones respiratorias, la prevención de exacerbaciones, la detección de organismos emergentes y la adecuación de las estrategias de control de infecciones pulmonares en pacientes con FQ.
The epidemiological and clinical management of cystic fibrosis (CF) patients suffering from acute pulmonary exacerbations or chronic lung infections demands continuous updating of medical and microbiological processes associated with the constant evolution of pathogens during host colonization. In order to monitor the dynamics of these processes, it is essential to have expert systems capable of storing and subsequently extracting the information generated from different studies of the patients and microorganisms isolated from them. In this work we have designed and developed an on-line database based on an information system that allows to store, manage and visualize data from clinical studies and microbiological analysis of bacteria obtained from the respiratory tract of patients suffering from cystic fibrosis. The information system, named Cystic Fibrosis Cloud database is available on the http://servoy.infocomsa.com/cfc_database site and is composed of a main database and a web-based interface, which uses Servoy's product architecture based on Java technology. Although the CFC database system can be implemented as a local program for private use in CF centers, it can also be used, updated and shared by different users who can access the stored information in a systematic, practical and safe manner. The implementation of the CFC database could have a significant impact on the monitoring of respiratory infections, the prevention of exacerbations, the detection of emerging organisms, and the adequacy of control strategies for lung infections in CF patients.
La fibrosis quística (FQ) es una enfermedad autosómica recesiva causada por la presencia de mutaciones en el gen que codifica la proteína reguladora de conductancia transmembrana de la FQ (cystic fibrosis transmembrane conductance regulator)8,15,30,33. La expresión defectuosa de esta proteína conduce a una deshidratación de las secreciones en las mucosas y a la producción de un moco anómalo y espeso, especialmente en pulmones, páncreas, intestino e hígado, y a altos niveles de cloruros en la secreción de las glándulas sudoríparas. Los rasgos distintivos de la enfermedad son las alteraciones nutricionales (retardo en el crecimiento, dificultad de ganar peso y altura), síntomas gastrointestinales (diarrea crónica por insuficiencia pancreática exocrina) y una afección pulmonar crónica caracterizada por un círculo vicioso de inflamación e infección.
Las alteraciones del sistema respiratorio determinan la predisposición de los pacientes con FQ a ser colonizados en su tracto broncopulmonar por diversos tipos de microorganismos, lo cual resulta la principal causa de morbilidad y mortalidad. Si bien los principales patógenos bacterianos reportados son Pseudomonas aeruginosa, Staphylococcus aureus y Haemophilus influenzae, otros patógenos oportunistas, como organismos del complejo Burkholderia cepacia (CBC), Burkholderia gladioli, Stenotrophomonas maltophilia y especies de Achromobacter, Ralstonia, Pandoraea y Acinetobacter, además de micobacterias atípicas, también se consideran patógenos emergentes problemáticos11,39.
Dada la afectación multisistémica que presentan, los pacientes con FQ necesitan ser asistidos en centros hospitalarios que cuenten con equipos multidisciplinarios constituidos por neumonólogos, kinesiólogos, nutricionistas, gastroenterólogos, bioquímicos, trabajadores sociales, psicoterapeutas y genetistas. El diagnóstico de la enfermedad debe ser temprano, en tanto que las evaluaciones clínicas y los exámenes complementarios deben ser frecuentes.
En las infecciones pulmonares, que mayoritariamente se convierten en crónicas, los microorganismos que colonizan el tracto respiratorio del hospedador pueden llegar a persistir varias décadas superando las presiones del entorno a través de diferentes estrategias de adaptación, tales como la diversificación y la formación de biofilm5,13,16,25.
A nivel internacional, se han desarrollado sistemas de información para el almacenamiento y la gestión de datos de epidemiología molecular de patógenos asociados a enfermedades infecciosas en general1. Particularmente en FQ, uno de los registros más difundidos es el Registro de Pacientes de la Sociedad Europea de Fibrosis Quística (Patient Registry [ECFS])9. En nuestro país, la Sociedad Argentina de Pediatría y el Ministerio de Salud de la Nación han reconocido la importancia de relevar datos epidemiológicos de los distintos centros de atención para pacientes con diagnóstico de FQ de todo el país. En este sentido, desde el año 2006 se dispone del Registro Nacional de Fibrosis Quística (RENAFQ)32. Del mismo modo surgió recientemente el Registro de Fibrosis Quística de la Provincia de Buenos Aires31, el cual permite analizar y comparar distintos tratamientos, desarrollar nuevas políticas acordes con los adelantos obtenidos a nivel local e internacional y, fundamentalmente, sumar esfuerzos tendientes a incrementar la sobrevida y la calidad de vida de los pacientes con FQ.
El ordenamiento y la utilización sistemática de la información recopilada, tanto la surgida de los pacientes como de los patógenos aislados, resulta una tarea muy compleja pero fundamental para llevar a cabo diferentes tipos de estudios. Si bien los métodos y las herramientas que se han empleado tradicionalmente para la recolección y la visualización de datos biológicos han mejorado en forma considerable en los últimos años, estos no resultan todavía del todo satisfactorios cuando la cantidad de información que se genera y se desea almacenar es muy grande, lo que hace que el usuario pueda sentirse superado por aquella.
Tradicionalmente, en los centros de salud y atención del paciente con FQ, el conjunto de datos colectados por los diferentes laboratorios o salas ha sido manejado a través de ficheros o tablas tipo Excel. Sin embargo, estos sistemas muestran limitaciones importantes en la capacidad de almacenamiento y recuperación de la información global. En consecuencia, existe en el sector de la salud pública una fuerte necesidad de poder contar con sistemas informáticos avanzados, que permitan gestionar una gran cantidad de datos provenientes de diferentes fuentes. En este sentido, hasta el presente no se dispone de un sistema informático que permita almacenar y gestionar tanto los datos clínicos como los epidemiológicos de la microbiota pulmonar de los pacientes con FQ. Un sistema de estas características permitiría al equipo médico recopilar información proveniente de las distintas especialidades y tener, a requerimiento y mediante una consulta a la biblioteca de datos disponibles, una visión global del estado y la evolución de la enfermedad, así como de las características de los microorganismos asociados a las infecciones pulmonares de los pacientes.
El objetivo del presente trabajo fue desarrollar un sistema informático basado en la web que permita almacenar, clasificar, visualizar y correlacionar información proveniente tanto de la clínica del paciente con FQ como de la microbiota de sus secreciones respiratorias. El sistema Cystic Fibrosis Cloud database (CFC database) desarrollado representa una herramienta informática que les permitirá a los profesionales de la salud monitorear la información clínica recopilada de pacientes con FQ y de los patógenos responsables de las infecciones respiratorias (agudas o crónicas), así como determinar, en función de la información disponible, la evolución de la interacción patógeno-hospedador. Este sistema podría tener un gran impacto en la prevención de las exacerbaciones, la detección de organismos emergentes y la adecuación de las estrategias de control de infecciones en pacientes con FQ.
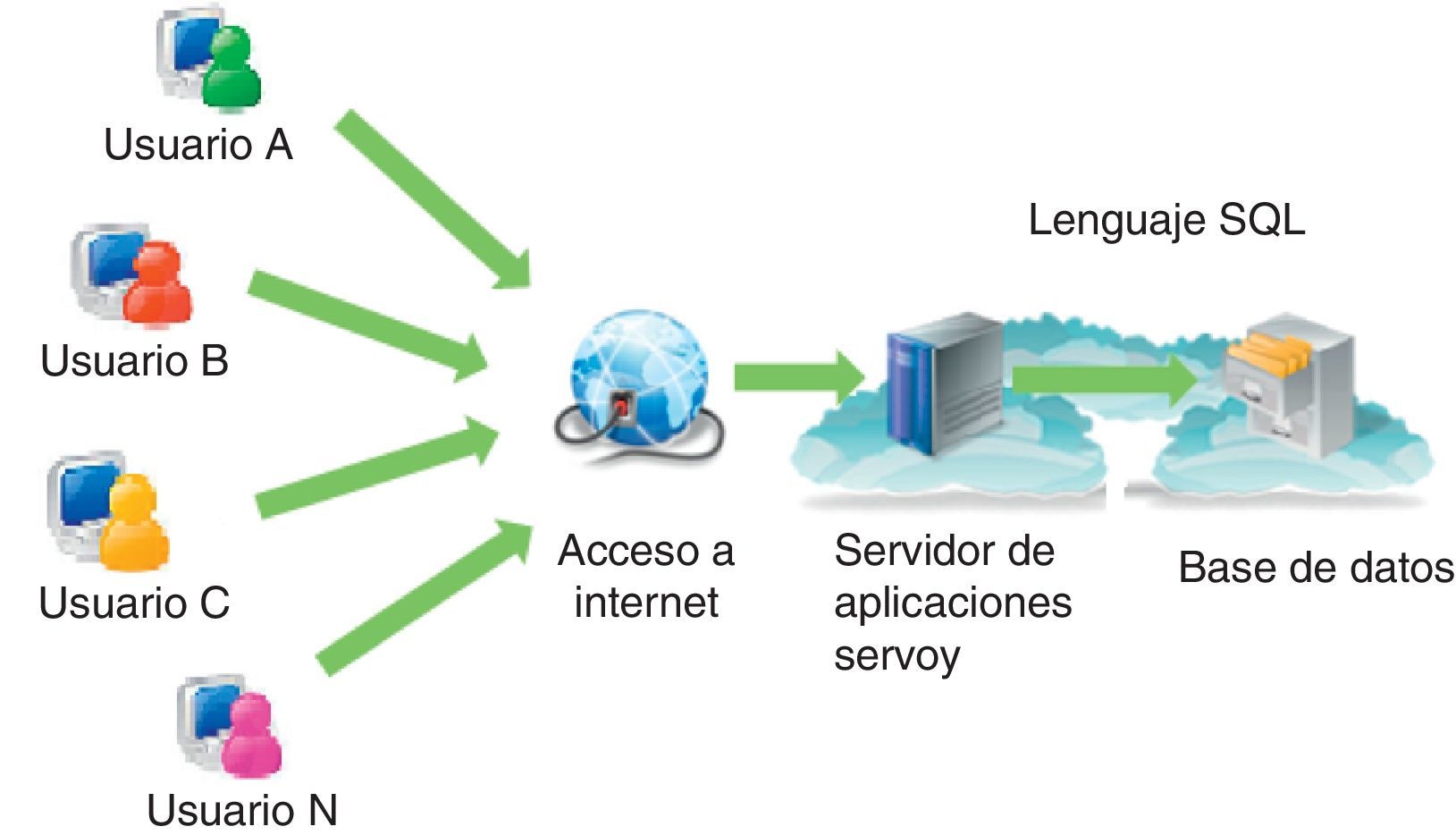
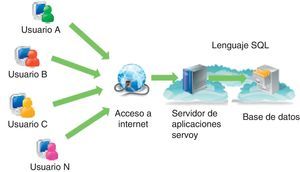
Materiales y métodosImplementación del sistema CFC databaseEl sistema CFC database consiste en un conjunto de elementos interconectados bajo ciertas reglas, que tiene como objetivo el registro, el almacenamiento, el procesamiento y la presentación de diferentes tipos de datos obtenidos en el marco de la patología del paciente con FQ. Este sistema está implementado en la «nube» en un servidor de aplicaciones Servoy35 con sistema operativo Linux, el cual contiene una plataforma que permite integrar en una base de datos varias fuentes de información y hacerlas accesibles al usuario vía web (fig. 1).
Componentes del sistema Cystic Fibrosis Cloud database. El sistema está implementado en «la nube» en un servidor de aplicaciones Servoy que opera con sistema operativo Linux; contiene una plataforma que permite integrar en una base de datos varias fuentes de información y hacerlas accesibles a los usuarios vía web.
El diseño de la presente base de datos tuvo en cuenta la totalidad del flujo de información que se genera desde el momento en que un paciente con FQ ingresa a un servicio hospitalario. La base desarrollada permite el almacenamiento de datos que se generan incluidas las causas del ingreso del paciente al centro asistencial, los síntomas y su estado clínico general (antropometría, grado de afectación). Luego admite el registro de los estudios generales y de las pruebas de función pulmonar que se le practicaron, de los análisis microbiológicos realizados en muestras respiratorias y de los resultados de la identificación y la caracterización fenotípica y/o molecular de los patógenos aislados, los cuales determinan el tratamiento que se debe implementar. Teniendo en cuenta las diferentes fuentes de generación de datos, en este flujo de información se establecieron 4 módulos conceptuales alrededor de los cuales se organizó el esquema de la base de datos: «Unidad asistencial/hospital», «Paciente/estudios clínicos», «Muestras» y «Ensayos microbiológicos» (tabla 1). En el diseño estructural de la base se habilitó, para el caso de los datos microbiológicos, la posibilidad de ingresar resultados de estudios de bacterias recuperadas de pacientes sin FQ y de muestras ambientales.
Descripción de los módulos conceptuales de la Cystic Fibrosis Cloud database
| Módulo conceptual | Información |
|---|---|
| Unidad asistencial/hospital | Ubicación geográfica: país, ciudad, región |
| Paciente/estudios clínicos | Datos personales Diagnóstico: FQ, diabetes, infección urinaria, septicemia, traumatismo/infección, neumonía, cardiopatía Diagnóstico FQ: pesquisa neonatal FQ, prueba del sudor, estudio molecular de mutaciones de FQ Parámetros clínicos: altura, percentil de IMC, percentil peso/edad, puntaje Z peso/edad, percentil talla/edad, puntaje Z talla/edad, número de exacerbaciones, edad, puntaje Z de IMC, % VEF1, número de internaciones |
| Muestras | Tipo de muestra FQ: esputo, aspirado nasofaríngeo, aguas, lavado broncoalveolar, aislamiento clínico, hisopo tosido, orina, líquido ecografía, sangre, desinfectante, otro Características: límpida, turbia, incolora, moco espeso, moco seco, líquido salivoso, líquido amarillo, otro Destino: laboratorio de bacteriología, laboratorios externos, centros de investigación Muestras ambientales y no FQ |
| Ensayos microbiológicos | Análisis morfológicos: características de las colonias, movilidad Pruebas bioquímicas clásicas, estudios fenotípicos (resistencia a antibióticos, factores de virulencia (hemólisis, proteólisis, formación de biofilm), tasa de mutación, estudios espectroscópicos Estudios moleculares para bacterias del CBC: PCR recA, PCR recA-RFLP Hae III, PCR gyrB, PCR gyrB-RFLP Hae III, PCR lepA, PCR phaC, PCR trpB, PCR gltB, PCR atpD, MSLT, secuenciación. Estudios moleculares para Pseudomonas: PCR oprF, PCR oprf-RFLP Hae III Pseudomonas Resultados: identificación bioquímica, interpretación antibiograma, perfiles de patrones de ADN, imágenes de geles de ADN, secuencia de genes, nivel de hipermutación |
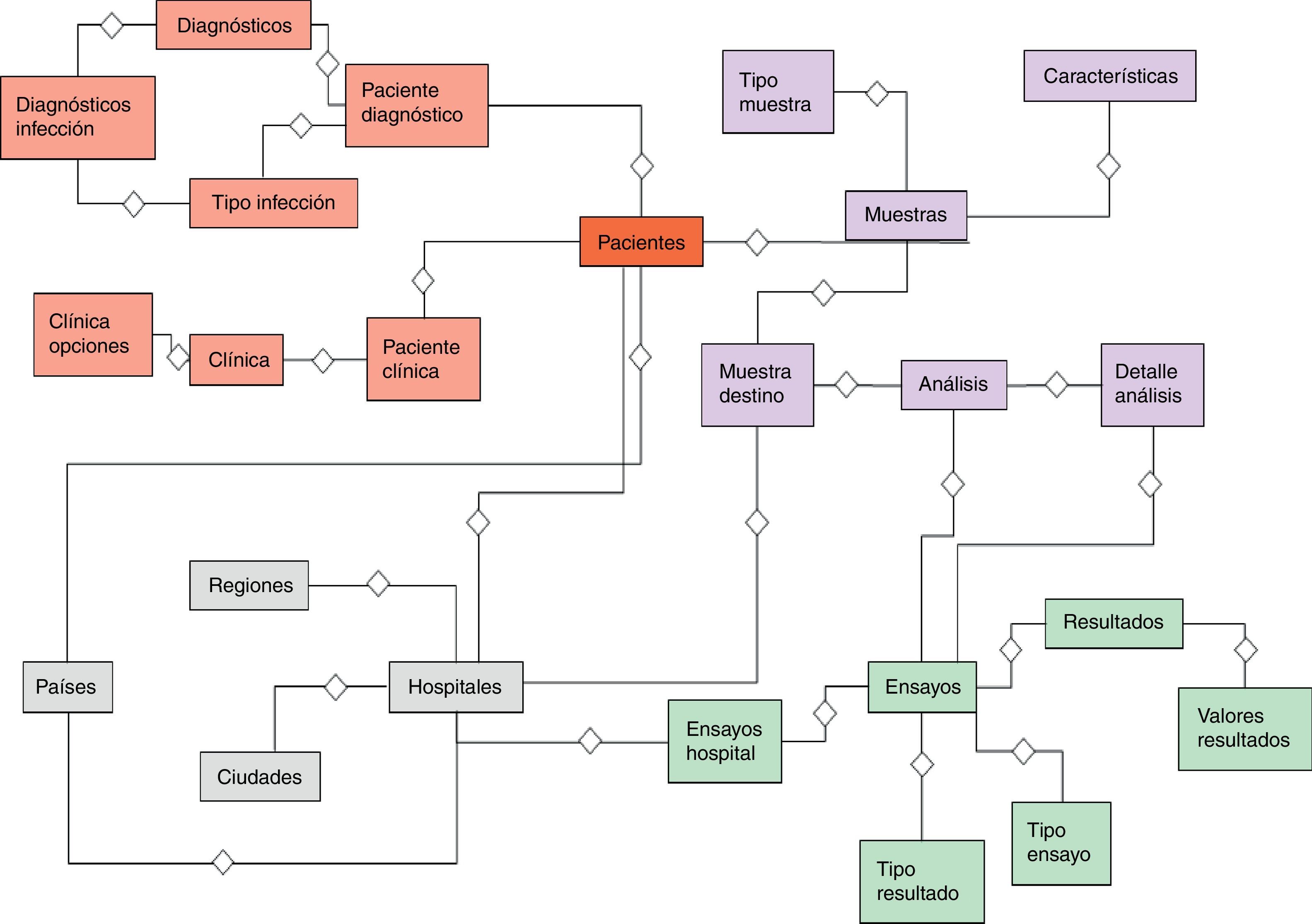
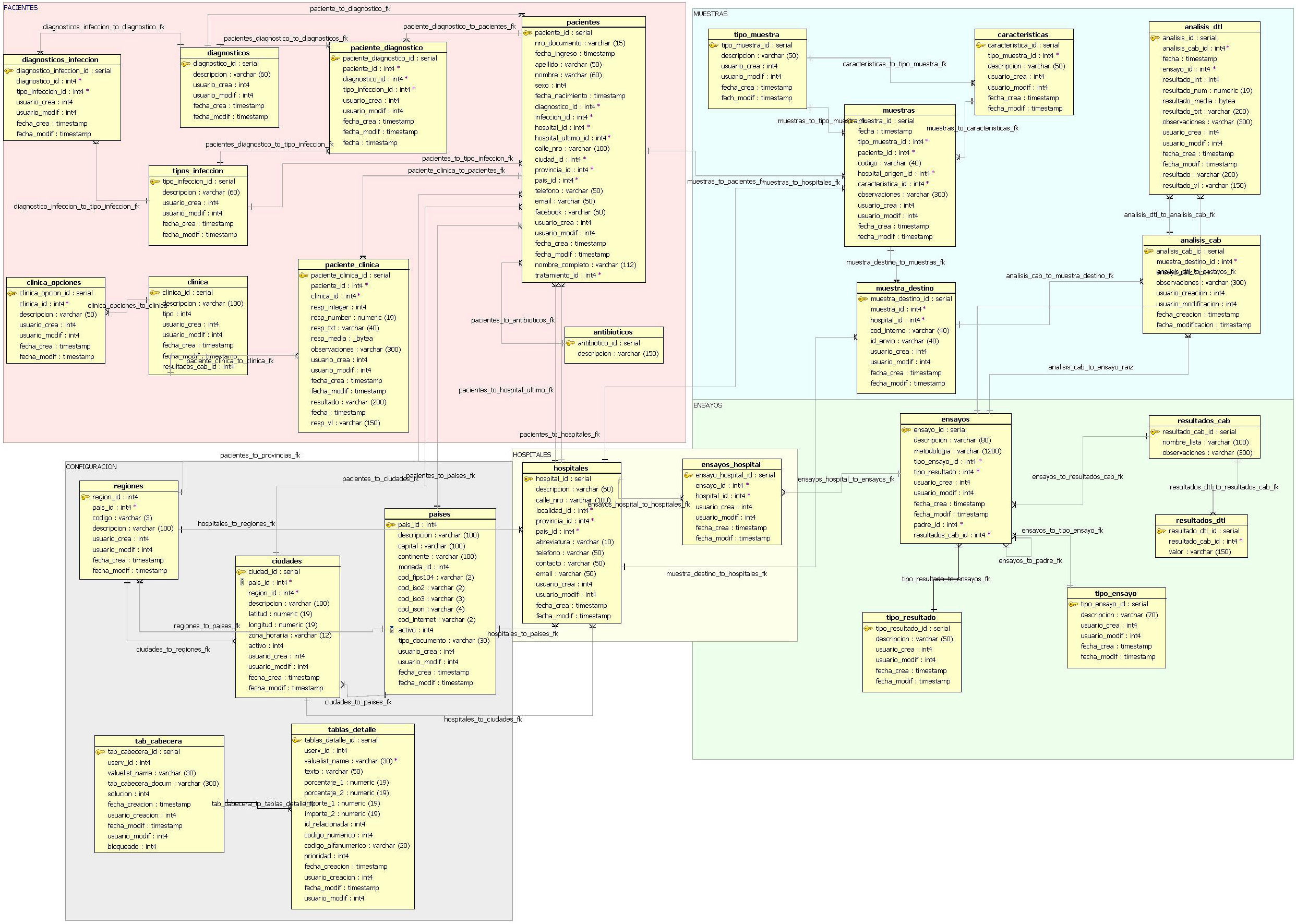
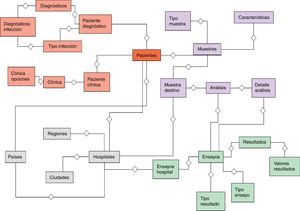
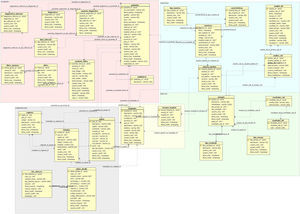
El desarrollo del sistema CFC database se implementó sobre una base de datos relacional PostgreSQL, que permite establecer interconexiones (relaciones) entre los datos almacenados en las tablas, y a través de dichas conexiones, permite relacionar los datos de las diferentes tablas. PostgreSQL es un software de código abierto29, el cual constituye una base de datos ampliamente empleada en diferentes ámbitos. El modelo relacional de tablas empleado opera con índices que facilitan el acceso a la información, donde las filas de las tablas constituyen los registros y las columnas los atributos. El diagrama entidad-relación mostrado en la figura 2 indica las entidades definidas de la base de datos y sus relaciones. Este diagrama permite tener una visión global de la información, que es posible almacenar en la base de datos. La figura 3 representa un diagrama extendido de dichas entidades y sus atributos. Ambas representaciones fueron obtenidas empleando el programa Aqua Data Studio 14.0. La descripción detallada de cada entidad, sus restricciones y los procedimientos para llevar a cabo la carga de datos en el sistema CFC database se detallan en el Manual de procedimientos que se adjunta como material suplementario.
El sistema CFC database fue implementado en «la nube», en un servidor de aplicaciones Servoy, el cual accede a una base de datos PostgreSQL (descrita en la sección anterior) que permite su accesibilidad para distintos usuarios vía web en el sitio http://servoy.infocomsa.com/cfc_database. La plataforma Servoy, que opera con sistema operativo Linux, permite realizar un enlace automático con la base de datos. La línea de productos Servoy aquí implementados, basados en tecnología Java, proporciona un ambiente de desarrollo rápido de aplicaciones, que permite trabajar con una altísima productividad en el desarrollo y mantenimiento de aplicaciones con el concepto rapid application development environment (RADE). Servoy posee una gran biblioteca de procedimientos y herramientas o plugins integrados, que permiten a modelos predefinidos ser altamente accesibles y fáciles de usar, y confieren una poderosa funcionalidad para implementar sistemas de flujo de trabajo. Estos productos poseen la ventaja adicional de que el contenido de la interfaz queda grabado en tablas de internacionalización, las cuales permiten la generación de una traducción de la base al idioma deseado en forma automática21,23,29,35.
El sistema CFC database utiliza como lenguaje de interacción entre la aplicación y la base de datos el lenguaje structured query language (SQL), considerado el estándar para el acceso a bases de datos relacionales. El conjunto de herramientas que conforman la arquitectura del sistema CFC database (la base de datos, su implementación y distribución entre los usuarios) han sido seleccionadas por su gran fiabilidad y flexibilidad para funcionar bajo diferentes ambientes, ya que el servidor Servoy puede ejecutarse en PC o servidores con cualquier sistema operativo Unix, Linux o Windows, así como con diferentes navegadores web (Chrome, Firefox, Internet Explorer, etc.).
Validación del sistema CFC databaseA fin de evaluar la consistencia de la arquitectura de la base de datos y el funcionamiento global del sistema se llevaron a cabo ensayos de validación. Este proceso consistió en verificar si datos clínicos y microbiológicos de pacientes con FQ eran correctamente almacenados y filtrados en el sistema CFC database. Se comprobó que para cada uno de los campos establecidos se cumplieran las consignas establecidas previamente para el registro de datos, tal como se explica en el Manual de procedimientos (material suplementario S1). Se analizaron potenciales problemas que podrían surgir en el ingreso de los datos, para lo cual se generó un sistema de alerta (frente a una carga errónea de datos este advierte al usuario que se está realizando la carga de manera incorrecta).
La validación del sistema CFC database se realizó empleando datos provenientes de 350 poblaciones microbianas diferentes, ambientales o recuperadas de pacientes con FQ o sin ella, que fueron analizadas con anterioridad en los laboratorios y centros de atención participantes de este trabajo19,20,22,38, y con la información clínica obtenida de 124 pacientes con FQ asistidos en el Servicio de Neumonología del Hospital de Niños «Sor María Ludovica», Centro de Referencia Provincial en Fibrosis Quística de La Plata.
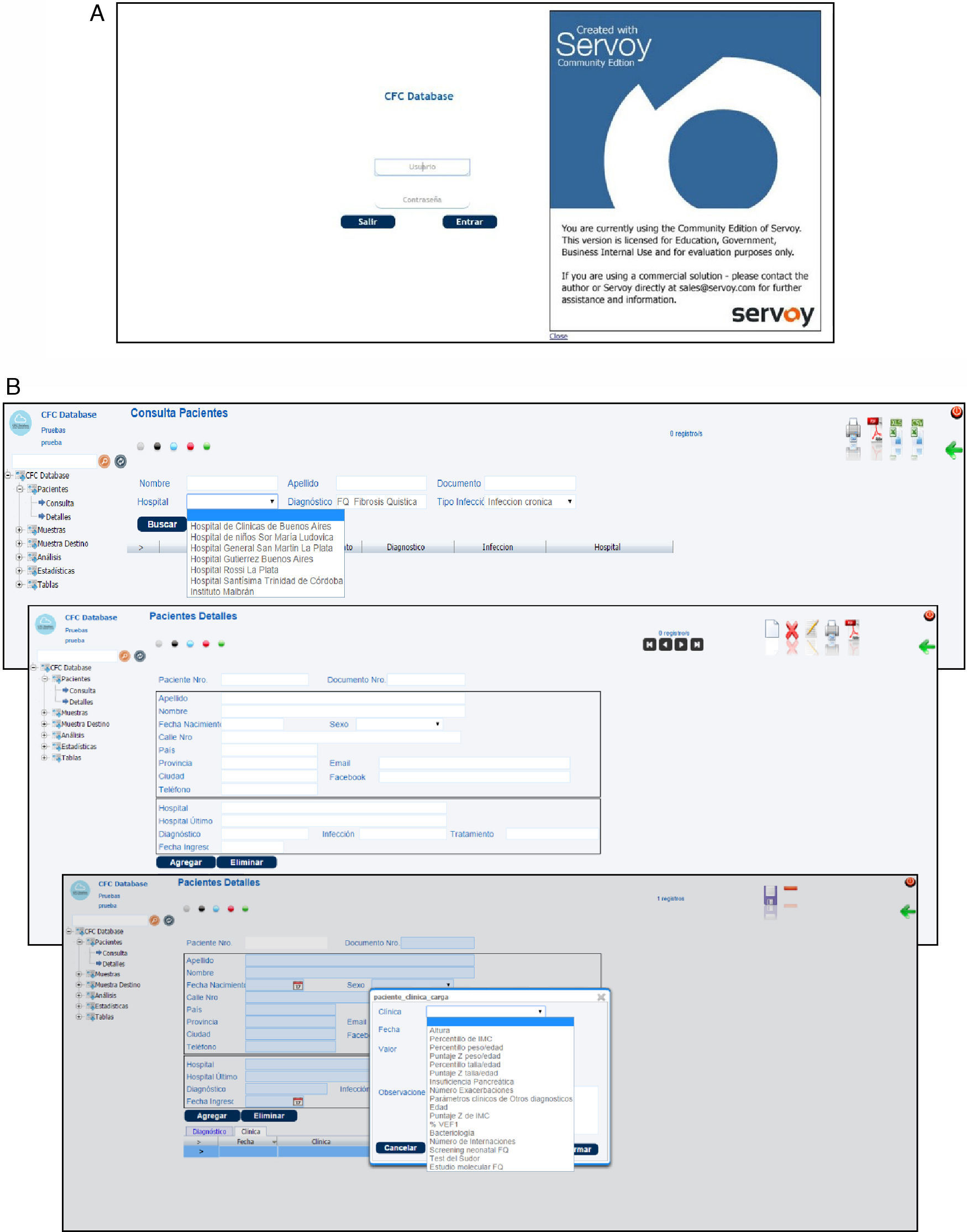
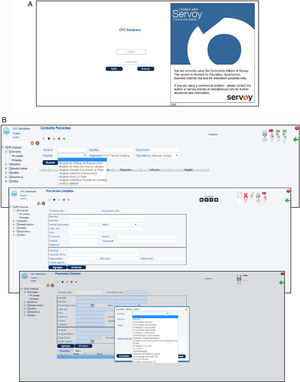
Accesibilidad, seguridad y respaldo de los datos almacenadosEl sistema informático CFC database es un software de código abierto, distribuido bajo los términos de la licencia pública general de GNU (GNU GPL, licencia libre, de copia permitida para software). Constituye un sistema de alta seguridad tanto desde el punto de vista del ingreso o acceso a la base de datos, como del resguardo de la información almacenada. Un primer nivel de seguridad implementado en este software es la identificación del usuario para iniciar cada sesión. El usuario debe identificarse con un nombre de usuario y una contraseña (fig. 4 A). Un segundo nivel de seguridad está representado por un comando de cierre de sesión implementado en la interfaz, el cual después de cierto tiempo de inactividad (determinado de acuerdo con el criterio del usuario), ante una señal de alerta el sistema cierra automáticamente la sesión obligando al usuario a identificarse nuevamente. Un tercer nivel de seguridad lo ofrece un esquema de base de datos secundario, al cual tiene acceso exclusivamente el administrador del sistema, que registra y almacena la información acerca de quién realiza operaciones de inserción, exclusión o actualización de la base de datos, y de dónde y en qué momento esto sucede.
Si bien el sistema CFC database puede ser utilizado como un programa local de uso privado en cada laboratorio o centro de asistencia a pacientes con FQ, para el manejo de los datos de sus propios enfermos, el sistema puede ser empleado y actualizado por diferentes usuarios y compartido desde distintos ámbitos de trabajo o centros de asistencia entre todos ellos, quienes podrán compartir una base de datos común —cada uno con un nombre de usuario y una contraseña asignada— y acceder a la información almacenada, ya sea de manera total o parcial, según las restricciones que el mismo grupo establezca en el servidor. De este modo, los datos almacenados en cada institución pueden ser compartidos total o parcialmente con otras instituciones para generar estadísticas de mayor cobertura.
El sistema CFC database cuenta con un nivel de seguridad en lo que atañe al respaldo de los datos almacenados, ya que el administrador local del sistema actualiza diariamente una copia de seguridad de la base de datos de cada usuario.
Resultados y discusiónA lo largo de más de 10 años de trabajo conjunto entre hospitales, centros de atención a pacientes con FQ y laboratorios de investigación, hemos observado la necesidad de contar con sistemas informáticos para gestionar la significativa cantidad de datos obtenidos de diferentes estudios clínicos y microbiológicos relacionados con organismos patógenos que colonizan las vías aéreas del paciente con FQ.
La interacción patógeno-hospedador en FQ plantea constantes desafíos, no solo desde la perspectiva epidemiológica, sino también dada la continua evolución microbiana, que impone una permanente vigilancia y monitorización de la evolución del paciente ante determinado tratamiento. Una estrategia clave para mejorar los resultados en esta área, que es en esencia dinámica, es lograr mantener actualizada la información sobre la magnitud y las tendencias de los problemas, a fin de poder conectarlos con el seguimiento del efecto de los tratamientos antimicrobianos34. El registro de los pacientes, con actualizaciones periódicas y evaluación frecuente de los resultados individuales y del conjunto de los pacientes afectados, ha demostrado ser una contribución muy importante para optimizar su pronóstico32. En este sentido, es imprescindible procurar obtener beneficios del análisis de la información generada desde el ingreso hasta el egreso de los pacientes de los servicios asistenciales. Las acciones que se tomen sobre la base de la vigilancia dependerán de la cobertura de la compilación y del análisis de los datos disponibles. Si bien los registros de pacientes disponibles en nuestro país recopilan cierta información de cada paciente (como edad, localización geográfica, origen genético de la enfermedad, etc.), no se dispone hasta el presente de una base de datos que almacene, interconecte y correlacione datos de la clínica del paciente con los colonizadores microbianos, en particular con los responsables de infecciones pulmonares crónicas.
El sistema informático CFC database, constituido por una base de datos principal y una interfaz basada en la web, es una herramienta sumamente versátil, de fácil accesibilidad, que permite almacenar, clasificar, visualizar y correlacionar la información proveniente tanto de la clínica del paciente con FQ como de la microbiota pulmonar. Para acceder al sistema solo hace falta contar con una PC estándar, conexión a Internet y ser un usuario autorizado con una clave de ingreso. Al ingresar al sistema, el operador encontrará una pantalla que le ofrece, a su izquierda, un menú de opciones: «Pacientes», «Muestras», «Muestras destino», «Análisis», «Estadísticas» y «Tablas». Los diferentes tipos de datos pueden ser cargados en la base siguiendo el flujo de información mencionado en la sección de metodología, incorporando los datos del centro asistencial, los personales del paciente, el estado clínico general, los estudios clínicos realizados, los análisis microbiológicos de muestras respiratorias efectuados y los ensayos de identificación, caracterización fenotípica y molecular de los patógenos aislados (fig. 4 B). Sin embargo, el almacenamiento de esta información puede realizarse también de manera aleatoria (véase el procedimiento de carga de datos en el Manual para el uso de la CFC database, material suplementario S1).
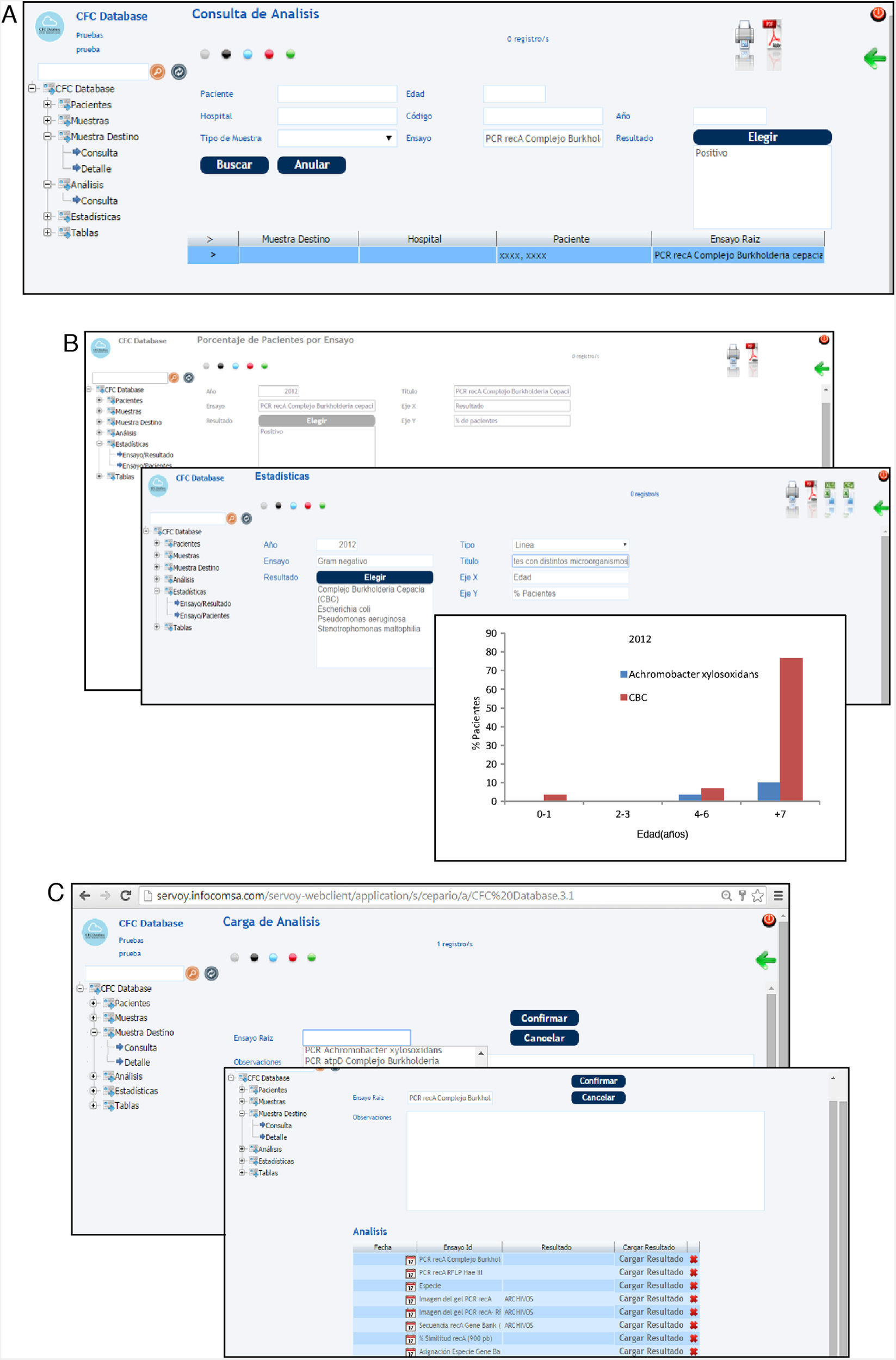
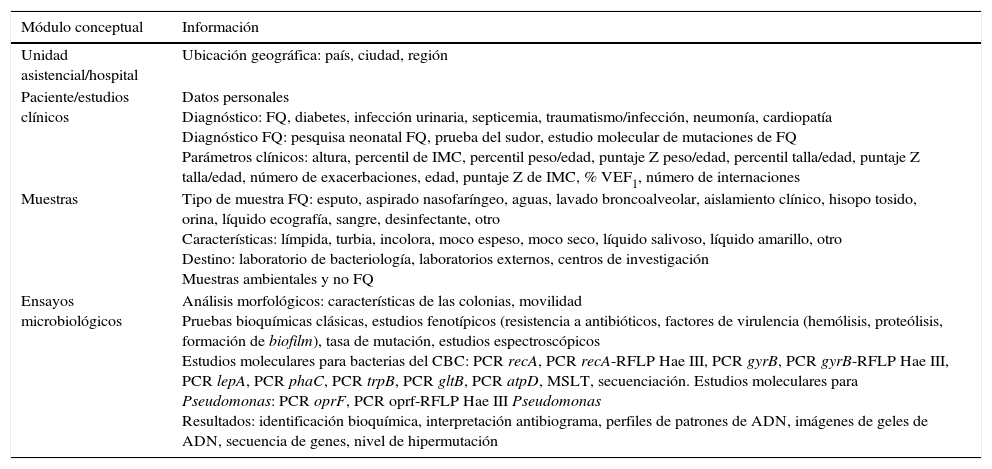
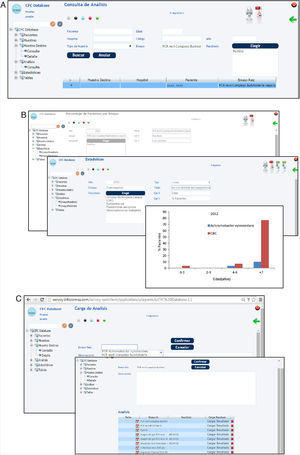
Una vez realizada la carga de los datos, el sistema permite realizar consultas de datos particulares (fig. 5 A). Estas pueden hacerse a través de los diferentes campos: pacientes, diagnóstico, tipo de microorganismo, tipo de muestra, tipo de ensayo, resistencia a antimicrobianos, características genéticas, fenotípicas, etc. Finalmente, con los datos almacenados en los diferentes campos es posible realizar análisis estadísticos y obtener gráficas, diagramas de barras, etc. (fig. 5 B).
Capturas de pantalla del sistema CFC database. A) Consulta de datos. B) Gráfico estadístico obtenido a partir de datos ingresados para la validación del sistema CFC database. C) Almacenamiento de datos de biología molecular (tipo de PCR, importación de la secuencia del gen, resultado de asignación a especie, importación de la imagen digital del gel de agarosa).
El diseño, la arquitectura, la organización y la validación del sistema CFC database se llevaron cabo teniendo en cuenta la información recopilada de la clínica y los estudios de la microbiota del tracto respiratorio de pacientes con FQ que asistieron a diferentes hospitales y centros de asistencia públicos locales durante un período de 11 años (2004-2014).
En relación con la microbiota analizada, si bien P. aeruginosa ha sido el patógeno oportunista gram negativo más importante recuperado de las vías aéreas de pacientes locales, tal como se ha reportado previamente19,20,22, las bacterias pertenecientes al CBC constituyen agentes infecciosos de alta incidencia a nivel regional. Estas bacterias pueden transmitirse fácilmente entre pacientes17, son multirresistentes a los antimicrobianos26 y, en algunos casos, su presencia produce una neumonía necrosante, con marcada reducción en la expectativa de vida del paciente37.
Desde 2004, año en que se detectó un brote regional de estas bacterias, la incidencia de estos organismos creció significativamente y se recuperaron diferentes especies del CBC no solo de pacientes con FQ, sino también de pacientes sin FQ y de muestras ambientales19,20. Asimismo, estos estudios epidemiológicos demostraron que de las 18 especies actualmente descritas para el CBC, B. contaminans era la de mayor incidencia local19. Estos antecedentes epidemiológicos locales fueron tenidos en cuenta para el desarrollo de la arquitectura del sistema CFC database. En este sentido, en el módulo conceptual «Análisis» se consideró la posibilidad de incorporar estudios bioquímicos, fenotípicos y moleculares de identificación microbiana avalados a nivel mundial y aceptados por las pautas de prevención y control de FQ, para caracterizar y discriminar la microbiota pulmonar del paciente con FQ3,6,14,34,40.
Como se indica en la tabla 1, el módulo conceptual «Análisis» considera también la información fenotípica que habitualmente se obtiene de los análisis de rutina hospitalaria —que permiten discriminar los organismos del CBC de los bacilos gram negativos multirresistentes conocidos como cepacia-like— y las pruebas de resistencia a antimicrobianos avaladas por el CLSI24. Del mismo modo, es posible incorporar datos provenientes de estudios de secuenciación de los genes recA y gyrB, de detección de cblA, B. cepacia epidemic strain marker (BCESM), así como las secuencias y los resultados de tipificación obtenidos mediante el empleo del sistema de identificación denominado multilocus sequence typing (MLST)4 para organismos del CBC, y los resultados de secuenciación y caracterización del gen oprF para la identificación y la caracterización de Pseudomonas spp. En relación con los estudios de biología molecular, la base de datos permite la incorporación de diferentes resultados, por ejemplo, permite la importación de secuencias de genes obtenidas de las bases de datos (MLST database o GenBank) o de imágenes digitales obtenidas de fotografías de geles de agarosa (fig. 5C).
En los últimos años se han reportado importantes avances en relación con el estudio de poblaciones bacterianas responsables de infecciones pulmonares crónicas en pacientes con FQ. A lo largo de una infección crónica, las vías respiratorias de estos pacientes representan un ecosistema en el que las bacterias patógenas oportunistas evolucionan en respuesta a las presiones de selección del entorno, como la respuesta inmunitaria del hospedador, las constantes terapias antimicrobianas y la limitación de oxígeno13,28. Se ha demostrado que tanto P. aeruginosa como bacterias del CBC poseen una alta capacidad de persistir en el tracto respiratorio de estos pacientes a través de cambios genéticos y fenotípicos10,12,18,20,28,36. Entre los cambios reportados a lo largo de este proceso evolutivo que deriva en infecciones crónicas podemos mencionar los siguientes: a) cambios en la resistencia antibiótica2; b) pérdida de movilidad celular36; c) inactivación de señales de quorum sensing2; d) disminución de la producción de factores de virulencia asociados a la infección aguda7, y e) incremento en la tasa de mutación10,19,26,37.
En el desarrollo del diseño de la base de datos del sistema CFC database se tuvo en cuenta la posibilidad de que el usuario cuente con herramientas para llevar a cabo alguno de los análisis específicos relacionados con la adaptación y persistencia de los microorganismos durante la infección crónica. En este sentido, en el módulo conceptual «Análisis» hemos incluido la posibilidad de registrar resultados de determinaciones, tales como tasa de mutación, detección de hipermutación20, capacidad de formación de biofilm medida por la técnica de cristal violeta27, producción de señales de quorum sensing y resistencia a antimicrobianos en cultivos planctónicos (CIM) y en biofilm (CIMB), entre otros (tabla 1).
También se consideró en el desarrollo de la arquitectura del sistema CFC database la posibilidad de que el usuario cuente con conexión a ciertos sitios web de interés para realizar diagnósticos microbiológicos por biología molecular. El sistema ofrece la posibilidad de conectarse a través de un acceso directo a bibliografía de interés, al GenBank y a la base de datos del MLST. También permite el acceso directo al Manual de uso del sistema CFC database y a la consulta por parte de cualquiera de los usuarios de las metodologías y los protocolos de trabajo de los diferentes análisis incluidos en la base.
La posibilidad que ofrece el sistema CFC database de recopilar y almacenar los datos clínicos y microbiológicos, de procesar dichos datos y de presentarlos en diversas formas (tablas, diagramas, etc.) permitirá a los usuarios realizar varias tareas, a saber: a) monitorizar la clínica y la evolución de los pacientes con FQ; b) registrar datos fenotípicos y moleculares de poblaciones microbianas, para luego poder analizar la evolución de los procesos infecciosos en pacientes locales; c) obtener estadísticas de infección; d) determinar el tipo de población bacteriana prevalente; e) evaluar la variación en la resistencia a antibióticos en el tiempo para un paciente en particular o una población; f) monitorizar la evolución de los pacientes para facilitar la aplicación de modos de prevención de las exacerbaciones, y g) organizar y sistematizar toda la información disponible en relación con la interacción patógeno-hospedador. La implementación de este sistema en «la nube» brinda la posibilidad de realizar trabajos coordinados entre los diferentes centros de atención a pacientes con FQ en red, dándole de este modo un valor adicional a la información almacenada.
ConclusionesEn este trabajo se presenta el desarrollo de un sistema de información de código abierto ubicado en «la nube», integrado por un grupo de elementos relacionados (un servidor con una plataforma que permite la conexión con una base de datos). Este sistema funciona como una biblioteca segura, versátil, de fácil accesibilidad, capaz de almacenar progresivamente la información obtenida por los usuarios. El sistema CFC database constituye un nuevo instrumento informático que permite por primera vez almacenar, organizar, catalogar y clasificar la información asociada a la patología del paciente con FQ, tanto la resultante de datos clínicos como de la microbiota pulmonar. Su implementación permitirá visualizar, mediante gráficos, esquemas y diagramas, la evolución de los parámetros respiratorios y la clínica de los pacientes con FQ, así como los cambios en las poblaciones microbianas responsables de los procesos pulmonares infecciosos crónicos. También permitirá analizar la epidemiología local y las modificaciones genéticas, fenotípicas y de resistencia a los antimicrobianos de los patógenos a lo largo del tiempo.
La implementación del CFC database tendrá un gran impacto en la monitorización de los pacientes con FQ y en la gestión de la información sobre las infecciones respiratorias de dichos pacientes. Esto incidirá positivamente en la prevención de las exacerbaciones, la detección de organismos emergentes y en la adecuación de las estrategias de control de infecciones. Por último, cabe señalar que este sistema podría emplearse en el procesamiento de información similar proveniente de otros procesos infecciosos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo se realizó con fondos de un Proyecto de Extensión de la Facultad de Ciencias Exactas de la Universidad Nacional de La Plata-Área Salud y Diagnóstico (2011), y del Programa Laboratorio de Salud Pública de la Facultad de Ciencias Exactas de la Universidad Nacional de La Plata. A. Bosch es Investigador de la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CIC PBA).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Se agradece a Julio Figari por su colaboración en tareas técnicas.