La salmonelosis es una de las enfermedades bacterianas que afectan el tracto digestivo de los terneros y provocan en ellos diarrea. Con el objetivo de estudiar la prevalencia de los distintos serovares de Salmonella en terneros de crianza artificial y determinar la asociación con signos diarreicos, se realizó un estudio epidemiológico con diseño transversal en la región lechera Mar y Sierras, ubicada en la Provincia de Buenos Aires (Argentina). Mediante hisopado de mucosa rectal, se muestrearon 726 terneros en período de crianza distribuidos en 50 establecimientos lecheros de dicha zona, se incluyeron animales con signos diarreicos y sin estos. Los aislamientos identificados como Salmonella spp. fueron tipificados utilizando antisueros poli- y monovalentes dirigidos contra antígenos somáticos, flagelares y capsulares (Vi). Salmonella spp. se detectó en el 36% de los establecimientos y los serovares hallados fueron S. Mbandaka, S. Anatum, S. Typhimurium, S. Dublin, S. Montevideo, S. Meleagridis, S. Newport, S. Seftemberg, S. subesp.16,7:z1, S. Infantis y S. Give. El 5,5% de los terneros fueron positivos y aquellos terneros con signología diarreica presentaron 5,9 veces más probabilidad de estar infectados con Salmonella spp. que aquellos que no tuvieron signos. La edad de los terneros positivos osciló desde un día hasta 53 días de vida; la mayor frecuencia se detectó al segundo día de nacidos. Se concluye que 11 serovares de Salmonella están presentes en más de un tercio de los establecimientos lecheros de la región lechera Mar y Sierras y que estos serovares mostraron estar asociados a la existencia de signos diarreicos en los terneros, sobre todo a la presencia de moco en las heces. La prevalencia de Salmonella fue mayor en terneros de menos de 21 días de vida.
Salmonellosis in calves is a bacterial disease that affects their digestive tract causing diarrhea. A cross-sectional epidemiological study was carried out with the aim of studying the prevalence of various serovars of Salmonella in calves and their relationship with diarrhea signs. The study was conducted in Mar and Sierras Dairy Basin located in Buenos Aires province, Argentina. Seven hundred and twenty six calves both with diarrhea signs or not were sampled by rectal mucosa swab in 50 dairy farms during the rearing period. Isolates identified as Salmonella spp. were classified using polyvalent and monovalent antisera against somatic, flagellar and capsule antigens (Vi). Salmonella spp. was found in 36% of the farms and serotypes were: S. Mbandaka, S. Anatum, S. Typhimurium, S. Dublin, S. Montevideo, S. Meleagridis, S. Newport, S. Seftemberg, S. subesp. 16,7:z1, S. Infantis, S. Give. A percentage of 5.5% calves was positive and calves showing diarrheal signs were 5.9 times more likely to be infected with Salmonella spp. than those having no signs. The age of positive calves ranged from the first day of life to 53; the second day being the most frequent time. In conclusion, 11 Salmonella serovars were detected in one out of 3dairy farms in Mar and Sierras Dairy Basin, and not only were these serovars associated with diarrhea signs including the presence of mucus in feces, but they were also more prevalent among calves aged up to 21 days.
La salmonelosis es una de las enfermedades bacterianas que afectan el tracto digestivo de los terneros y provocan en ellos diarrea; está ampliamente difundida en el mundo y su incidencia es creciente en los sistemas de producción intensivos, como lo son los establecimientos lecheros. La especie y subespecie que afecta a los bovinos se denomina Salmonella enterica subsp. enterica. A su vez, esta se clasifica en serovares en función de diferentes asociaciones de factores antigénicos somáticos O y flagelares H. Los serovares son agrupados teniendo en cuenta el antígeno somático O, y así se determinan grupos denominados con letras, desde la A hasta la Z7. Los serovares aislados con mayor frecuencia en el ganado bovino son S. Typhimurium y S. Dublin, que se manifiestan en forma endémica en el noreste de Europa, con diferencias en su distribución geográfica.
En el Reino Unido, S. Typhimurium está ampliamente difundido, mientras que S. Dublin se detecta en el norte y sudoeste de Inglaterra y Gales. En Estados Unidos, S. Typhimurium es endémica en todo el país, a diferencia de S. Dublin, que solo se ha aislado en determinadas regiones2. Además de estos serovares, se citan aproximadamente otros 100; entre ellos, S. Newport es el más prevalente1.
Tanto S. Typhimurium como S. Dublin son causales de diarrea en vacas durante los primeros 5 días posparto6. La prevalencia es menor en terneros de razas de carne, que permanecen mamando al pie de la madre hasta el destete1. Los brotes pueden ocurrir con alta mortalidad y morbilidad. La infección con Salmonella se asocia a la presencia de signos de enterocolitis, neumonía, septicemia y aborto en rodeos lecheros19,20. La forma entérica de la enfermedad es predominante, la cual se caracteriza por pirexia, embotamiento y anorexia, seguidos de diarrea; estas heces pueden contener fibrina y mucus.
La patogenia de S. enterica es compleja: involucra inflamación, necrosis y aumento de la secreción de fluidos. Esta afección disminuye la absorción y digestión de los nutrientes. La principal vía de infección en terneros es la oral. La presentación de los signos depende de la carga bacteriana, la susceptibilidad del ternero, el grado de transferencia de inmunidad pasiva, del estrés y de la nutrición, entre otros.
Luego de ser ingerida, Salmonella se adhiere a las células de la mucosa intestinal mediante adhesinas específicas y, por medio de un sistema de secreción tipo iii, causa daño al enterocito y penetra la lámina propia, lo que origina una reacción inflamatoria. Esta unión se ve facilitada cuando la microbiota está desbalanceada o se produce una estasis gastrointestinal. Salmonella tiene predilección por el tejido linfático y es a partir de este cuando se produce la bacteriemia8.
Las heces pueden contener sangre, principalmente cuando hay lesiones del colon8, y pueden ser de aspecto fibrinoso por la presencia de mucosa intestinal necrótica. Los terneros rápidamente presentan debilidad, decaimiento y deshidratación y, a menos que los traten, aquellos que están infectados mueren a los 5-7 días luego del comienzo de la enfermedad.
El primer aislamiento de S. Dublin comunicado en Argentina fue obtenido de terneros clínicamente enfermos, en el contexto de 2brotes ocurridos en los años 1979 y 1981 en terneros de raza Holando Argentino bajo crianza artificial, en la localidad 30 de Agosto, Provincia de Buenos Aires24. En establecimientos con antecedentes de la enfermedad se ha detectado una prevalencia del 8,2% y una tasa de mortalidad del 4%; el 96,8% de los aislamientos correspondieron a S. Dublin y el 3,8% a S. Typhimurium5.
La información disponible referida a la prevalencia de Salmonella y de los diferentes serovares en terneros de crianza artificial en Argentina, así como su asociación con los signos diarreicos, se remite a hallazgos clínicos aislados y no a estudios planificados en establecimientos lecheros, de los que no se disponía de antecedentes referidos a la incidencia de Salmonella spp.
Los objetivos del presente trabajo fueron estudiar la prevalencia de los distintos serovares de Salmonella en terneros con signos diarreicos o sin estos, criados artificialmente en establecimientos lecheros de la región lechera Mar y Sierras, analizar la distribución etaria de los animales positivos, caracterizar los signos diarreicos y analizar y cuantificar la relación entre la detección de Salmonella y la presencia de los distintos signos diarreicos.
Materiales y métodosSe realizó un estudio epidemiológico con diseño transversal y analítico en la cuenca lechera Mar y Sierras, Provincia de Buenos Aires (Argentina), de mayo a octubre de los años 2008 y 2009. El presente trabajo forma parte de uno de mayor envergadura, en el cual se estudiaron los principales agentes causales de diarreas en terneros (rotavirus, coronavirus, Escherichia coli, Salmonella spp., coccidios, Cryptosporidium).
Se muestrearon en total 726 terneros de raza Holando Argentino o Jersey distribuidos en 50 establecimientos lecheros; todos ellos en el período de crianza. Los terneros eran criados en sistemas individuales en el 90% de los casos y los restantes, de manera colectiva.
Para el cálculo del tamaño muestral, se consideró el agente con menor prevalencia esperada, manteniendo constante el error relativo, lo cual redundaría en un tamaño de muestra mayor. Dicho agente fue el coronavirus. El tamaño de muestra fue estimado a partir de una prevalencia esperada del 12%, un error relativo del 20% (error absoluto del 2,4%) y una confianza del 95%. Se consideraron los siguientes estratos etarios (en días de vida): 1-15, 16-30, 31-45, 46-60 y >60 (tabla 1); de 74 animales no se tenía el dato de la edad. Se muestrearon animales con y sin diarrea para analizar estadísticamente la relación entre la detección de los agentes causales de diarrea neonatal y los signos diarreicos.
Los indicadores para considerar que un ternero tenía signos diarreicos fueron los siguientes: aumento del número de deposiciones (en el momento del muestreo, si se observaba más de 2deposiciones frescas), heces de color no característico del ternero en lactancia, heces de consistencia semilíquida o líquida, presencia en las heces de moco o estrías de sangre (o ambos). La presencia de al menos uno de estos signos fue suficiente para ubicar al ternero en este grupo. El ternero sin signos de diarrea se definió como aquel que presentaba heces de consistencia sólida o semisólida, del color característico del ternero en lactancia, exentas de moco o estrías de sangre, sin aumento del número de deposiciones. La caracterización de la materia fecal y la categorización del ternero (con signos diarreicos o sin estos) la realizó la misma persona para los 726 animales.
De cada ternero se registró la edad, la consistencia y el color de la materia fecal, la presencia de moco y de estrías de sangre y la cantidad de deposiciones. Una única muestra de mucosa rectal se tomó de cada animal, con un hisopo estéril. Las muestras fueron procesadas en el Laboratorio de Microbiología Clínica y Experimental del Departamento de Sanidad Animal y Medicina Preventiva de la Facultad de Ciencias Veterinarias de la Universidad Nacional del Centro de la Provincia de Buenos Aires.
Con cada muestra se realizó el procedimiento habitual del laboratorio para el aislamiento de Salmonella. El extremo con algodón del hisopo se colocó en tubos de 10ml que contenían caldo tetrationato base, ya adicionado con inhibidores selectivos: 0,2ml de solución yodada (6g de yodo cristal, 5g de yoduro de potasio y 20ml de agua destilada estéril); 0,1ml de verde brillante (0,1%) y 0,1ml de novobiocina (0,4%). Estos caldos fueron incubados a 37°C durante 7 días. A partir de ellos se realizaron 3subcultivos sucesivos en placas de agar Salmonella-Shigella a los 2, 4 y 7 días. Las placas se incubaron 24h a 37°C. A partir de las colonias medianas redondeadas, de bordes enteros, transparentes, lactosa negativas, con o sin producción de sulfhidrilo, se realizaron extendidos y coloración de Gram. Si el resultado de la observación eran bacilos gram negativos, se subcultivaba en triple azúcar hierro, con incubación de 24h a 37°C. Transcurrido ese lapso, se observó fondo negro por la producción de sulfhidrilo, con el pico de flauta rosado alcalino por la no fermentación de lactosa y sacarosa. A partir de este material se realizaron las siguientes pruebas, cuyos resultados se indican entre paréntesis: oxidasa (−); catalasa (+); reducción de nitratos a nitritos (+); rojo de metilo (+); Voges Proskauer (−); citrato de Simons (+); SIM [sulfhidrilo (+), indol (−), movilidad (+)]; urea de Christensen (−); fenilalanina desaminasa (−); lisina descarboxilasa (+) y orto-nitro-fenil galactosidasa (−).
De los 40 aislamientos identificados como Salmonella spp., 4cepas no se mantuvieron viables, por lo que solo 36 fueron serotipificadas en el Laboratorio de Bacteriología del Departamento de Producción Animal del INTA-Balcarce, utilizando antisueros poli- y monovalentes dirigidos contra antígenos somáticos y flagelares, así como también antígeno de virulencia (Vi). Para ello se siguió el esquema de Kauffman-White, que agrupa a todos los serovares conocidos sobre la base de los componentes antigénicos somáticos O y flagelares H14. La serotipificacion se realizó siguiendo el protocolo y los antisueros utilizados por el Servicio de Enterobacterias del Instituto Nacional de Enfermedades Infecciosas ANLIS Dr. Carlos G. Malbrán, centro de referencia para la Argentina7.
Análisis de datosSe estimó la prevalencia con su intervalo de confianza. Se analizó la relación entre la detección de Salmonella y los signos diarreicos por medio del test de Chi2 y se cuantificó la asociación por medio del odds ratio, con su correspondiente intervalo de confianza del 95%. Se describió la característica de la materia fecal de aquellos terneros que presentaron diarrea y su relación con la presencia de Salmonella como único agente detectado.
ResultadosDurante los años 2008 y 2009 se muestrearon 726 terneros en período de crianza, distribuidos en 50 establecimientos de la cuenca lechera Mar y Sierras. La presencia de Salmonella spp. se evidenció en el 36% de los establecimientos (18/50), de los cuales la mitad presentó más de un ternero positivo, con un máximo de 6.
La prevalencia de Salmonella en terneros fue de 5,5% (40/726), con un intervalo de confianza del 95% (3,78-7,24%). De los 40 terneros con Salmonella, 29 presentaron signos de diarrea. Se detectó Salmonella spp. como único agente causal en 11 terneros. La característica predominante de la materia fecal de estos animales fue la presencia de moco (77,7%); en menor proporción se observó el color no característico del ternero lactante (66,6%), la consistencia anormal (líquida y semilíquida, 44,4%) y las estrías de sangre (11,1%).
Se seleccionaron, en igual proporción, terneros con signos diarreicos y sin estos. Los terneros con signología diarreica tuvieron 5,9 veces más probabilidad de estar infectados con Salmonella spp. que aquellos que no presentaban signos. Chi2p = 0,014; odds ratio = 5,906 (IC 95%: 1,219-28,60).
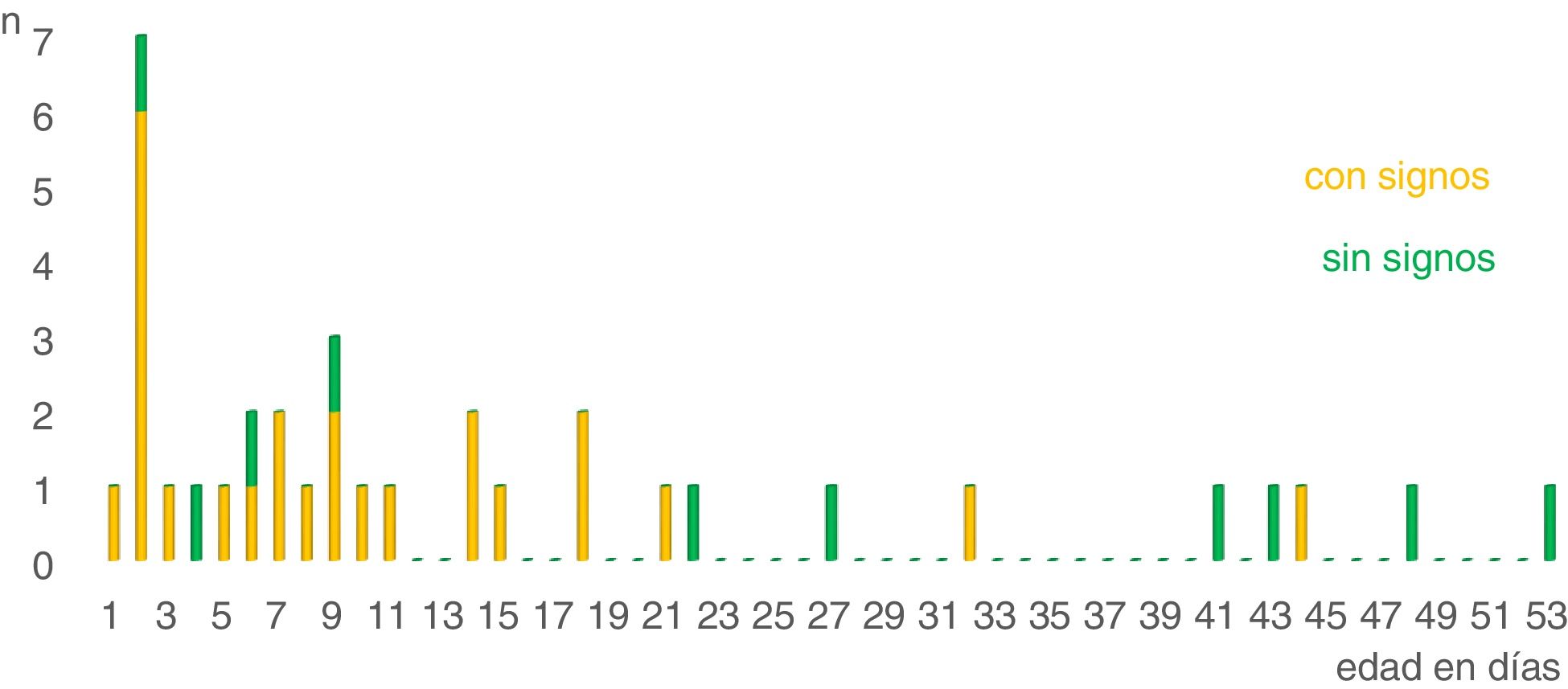
La excreción de este patógeno se detectó en un rango de edad de uno a 53 días de vida, con el segundo día de vida del ternero como el momento de mayor frecuencia. La mediana de la edad de los terneros en los que se detectó Salmonella spp. fue 9 días.
La figura 1 corresponde a un histograma que muestra la cantidad de terneros infectados con Salmonella spp. en relación con la presencia o ausencia de signos diarreicos, en función de la edad. No se pudo conocer la edad de 5 terneros afectados por Salmonella.
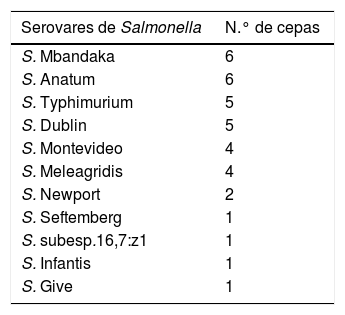
En relación con la caracterización antigénica de las cepas encontradas, se detectaron 11 serovares diferentes de Salmonella (tabla 2) y, de los 9 tambos que tenían más de un ternero positivo, solo 3 demostraron tener el mismo serovar actuante. Las combinaciones halladas fueron las siguientes: S. Typhimurium y S. Senftemberg; S. Meleagridis, S. Mbandaka y S. Infantis; S. Give con S. Mbandaka; S. subesp.16,7:z1 y S. Anatum, S. Meleagridis y S. Mbandaka.
DiscusiónLa presencia de Salmonella en el 36% de los establecimientos lecheros estudiados es relevante y podría ser mayor si el muestreo de cada establecimiento se hubiese realizado periódicamente. En efecto, en un estudio en el cual se muestrearon 110 establecimientos con 5visitas en un año, la prevalencia alcanzó el 90%12.
En este estudio, la prevalencia detectada en terneros fue del 5,5%; cabe destacar que este resultado se obtuvo a partir de un muestreo efectuado en establecimientos sin antecedentes conocidos de la enfermedad, con una selección aleatorizada de los terneros, lo que incluyó tanto animales con signos diarreicos como animales sin estos signos. Este es un punto fundamental para tener en cuenta si se pretende comparar con otras prevalencias publicadas en Argentina, como aquella comunicada por Bellinzoni et al.3, quienes estudiaron terneros diarreicos de hasta aproximadamente un mes de edad (prevalencia reportada: 0,4%), o la que surge del estudio de Bilbao5, que tuvo un diseño longitudinal y comprendió establecimientos con antecedentes de la enfermedad (prevalencia reportada: 8,2%).
En este estudio la mayor prevalencia se observó en las 3 primeras semanas de vida, con una frecuencia elevada en el segundo día de vida y la mediana a los 9 días. Esto es coincidente con los hallazgos de un estudio realizado en California, en donde detectaron que el 58% (43/74) de los terneros de razas lecheras eliminaban Salmonella en las heces dentro de las primeras 24 h de vida y el 85% lo hacía durante la primera semana15. Fossler et al.13 indican mayor prevalencia entre las semanas 2 y 6.
Durante las primeras 24 h de vida, los terneros son más proclives a contraer la infección debido a que su sistema inmunitario aún se encuentra inmaduro, al alto valor del pH abomasal y a la falta de estabilidad de la microbiota intestinal.
El hallazgo de una menor prevalencia de excreción fecal de Salmonella en terneros de mayor edad se puede atribuir a cambios en la composición de la microbiota intestinal, que se observan a medida que los animales avanzan en edad, independientemente de la dieta que reciben17. La microbiota intestinal de terneros de mayor edad, comparada con la del recién nacido, es más eficiente en competir con Salmonella y excluir a este microorganismo4. Otro factor que se debe tener presente es que el sistema inmunitario del ternero madura con la edad y esto reduce la eliminación de Salmonella spp.16.
Los aislamientos de Salmonella de terneros que no están clínicamente afectados pueden provenir de aquellos animales que padecieron la infección con signos clínicos y, una vez recuperados de los signos, continúan eliminando la bacteria; o bien de animales en los que la bacteria no logró una infección activa, pero la eliminan a través de las heces4.
La lectura de esta situación es que los terneros actúan como hospedadores y eliminadores asintomáticos del patógeno10 y, como consecuencia, son una fuente de infección para el resto de los terneros y de contaminación del ambiente. En los sistemas de crianza en los que no se agrupan los terneros por edad, los animales asintomáticos pueden ser fuente de infección para los neonatos, que es la categoría etaria más susceptible de adquirirla.
Es de destacar el hallazgo de 11 serovares diferentes y de ciertas combinaciones entre ellos, debido a que no existen estudios previos en Argentina que hayan documentado la presencia de algunos de estos serovares en terneros durante el período de crianza. A escala mundial, la gama de serovares detectados en rodeos lecheros es muy amplia y variable. Sato et al.21 encontraron 33 serovares en rodeos lecheros de California y como predominante a S. Typhimurium (43,8%), seguida por S. Montevideo (9,6%), S. Muenster (5,1%), S. Anatum (4,7%), S. Dublin (4,7%), S. Give (4,4%), S. Newbrunswick (4,2%), S. Menhaden (3,7%), S. Cerro (3,4%), S. Kentucky (2,4%), S. Agona (2,2%), S. Derby (1,3%) y S. Newport (1,2%). La proporción de los serovares restantes estaba por debajo del 1%. En el sudoeste de Estados Unidos, Edrington et al.11 hallaron en vacas sanas de rodeos lecheros 22 serovares de Salmonella, los más prevalentes fueron S. Mbandaka, S. Montevideo, S. Kentucky, S. Senftenberg y S. Soerenga.
En infecciones de terneros de menos de 30 días, el laboratorio California Animal Health and Food Safety, en Tulare, encontró los serovares S. Typhimurium, S. Newport y S. Dublin como los más prevalentes1. En un estudio retrospectivo de aislamientos de S. enterica realizado por el Laboratorio de Diagnóstico Veterinario de Wisconsin durante los años 2006 a 2015, con aproximadamente 5.000 aislamientos identificados, el serovar más prevalente fue S. Dublin (23%); en orden de importancia le siguieron S. Cerro (16%), S. Newport (14%), S. Montevideo (8%), S. Kentucky (8%) y S. Typhimurium (4%)22.
Van Kessel et al.23 detectaron en muestras de leche de tanque y filtros de leche los serovares S. Cerro, S. Kentucky, S. Muenster, S. Anatum y S. Newport como los más prevalentes. Se ha informado que la habilidad de colonizar el intestino no es igual para los diferentes serovares de Salmonella: esta depende de factores que afectan al número de bacterias y al sitio de colonización18. La tasa de pasaje en el ciego y el colon puede influir en el crecimiento y la multiplicación de la bacteria.
La presencia de moco en la materia fecal fue la característica que predominó en esta investigación; esta característica fue observada en la totalidad de los casos bacteriológicamente positivos en el estudio epidemiológico de Bilbao5. La presencia de heces con cambio en el color y la consistencia (pastosas o fluidas), sumada en ocasiones a la presencia de estrías de sangre, hebras de fibrina o restos de mucosa, es característica de la signología de la salmonelosis9. Algunas de ellas fueron detectadas en el presente trabajo.
Además de eliminar al agente causal de la salmonelosis por las heces, los terneros eliminan este agente infeccioso por la orina y las secreciones orales y nasales, sobre todo, en el inicio de los signos clínicos. La falta de conocimiento acerca de la probabilidad de eliminar Salmonella por la vía oronasal contribuye a propagar la infección a través de los alimentos y los elementos utilizados para proveerlos (botellas, baldes, tubo esofágico), también a través de los utensilios empleados en los tratamientos y las manos de los operarios. Esto compromete la eficacia de los programas de bioseguridad internos de los establecimientos lecheros, con un importante impacto sobre la salud pública1,9.
ConclusiónEn el 36% de los establecimientos lecheros relevados —ubicados todos en la región lechera Mar y Sierras— se detectó la presencia de Salmonella, representada por un total de 11 serovares. Se encontró que su prevalencia era mayor en terneros menores de 21 días de vida y que su detección está asociada a la manifestación de signos diarreicos, entre los cuales la presencia de moco en las heces es el predominante.
FinanciaciónEl presente trabajo ha sido financiado por la Secretaría de Ciencia Arte y Tecnología de la UNCPBA bajo el código 03/H205 e ingresos de actividades de extensión del grupo CRIAR Terneros de la FCV, UNCPBA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos expresar nuestro agradecimiento al personal del laboratorio de Microbiología Clínica y Experimental del Departamento de Sanidad Animal y Medicina Preventiva de la Facultad de Ciencias Veterinarias de la Universidad Nacional del Centro de la Provincia de Buenos Aires por la colaboración en el aporte de insumos y el procesamiento de las muestras; al Laboratorio de Bacteriología, Departamento de Producción Animal INTA Balcarce por la serotipificación de las cepas y a la Dra. María Inés Caffer del Servicio de Enterobacterias del Departamento de Bacteriología de ANLIS (Buenos Aires) por brindar insumos para la serotipificación de las cepas.