Los hongos micorrícicos arbusculares (HMA) de los ambientes áridos y semiáridos son importantes para el desarrollo de las plantas que crecen bajo estrés biótico y abiótico en áreas naturales o en agroecosistemas. Existe poca información sobre la diversidad temporal de los HMA en plantas perennes de ecosistemas áridos en el norte de México. En este estudio se evaluaron la colonización micorrícica y la diversidad temporal de los HMA en la rizosfera de Larrea tridentata, planta perenne de amplia distribución en el Desierto Chihuahuense. Se obtuvieron muestras de la rizosfera y de raíces de 15 plantas, en 3 fechas de muestreo del año 2015. Se encontró un total de 17 especies de HMA, distribuidas en 12 géneros y 7 familias dentro del phylum Glomeromycota. La especie más abundante fue Funneliformis geosporum. Esta especie pertenece a la familia Glomeraceae, la única que estuvo representada con varios géneros en L. tridentata. El mayor porcentaje de micorrización se presentó en febrero, con un 83,22%, en septiembre fue del 75,27% y en mayo del 65,27%. El muestreo realizado en febrero presentó el mayor número de especies (16), seguido por el de mayo (15) y el de septiembre (12). El análisis estadístico mostró diferencias significativas en el número de esporas entre los muestreos de febrero y los de mayo y septiembre.
Arbuscular mycorrhizal fungi (AMF) of arid and semiarid ecosystems are important for the development of plants that grow under biotic stress in wild or in agro-ecosystems. There is little information on the temporal diversity of these organisms in perennial plants from arid ecosystems in northern Mexico. On this study, the mycorrhizal colonization and the temporal diversity of AMF in the rhizosphere of Larrea tridentata, perennial plant abundant in the Chihuahuan Desert region were explored. Samples of the rhizosphere and roots of fifteen plants in each of the three sampling dates during the 2015 year were obtained. A total of 17 species of HMA belonging to 12 genera and 7 families within the phylum Glomeromycota in all three sampling dates were found. Funneliformis geosporum was the dominant species belonging to the family Glomeraceae which possess the highest genera number on L. tridentata. The highest mycorrhization percentage was in February with 83.22, followed by September and May with 75.27 and 65.27%, respectively. A maximum of 16 AM fungal species were isolated and identified from L. tridentata rhizosphere in February, 15 species in May and 12 species in September. Statistical analysis showed significant differences between sampling dates in the spores number.
Los hongos micorrícicos arbusculares (HMA) pertenecen al phylum Glomeromycota39. Son simbiontes obligados que forman una asociación mutualista con las raíces de más del 80% de las plantas terrestres41. Estos organismos proporcionan a las plantas mayor acceso a los nutrientes minerales del suelo, en especial al fósforo y al nitrógeno9,29,41. Además de aumentar la superficie de absorción del agua48, mejoran la resistencia al estrés biótico45 y abiótico20, sobre todo en ecosistemas áridos y semiáridos1.
Como grupo funcional, estos hongos muestran poca o ninguna especificidad respecto de sus plantas hospedantes47. Estas asociaciones plantas-HMA forman comunidades que presentan cambios a través del espacio y del tiempo, que pueden estar determinados por distintos factores en los ecosistemas40. El estudio de la diversidad de los HMA en las comunidades rizosféricas es importante debido a que estos influyen en gran medida en la dinámica de los ecosistemas, ya que promueven la diversidad de las plantas y el mantenimiento de la productividad23. Las especies de HMA varían en su potencial para promover el crecimiento de las plantas y su adaptación a los factores bióticos y abióticos24.
Se han realizado trabajos en los que se analiza la dinámica temporal de los HMA en ecosistemas áridos. Sanchez-Castro et al.34 mostraron la existencia de diferencias intraanuales moderadas pero significativas en la composición de especies en las comunidades de los HMA que colonizan plantas de Rosmarinus officinalis y Timo zygis en un ecosistema mediterráneo semiárido del sureste de España. Carballar-Hernández et al.8 reportaron cambios de la diversidad de HMA en la rizosfera de Agave potatorum a lo largo de las distintas estaciones del año en un ecosistema semiárido en el estado de Oaxaca, México.
Debido a que no existe información sobre la distribución, la abundancia y la dinámica temporal de las comunidades de los HMA en ambientes áridos y semiáridos del Desierto Chihuahuense, en el norte de la República Mexicana, el objetivo de este estudio fue evaluar la variación temporal de la diversidad y el grado de colonización micorrícica en las raíces de Larrea tridentata (Sesse & Mocino ex DC) Coville.
L. tridentata es un arbusto de la familia Zygophyllaceae que predomina en las zonas de desierto del norte de México, en los estados de San Luis Potosí, Coahuila, Chihuahua, Durango, Sonora, Zacatecas, Baja California Norte y Baja California Sur, y también en el suroeste de los Estados Unidos, en Arizona, California, Nevada, Texas y Nuevo México33, donde forma islas de fertilidad que influyen en la abundancia y distribución de plantas anuales nativas y no nativas dentro de estos ecosistemas35.
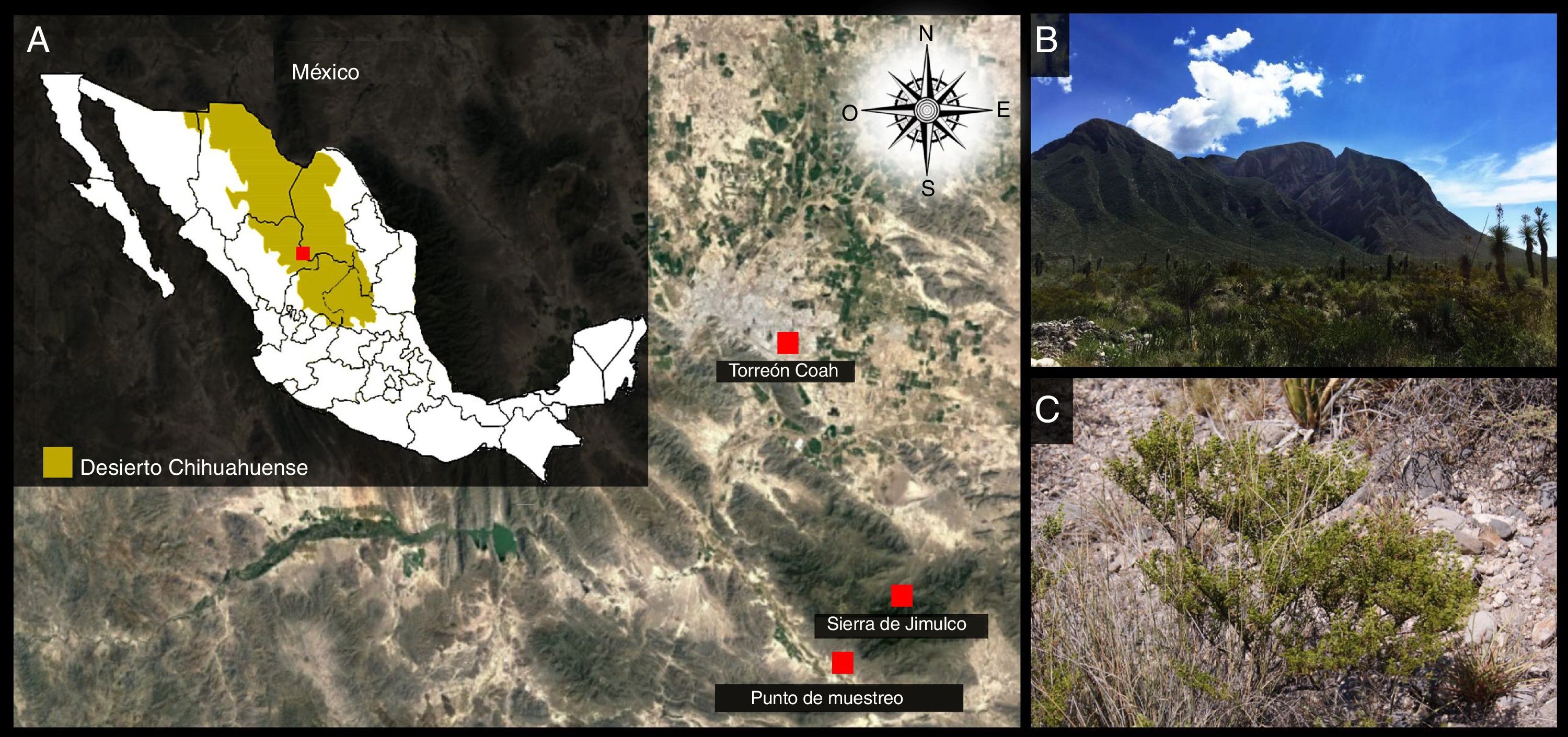
Materiales y métodosSitio de muestreoEl estudio se realizó en la Reserva Ecológica Municipal Sierra y Cañón de Jimulco (REM-SCJ), ubicada dentro del Municipio de Torreón, en la parte suroeste del estado de Coahuila de Zaragoza, entre los paralelos 24°56’18” y 25°17’52” de latitud norte y los meridianos 103°30’34” y 103°05’15” de longitud oeste, en el centro del Desierto Chihuahuense19 (fig. 1). El clima en la zona es de 2 tipos principales: seco o estepario (BSo) y muy seco o desértico (BW). Este último es el que domina dentro de la reserva, ocupando el 56,63% de su superficie; se localiza sobre sierras, valles, bajadas y llanuras. El clima de tipo seco o estepario cubre la superficie restante (43,37%) y se localiza sobre todo en la parte central de la reserva, distribuido principalmente sobre sierras en una franja horizontal de este a oeste5. El tipo de vegetación presente en el área corresponde a un matorral semidesértico xerófilo, dominado en este caso por L. tridentata. Las asociaciones vegetales incluyen la presencia de especies como Fouqueria splendens, Jatropha dioica, Prosopis glandulosa, Acacia berlandieri, Lippia graveolens, Euphorbia antisyphilitica, Yucca carnerosana y Agave lecheguilla, entre otras33.
MuestreosSe seleccionaron al azar 15 individuos de L. tridentata de tamaño semejante, separados de otras plantas para asegurar que la rizobiota proviniera del suelo circundante a esos ejemplares. Se recolectaron raíces y suelo a una profundidad de entre 2 y 15cm. Los muestreos se realizaron en 3 meses distintos del 2015: febrero, mayo (temporada de sequía) y septiembre (temporada de lluvias). Es importante resaltar que de acuerdo con los registros del Servicio Meteorológico Nacional, en el mes de febrero de ese año se presentaron lluvias atípicas en el área de muestreo.
El suelo se pasó por un tamiz de 2mm de malla y se secó a temperatura ambiente durante 72h, para luego almacenarse en bolsas de polietileno y refrigerarse a 4°C hasta su procesamiento. Además, se tomaron 3 muestras de 1000g de suelo para el análisis físico y químico.
Análisis físico y químico del sueloLa textura se determinó por el método del hidrómetro de Bouyoucos y el pH con un medidor de electrodo de vidrio en una relación de suelo-agua 1-2,5 (p/v). El porcentaje de carbono total y la materia orgánica se determinó por el método de oxidación húmeda de Walkley y Black46, mientras que el porcentaje total de nitrógeno se midió por el método de micro-Kjeldahl. El fósforo disponible se ensayó por el método de Bray y Kurtz6.
Análisis del porcentaje de micorrizaciónLas raíces frescas se lavaron con agua corriente para eliminar cualquier residuo de suelo. Luego fueron clareadas usando KOH al 10% y teñidas con azul de tripano. Se examinaron 10 segmentos de aproximadamente 1cm de largo. Para realizar la evaluación de las estructuras morfológicas características de los HMA, se realizaron observaciones en el microscopio óptico a través del objetivo de 40× empleando el método de Phillips y Hayman31. Para ello se efectuaron 3 pasajes equidistantes por laminilla. Al revisar un campo óptico, se le otorgó el valor de 1 para la evaluación total toda vez que se encontró alguna estructura de los HMA (hifas, vesículas o arbúsculos), independientemente de la intensidad de micorrización7.
Determinación del número de esporas y morfo-especies de HMASe extrajeron las esporas de HMA de 50g de suelo seco de la rizosfera de cada planta muestreada. Para ello se utilizó el método de tamizado en húmedo y decantación, seguido por centrifugación en gradiente de sacarosa al 20 y 60%18. Las esporas sanas se colocaron en una placa de Petri para la observación directa bajo un microscopio estereoscópico (40×), en donde se separaron sobre la base de sus características morfológicas; posteriormente, se determinó el número de esporas. Para la identificación, cada tipo de esporas se montó en alcohol polivinílico, ácido láctico y glicerol (PVLG)25 y reactivo de Melzer7 en proporción 1:1 (v/v). La identificación de las especies de HMA se realizó con base en las características morfológicas de las esporas, como describen Schenck y Perez36. Las características observadas se registraron, compararon y contrastaron con las que aparecen en las descripciones disponibles en los sitios web de la Colección Internacional de Cultivos de HMVA (http://invam.wvu.edu/) y en la Colección de Glomeromycota del Profesor Janusz Blaszkowski, taxónomo de Glomeromycota del Departamento de Patología de Plantas de la Universidad de Agronomía de Szczecin, Polonia (http://www.zor.zut.edu.pl/Glomeromycota/Taxonomy.html).
Para la designación de las especies se usó la nomenclatura de Glomeromycota propuesta por Schüßler et al.38 y Schüßler y Walker39, disponible en la página web Phylogeny and taxonomy of Glomeromycota (arbuscular mycorrhizal [AM] and related fungi [http://www.amf-phylogeny.com/]). Las esporas se analizaron bajo microscopio óptico (40× y 100×) con contraste de interferencia de Nomarski; las dimensiones se obtuvieron con una reglilla micrométrica acoplada al ocular (Nikon Optiphot II, Nikon, Tokio, Japón).
Análisis ecológicoLos parámetros ecológicos se determinaron para cada una de las fechas de muestreo y también como un resultado global. Los parámetros describen la estructura de las comunidades de los HMA comprendiendo la riqueza de especies, la abundancia de esporas, la frecuencia de aislamiento15, la abundancia relativa y los índices de equidad y dominancia, además de la biodiversidad entre las fechas de muestreo27.
La riqueza es el número total de especies identificadas (S). La abundancia es el número total de esporas (n E) de las especies de los HMA encontradas en 50g de suelo rizosférico. La frecuencia de aislamiento (Fi) de cada especie i en cada una de las fechas de muestreo se calculó de acuerdo con la siguiente ecuación:
Fi=Ji/K,
donde Ji es el número de muestras en las que se presentó la especie i y K es el número total de muestras15.
La abundancia relativa (pi) es el número de esporas de cada una de las morfoespecies dividido entre el total de esporas y multiplicado por 100; este parámetro indica la capacidad de esporulación de cada una de las especies de los HMA27.
La diversidad se calculó por el índice de Shannon-Wiener que expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra. Se calculó de acuerdo con Magurran27 aplicando la siguiente fórmula:
H¿=-Σpi ln pi,
donde pi es la abundancia relativa de cada especie identificada, y se calcula por la siguiente fórmula: pi=ni/N, donde ni es el número de esporas de una especie y N es el número total de esporas en todas las muestras.
El índice de Pielou mide la proporción de la diversidad observada en cada fecha de muestreo con relación a la máxima diversidad esperada. Su valor va de 0 a 1, de tal forma que 1 corresponde a situaciones donde todas las especies son igualmente abundantes y viene dada por:
J‘=H’/H’máx,
donde H’máx es el valor máximo de H, se estima por: H’máx=Ln(S)27.
El índice de dominancia de Simpson manifiesta la probabilidad de que 2 individuos tomados al azar de una muestra sean de la misma especie y se calcula mediante la siguiente fórmula:λ= Σpi2
El índice de Sörensen fue usado para determinar la similitud entre las composiciones de las comunidades de los HMA de las 3 fechas de muestreo (diversidad beta), el índice cualitativo de Sörensen se calculó mediante la siguiente fórmula:
IS=2C/A+B,
donde A y B son el número de especies en las muestras A y B, respectivamente, y C es el número de especies compartidas por las 2 muestras. El índice de Sörensen cuantitativo se calculó por medio de:
IScuant=2pN/aN+bN,
donde aN y bN son el número total de esporas en las muestras A y B, respectivamente, y pN es la sumatoria de la abundancia más baja de cada una de las especies compartidas por las 2 muestras27.
Evaluación del esfuerzo de muestreoLa evaluación del esfuerzo de muestreo y la comparación de la riqueza entre fechas de muestreo se efectuaron mediante el uso de modelos ajustados a curvas de acumulación de especies; se utilizaron los estimadores de diversidad no paramétricos Chao2 y Jackknife de primer orden27, cuyo objetivo es conocer el total de especies de una comunidad, mostrando el número de especies acumuladas conforme se aumenta el esfuerzo de muestreo, hasta un máximo donde no se registran nuevas especies (asíntota). La expresión matemática del modelo de Chao2 es la siguiente:
Chao2=Sobs+(L2/2M),
donde Sobs es el número de especies conocidas; L=número de especies que ocurren solo en una muestra (singletons: especies con un individuo); y M=número de especies que ocurren exactamente en 2 muestras (doubletons: especies que cuentan con 2 individuos).
La expresión matemática del modelo de Jackknife es:
Jack 1=Sobs+L (m−1/m),
donde m=número de muestras. Para el cálculo de la riqueza y abundancia de especies se usó el modelo de Mao-Tau y en la construcción de la curva de acumulación se usó el programa EstimateS 8.2. Las gráficas se editaron con líneas suavizadas para una mejor representación13.
Análisis estadísticoLos análisis de varianza (ANOVA) y la prueba de comparación de medias por el método de Tukey al 0,05 de probabilidad de error se utilizaron para examinar la relación entre el número de especies, el número de esporas, las características físicas y químicas del suelo de las comunidades de los HMA. Todos los análisis se realizaron utilizando el software estadístico SPSS versión 17.0 para Windows42.
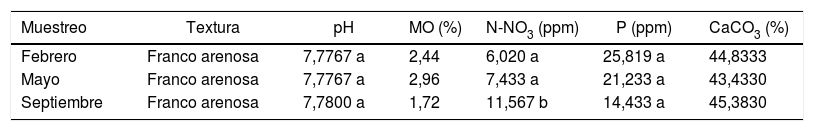
Resultados y discusiónAnálisis físicos y químicos del sueloLa mayoría de los parámetros físicos y químicos de los suelos estudiados no presentaron diferencias significativas (p<0,05) entre las 3 fechas de muestreo (tabla 1). Los suelos son suelos calcáreos, medianamente alcalinos, no salinos y no sódicos. Los niveles de nitratos fueron bajos y los de fósforo medios. Solo es significativa la diferencia en el nivel de nitratos del muestreo realizado en septiembre, que tuvo un incremento del 92,14% con respecto al contenido de febrero y del 55,58% en comparación con el de mayo (tabla 1). Al respecto, Zheng et al.50 reportaron que no existe gran influencia del nitrógeno sobre la diversidad de las comunidades de HMA.
Caracterización física y química del suelo rizosférico de Larrea tridentata
| Muestreo | Textura | pH | MO (%) | N-NO3 (ppm) | P (ppm) | CaCO3 (%) |
|---|---|---|---|---|---|---|
| Febrero | Franco arenosa | 7,7767 a | 2,44 | 6,020 a | 25,819 a | 44,8333 |
| Mayo | Franco arenosa | 7,7767 a | 2,96 | 7,433 a | 21,233 a | 43,4330 |
| Septiembre | Franco arenosa | 7,7800 a | 1,72 | 11,567 b | 14,433 a | 45,3830 |
Diferentes letras indican diferencias estadística significativas (p<0,05).
MO: materia orgánica; N-NO3: nitrógeno como nitratos; P: fósforo; CaCO3: carbonatos totales.
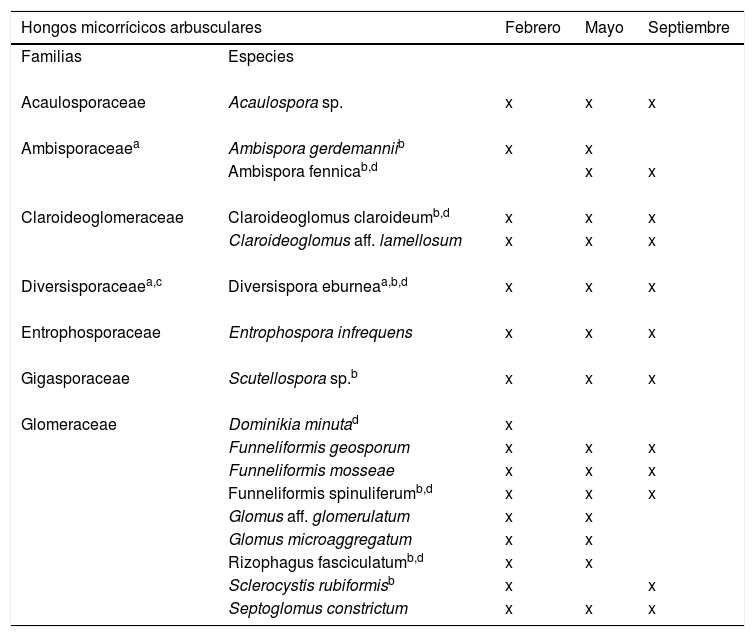
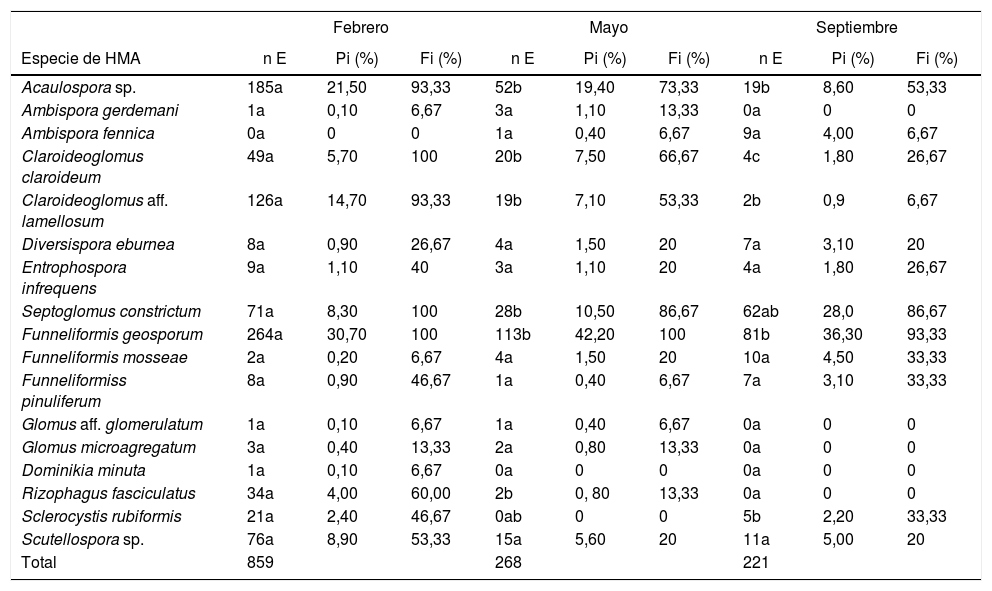
De las 17 morfoespecies aisladas, 15 fueron identificadas a nivel de especie y 2 a nivel de género (tabla 2). Se encontró que estas pertenecían a 7 familias (Acaulosporaceae, Ambisporaceae, Diversisporaceae, Entrophosporaceae, Gigasporaceae, Claroideoglomeraceae y Glomeraceae). Los géneros encontrados fueron Funneliformis, Glomus, Dominikia, Septoglomus, Ambispora, Claroideoglomus, Acaulospora, Diversispora, Entrophospora, Rizophagus, Sclerocystis y Scutellospora. La mayor riqueza específica de HMA se obtuvo en febrero (16 especies); en mayo se encontraron 15 especies y en septiembre 12 especies. La familia Glomeraceae fue la mejor representada con 9 especies que constituyeron el 52,94% del total, seguida por Ambisporaceae y Claroideoglomeraceae, con 11,76% cada una.
Especies de HMA identificadas en suelo rizosférico de Larrea tridentata
| Hongos micorrícicos arbusculares | Febrero | Mayo | Septiembre | |
|---|---|---|---|---|
| Familias | Especies | |||
| Acaulosporaceae | Acaulospora sp. | x | x | x |
| Ambisporaceaea | Ambispora gerdemanniib | x | x | |
| Ambispora fennicab,d | x | x | ||
| Claroideoglomeraceae | Claroideoglomus claroideumb,d | x | x | x |
| Claroideoglomus aff. lamellosum | x | x | x | |
| Diversisporaceaea,c | Diversispora eburneaa,b,d | x | x | x |
| Entrophosporaceae | Entrophospora infrequens | x | x | x |
| Gigasporaceae | Scutellospora sp.b | x | x | x |
| Glomeraceae | Dominikia minutad | x | ||
| Funneliformis geosporum | x | x | x | |
| Funneliformis mosseae | x | x | x | |
| Funneliformis spinuliferumb,d | x | x | x | |
| Glomus aff. glomerulatum | x | x | ||
| Glomus microaggregatum | x | x | ||
| Rizophagus fasciculatumb,d | x | x | ||
| Sclerocystis rubiformisb | x | x | ||
| Septoglomus constrictum | x | x | x | |
La presencia predominante de la familia Glomeraceae hallada en este estudio coincide con lo observado por de Souza et al.16 en Brasil para Mimosa tenuiflora, una fabácea de ecosistemas semiáridos; también con los resultados obtenidos por Carballar-Hernández et al.8 para A. potatorum en ecosistemas semiáridos del estado de Oaxaca, México y con los de Bai et al.4, quienes encontraron una diversidad de 13 especies, la mayoría de ellas de la familia Glomeraceae, en un estudio de la influencia del pastoreo en plantas del desierto.
Asimismo, estos hallazgos concuerdan con los de Chaudhary et al.10, quienes reportaron 42 especies de HMA en plantas del género Artemisia —familia Asteraceae— en el sur de Utah (EE. UU.); el 50% de aquellas eran miembros de la familia Glomeraceae. Estos autores propusieron que los ecosistemas áridos se caracterizan por presentar una alta diversidad de HMA, pero una baja biomasa fúngica.
En el presente estudio se reportan 2 nuevas familias (Ambisporaceae y Diversisporaceae) y 7 nuevos géneros (Ambispora, Claroideoglomus, Diversispora, Scutellospora, Funneliformis, Rizophagus y Sclerocystis) para el área del Desierto Chihuahuense, tomando como referencia lo reportado por Pezzani et al.30. Además se reportó una nueva familia (Diversisporaceae) y 5 nuevas especies (Ambispora fennica, Claroideoglomus claroideum, Diversispora eburnea, Dominikia minuta, Funneliformis spinuliferum y Rizophagus fasciculatum) para el tipo de vegetación de matorral xerófilo, tomando como referencia lo reportado por Montaño et al.28 y Chimal-Sánchez et al.11.
Abundancia de esporas de HMASe apreciaron diferencias significativas (p<0,05) en el número de esporas aisladas de la rizosfera de L. tridentata en el muestreo de febrero con respecto a los de mayo y septiembre (tabla 3). El mayor número de esporas se aisló en febrero (859 esporas) y el menor en septiembre (221 esporas). Las especies con mayor abundancia de esporas en las 3 fechas de muestreo fueron Funneliformis geosporum y Acaulospora sp. A estas le siguieron en abundancia Claroideoglomus aff. lamellosum en febrero; C. claroideum en mayo y Septoglomus constrictum en septiembre. La especie más abundante en todas las fechas fue F. geosporum; esta especie además presentó diferencias significativas (p<0,05) al comparar fechas de muestreo: en febrero se contó un mayor número de esporas (264) en relación con mayo (113 esporas) y septiembre (81 esporas) (tabla 3). Esta especie fue la de mayor abundancia relativa en todas las fechas de muestreo, con una frecuencia de aislamiento igual o mayor del 93,33%. Estos resultados coinciden con los encontrados por Carballar-Hernández et al.8 para A. potatorum en ecosistemas semiáridos del estado de Oaxaca, México.
Variables de abundancia y riqueza de las morfoespecies de HMA presentes en Larrea tridentata
| Febrero | Mayo | Septiembre | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Especie de HMA | n E | Pi (%) | Fi (%) | n E | Pi (%) | Fi (%) | n E | Pi (%) | Fi (%) |
| Acaulospora sp. | 185a | 21,50 | 93,33 | 52b | 19,40 | 73,33 | 19b | 8,60 | 53,33 |
| Ambispora gerdemani | 1a | 0,10 | 6,67 | 3a | 1,10 | 13,33 | 0a | 0 | 0 |
| Ambispora fennica | 0a | 0 | 0 | 1a | 0,40 | 6,67 | 9a | 4,00 | 6,67 |
| Claroideoglomus claroideum | 49a | 5,70 | 100 | 20b | 7,50 | 66,67 | 4c | 1,80 | 26,67 |
| Claroideoglomus aff. lamellosum | 126a | 14,70 | 93,33 | 19b | 7,10 | 53,33 | 2b | 0,9 | 6,67 |
| Diversispora eburnea | 8a | 0,90 | 26,67 | 4a | 1,50 | 20 | 7a | 3,10 | 20 |
| Entrophospora infrequens | 9a | 1,10 | 40 | 3a | 1,10 | 20 | 4a | 1,80 | 26,67 |
| Septoglomus constrictum | 71a | 8,30 | 100 | 28b | 10,50 | 86,67 | 62ab | 28,0 | 86,67 |
| Funneliformis geosporum | 264a | 30,70 | 100 | 113b | 42,20 | 100 | 81b | 36,30 | 93,33 |
| Funneliformis mosseae | 2a | 0,20 | 6,67 | 4a | 1,50 | 20 | 10a | 4,50 | 33,33 |
| Funneliformiss pinuliferum | 8a | 0,90 | 46,67 | 1a | 0,40 | 6,67 | 7a | 3,10 | 33,33 |
| Glomus aff. glomerulatum | 1a | 0,10 | 6,67 | 1a | 0,40 | 6,67 | 0a | 0 | 0 |
| Glomus microagregatum | 3a | 0,40 | 13,33 | 2a | 0,80 | 13,33 | 0a | 0 | 0 |
| Dominikia minuta | 1a | 0,10 | 6,67 | 0a | 0 | 0 | 0a | 0 | 0 |
| Rizophagus fasciculatus | 34a | 4,00 | 60,00 | 2b | 0, 80 | 13,33 | 0a | 0 | 0 |
| Sclerocystis rubiformis | 21a | 2,40 | 46,67 | 0ab | 0 | 0 | 5b | 2,20 | 33,33 |
| Scutellospora sp. | 76a | 8,90 | 53,33 | 15a | 5,60 | 20 | 11a | 5,00 | 20 |
| Total | 859 | 268 | 221 | ||||||
Se comparó el n E entre las diferentes fechas de muestreo; diferentes letras indican diferencia significativa (p<0,05).
n E: número de esporas; Pi: abundancia relativa; Fi: frecuencia de aislamiento.
Lo anterior indica que F. geosporum es una especie de hongo que produce muchas esporas de manera sostenida, fenómeno que le permite tener una distribución temporal amplia dentro del ecosistema; esta esporulación constante puede explicarse por el hecho de que los miembros de la familia Glomeraceae colonizan con éxito raíces de nuevos hospedantes a partir de diferentes tipos de propágulos (esporas, fragmentos de raíz micorrizada y micelio externo)44, lo que les suministra recursos para la producción constante y cuantiosa de esporas. Adicionalmente, se ha reportado que esta especie de HMA se adapta fácilmente a diferentes condiciones ambientales y a sus cambios bruscos22.
Porcentaje de micorrizaciónEl tipo de micorrización en L. tridentata es Arum debido a la presencia de arbúsculos17. El porcentaje de micorrización más alto se presentó en febrero con un 83,22% y el más bajo en mayo con un 65,48%. Estos resultados concuerdan con los obtenidos por Collier et al.12 para la misma especie en el norte del Desierto Chihuahuense, quienes hallaron un 72% de micorrización y con los obtenidos por Zhang et al.49, que fueron del 70% en plantas de Robinia pseudoacacia en zonas semiáridas. No obstante, difieren de los informados por Pezzani et al.30 en gramíneas del Desierto Chihuahuense, donde el mayor porcentaje de colonización micorrícica fue del 33%.
En el mismo sentido, fueron los resultados del trabajo realizado en L. tridentata durante un periodo de 2 años en el desierto de Mojave donde los valores máximos de colonización fueron del 30-40% después de la precipitación de verano y otoño, aunque se mantuvieron por debajo del 20% durante todo el resto del tiempo2.
Los resultados obtenidos en este estudio pueden explicarse por la disponibilidad de agua en la región durante el año de muestreo, ya que hubo una acumulación de 87,16mm de lluvia en el mes de febrero, precipitación inusual para este ecosistema, que en promedio presenta 210mm al año. Al respecto, se ha documentado que la colonización se incrementa durante la temporada de lluvias debido a que la humedad favorece la germinación de esporas de HMA y el crecimiento hifal21,32.
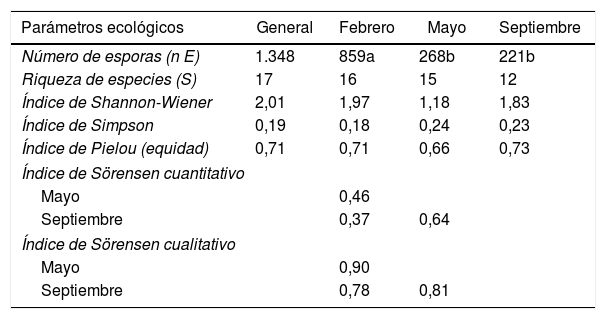
Parámetros ecológicosLa diversidad estimada a través del índice de Shannon-Wiener presentó un valor más alto para el muestreo de febrero con relación a los de mayo y septiembre (tabla 4). Eso indica que la comunidad fue más diversa en ese momento del año. En septiembre, la comunidad de HMA presentó mayor equidad y baja dominancia. La dominancia (índice de Simpson) fue mayor en mayo, con 0,24, y menor en febrero, con 0,18 (tabla 4); estos resultados coinciden con los reportados por Carballar-Hernández et al.8, quienes evaluaron la diversidad de HMA asociados a la rizosfera de A. potatorum en Oaxaca, México8.
Parámetros ecológicos de las comunidades de HMA presentes en la rizosfera de Larrea tridentata
| Parámetros ecológicos | General | Febrero | Mayo | Septiembre |
|---|---|---|---|---|
| Número de esporas (n E) | 1.348 | 859a | 268b | 221b |
| Riqueza de especies (S) | 17 | 16 | 15 | 12 |
| Índice de Shannon-Wiener | 2,01 | 1,97 | 1,18 | 1,83 |
| Índice de Simpson | 0,19 | 0,18 | 0,24 | 0,23 |
| Índice de Pielou (equidad) | 0,71 | 0,71 | 0,66 | 0,73 |
| Índice de Sörensen cuantitativo | ||||
| Mayo | 0,46 | |||
| Septiembre | 0,37 | 0,64 | ||
| Índice de Sörensen cualitativo | ||||
| Mayo | 0,90 | |||
| Septiembre | 0,78 | 0,81 | ||
Diferentes letras indican diferencia significativa (p<0,05) entre distintas fechas de muestreo.
En cuanto a la equidad (índice de Pieluo), el muestreo de septiembre donde la comunidad de los HMA presentó un valor mayor. Estos resultados coinciden con los reportados por Carballar-Hernández et al.8. Aunque difieren de los reportados por Dandan y Zhiwei15 en una comunidad de HMA al sureste de China.
La evaluación de la diversidad beta por medio del índice Sörensen (tabla 4) mostró que las comunidades de febrero y septiembre presentaron mayor diferencia en la composición de especies, mientras que las de mayo y septiembre presentaron mayor similitud entre sí. Estos resultados difieren de los obtenidos por Carballar-Hernández et al.8, los cuales reportaron mayor uniformidad entre las comunidades. Ya han sido documentados cambios en la diversidad de los HMA relacionados con factores espaciales y temporales3,15,40.
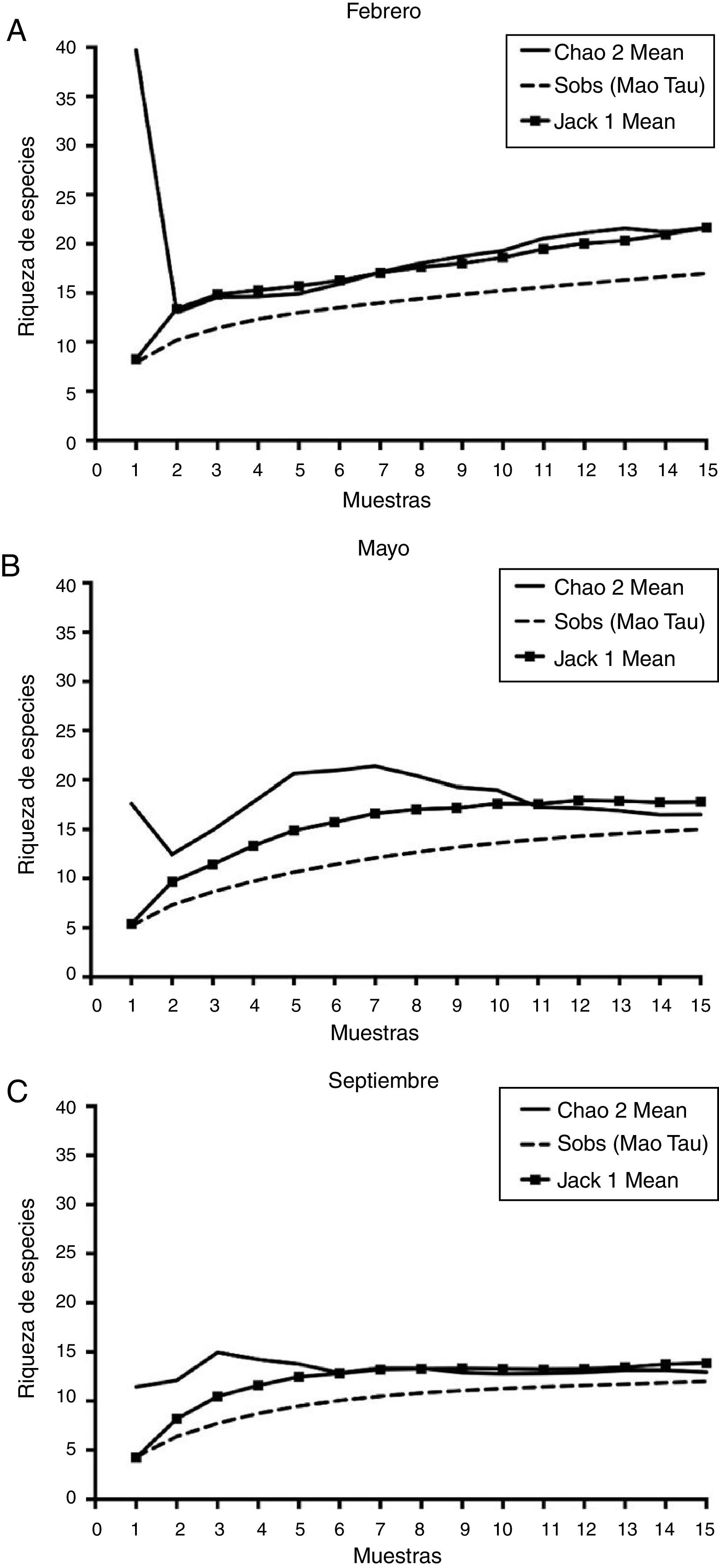
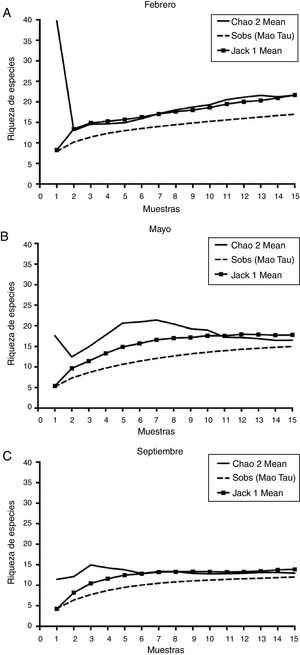
Curvas de acumulación de especiesLos valores de riqueza de HMA estimados por el método de Jackknife 1 revelaron que los muestreos no representaron adecuadamente la riqueza de los HMA, excepto los de septiembre. El modelo de Jackknife para la acumulación de especies de HMA mostró un aumento en el número de especies en los muestreos de febrero y mayo (fig. 2). Para el mes de febrero, con las 15 muestras de suelo rizosférico no se alcanzó la asíntota en la acumulación de especies, es decir, la riqueza de especies es mayor que lo encontrado. En contraste, el muestreo de mayo se estabilizó a partir de la muestra 13 y el de septiembre a partir de la muestra 9. El estimador Chao2 predijo 22 especies para el muestreo de febrero, 17 para el de mayo y 13 para el de septiembre. Estos modelos se han aplicado en algunos estudios de HMA sobre diversidad14,26,37,43.
Las curvas de acumulación de especies de HMA destacan la importancia de la toma de muestras en diferentes fechas e indican el potencial de encontrar especies raras con un mayor esfuerzo de muestreo y que, sumadas a aquellas que son comunes y a las que no son tan raras, integran los diferentes conjuntos de especies de las comunidades de HMA a lo largo del tiempo en ambientes particulares, en este caso, en ecosistemas semiáridos. La importancia de los ensamblajes de especies de HMA radica en que diferentes especies, además de cumplir distintas funciones, pueden ser más o menos eficaces, de manera que se complementan entre sí.
En conclusión, la riqueza específica y la abundancia de las especies de HMA varían a lo largo del año en la rizosfera de L. tridentata, lo que se traduce en un cambio en la diversidad. La mayor abundancia de especies de HMA de esporas pequeñas puede deberse a que estas tienen más probabilidad de sobrevivencia en ambientes áridos y semiáridos. Los altos porcentajes de micorrización en L. tridentata durante todo el año indican que dadas las condiciones de aridez, la micorrización es de gran importancia para la adaptación de esta planta a tales ambientes, lo que, aunado a la diversidad y abundancia de esporas encontradas en su rizosfera, refuerza la importancia de L. tridentata como isla de fertilidad para la preservación de los ecosistemas áridos y semiáridos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Biol. Ruben Palacio Rodriguez y Biol. Benjamin Nava Reyes, por la asistencia técnica brindada en campo. A la Ing. Karla Adriana Tungui Calderon por el apoyo en el aislamiento de esporas.