Streptococcus equi subsp. equi es el agente etiológico de la adenitis equina, una enfermedad infecciosa que afecta al tracto respiratorio superior y linfonódulos de cabeza y cuello de equinos. La terapia antimicrobiana tradicional incluye como antibiótico de primera elección a la penicilina G (PEN), a la que los estreptococos suelen ser sensibles. El objetivo de este trabajo fue estudiar el perfil de sensibilidad a distintos antimicrobianos de cepas de S. equi que circulan en la provincia de Buenos Aires, Argentina. Se estudiaron 92 aislamientos mediante el método de difusión con discos; los antimicrobianos evaluados fueron PEN, cefotaxima, eritromicina, tetraciclina, enrofloxacina (ENR), trimetroprima-sulfametoxazol (TMS), ciprofloxacina, clindamicina (CLI), estreptomicina (STR) y florfenicol. Se determinó la concentración inhibitoria mínima (CIM) de la PEN y de aquellos antimicrobianos frente a los cuales S. equi mostró resistencia o sensibilidad intermedia. Se obtuvieron altos porcentajes de sensibilidad a todos los antimicrobianos por el método de difusión y valores de CIM por debajo de los puntos de corte para PEN, TMS y CLI. Se identificaron cepas resistentes a ENR y STR, con CIM50, CIM90 y rangos de CIM por encima de los puntos de corte. Los resultados confirman que la PEN podría utilizarse empíricamente, ya que las cepas circulantes en Buenos Aires no mostraron resistencia a este antimicrobiano. Se enfatiza en la relevancia del uso racional de los antibióticos para lograr éxito terapéutico, evitar la cronicidad, la recidiva de infecciones y la aparición de resistencia.
Streptococcus equi subsp. equi is the etiologic agent of strangles, an infectious disease affecting the upper respiratory tract and head and neck lymph nodes of equines. Routine antimicrobial therapy includes penicillin (PEN) as antibiotic of first choice. Streptococci are usually susceptible to PEN and only a few antimicrobial studies had been performed. The aim of this work was to study the antimicrobial susceptibility profile of S. equi from Buenos Aires, Argentina. Ninety-two isolates were studied by the single disk method to PEN, cefotaxime, erythromycin (ERY), tetracycline, enrofloxacin (ENR), trimethoprim sulfamethoxazole (TMS), ciprofloxacin, clindamycin (CLI), streptomycin (STR) and florfenicol. Minimum inhibitory concentration (MIC) to PEN and antibiotics with resistance and intermediate susceptibility were tested. High percentages of susceptibility were obtained by the disk diffusion method and MIC values of PEN, TMS and CLI were found to be under the breakpoint values. Resistant strains of ENR and STR with MIC50, MIC90 and MIC ranges above breakpoints were identified. These findings confirm that PEN may be used empirically because resistant strains were not found in Buenos Aires. Emphasis is placed on the rational use of antibiotics to achieve therapeutic success, to prevent chronicity, recurrence of infections and the emergence of resistance.
Streptococcus equi subsp. equi es el agente etiológico de la adenitis equina, una enfermedad infecciosa mundialmente distribuida que afecta al tracto respiratorio superior y los linfonódulos de cabeza y cuello, principalmente de animales jóvenes3,19,20. La bacteria puede permanecer durante un largo período en la nasofaringe y las bolsas guturales de caballos recuperados de la enfermedad, los que actúan como portadores y fuentes de infección para otros equinos susceptibles3,4,13-15.
El tratamiento de la adenitis equina es controvertido, pero a pesar de las distintas opiniones, se recomiendan medidas terapéuticas según el estadio de la enfermedad2,3,9,17,19,20. Lo que se busca es controlar la transmisión de la enfermedad y eliminar la infección, al mismo tiempo que se genera inmunidad postinfección.
La terapia antimicrobiana tradicional incluye como antibióticos de primera elección a los β-lactámicos, principalmente la penicilina G (PEN)2,3,9,12,17,20, con muy buena respuesta clínica. Otros grupos de antimicrobianos utilizados son las sulfas potenciadas, como la trimetroprima-sulfametoxazol (TMS), y los macrólidos, como la eritromicina (ERY)12,17,20.
Ante un brote de la enfermedad, los animales que comiencen con hipertermia y decaimiento deben ser aislados y recibir tratamiento antibiótico durante 3-5 días para prevenir la abscedación de los linfonódulos, pero en aquellos animales que ya se presentan abscesos, no se recomienda la terapia antimicrobiana, ya que solo detiene la respuesta inmunitaria, pero una vez suspendido el tratamiento, la abscedación retorna20.
Una de las complicaciones más graves de la adenitis equina es la diseminación linfohemática de la bacteria, lo que produce un cuadro conocido como «adenitis bastarda», con formación de abscesos en diferentes órganos y tejidos2,19,20. Sea cual sea la ubicación de la infección metastásica, el tratamiento antibiótico sistémico está siempre indicado.
Por otro lado, los animales recuperados deben ser examinados para identificar a los portadores y, una vez detectados, es importante aislarlos y tratarlos para eliminar al agente13-15,19. En portadores, las masas de pus (denominadas condroides) que existen en las bolsas guturales deben eliminarse por vía endoscópica o quirúrgica, ya que la llegada del antibiótico allí es limitada. En caballos con empiema de las bolsas, la secreción purulenta debe eliminarse para garantizar el éxito del tratamiento. En todo portador se recomienda la utilización local de la PEN gelificada, además de la antibioticoterapia sistémica2,9,20.
Si bien los ensayos de sensibilidad in vitro no se realizan de forma rutinaria para este microorganismo, dada su usual sensibilidad a la PEN, se han realizado algunos estudios en otros países8,10-12. Es así como según datos de los laboratorios de microbiología clínica de las Universidades de Pennsylvania y de Guelph (1993-1997)17, los aislamientos de Streptococcus spp. β-hemolíticos del grupo C de equinos presentaron elevados porcentajes de sensibilidad a numerosos fármacos, entre los que se destacan la PEN, la ampicilina, la oxacilina, la cefalotina, el ceftiofur, el cloranfenicol, la ERY, la rifampicina y la vancomicina. Por otro lado, los ensayos realizados con cepas de Brasil evidenciaron la presencia de resistencia a la ampicilina, la estreptomicina (STR) y las tetraciclinas11,12. Es de destacar que aunque el porcentaje de sensibilidad a la PEN suele ser elevado, estudios recientes notifican la presencia de algunos aislamientos de India y Brasil resistentes a este antimicrobiano10,12, por lo que debe considerarse la circulación de cepas resistentes. Sin embargo, la mayoría de los estudios solo evalúan la susceptibilidad mediante el método de difusión con discos sin determinar la concentración inhibitoria mínima (CIM) y este valor es sin duda de gran importancia para predecir el éxito terapéutico en los pacientes.
Debido a que en nuestro medio hípico se utilizan habitualmente la PEN-STR y la TMS frente a la adenitis equina, y a que el uso de antimicrobianos está cada vez más difundido en la clínica diaria, habitualmente de forma empírica12,16, consideramos que estudiar el perfil de sensibilidad antibiótica de S. equi constituiría un aporte a la terapéutica y al conocimiento de este patógeno. Por lo tanto, el objetivo de este trabajo fue estudiar el perfil de sensibilidad a los antimicrobianos de aislamientos de S. equi circulantes en la provincia de Buenos Aires, Argentina.
Materiales y métodosAislamientosSe trabajó con un total de 92 aislamientos de S. equi del cepario de la Cátedra de Enfermedades Infecciosas de Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, que fueron obtenidos en el período 2010-2013 a partir de equinos enfermos y de equinos clínicamente sanos recuperados de adenitis equina.
Los aislamientos fueron identificados según los procedimientos bacteriológicos de rutina para S. equi: cultivo en agar sangre equina para detectar la presencia de β-hemólisis, pruebas bioquímicas de primera etapa (tipo de respiración, movilidad, óxido-fermentación de glucosa, oxidasa y catalasa), detección del grupo C de Lancefield mediante aglutinación de látex (Oxoid, Inglaterra) y estudio del perfil bioquímico-metabólico mediante el sistema API 20 Strep (bioMérieux, Francia). Se identificaron además los genes sodA y seeH, característicos de S. equi, mediante la técnica de PCR, amplificando segmentos de 235 pb y 503 pb, respectivamente.
Método de difusión en agar con discosSe realizó un estudio con el método de difusión con discos según Bauer-Kirby1 y las recomendaciones del CLSI para Streptococcus spp. β-hemolíticos5-7 utilizando agar Mueller Hinton (Laboratorios Britania, S.A., Argentina) pero suplementado con 5% de sangre equina y no con sangre de carnero. Los antibióticos probados fueron PEN (PEN 10 U; Oxoid, Argentina), cefotaxima (CTX 30μg; Oxoid), ERY (ERY 15μg; Britania, Argentina), tetraciclina (TET 30μg; Britania), enrofloxacina (ENR 5μg; Oxoid), TMS (TMS 25μg; Britania), ciprofloxacina (CIP 5μg; Britania), clindamicina (CLI 5μg; Oxoid), STR (STR 300μg; Oxoid) y florfenicol (FFC 30μg; Oxoid).
Determinación de la CIMSe determinó la CIM de la PEN mediante el método de microdilución, siguiendo las recomendaciones del CLSI para Streptococcus spp. β hemolíticos5-7 y utilizando caldo Mueller Hinton (Britania) suplementado con 5% de sangre equina desfibrinada y lisada. Se determinó la CIM de este antibiótico frente a los aislamientos viables que presentaron sensibilidad intermedia o fueron resistentes a TMS, CLI, ENR y STR con el método de difusión en discos.
Se utilizaron fármacos con pureza y potencia conocidas: se trabajó con PEN (Biogénesis, Bagó, lote 1212403) con una potencia de 100%; STR (Biogénesis, Bagó, lote S2140909) con una potencia de 923μg/mg; CLI con una potencia de 860μg/mg; TMS (lote 30TTRI) con una potencia del 100% y sulfametoxazol (lote 980171) de una potencia de 99,3%. En el caso de la ENR, al no encontrarse disponible fármaco con pureza y potencia conocidas, se empleó la formulación comercial (Baytril, Bayer, Alemania, Serie KP0AC8B). Para el control de calidad, se utilizó en la determinación de todas las CIM la cepa de Staphylococcus aureus ATTCC 29213, según lo recomendado por el CLSI7-9.
ClasificaciónLos aislamientos se clasificaron como sensibles, intermedios o resistentes según los resultados de las pruebas de sensibilidad, sobre la base de los puntos de corte indicados por el CLSI para bacterias aisladas de animales5 y, en caso de no encontrarse disponibles estos datos, se extrapolaron los valores utilizados para bacterias aisladas de humanos5,6. Los puntos de corte utilizados para delimitar las categorías, con las referencias del microorganismo y la especie animal de la cual se tomaron, se encuentran en las tablas 1 y 2.
Método de difusión con discos: aislamientos estudiados para cada antimicrobiano y puntos de corte según el CLSI (en mm)
| ATM | n | Punto de corte | Referencias del punto de corte usado | ||
|---|---|---|---|---|---|
| S | I | R | |||
| PEN | 92 | ≥ 24 | – | – | Streptococcus spp. β-hemolíticosa,c |
| CTX | 92 | ≥ 24 | – | – | Streptococcus spp. β-hemolíticosa |
| CIP | 92 | ≥ 17 | 14-16 | ≤ 13 | Streptococcus spp. β-hemolíticosa |
| TET | 92 | ≥ 23 | 19-22 | ≤ 18 | Streptococcus spp. (no S. pneumoniae)c |
| FFC | 92 | ≥ 21 | 18-20 | ≤ 17 | Streptococcus spp. (no Streptococcus)c |
| ERY | 92 | ≥ 21 | 16-20 | ≤ 15 | Streptococcus spp.c |
| TMS | 92 | ≥ 19 | 16-18 | ≤ 15 | Streptococcus pneumoniaea |
| CLI | 87 | ≥ 21 | 15-20 | ≤ 14 | Streptococcus spp. β-hemolíticos (caninos)b |
| STR | 87 | ≥ 16 | 13-15 | ≤ 12 | Enterobacteriaceae, Pseudomonas auriginosa, Actinobacillus spp. (equino)b |
| ENR | 92 | ≥ 17 | 14-16 | ≤ 13 | Streptococcus spp. β-hemolíticosa |
ATM: antimicrobiano; I: sensibilidad intermedia; n: número de aislamientos testeados; R: resistente; S: sensible.
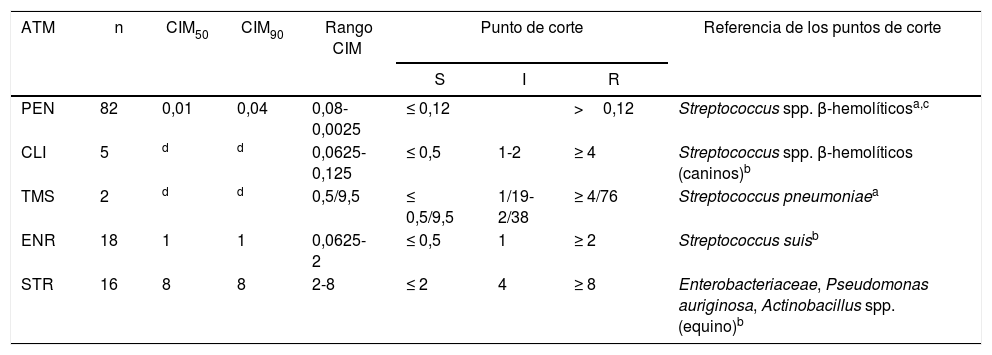
Resultados de la concentración inhibitoria mínima (CIM) para PEN, CLI, TMS, ENR y STR expresadas en CIM50 y CIM90 y rango de CIM
| ATM | n | CIM50 | CIM90 | Rango CIM | Punto de corte | Referencia de los puntos de corte | ||
|---|---|---|---|---|---|---|---|---|
| S | I | R | ||||||
| PEN | 82 | 0,01 | 0,04 | 0,08-0,0025 | ≤ 0,12 | >0,12 | Streptococcus spp. β-hemolíticosa,c | |
| CLI | 5 | d | d | 0,0625-0,125 | ≤ 0,5 | 1-2 | ≥ 4 | Streptococcus spp. β-hemolíticos (caninos)b |
| TMS | 2 | d | d | 0,5/9,5 | ≤ 0,5/9,5 | 1/19-2/38 | ≥ 4/76 | Streptococcus pneumoniaea |
| ENR | 18 | 1 | 1 | 0,0625-2 | ≤ 0,5 | 1 | ≥ 2 | Streptococcus suisb |
| STR | 16 | 8 | 8 | 2-8 | ≤ 2 | 4 | ≥ 8 | Enterobacteriaceae, Pseudomonas auriginosa, Actinobacillus spp. (equino)b |
Se detallan los puntos de corte según el CLSI (en μg/ml).
ATM: antimicrobiano; I: sensibilidad intermedia; n: número de aislamientos testeados; R: resistente; S: sensible.
CLSI, 2010 (tabla 2H1: Normas interpretativas de zonas de diámetros y puntos de corte de CIM para Streptococcus spp. β-hemolíticos de humanos).
CLSI, 2013 (tabla 2A: Normas interpretativas de zonas de diámetros y puntos de corte de CIM para patógenos veterinarios).
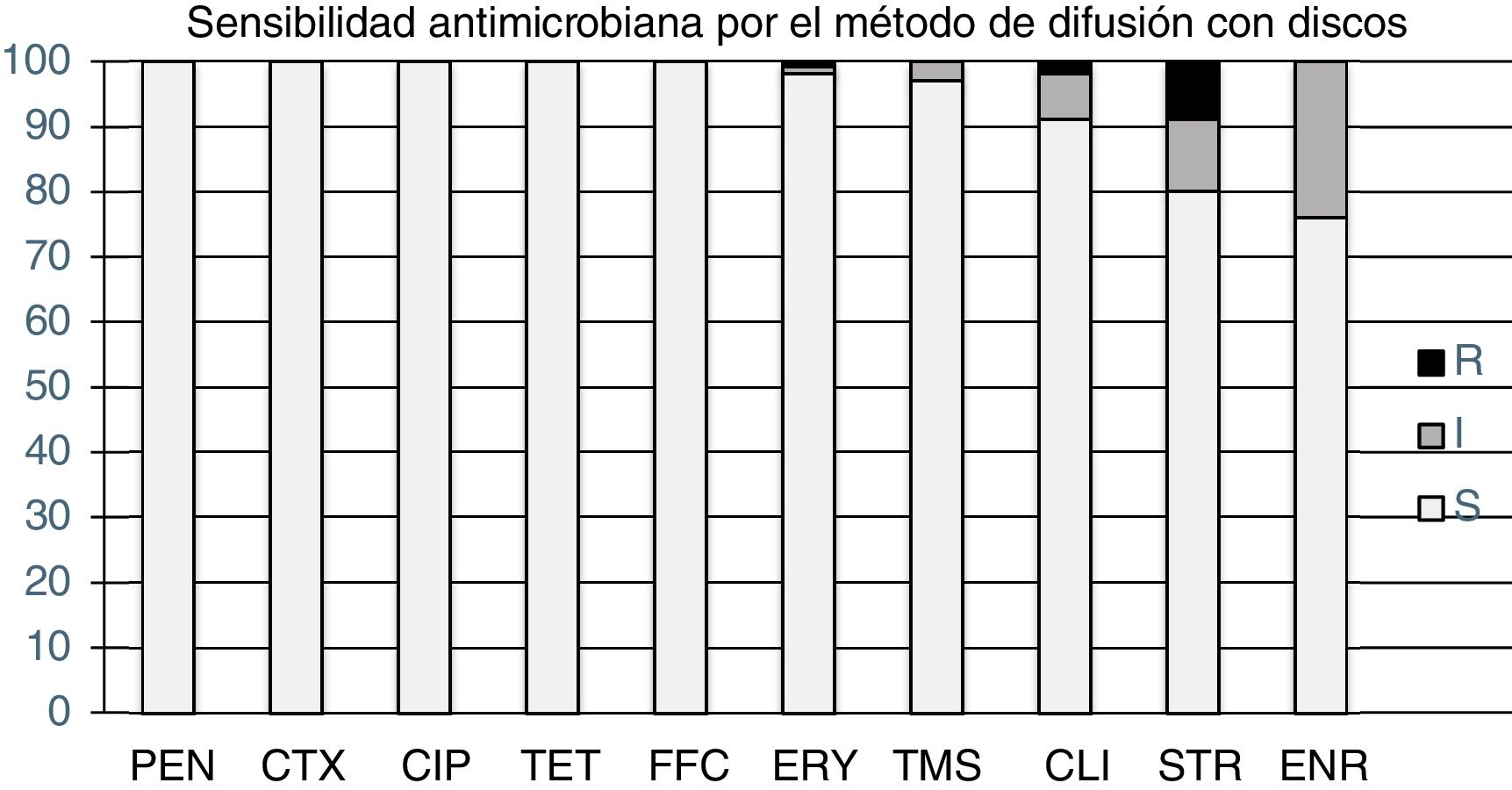
Se determinó el perfil de sensibilidad a los antimicrobianos por el método de difusión con discos y se obtuvieron altos porcentajes de sensibilidad, que se detallan en la figura 1. Los valores de CIM50, CIM90 y rango de CIM obtenidos se presentan en la tabla 2. Si bien se encontró un aislamiento con sensibilidad intermedia y un aislamiento resistente a ERY mediante el método de difusión con discos, no se determinó la CIM. Esto se debió a que no se encontró disponible en el mercado esta droga con potencia y pureza conocidas, y con la formulación comercial disponible no se obtuvieron los valores de CIM esperados para la cepa de referencia.
S. equi suele ser sensible a los β-lactámicos y, por lo tanto, diferentes investigadores y clínicos experimentados no consideran necesario realizar pruebas de sensibilidad a los antimicrobianos de rutina empleando empíricamente la PEN3,9,17-20. Además, como ya se mencionó, el tratamiento antibiótico de la adenitis equina dependerá del estadio clínico de la enfermedad; este se recomienda durante la aparición de los signos tempranos (hipertermia), signos de septicemia o adenitis bastarda y en casos de condroides y empiema de bolsas guturales. A pesar de que muchos investigadores no aconsejan el tratamiento de la adenitis equina durante su fase clínica que cursa con abscedación de los linfonódulos3,19,20, en nuestro país esta es la principal práctica llevada a cabo en la realidad. Muchos veterinarios clínicos prefieren aplicar de todos modos la PEN a los animales con signología específica y no a los que presentan hipertermia, ya que los antibióticos son considerados un costo muy importante en producción equina (C.P. Bustos, comunicación personal). Es necesario recordar que en esta fase clínica la terapia con antimicrobianos retrasaría la cura y que con el tratamiento local de los abscesos se consiguen excelentes resultados.
De los hallazgos de este estudio se destaca el elevado porcentaje de sensibilidad a los antibióticos que se obtiene con el método de difusión con discos, principalmente a β-lactámicos (PEN y CTX), lo que coincide con lo que se informa en la literatura internacional, que describe la PEN como el antibiótico de elección para la adenitis equina3,9,19. Además, los antimicrobianos más utilizados en esta enfermedad (PEN, TMS y ERY) tuvieron una sensibilidad comprendida entre el 97 y el 100% (fig. 1), lo que coincide con la clínica y el éxito terapéutico en la utilización de estos fármacos.
Todos los aislamientos presentaron un rango de CIM y una CIM90 por debajo del punto de corte del CLSI para PEN. Estos resultados refuerzan los obtenidos con el método de difusión con discos, los obtenidos por otros autores y lo reportado a partir de datos de los laboratorios de microbiología clínica de las Universidades de Pennsylvania y Guelph (1993-1997)8,11,17. Se confirma entonces que la PEN es el antibiótico de elección para tratar la adenitis equina y que podría utilizarse empíricamente, ya que las cepas circulantes en Buenos Aires no mostraron resistencia.
Las cepas locales presentaron un elevado porcentaje de sensibilidad a TMS: el 97% fue sensible y el 3% tuvo sensibilidad intermedia en el antibiograma de difusión con discos (fig. 1) y valores de CIM por debajo de los puntos de corte para cepas resistentes. Sin embargo, es interesante considerar que otros estudios identificaron una resistencia del 42% y una sensibilidad intermedia del 7,8% frente a TMS8, aunque sin confirmarlas mediante la determinación de la CIM, considerada la técnica gold standard.
Se confirmó la presencia de cepas resistentes a STR, por la obtención de valores de CIM50 y CIM90 por encima del punto de corte del CLSI. Si observamos los resultados para STR, el 9% de resistencia que se obtuvo por difusión con discos aumentó cuando se determinó la CIM de los aislamientos resistentes y de sensibilidad intermedia, esta pasó a ser del 13,79% (12/87). Este valor coincide con lo reportado por otros investigadores, que encontraron un 13% de resistencia a la STR en S. equi11.
Como las formulaciones comerciales suelen tener la combinación PEN-STR, que se utiliza a un intervalo posológico inadecuado para STR, su empleo difundido podría relacionarse con el porcentaje de resistencia observado o, quizá, la resistencia natural que poseen los gram positivos a los aminoglucósidos17 sea la explicación de la resistencia encontrada.
Por otro lado, los aislamientos presentaron un 76% de sensibilidad y un 24% de sensibilidad intermedia por el método de difusión con discos, y valores de CIM50 y CIM90 de 1μg/ml (punto de corte de sensibilidad intermedia) a ENR. Uno de los aislamientos presentó una CIM de 2μg/ml y se clasificó como resistente, y aunque las fluoroquinolonas no suelen utilizarse en animales jóvenes por sus efectos sobre los cartílagos de crecimiento, es importante destacar que en Brasil también se obtuvieron cepas resistentes y con sensibilidad intermedia11.
Los aislamientos mostraron un alto porcentaje de sensibilidad a la CLI (fig. 1), sin evidenciarse CIM mayores que el punto de corte en los aislamientos testeados. Aunque no es un antimicrobiano utilizado en la clínica equina por sus posibles efectos adversos17, se destaca la sensibilidad de S. equi a los aminoglucósidos.
Finalmente, se enfatiza la relevancia del uso racional de los antibióticos, para evitar su uso innecesario y garantizar el éxito terapéutico, con buenas prácticas de manejo y un «enfoque 5R», que involucra responsabilidad, reducción, refinamiento, reposición y revisión de la terapia antimicrobiana16. Además, así se pueden evitar la cronicidad, la recidiva de las infecciones y la aparición de resistencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue subsidiado por la Universidad de Buenos Aires: proyecto de investigación UBACyT 2011-2014 (20020100100149). Carla Bustos fue becaria doctoral UBACyT 2010-2015.
Conflicto de interesesNo existe conflicto de intereses.
Agradecemos a Ariel Koval y al laboratorio Biogénesis-Bagó por proveernos PEN y STR, a la Dra. Nora Mestorino de la Facultad de Ciencias Veterinarias de la Universidad de La Plata por el TMS y a la Dra. Liliana Fernández Canigia del Hospital Alemán por la CLI. A la Dra. Graciela Carloni por sus consejos académicos con las pruebas de sensibilidad antimicrobianas realizadas y a nuestros compañeros de la Cátedra de Enfermedades Infecciosas.