La campilobacteriosis genital bovina es una enfermedad reproductiva que afecta la producción bovina. Es causada por las subespecies de Campylobacter fetus, C. fetus fetus (Cff) y C. fetus venerealis (Cfv). El objetivo de este estudio fue identificar la presencia de C. fetus en fluidos genitales mediante cultivo bacteriológico e inmunofluorescencia directa (IFD) y comparar los resultados. Se conformaron 2 grupos de 6 vaquillonas y 5 toros cada uno. Uno se infectó con Cff (grupo Cff) y el otro con Cfv (grupo Cfv). Dos vaquillonas y 2 toros sin infectar conformaron el grupo control. Periódicamente se tomaron muestras de mucus cervicovaginal y fluido prepucial, las que se procesaron por cultivo e IFD. En el grupo Cff se infectó el 100% de las vaquillonas y el 80% de los toros, mientras que en el grupo Cfv se infectó el 50 y el 60%, respectivamente. Los valores de concordancia (Kappa) obtenidos al comparar las técnicas diagnósticas fueron de 0,57 para las vaquillonas del grupo Cff y 0,52 para las del grupo Cfv, y para los toros fueron de 0,17 y 0,27, respectivamente. En las vaquillonas, la IFD arrojó más resultados positivos que el cultivo, un 5,6% más para el grupo Cff y un 7,4% más para el grupo Cfv. El menor porcentaje de resultados positivos por IFD en los toros, un 40% menos que por cultivo para el grupo Cff y un 5,3% menos para el grupo Cfv, podría deberse a un muestreo incorrecto. Los valores de Kappa indican una concordancia moderada en las vaquillonas y baja en los toros.
Bovine genital campylobacteriosis is a reproductive disease that affects cattle production. It is caused by Campylobacter fetus subspecies, C. fetus fetus (Cff) and C. fetus venerealis (Cfv). The aim of this study was to identify the presence of C. fetus in genital fluids by bacteriological culture and direct immunofluorescence (DIF) and to compare the results. Two groups of 6 heifers and 5 bulls, one infected with Cff (Cff group) and the other with Cfv (Cfv group) were formed. Two heifers and 2 bulls, all of them uninfected, made up the control group. Samples of cervicovaginal mucus and preputial fluid were processed by culture and DIF. In the Cff group, 100% of the heifers and 80% of the bulls were infected, while in the Cfv group, 50% of the heifers and 60% of the bulls were infected. The degree of agreement (Kappa values) from benchmarking diagnostic techniques were 0.57 for heifers in the Cff group and 0.52 for heifers in the Cfv group, whereas the values for bulls were 0.17 and 0.27, respectively. Heifers yielded more positive results in the DIF assay than in the culture, exhibiting 5.6% increase in the Cff group and 7.4% in the Cfv group. The lowest percentage of positive results for DIF in bulls, 40% less for the Cff group and 5.2% for the Cfv group, could be due to improper sampling. Kappa values showed moderate agreement for the heifers and low for the bulls.
La campilobacteriosis genital bovina (CGB) es una enfermedad reproductiva infecciosa venérea de los bovinos causada por Campylobacter fetus, que comprende las subespecies C. fetus fetus (Cff) y C. fetus venerealis (Cfv), incluyendo en esta última el biotipo intermedius16. En Argentina, uno de los aspectos limitantes de la eficiencia reproductiva de los rodeos de cría bovina está representado por la alta incidencia de enfermedades de la reproducción, en donde más del 50% de las fallas se deben a enfermedades infecciosas21. En nuestro país se estima que la prevalencia de CGB oscila entre un 8,5 y un 20%24. Por otro lado, entre las causales de abortos en bovinos, C. fetus sp. ha sido identificado en el 33,6% de los fetos arribados a los laboratorios de bacteriología de Argentina y es el agente etiológico más comúnmente aislado del líquido de abomaso y de pulmón17.
El género Campylobacter está conformado por bacilos gram negativos, curvados en forma de comas o espirales y móviles. Las colonias se desarrollan en condiciones microaerofílicas a las 48-72h, son pequeñas, con aspecto de cabezas de alfiler, ligeramente rosadas y translúcidas. Los cultivos son catalasa y oxidasa positivos, y gelatina e indol negativos. Los cultivos de Cff son menos exigentes que los de Cfv y pueden llegar a producir ácido sulfhídrico en un medio con cisteína, a tolerar y reducir el selenito de sodio y a desarrollarse en un medio que contenga hasta 1,3% de glicina4.
En las hembras el agente persiste en las secreciones genitales, donde provoca la muerte embrionaria temprana, infertilidad temporaria durante 6 meses, repetición de celo y, ocasionalmente, abortos esporádicos entre el mes 5 y 6 de la gestación (<10%). Se ha demostrado que ambas subespecies de C. fetus pueden permanecer viables en la vagina y el cérvix durante la preñez; en algunos casos las hembras llegan hasta el final de la gestación con el nacimiento de un ternero normal5,9,10. Este hecho podría explicar la presencia de hembras portadoras que mantienen la infección de un servicio al otro, reinfectando por medio del toro al resto del rodeo14,15. En los toros, el agente se localiza en las criptas de la mucosa prepucial y en la uretra distal; se establece así una infección crónica de portador asintomático16,24.
Usualmente la CGB cursa de manera subclínica, por lo que no suele ser detectada, a menos que se utilicen métodos de diagnóstico eficientes. El diagnóstico de la CGB se realiza mediante la técnica de inmunofluorescencia directa (IFD) en muestras de fluido prepucial (FP) y de mucus cervicovaginal (MCV) de vaquillonas/vacas vacías o abortadas, o de líquido de abomaso de fetos abortados18. Adicionalmente, en laboratorios más sofisticados se realiza el cultivo a partir de estas muestras, pero también de la placenta o el pulmón fetal22,26. Mientras que la técnica de IFD arroja un resultado a nivel de especie (C. fetus), el aislamiento seguido de pruebas bioquímicas permite diferenciar entre las subespecies (Cff y Cfv).
En el presente trabajo comparamos la eficiencia diagnóstica del cultivo bacteriológico con la de la técnica de IFD, analizando por separado muestras de MCV y de FP tomadas de vaquillonas y de toros infectados experimentalmente con cepas autóctonas de Cff y Cfv.
Materiales y métodosAnimales y grupos experimentalesEl ensayo se realizó durante 8 meses, utilizando 10 toros Aberdeen Angus de 4-5 años, clínicamente aptos y con una buena condición corporal, y 12 vaquillonas Aberdeen Angus y cruzas Hereford, vírgenes, de 15-18 meses, con adecuado desarrollo genital, actividad ovárica cíclica y una buena condición corporal. Los animales provenían de un rodeo libre de brucelosis, neosporosis y enfermedades venéreas, perteneciente a una reserva ganadera de la EEA INTA Balcarce, provincia de Buenos Aires, Argentina. Los cultivos de MCV de las vaquillonas y de FP de los toros realizados antes del comienzo del ensayo resultaron negativos a enfermedades venéreas, brucelosis y neosporosis. Los animales fueron separados aleatoriamente en 2 grupos de infección: uno compuesto por 6 vaquillonas y 5 toros seleccionados para la infección experimental con Cff (grupo Cff), y otro compuesto por 6 vaquillonas y 5 toros seleccionados para la infección experimental con Cfv (grupo Cfv). Las vaquillonas fueron infectadas por vía vaginal en una única vez y los toros fueron infectados por vía prepucial en 2 oportunidades. Los grupos Cff y Cfv permanecieron separados entre sí durante todo el período de ensayo para evitar infecciones cruzadas. Los toros y las vaquillonas de cada grupo permanecieron en servicio durante los 120 días posteriores a la infección experimental, realizando los muestreos correspondientes cada 15-20 días. En el tercer muestreo, efectuado a los 54 días postinfección (dpi), no se tomaron muestras para cultivo. Una vez finalizado el ensayo se realizó el diagnóstico de preñez por palpación transrectal y ecografía. Para la conformación del grupo control se seleccionaron 2 vaquillonas y 2 toros negativos a brucelosis y enfermedades venéreas, que fueron muestreados de idéntica forma y en similares períodos de tiempo que los grupos Cff y Cfv.
Inóculos para el desafíoLas cepas de Cff (INTA C1N3) y Cfv (INTA 97/608) utilizadas como inóculos fueron seleccionadas del cepario del Laboratorio de Bacteriología de la EEA INTA Balcarce, a partir de aislamientos regionales obtenidos mediante cultivos de MCV de vaquillonas abortadas. Las cepas fueron tipificadas mediante pruebas bioquímicas siguiendo los estándares internacionales11. Se utilizaron las siguientes pruebas: catalasa, producción de ácido sulfhídrico en medio con cisteína, reducción del selenito de sodio, crecimiento en cloruro de sodio al 3% y tolerancia a glicina al 1, 1,3, 1,5 y 1,9%. Además, ambas cepas fueron caracterizadas por métodos moleculares de tipificación de C. fetus específicos mediante reacción en cadena de la polimerasa (PCR)-análisis del polimorfismo de largos fragmentos amplificados26.
Infección experimentalVaquillonas: se realizó una única inoculación que consistió en 2ml de cada cepa suspendida en 3ml de agar Brucella semisólido depositada en la parte anterior de la vagina. La concentración del inóculo fue de 4,0×108UFC/ml para Cfv y de 4,3×108UFC/ml para Cff.
Toros: se realizaron 2 inoculaciones intraprepuciales con un intervalo de 20 días. La primera se realizó con un inóculo de 5ml de cultivo bacteriano suspendido en 5ml de agar Brucella semisólido con una concentración de 4,0×108UFC/ml para Cfv y de 4,3×108UFC/ml para Cff; la segunda inoculación se hizo con igual volumen final con una concentración de 11,0×107UFC/ml para Cfv y de 10,8×107UFC/ml para Cff.
Recolección de muestrasSe recolectaron muestras de MCV y FP mediante pipeta de Cassou; estas se transportaron refrigeradas al laboratorio dentro de las 2h de obtenidas. Las muestras de FP se colocaron en solución formolada al 1% para IFD y medio de transporte Cary Blair para el cultivo, y las muestras de MCV solo se colocaron en medio de transporte Cary Blair, a partir del cual se realizó un enriquecimiento previo para luego realizar el cultivo y la IFD8.
Cultivo bacteriológicoMuestras de MCV: se realizó un preenriquecimiento de las muestras incubándolas en tubos con agar Brucella semisólido con el agregado de antibióticos (bacitracina 15UI/ml, novobiocina 5μg/ml, cicloheximida 50μg/ml y polimixina B 7UI/ml) durante 48h a 37°C en microaerofilia. Una vez observado el desarrollo bacteriano, se tomó el anillo de crecimiento superficial y se cultivó una parte en placas de agar Skirrow (ASK); la otra parte se colocó en solución formolada al 1% para realizar IFD. Las placas de ASK se incubaron a 37°C en atmósfera microaerofílica y fueron observadas a diario durante 7 días, ya que Campylobacter es una bacteria de desarrollo lento.
Muestras de FP: fueron sembradas directamente desde el medio de transporte en placas de ASK e incubadas bajo las mismas condiciones de temperatura y atmósfera que las de MCV. Las placas se observaron todos los días durante 7 días.
Criterios de positividad y clasificación a nivel de subespecie: cuando se identificaron colonias con morfología compatible con C. fetus se observaron en un microscopio de contraste de fase para constatar la morfología bacteriana y el movimiento característico del género Campylobacter. Las colonias fueron repicadas a un medio agar sangre Columbia con agregado de sangre bovina al 7% y, una vez desarrolladas, fueron repicadas a tubos con medio Kligler en pico de flauta para determinar que se trataba de la especie C. fetus sobre la base de la actividad de la enzima catalasa (positiva) y la producción de ácido sulfhídrico (negativa). Para la clasificación de la subespecie se efectuaron las pruebas de desarrollo en selenito de sodio, cisteína, cloruro de sodio y glicina, esta última al 1, 1,3, 1,5 y 1,9%. Las cepas aisladas se identificaron como Cff cuando se obtuvo desarrollo en selenito de sodio, cisteína y al menos en glicina hasta 1,5%, mientras que fueron identificadas como Cfv cuando no se obtuvo desarrollo en ninguna prueba, pues todas estas son negativas.
Inmunofluorescencia directaPara la detección por medio de inmunofluorescencia se utilizó un conjugado comercial (Laboratorio Biológico de Tandil, Argentina) con una dilución de 1/60 en agua destilada, según indicaciones del fabricante. La técnica de IFD aplicada fue la descrita anteriormente8. La observación se realizó con microscopio óptico (NIKON Microflex HFM, Japón) con sistema de epifluorescencia con lente de 40× y se confirmó el diagnóstico con observación a 100×. Como criterio de positividad se tomó la observación simultánea de la morfología compatible con Campylobacter y de fluorescencia.
Muestras de MCV: luego del preenriquecimiento descrito anteriormente, se tomó parte del anillo de crecimiento superficial y se colocó en solución formolada al 1% para realizar IFD.
Muestras de FP: fueron tomadas y colocadas directamente en solución formolada al 1% y mantenidas refrigeradas a 4°C hasta su procesamiento.
Análisis de los datosSe analizaron los porcentajes de cultivos bacteriológicos positivos y los resultados positivos por IFD a lo largo de todo el ensayo. La concordancia entre el cultivo y la técnica de IFD se comparó calculando el valor Kappa25.
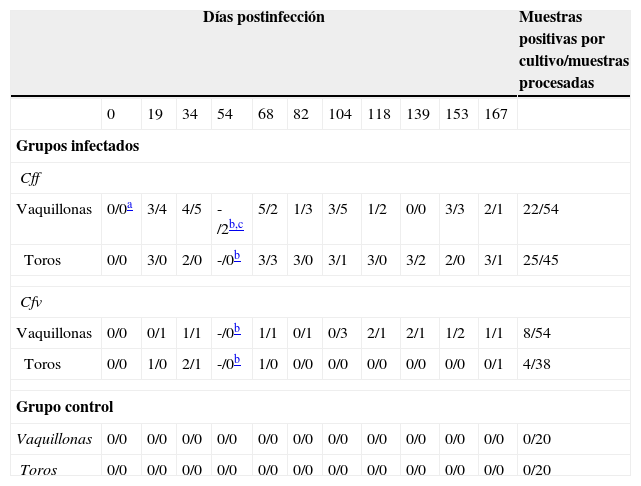
ResultadosCultivoSe logró establecer la infección experimental genital con ambas subespecies de C. fetus tanto en las vaquillonas como en los toros, con lo cual, además, se constató la viabilidad de los inóculos. Cff y Cfv fueron aislados de los animales de cada grupo inoculado hasta el final del ensayo (167 días posdesafío). Durante el período de estudio, Cff fue aislado en 22 oportunidades de todas las vaquillonas en el 89% de los muestreos y 25 veces de 4/5 toros en el 100% de los muestreos. Cfv fue aislado en 8 oportunidades de 3/6 vaquillonas en el 66,7% de los muestreos y 4 veces de 3/5 toros en el 33,3% de los muestreos realizados (tabla 1).
Resultados positivos obtenidos por cultivo e IFD de muestras de MCV y FP de los grupos de infección (Cff y Cfv) y el grupo control
| Días postinfección | Muestras positivas por cultivo/muestras procesadas | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 19 | 34 | 54 | 68 | 82 | 104 | 118 | 139 | 153 | 167 | ||
| Grupos infectados | ||||||||||||
| Cff | ||||||||||||
| Vaquillonas | 0/0a | 3/4 | 4/5 | -/2b,c | 5/2 | 1/3 | 3/5 | 1/2 | 0/0 | 3/3 | 2/1 | 22/54 |
| Toros | 0/0 | 3/0 | 2/0 | -/0b | 3/3 | 3/0 | 3/1 | 3/0 | 3/2 | 2/0 | 3/1 | 25/45 |
| Cfv | ||||||||||||
| Vaquillonas | 0/0 | 0/1 | 1/1 | -/0b | 1/1 | 0/1 | 0/3 | 2/1 | 2/1 | 1/2 | 1/1 | 8/54 |
| Toros | 0/0 | 1/0 | 2/1 | -/0b | 1/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/1 | 4/38 |
| Grupo control | ||||||||||||
| Vaquillonas | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/20 |
| Toros | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/20 |
IFD: inmunofluorescencia directa; MCV: mucus cervicovaginal; FP: fluido prepucial; Cff: grupo infectado con Campylobacter fetus fetus; Cfv: grupo infectado con Campylobacter fetus venerealis.
Los animales que resultaron negativos al cultivo en todos los muestreos fueron considerados no infectados o refractarios a la infección. Los animales de los grupos controles resultaron negativos a los cultivos en todos los muestreos realizados (tabla 1).
Inmunofluorescencia directaAmbos grupos (Cff y Cfv) fueron negativos a IFD en el muestreo previo al desafío. Se identificó a C. fetus en el 100% de los muestreos realizados (tabla 1). En el grupo Cff, Cff fue detectado a partir de los 19dpi en todas las vaquillonas en el 90% de los muestreos, mientras que fue detectado a partir de los 68dpi en 4/5 toros en el 40% de los muestreos. En el grupo Cfv, Cfv fue detectado a partir de los 19dpi en 4/6 vaquillonas en el 90% de los muestreos, mientras que fue detectado a partir de los 34dpi en 2/5 toros en el 20% de los muestreos (tabla 1). Los animales de los grupos controles resultaron negativos a IFD en todos los muestreos realizados (tabla 1).
Concordancia entre las técnicas de cultivo e inmunofluorescencia directaLos totales resultan de la suma de las muestras obtenidas de los muestreos en los que se les realizaron ambas técnicas diagnósticas (9/10), ya que no se realizó cultivo en el día 53 posdesafío.
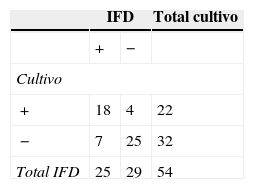
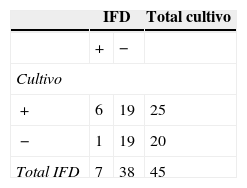
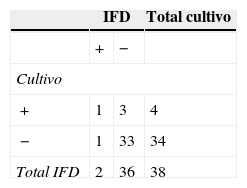
En el grupo Cff, la técnica de IFD permitió detectar en las vaquillonas un 5,5% más de animales positivos que el cultivo, mientras que en los toros se obtuvo un 40% menos de resultados positivos por IFD en comparación con el cultivo (tablas 2 y 3). En las vaquillonas, del total de resultados positivos a IFD (n=25), se encontró concordancia con el cultivo en el 72% de los casos (tabla 2). En los toros, del total de resultados positivos a IFD (n=7), el 85,7% de las muestras también fueron positivas por cultivo (tabla 3). Los valores de Kappa obtenidos en el grupo Cff fueron 0,57 para las vaquillonas y 0,17 para los toros.
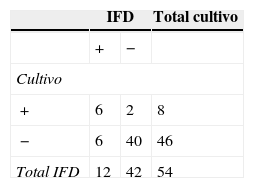
En el grupo Cfv, la técnica de IFD permitió detectar en las vaquillonas un 7,4% más de animales positivos que el cultivo, mientras que en los toros se obtuvo un 5,3% menos de resultados positivos por IFD en comparación con el cultivo (tablas 4 y 5). En las vaquillonas, del total de resultados positivos por IFD (n=12) se encontró concordancia con el cultivo en el 50% de los casos (tabla 4). En los toros, del total de resultados positivos por IFD (n=2), el 50% de las muestras también fueron positivas por cultivo (tabla 5). Los valores de Kappa obtenidos en el grupo Cfv fueron 0,52 para las vaquillonas y 0,27 para los toros.
En el grupo Cff se detectó un 33% de vaquillonas preñadas con un período promedio de gestación de 2,5 meses, mientras que en el grupo Cfv se detectó el 100% de las vaquillonas preñadas con un período promedio de gestación de 4,5 meses.
DiscusiónEn este ensayo de infección genital experimental con el aislamiento de ambas subespecies de C. fetus demostramos la viabilidad de las cepas seleccionadas hasta la finalización del ensayo (167dpi) tanto en las vaquillonas como en los toros. En este ensayo, el aislamiento de las cepas por cultivo se considera exitoso si se contrasta con resultados publicados por otros autores, lo que pone de manifiesto la alta dificultad para caracterizar bacteriológicamente la infección genital por C. fetus en bovinos18. Otros autores19, utilizando para el diagnóstico de Cfv muestras prepuciales de toros, obtuvieron mejores resultados de sensibilidad (85,4%) con el uso de PCR en tiempo real (RT-PCR) versus el cultivo directo sobre agar sangre (82,3%), aunque la especificidad fue inferior (85 versus 100%), con lo cual la RT-PCR podría mejorar el diagnóstico de Cfv en toros, principalmente si se realiza repetidamente. El valor diagnóstico del cultivo del FP y del MCV en bovinos infectados con Cff y Cfv fue comparado con el de la RT-PCR a los 7, 13 y 21 días postinfección experimental. El aislamiento tuvo éxito en todos los muestreos, y además, la RT-PCR identificó específicamente cada subespecie, lo que evidencia que esta técnica sería una herramienta complementaria al cultivo y permitiría el diagnóstico a partir de muestras de animales infectados27.
Los datos de los aislamientos indican que el número de animales infectados con cultivos positivos fue mayor en el grupo infectado con Cff en las vaquillonas y en los toros. El mayor porcentaje de aislamientos de Cff coincide con lo que indica la bibliografía de Argentina, a diferencia de lo que ocurre en otros países como Australia o Estados Unidos, donde prevalecen los aislamientos por cultivo de Cfv1.
Si bien con nuestros resultados no podemos explicar esta diferencia, la distinta patogenicidad observada podría indicar que la cepa de Cff utilizada en este estudio fue más virulenta o más resistente a la eliminación por parte del sistema inmunitario del área genital que la cepa de Cfv, tal como fue expresado en otros trabajos2,12. Es probable que la variabilidad en la virulencia de las cepas de C. fetus determine diferentes respuestas inmunitarias a la infección y, por ende, diferente probabilidad de supervivencia en el área genital y de aislamiento por cultivo. Al menos se conoce que la resistencia a la fagocitosis por parte de C. fetus estaría relacionada con la variabilidad en el tamaño y la estructura de proteínas presentes en la capa «S»2. Otros investigadores analizaron la capacidad de colonización genital de cepas regionales de Cff y Cfv y hallaron que el 100% de las cepas de Cff presentaron capacidad infectante, mientras que solo el 67% de las cepas de Cfv la presentaron; de esto concluyeron que la presencia de cápsula determinaría la capacidad de colonización genital y, consecuentemente, la virulencia y la probabilidad de recuperación por cultivo7. Otros autores15 utilizaron un método de filtración pasiva sobre el medio ASK en muestras de FP de toros infectados con Cfv y obtuvieron mejores resultados de recuperación del patógeno y menor contaminación fúngica6, con lo cual el uso de esta metodología podría incrementar el éxito de cultivo en estas muestras.
Los análisis de gestación indican que a pesar de la infección experimental, todas las vaquillonas del grupo Cfv lograron una preñez normal dentro del primer mes de servicio, mientras que solo 2 vaquillonas del grupo Cff lograron la preñez más tardíamente, lo que evidencia un mayor número de repeticiones de celo. Esto también podría ser un indicio de una mayor virulencia de Cff en comparación con Cfv. El aislamiento de Cff y Cfv en muestras de MCV de hembras preñadas demuestra la importancia de la persistencia de la infección en el rodeo debido a la presencia de hembras carrier, tal como se demostró en trabajos anteriores5,9,10.
En muestras de MCV, la técnica de IFD mostró más resultados positivos que el cultivo en ambos grupos, lo que pone en evidencia la confiabilidad de la IFD para procesar muestras de MCV. En contraposición, otros trabajos obtuvieron una mayor sensibilidad del cultivo respecto de la IFD9,10 y concluyeron que los resultados dependen principalmente de la calidad de la muestra recogida en el campo. Los valores de Kappa obtenidos para las muestras de MCV tanto para el grupo Cff como el Cfv establecen que la concordancia entre las técnicas (cultivo versus IFD) podría considerarse aceptable, en coincidencia con lo informado en trabajos anteriores8,14.
En muestras de FP, la técnica de IFD arrojó un menor porcentaje de resultados positivos en comparación con el cultivo, coincidentemente con lo hallado por otros autores13. Estos resultados podrían deberse a que la técnica utilizada para la obtención del material en toros (pipetas) no sería la más apropiada; este es uno de los factores destacados por otros autores como causa de discrepancias al analizar la misma muestra23. La menor detección de C. fetus por IFD, cuyo límite de detección es de 100UFC/ml, podría deberse a que el número de microorganismos disponibles en las secreciones prepuciales es variable, y a que el volumen de muestra tomada fue pequeño3,20. Los valores de Kappa obtenidos para las muestras de FP tanto en el grupo Cff como en el Cfv están por debajo de los límites definidos para una concordancia moderada entre las 2 técnicas, en contraposición con lo observado en otros estudios22,28. Esta baja concordancia podría deberse a lo explicado anteriormente en relación con la metodología de muestreo y con la calidad/cantidad de muestra de FP.
ConclusionesLos resultados del presente trabajo experimental de infección genital en vaquillonas y toros con cepas de Cff y Cfv, basados en el análisis de muestras de MCV y FP, evidencian que existió diferencia en la patogenicidad de las cepas de C. fetus empleadas. La baja eficiencia de la IFD para detectar la infección en los machos pudo deberse al escaso número de microorganismos presentes en la cavidad prepucial tras el desafío con C. fetus, el cual resultaría en una baja sensibilidad de las técnicas diagnósticas (IFD, cultivo). Cuando las muestras procesadas correspondieron a MCV se logró una moderada concordancia entre el cultivo y la técnica de IFD.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.