El control y la erradicación de la tuberculosis bovina basados en la detección de los animales infectados y su inmediata faena permitió lograr progresos satisfactorios en varios países y regiones, pero no todos pudieron lograrlo debido principalmente a la presencia de fauna silvestre infectada con Mycobacterium bovis. La Argentina aplica desde 1999 estas mismas premisas y ha logrado avances en los rodeos lecheros, aunque no se ha evaluado el factor ambiental como la fauna silvestre. El objetivo de este trabajo fue determinar si la fauna silvestre de la cuenca lechera de Santa Fe está infectada con M. bovis.
Se realizó la captura/sacrificio de fauna silvestre presente en 5 rodeos lecheros con altos niveles de reaccionantes positivos a la prueba de tuberculina. Sobre 95 mamíferos silvestres examinados, se aisló M. bovis de 7 individuos de comadreja overa (Didelphis albiventris), de uno de zorro gris (Lycolapex gimnocercus) y de uno de rata (Rattus norvegicus). Los sitios anatómicos que produjeron estos aislamientos variaron de acuerdo con las especies; en ninguno de los ejemplares evaluados se observaron lesiones macroscópicas de tuberculosis. Los espoligotipos de M. bovis aislados con mayor frecuencia de los animales silvestres correspondieron a los tipos 34 (4 aislamientos) y 12 (3 aislamientos); el primero es el más corrientemente aislado del ganado en Argentina. Se discute en este estudio el papel de la comadreja overa (D. albiventris) como hospedador circunstancial de M. bovis.
Control eradication campaigns of bovine tuberculosis based on the «test and slaughter» approach were successful in many countries and regions; however, in some areas the infection persists and one of the main reasons is Mycobacterium bovis infection in wild life species. Argentina has applied the same approach since 1999, achieving progress in dairy cattle herds. Nonetheless, the wildlife role has never been investigated. The objective of this study was to determine if wildlife from the Santa Fe dairy area is infected with M. bovis.
Wildlife species having a positive tuberculin skin test were captured in five dairy farms. Ninety five wildlife mammals were captured; M. bovis was recovered from 7 possums (Didelphys albiventris), from one fox (Lycolapex gimnocercus) and from one rat (Rattus norvegicus). None of the animals exhibited macroscopic lesions. The most frequently isolated M. bovis spoligotypes were types 34 (4 isolates) and 12 (3 isolates). Spoligotype 34 is the most frequently isolated type in Argentine cattle. The role of D. albiventris as spillover host of M. bovis is discussed in this study.
El agente causal de la tuberculosis bovina (TBb) es Mycobacterium bovis, que produce infecciones en animales domésticos y silvestres y en el hombre. En las últimas décadas, numerosos países ejecutaron programas de control y erradicación de la TBb en sus rodeos bovinos, basándose en la detección de los animales infectados y su inmediata faena (procedimiento conocido como test and slaughter). A pesar de haberse logrado progresos satisfactorios en extensas regiones, en algunas áreas persistieron las reinfecciones en los rodeos saneados. La causa principal de que esto ocurriera fue la presencia de fauna silvestre infectada10,14,17,27,33.
En Argentina existe desde 1999 un plan oficial de control y erradicación de TBb35,36 basado en la misma premisa, aunque no se contempla la indemnización de los productores por el descarte de los animales positivos. Desde su puesta en marcha, el número de rodeos bovinos que fueron declarados libres de tuberculosis (TB), especialmente el de rodeos lecheros, ha ido en constante aumento. Sin embargo, los conglomerados geográficos más afectados aún coinciden con las zonas lecheras, de ellos el más significativo es el que agrupa a los departamentos centrales de la provincia de Santa Fe (Castellanos, La Capital, Las Colonias, San Jerónimo y San Justo), al que se suma parte del departamento San Justo de la provincia de Córdoba30. Los departamentos Castellanos y Las Colonias evidenciaron prevalencias del orden de 7,7% y 4,1%, respectivamente, en vacas, y de 30% y 15,6% en rodeos lecheros1,2. Diversos factores de manejo y del medio ambiente pueden explicar las variaciones de incidencia y prevalencia entre regiones y entre rodeos de una misma región27.
La participación de la fauna silvestre local ha sido poco estudiada en Argentina: solo se han comunicado aislamientos circunstanciales de M. bovis en liebres (Lepus europaeus)23, jabalí (Sus scrofa)3 y puma (Puma concolor) en cautiverio31. Hasta el momento no se han realizado estudios sistemáticos sobre la infección de la fauna autóctona por M. bovis y su relación con las especies de interés pecuario, por tal motivo, el objetivo del presente trabajo fue determinar si la fauna silvestre existente en la cuenca lechera de Santa Fe está infectada con M. bovis.
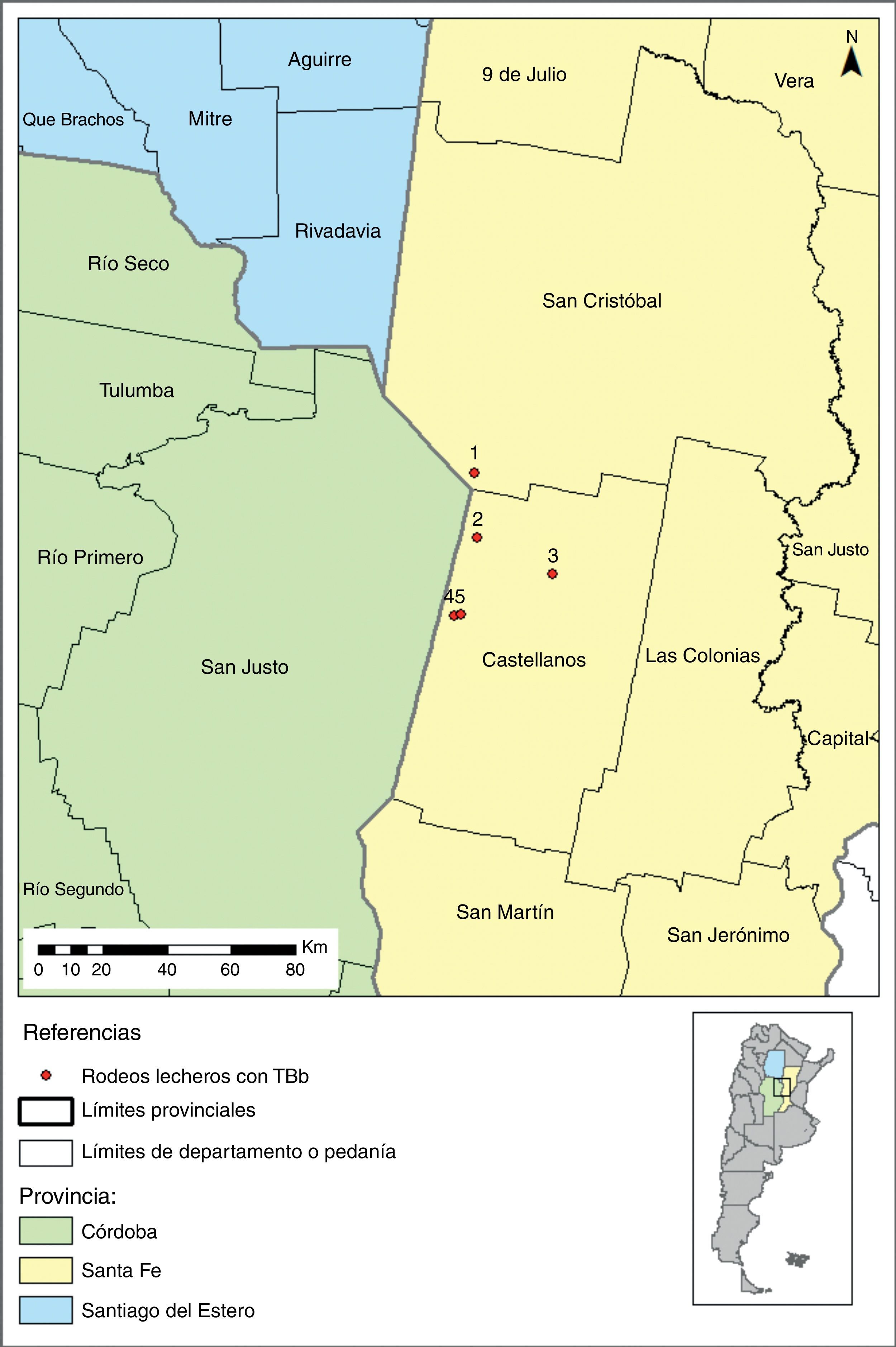
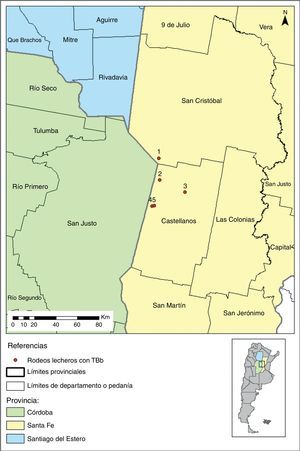
Materiales y métodosLocalización de rodeos lecherosPara efectuar el estudio se seleccionaron 5 rodeos lecheros de la denominada cuenca lechera Santa Fe ubicados en predios en los que se permitiría la captura de animales silvestres (fig. 1). Tres de estos rodeos presentaron prevalencias elevadas en sus vacas a la prueba de tuberculina ano-caudal: el 7 a 29% de animales positivos. Los 2 rodeos restantes tuvieron reaccionantes positivos a tuberculina (2 al 4% sobre el total del rodeo) luego de haber finalizado ambos un programa de saneamiento de esta enfermedad; en uno de ellos se había aislado previamente una cepa de M. bovis a partir de lesiones visibles detectadas en frigorífico en uno de sus bovinos.
Las labores de muestreo de fauna se realizaron durante los años 2007 y 2008 y el primer semestre del año 2009.
Captura de animalesSe procuró la captura de todas las especies de mamíferos silvestres existentes en los predios. Para tal fin se utilizaron trampas tipo Tomahawk para los roedores pequeños y otra de diseño semejante, pero de dimensiones superiores, para las especies de mayor tamaño. Las trampas se colocaron en línea, separadas por 2 o 3 m entre sí, en áreas donde naturalmente se refugian los animales silvestres. Estas incluyeron las zonas perimetrales de las pasturas utilizadas por los bovinos, zonas donde existía cobertura de árboles y pajonales naturales, áreas próximas a las instalaciones de ordeño y sitios donde se depositan los bovinos muertos de estos establecimientos.
Los roedores capturados fueron manipulados y sacrificados siguiendo normas estándares para roedores del Centers for Disease Control and Prevention26.
En el caso de animales del orden Xenarthra (peludos), Didelphimorphia (comadrejas) y Galactis (hurón), se siguieron las recomendaciones del CICUAE INTA-CICVyA8, con la administración de xilazina (Rompun®, Bayer Argentina) IM en dosis de 5mg/kg de peso como tranquilizante, antes de la aplicación intracardíaca del eutanásico (T61®, Intervet Argentina S.A). Las labores de colocación de trampas se realizaron en 2-3 períodos de 5 días por cada establecimiento, entre los meses de mayo y septiembre. Para la captura de zorros y liebres se recurrió al empleo de armas de fuego. Se contó con la autorización expresa del Gobierno de la Provincia de Santa Fe (Res. 0040/08 Exp. N° 02101-00009273-3).
Las carcasas de los animales se mantuvieron refrigeradas desde su captura-sacrificio hasta su procesamiento, sin superar las 8 h post mortem.
Toma de muestras en bovinosSe procuró el aislamiento de M. bovis en los bovinos de todos los rodeos donde se hicieron las capturas de animales silvestres, a fin de determinar las cepas presentes y los espoligotipos (spo). Se realizaron necropsias en 3 de los establecimientos y de solo un bovino en cada uno de ellos. Las muestras se obtuvieron de las lesiones macroscópicas compatibles con TB cuando estas se observaron, y de ganglios retrofaríngeos y mediastínicos cuando los bovinos no presentaban lesiones. Las muestras se acondicionaron en recipientes estériles, se refrigeraron inmediatamente después de su obtención y se mantuvieron a −18°C hasta su procesamiento. En el establecimiento donde no se pudieron realizar necropsias ni inspección en frigorífico, se procuró el aislamiento de M. bovis a través de hisopados nasales. De igual manera, se procedió en los rodeos que habiendo realizado necropsia de un bovino no se pudo aislar M. bovis. Estos muestreos se realizaron a un número de 10 animales positivos a tuberculina en 2 oportunidades por rodeo. La toma de muestras se realizó con hisopos estériles construidos artesanalmente e introducidos unos 8-10cm en los ollares de los bovinos y colocados posteriormente en tubos de 50ml de capacidad que contenían 15ml de buffer fosfato estéril. Estas muestras fueron mantenidas congeladas a −18°C hasta su procesamiento en el laboratorio de bacteriología.
Toma de muestras en animales silvestresPara todas las especies silvestres se aplicó una rutina de necropsia que consistió en la apertura de cavidades por la línea media y la observación macroscópica de presencia de lesiones compatibles con TB en órganos. Se tomaron muestras individuales de pulmón y alícuotas de bazo, hígado y riñón, las que se colocaron en contenedores estériles. En los mamíferos de mayor tamaño se recolectaron ganglios retrofaríngeos, submandibulares, tonsilas y preescapulares. Todas las muestras destinadas a estudios bacteriológicos se conservaron a −18°C hasta su procesamiento.
Cultivos bacteriológicosLas muestras de tejido fueron trituradas utilizando un homogeneizador mecánico (Stomacher® Basic 470, Sedward, England) y descontaminadas por la técnica de Petroff. Ambos procesos se realizaron siguiendo la metodología recomendada por el Manual de micobacterias de la AAVLD21. Posteriormente se sembraron por duplicado en medios de Löwenstein-Jensen y Stonebrink. Los desarrollos en cultivos fueron coloreados con Ziehl-Neelsen (ZN) para la identificación morfológica de las micobacterias.
Técnicas molecularesLa identificación de aquellos aislamientos con tinción de ZN positiva como pertenecientes al complejo Mycobacterium tuberculosis (CMT) se realizó por la técnica de PCR-IS6110, utilizando los cebadores INS1 CGTGAGGGCATCGAGGTGGC e INS2 CGTAGGCGTCGGTGACAAA, de acuerdo con lo descrito por Hermans et al.20.
La tipificación molecular de los aislamientos identificados como pertenecientes al CMT se efectuó utilizando la técnica conocida como Spoligotyping, de acuerdo con lo descrito por Kamerbeek et al.22.
Análisis estadísticoLa búsqueda de asociaciones entre aislamiento de M. bovis en comadreja overa y variables independientes como el sexo, la prevalencia de infección en vacas lecheras, el tamaño del rodeo y la presencia o ausencia de rodeos reinfectados se efectuó mediante el test exacto de Fischer y el cálculo de los odds ratio (OR) con sus correspondientes intervalos de confianza del 95% (IC del 95%), utilizándose el software SatWin Ep. Scope V. 2.0®.
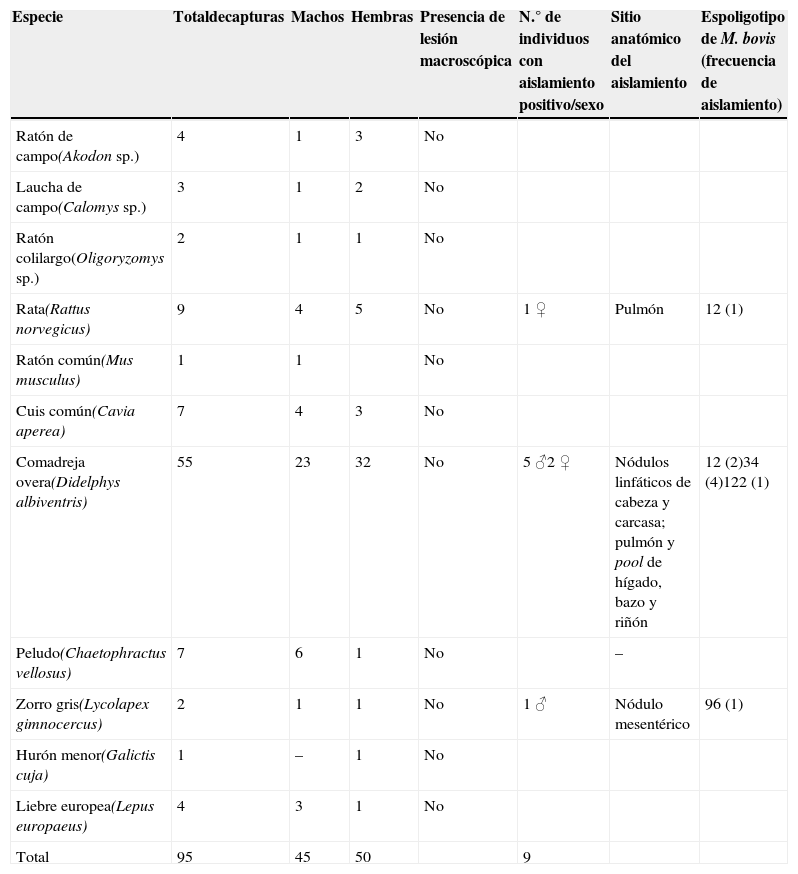
ResultadosSe capturó a un total de 95 mamíferos y se aisló M. bovis de 9 individuos, lo que implica una prevalencia de infección del 9,4%. Siete aislamientos provinieron de comadreja overa (Didelphys albiventris), uno de zorro gris (Lycolapex gimnocercus) y otro de rata (Rattus norvegicus). La prevalencia de infección en comadrejas resultó del 12,7% (tabla 1). Ninguno de los individuos capturados presentó lesiones macroscópicas compatibles con TB.
Presencia de M. bovis en fauna silvestre de 5 establecimientos con rodeos lecheros ubicados en Santa Fe, Argentina
| Especie | Totaldecapturas | Machos | Hembras | Presencia de lesión macroscópica | N.° de individuos con aislamiento positivo/sexo | Sitio anatómico del aislamiento | Espoligotipo de M. bovis (frecuencia de aislamiento) |
|---|---|---|---|---|---|---|---|
| Ratón de campo(Akodon sp.) | 4 | 1 | 3 | No | |||
| Laucha de campo(Calomys sp.) | 3 | 1 | 2 | No | |||
| Ratón colilargo(Oligoryzomys sp.) | 2 | 1 | 1 | No | |||
| Rata(Rattus norvegicus) | 9 | 4 | 5 | No | 1 ♀ | Pulmón | 12 (1) |
| Ratón común(Mus musculus) | 1 | 1 | No | ||||
| Cuis común(Cavia aperea) | 7 | 4 | 3 | No | |||
| Comadreja overa(Didelphys albiventris) | 55 | 23 | 32 | No | 5 ♂2 ♀ | Nódulos linfáticos de cabeza y carcasa; pulmón y pool de hígado, bazo y riñón | 12 (2)34 (4)122 (1) |
| Peludo(Chaetophractus vellosus) | 7 | 6 | 1 | No | – | ||
| Zorro gris(Lycolapex gimnocercus) | 2 | 1 | 1 | No | 1 ♂ | Nódulo mesentérico | 96 (1) |
| Hurón menor(Galictis cuja) | 1 | – | 1 | No | |||
| Liebre europea(Lepus europaeus) | 4 | 3 | 1 | No | |||
| Total | 95 | 45 | 50 | 9 |
Los aislamientos obtenidos en comadrejas fueron a partir del conjunto de ganglios de cabeza (n=4), pulmón (n=2) y pool de hígado, bazo y riñón (n=1). En el zorro se obtuvo a partir de nódulos mesentéricos y en la rata de pulmón (tabla 1).
En las capturas de comadreja overa no se encontraron asociaciones significativas entre tasa de aislamiento de M. bovis y sexo (p=0,418), prevalencia de infección en el rodeo de vacas (p=0,29) y tamaño del rodeo (p=0,293). Los rodeos con reinfección tuvieron 4 veces más riesgo de aislamiento de M. bovis en la fauna silvestre capturada dentro de sus predios que los rodeos infectados (p=0,045).
La tipificación molecular de los aislamientos obtenidos de la fauna silvestre corroboró que estos pertenecían a la especie M. bovis. Se identificaron 4 spo diferentes. A partir de 4 comadrejas y de una rata se aisló en 4 ocasiones el spo 34 y en 3 el spo 12. Se detectó en una sola oportunidad el spo 96, obtenido de zorro, y el spo 122, proveniente de una comadreja (tabla 1).
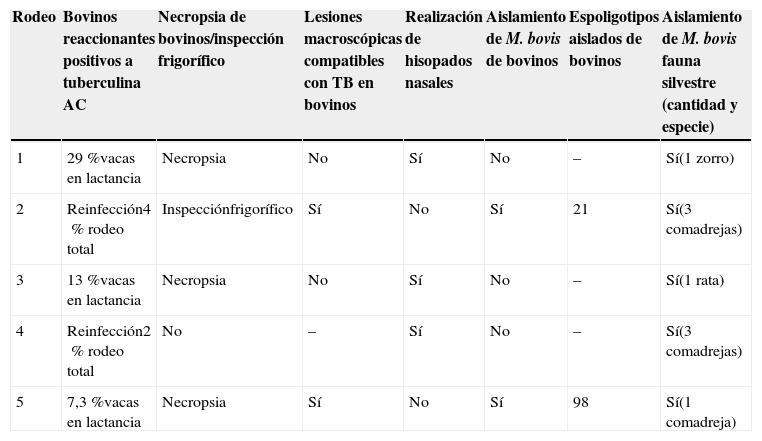
En todos los establecimientos estudiados se obtuvo al menos una cepa de M. bovis en alguna de las especies de animales silvestres capturados (tabla 2).
Aspectos epidemiológicos de tuberculosis bovina en los 5 rodeos lecheros investigados
| Rodeo | Bovinos reaccionantes positivos a tuberculina AC | Necropsia de bovinos/inspección frigorífico | Lesiones macroscópicas compatibles con TB en bovinos | Realización de hisopados nasales | Aislamiento de M. bovis de bovinos | Espoligotipos aislados de bovinos | Aislamiento de M. bovis fauna silvestre (cantidad y especie) |
|---|---|---|---|---|---|---|---|
| 1 | 29%vacas en lactancia | Necropsia | No | Sí | No | – | Sí(1 zorro) |
| 2 | Reinfección4% rodeo total | Inspecciónfrigorífico | Sí | No | Sí | 21 | Sí(3 comadrejas) |
| 3 | 13%vacas en lactancia | Necropsia | No | Sí | No | – | Sí(1 rata) |
| 4 | Reinfección2% rodeo total | No | – | Sí | No | – | Sí(3 comadrejas) |
| 5 | 7,3%vacas en lactancia | Necropsia | Sí | No | Sí | 98 | Sí(1 comadreja) |
Se realizaron necropsias de bovinos en 3 de los 5 establecimientos; se observaron lesiones macroscópicas de TBb en un animal del cual se logró aislamiento (tabla 2). El otro aislamiento se obtuvo de lesiones observadas en frigorífico cuando del rodeo se enviaron animales a faena (tabla 2). Los intentos realizados para obtener más aislamientos utilizando la técnica de hisopados nasales sobre bovinos positivos a tuberculina no produjeron resultados positivos. Los aislamientos de M. bovis provenientes de estos establecimientos correspondieron al spo 21 para el establecimiento 2 (obtenido en frigorífico) y al spo 98 para el establecimiento 5 (tabla 2).
DiscusiónEl aislamiento de M. bovis en fauna autóctona de Argentina está en relación con la capacidad de M. bovis de infectar a un amplio rango de hospedadores12,29. La infección en especies de carnívoros y omnívoros parece ocurrir como consecuencia de la presencia de la infección en bovinos u otros rumiantes5,11,13,32,34,37,39.
La prevalencia de infección por M. bovis sobre el total de animales silvestres capturados, que fue del 9,4%, se considera elevada y podría estar relacionada con los altos niveles de infección que presentaban los rodeos bovinos que cohabitaban con ellos. Se han observado prevalencias de infección también elevadas (>4%) en carnívoros y omnívoros en un área donde existe un huésped silvestre de mantenimiento, como lo es el ciervo de cola blanca (Odocoileus virginianus)39 en el estado de Michigan, EE. UU.5.
La prevalencia de infección por M. bovis en comadrejas overas (D. albiventris) obtenida en este estudio (12,7%) fue superior a la descrita en comadrejas de América del Norte (Didelphis virginiana), las cuales adquieren la infección por consumo de despojos de ciervos de cola blanca (O. virginianus) y donde tampoco presentaron lesiones visibles o sospechosas de TB5,39.
El aislamiento de M. bovis en animales silvestres sin lesiones visibles ha sido informado tanto en especies consideradas reservorios9 como en aquellas consideradas hospedadores finales5,13,25. Esta falta de identificación de lesiones en animales silvestres infectados puede deberse a varios factores, entre ellos la metodología utilizada en las necropsias y los muestreos, así como los relacionados con la virulencia de la cepa de M. bovis, la resistencia natural del huésped, la especie y la edad del animal18.
El aislamiento de M. bovis en ratas (R. norvegicus) fue comunicado previamente en 2 relevamientos de fauna silvestre, publicados en 198224 y 200212, correspondientes a las áreas endémicas del sur del Reino Unido, como Dorset y Gales, donde se informaron niveles bajos de infección, del orden del 2,2 y el 1,2%, respectivamente. Se considera esta especie como muy resistente a la enfermedad, ya que la inoculación experimental con dosis altas de M. bovis no produce desarrollo de lesiones12,24. Esto hace de la rata un hospedador poco probable de transmitir la infección a otras ratas o a otras especies de animales, dada la escasa probabilidad de excreción de M. bovis24.
El hallazgo de la infección en uno de los 2 zorros capturados es coincidente con otros trabajos del Reino Unido12,13,24 y EE. UU.5,6, en los que también se obtuvo M. bovis de zorros. En estos casos, los aislamientos de M. bovis se obtuvieron siempre a partir de linfonódulos como los faríngeos, mediastínicos, bronquiales y mesentéricos, los que en su mayoría carecían de lesiones visibles6,12,13,24. El hábito de estos animales de ingerir carroña hace que la principal vía de ingreso de la infección sea la digestiva, al consumir los despojos de los animales que actúan como reservorios de TB y que están presentes en su medio ambiente6,13,24,28,39.
La vía digestiva puede ser también una vía de excreción de M. bovis en los zorros infectados, aunque la mayoría no presente lesiones macroscópicas. A pesar de esta incertidumbre en el desarrollo de la enfermedad en la especie, el riesgo de transmisión de la TB a los bovinos no parecería ser alto13. La baja cantidad de zorros obtenidos en el presente trabajo se debió a las dificultades que la captura de esta especie presenta en las provincia de Santa Fe, pues al no estar legalizada su caza es difícil contar con la ayuda de cazadores deportivos, lo cual hubiera permitido obtener mayor número de muestras y así determinar con mayor representatividad el peso de la infección en esta especie.
La tasa de aislamientos obtenidos en comadrejas overas a partir de ganglios de la cabeza (4/7) y de pool de órganos como bazo, hígado y riñón (1/7) indicaría que la digestiva podría ser la principal vía por la cual las comadrejas adquieren la infección, lo que se corresponde con su capacidad de alimentarse de carroña. La localización en pulmón de M. bovis (2/7) orienta hacia otra de las vías probables de entrada de la bacteria a esta especie, en la que se requeriría un estrecho contacto entre la comadreja y el animal infectado excretor. La comadreja es un animal nocturno que merodea las instalaciones rurales en búsqueda de alimento, la interacción con bovinos puede darse en estos espacios o bien en la proximidad de su hábitat, que para el caso de los rodeos lecheros seleccionados fueron las estrechas arboledas y los pajonales ubicados contiguos a los alambrados perimetrales de las pasturas.
Otra posible explicación del aislamiento de M. bovis a partir del pulmón de esta especie puede estar en su comportamiento. Estos animales son principalmente solitarios y de carácter agresivo entre congéneres, esta conducta es bien pronunciada entre machos. Durante la época de apareamiento, las hembras suelen ser agresivas con los machos pero estos no responden a la agresión19. Es probable que durante estos contactos ocurra la eliminación de aerosoles por parte de individuos infectados; de esta manera, la infección se trasladaría de un animal a otro. En el presente trabajo las infecciones se detectaron mayoritariamente en machos, pero esto no tuvo peso estadístico (p=0,418). Esta ruta de los aerosoles se mostró eficaz en infecciones experimentales en comadrejas de América del Norte (D. virginiana) y llevó al desarrollo de lesiones, particularmente en pulmones16.
Esta susceptibilidad a M. bovis de comadrejas, muy semejante a la observada en comadrejas de América del Sur, fue comprobada también por otras vías, como la digestiva y la intramuscular16. La eliminación de M. bovis fue evaluada en materia fecal y se comprobó que muy pocos animales eliminaban la bacteria por esta vía, independientemente de la ruta y la dosis utilizadas para establecer la infección15,16.
El hecho de que no se observaron lesiones visibles, a pesar de los aislamientos logrados en varios individuos de comadrejas, hace suponer una lenta evolución de la enfermedad cuando la infección ocurre naturalmente en esta especie, sin afectar la condición corporal de los individuos. En forma similar, ni la condición corporal ni tampoco el comportamiento parecieron estar afectados en las comadrejas originarias de América del Norte que desarrollaron lesiones en las inoculaciones experimentales, aunque estos animales no sobrepasaron los 90 días postinoculación, ya que fueron sacrificados16.
Debido a la semejanza entre ambas comadrejas (D. virginiana y D. albiventris), que pertenecen al mismo género junto con otras especies más del continente americano38, es de esperar una susceptibilidad similar de la comadreja sudamericana D. albiventris a M. bovis. En el estado de Michigan (EE. UU.) se considera a D. virginiana como un probable hospedador circunstancial o «spillover host» de M. bovis; esto significa que si bien puede ser un potencial reservorio, no tendría un papel importante en la transmisión del organismo a los ciervos y bovinos15,16. Estos antecedentes también permitirían formular la hipótesis de que la especie D. albiventris podría ser otro hospedador circunstancial o «spillover host» de M. bovis.
Los spo encontrados en los 2 aislamientos obtenidos de bovinos (21 y 98) no se correspondieron con los spo de los aislados de animales silvestres. Esto tal vez se deba a las pocas oportunidades que se tuvo de realizar necropsias en los bovinos y de obtener material para cultivo. El uso de hisopados nasales como método para obtener aislamientos de M. bovis a partir de bovinos vivos y positivos a la PT no se mostró competente para tal fin, por lo menos en este trabajo. Ambos spo han sido previamente detectados en aislamientos de bovinos en Argentina, el spo 21 es el segundo en frecuencia a nivel nacional40.
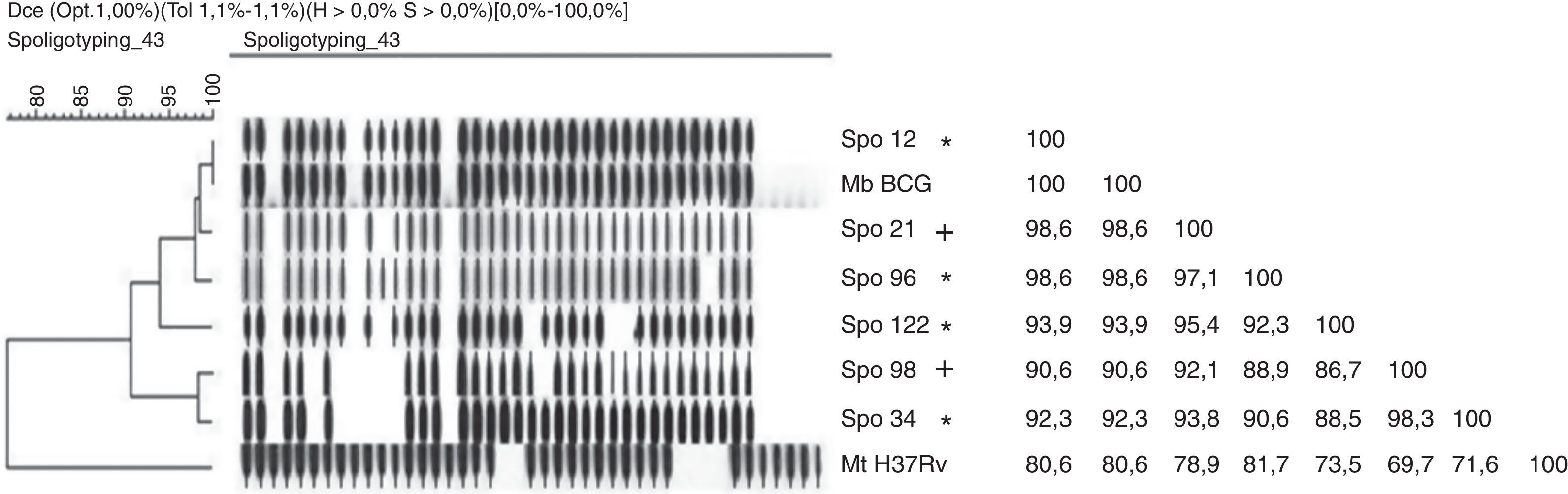
Los patrones de spo 34 (4/9) y 12 (3/9) de M. bovis obtenidos de 6 ejemplares de comadrejas y de la rata también registran numerosas notificaciones de aislamiento en bovinos de Argentina, encabezando este ranking el spo 34, que agrupa al 45% de aislamientos7,40,41. En la provincia de Santa Fe, estos ocupan el primer y el tercer lugar en frecuencia de aislamiento en bovinos (Zumárraga, comunicación personal). El spo 96 obtenido del zorro es el segundo aislamiento de este tipo registrado en el país, ya que el primero se obtuvo de un puma en cautiverio (Traversa, comunicación personal). Por otra parte, este se diferencia del spo 12 por la ausencia de un solo espaciador (el n.° 35), ambos patrones están relacionados en un 98,6% (fig. 2). Esto sería un posible indicador de que el spo 12 habría sido el precursor del spo 96, originado mediante la pérdida del espaciador 35. Cabe destacar que según la teoría evolutiva de las micobacterias del complejo M. tuberculosis propuesta por Brosch et al.4, aquella habría sido unidireccional en el sentido de pérdida de material genético en forma progresiva. En el mismo marco evolutivo, el spo 98 habría derivado del spo 34 por la pérdida del espaciador 23 (fig. 2).
Dendrograma y matriz de similitud entre espoligotipos de M. bovis aislados de animales silvestres y de bovinos de la cuenca lechera de Santa Fe y las cepas de referencia M. bovis BCG y M. tuberculosis H37Rv.
*: aislamientos obtenidos en fauna silvestre; +: aislamientos obtenidos en bovinos
El spo 122 obtenido de una comadreja representa un patrón único y exclusivo, tanto de hospedador como de país (Argentina); este no se ha detectado en ninguna otra especie ni país, y no está registrado en la base de datos internacional (www.mbovis.org). Este spo se diferencia del spo 21 por la ausencia de los espaciadores 22, 28 y 29 (fig. 2).
Esta correlación entre los spo circulantes en los bovinos de Argentina y los obtenidos en los animales silvestres objeto de captura indica el pasaje de la infección de los primeros a las especies silvestres en una de las zonas lecheras más importantes de la Argentina.
Se concluye que las especies autóctonas de comadreja overa, zorro gris y rata son susceptibles de adquirir la infección de M. bovis cuando comparten hábitat con bovinos con alto nivel de infección. La presencia de spo de M. bovis en fauna silvestre detectados previamente en bovinos demuestra la transmisión desde el bovino hacia los otros hospedadores.
Debido al aislamiento de M. bovis de comadreja overa puede considerarse a esta especie como un probable hospedador circunstancial o «spillover host» de este importante patógeno. Sin embargo, la importancia que la infección en esta especie silvestre puede tener sobre los programas de control y erradicación de la TBb vigentes en esta región de Argentina se conocerá cuando los niveles de infección de los rodeos bovinos decrezcan notoriamente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónProyecto Específico AESA - 202831 «Tuberculosis» Instituto Nacional de Tecnología Agropecuaria, Argentina.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Roxana Galarza, Miguel Marin, Oscar Warnke, Santiago Nava, Mario Argañaraz y Ariel Risso, por su valiosa colaboración en las tareas de campo. A Marcelo Signorini, por su colaboración en el análisis estadístico. A los compañeros del Área de Recursos Naturales y Suelos de la EEA INTA Rafaela. A los colegas veterinarios Adalberto Racca, Juan M. Feroglio, Elvio Ballari, Julio Rho y Rubén Morra, por su estimada ayuda en la selección de los rodeos, y a los productores y su personal, que colaboraron y permitieron los muestreos en sus campos.