Las cepas de Escherichia coli productoras de toxina Shiga (STEC) son reconocidas como responsables de un alto número de casos de enfermedades de transmisión alimentaria a nivel mundial. Su patogenicidad ha sido vinculada directamente con la actividad de las toxinas (Stx); sin embargo, la habilidad de estas bacterias para colonizar al huésped y otras superficies puede ser esencial para desarrollar su poder patogénico. La gran plasticidad genómica de cepas STEC se infiere de la variabilidad de perfiles de virulencia, con la frecuente emergencia de cepas con nuevos genes, codificados en nuevas islas de patogenicidad vinculadas al metabolismo y la adherencia. La formación de biofilm es un mecanismo espontáneo por el cual las cepas STEC resisten en un ambiente hostil, lo que les permite sobrevivir y, de esa forma, llegar al huésped, a través de los alimentos o de las superficies que están en contacto con ellos. Este mecanismo presenta una alta variabilidad intra e interserotipo y su desarrollo no depende solo de los microorganismos que lo conforman. Factores inherentes al ambiente (pH, temperatura) y la superficie (acero inoxidable, poliestireno) a la que pueden adherirse influyen en la expresión de biofilm. El concepto «una salud» implica la interrelación entre los actores de salud pública, animal y ambiental para lograr alimentos inocuos y evitar contaminación cruzada y resistencia a sanitizantes, lo cual pone de manifiesto la necesidad de identificar patógenos emergentes a través de nuevos marcadores moleculares, que detecten cepas STEC portadoras del denominado locus for enterocyte effacement (LEE) o del locus de adherencia y autoagregación (LAA).
Shiga Toxin-producing Escherichia coli (STEC) is recognized as being responsible for a large number of foodborne illnesses around the world. The pathogenicity of STEC has been related to Stx toxins. However, the ability of STEC to colonize the host and other surfaces can be essential for developing its pathogenicity. Different virulence profiles detected in STEC could cause the emergence of strains carrying new genes codified in new pathogenicity islands linked to metabolism and adherence. Biofilm formation is a spontaneous mechanism whereby STEC strains resist in a hostile environment being able to survive and consequently infect the host through contaminated food and food contact surfaces. Biofilm formation shows intra-and inter-serotype variability, and its formation does not depend only on the microorganisms involved. Other factors related to the environment (such as pH, temperature) and the surface (stainless steel and polystyrene) influence biofilm expression. The «One Health» concept implies the interrelation between public, animal, and environmental health actors to ensure food safety, prevent cross-contamination and resistance to sanitizers, highlighting the need to identify emerging pathogens through new molecular markers of rapid detection that involve STEC strains carrying the Locus of Enterocyte Effacement or Locus of Adhesion and Autoaggregation.
En el siglo XIX, el patólogo alemán Rudolph Virchow propuso que la medicina animal y la medicina humana debían estar correlacionadas, con una visión integradora de ambas. Su teoría se basaba en que más de la mitad de los patógenos que afectan al ser humano provienen de los animales63. Actualmente, la alianza tripartita conformada por la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la Organización Mundial de Sanidad Animal (OIE) y la Organización Mundial de la Salud (OMS)44 han incorporado el concepto de «una salud» y emitido una guía para establecer mecanismos nacionales de coordinación, comunicación y colaboración multisectoriales para hacer frente a las amenazas que plantean las enfermedades. El objetivo de este concepto es reconocer los vínculos importantes de los riesgos sanitarios en la interfaz hombre-animal-medio ambiente, considerando de gran importancia el abordaje integral de las enfermedades31.
La OMS afirma que las enfermedades de transmisión alimentaria (ETA) constituyen uno de los problemas de salud más relevantes, tanto en los países desarrollados como en los países en vías de desarrollo. Cada año enferman aproximadamente 600 millones de personas (casi uno de cada 10 habitantes del planeta) por ingerir alimentos contaminados, de las cuales 420.000 mueren43. Si bien existen diversas causas de origen infeccioso, un agente representativo es Escherichia coli productora de toxina Shiga (STEC), reconocida como responsable de un alto número de casos de ETA a nivel mundial. Esta bacteria puede producir diarrea, colitis hemorrágica (CH) o síndrome urémico hemolítico (SUH)2,69. Se trata de un microorganismo zoonótico transmitido al huésped, en general, por el consumo de agua o alimentos, principalmente carne, contaminados a partir de materia fecal5,59. La contaminación del medio ambiente a través de bacterias eliminadas en la materia fecal y el contacto directo con el cuero contaminado por animales son causas que no deben subestimarse13,25.Debido a la relevancia de STEC como responsables de ETA, el objetivo de este trabajo fue realizar una actualización sobre las estrategias y los factores de virulencia utilizados por este grupo bacteriano para sobrevivir en distintos nichos ecológicos.
¿Por qué STEC es patógeno?E. coli es un microorganismo comensal que se aloja en el tracto gastrointestinal de animales y humanos9. Si bien la mayoría son bacterias comensales, muchas tienen la capacidad de adquirir factores de virulencia que las convierten en patógenas para el ser humano23. Entre las E. coli patógenas se encuentran las que tienen la capacidad de producir toxina Shiga (Stx), a las que se conoce como STEC42. Si bien se considera al ganado bovino como el principal reservorio de STEC, también se han aislado de otras especies animales destinadas al consumo humano, como pollos y cerdos, entre otras1,13,25. La transmisión al humano generalmente se da mediante el consumo de alimentos o aguas contaminadas; sin embargo, se han registrado casos aislados y brotes generados por el contacto directo con animales portadores, con ambientes contaminados, por el contacto persona-persona y por la vía fecal-oral. Se ha demostrado, también, el rol del ser humano como portador asintomático22,48.
En Argentina, durante el 2019, se notificaron 220 casos de SUH, de los cuales 179 (81%) correspondieron a niños menores de cinco años56. Las consecuencias del SUH en nuestro país son alarmantes, ya que esta afección constituye la primera causa pediátrica de insuficiencia renal aguda y la segunda de insuficiencia renal crónica, y es, además, responsable del 20% de los trasplantes renales en niños, niñas y adolescentes51.
El principal factor de virulencia de STEC es la producción de Stx, con sus variantes y subtipos. Se reconocen, principalmente, dos variantes, Stx1 y Stx2, con cuatro subtipos pertenecientes a Stx1 (Stx1a, Stx1c Stx1d y Stx1e) y 12 subtipos pertenecientes a Stx2 (Stx2a-Stx2l, entre otros)22,35,54. Una misma cepa puede producir un subtipo o combinaciones de ellos. Si bien se ha establecido una relación entre subtipos de Stx y enfermedad grave, actualmente se considera que todos los subtipos están relacionados con patogenicidad6,22,33.
La patogenicidad de STEC se ha relacionado directamente con la actividad de las toxinas; sin embargo, la habilidad de la bacteria para colonizar el epitelio intestinal del huésped es esencial para la patogénesis, y este proceso ha sido considerado como el «primer eslabón» para que se desarrolle la enfermedad32.
Existe una gran variedad de genes de STEC vinculados al proceso de adherencia, muchos de los cuales están organizados en islas de patogenicidad (PAI)38. Las PAI son conjuntos de elementos genéticos móviles conformados por un subgrupo de genes de virulencia que se encuentran presentes en bacterias patógenas y contribuyen a la virulencia de las cepas que las portan y a la patogénesis17,20; la transferencia horizontal favorece la evolución de este patógeno22.
Un grupo de cepas STEC portan el locus for enterocyte effacement (LEE), una PAI que contiene los genes necesarios para adherirse al intestino del huésped y producir la lesión attaching and effacing (A/E), característica del desarrollo de enfermedades causadas por STEC24,30. A partir de la presencia o ausencia de este locus, las cepas se clasifican en LEE-positivas o LEE-negativas57.
Mientras que las cepas LEE-positivas han sido ampliamente descriptas, las carentes de LEE no han sido suficientemente estudiadas en cuanto a los mecanismos genéticos relacionados con la patogenicidad16,39. Sin embargo, se ha detectado que el LEE no es indispensable para la patogénesis debido a que muchas cepas STEC implicadas en la enfermedad grave en el ser humano (incluyendo el SUH) no portan este locus38,39. Se han reportado factores de virulencia únicos en cepas LEE-negativas, como la adhesina aglutinante de STEC (Saa)46, el autotransportador Sab32 y la citotoxina subtilasa (SubAB)45, todos codificados en el plásmido de virulencia pO11357, aunque hay cepas que carecen de este plásmido. Si bien algunos factores de virulencia no pueden considerarse esenciales para las infecciones humanas, podrían facilitar la supervivencia y la persistencia de las cepas en diferentes ambientes65.
Las cepas LEE-negativas no poseen los genes necesarios para producir la lesión A/E, pero poseen otros factores de virulencia adicionales27, como aquellos codificados en la PAI denominada locus de adherencia y autoagregación (LAA). Esta isla se compone de 80 genes y está organizada en cuatro módulos. Puede presentarse en algunos serotipos STEC LEE-negativos en forma completa (los cuatro módulos) o incompleta, es decir, con solo algunos módulos. Se conoce que los genes que la integran se pueden movilizar independientemente por transferencia genética horizontal. Análisis filogenéticos realizados con la secuencia completa del genoma han mostrado que LAA completa está exclusivamente presente en cepas LEE-negativas patógenas aisladas de casos de CH y SUH39. Esto permitiría reconocer que cepas LEE-negativas portadoras de LAA completa están asociadas a patogenicidad.
Cada módulo de LAA posee varios genes, aunque para su caracterización se detectan solo uno o dos genes por módulo. El gen hes codifica proteínas que participan en la autoagregación y la adherencia e invasión, y se encuentra en el módulo 1. Los genes iha y lesP se encuentran dentro del módulo 2. Iha es una proteína que confiere adherencia y también un receptor de sideróforos, que puede estar codificada en uno o dos genes localizados en elementos genéticos móviles15. El gen lesP codifica una variante de una serinproteasa autotransportadora de enterobacterias (SPATE), que, al ser parte de LAA, tiene el nombre de lesP39. El módulo 3 posee los genes pagC y tpsA, entre otros. El gen pagC tiene un 60% de similitud con el gen homólogo pagC que codifica una proteína de la membrana externa importante en la resistencia sérica en Salmonella enterica39,41. Por otro lado, tpsA ha sido relacionado con múltiples funciones, como son la adherencia, la proteólisis, la inhibición de la fagocitosis, la agregación y formación de biofilm34. Finalmente, el gen agn43 se encuentra en el módulo 4, el cual se relaciona con la capacidad de autoagregación y acúmulo de células, lo que promueve la formación de biofilm50. Nuestro grupo ha detectado que el 46% de las cepas LEE-negativas aisladas de bovinos y alimentos portan LAA con los cuatro módulos, y se pudo relacionar esta característica con aquellas cepas altamente patógenas16.
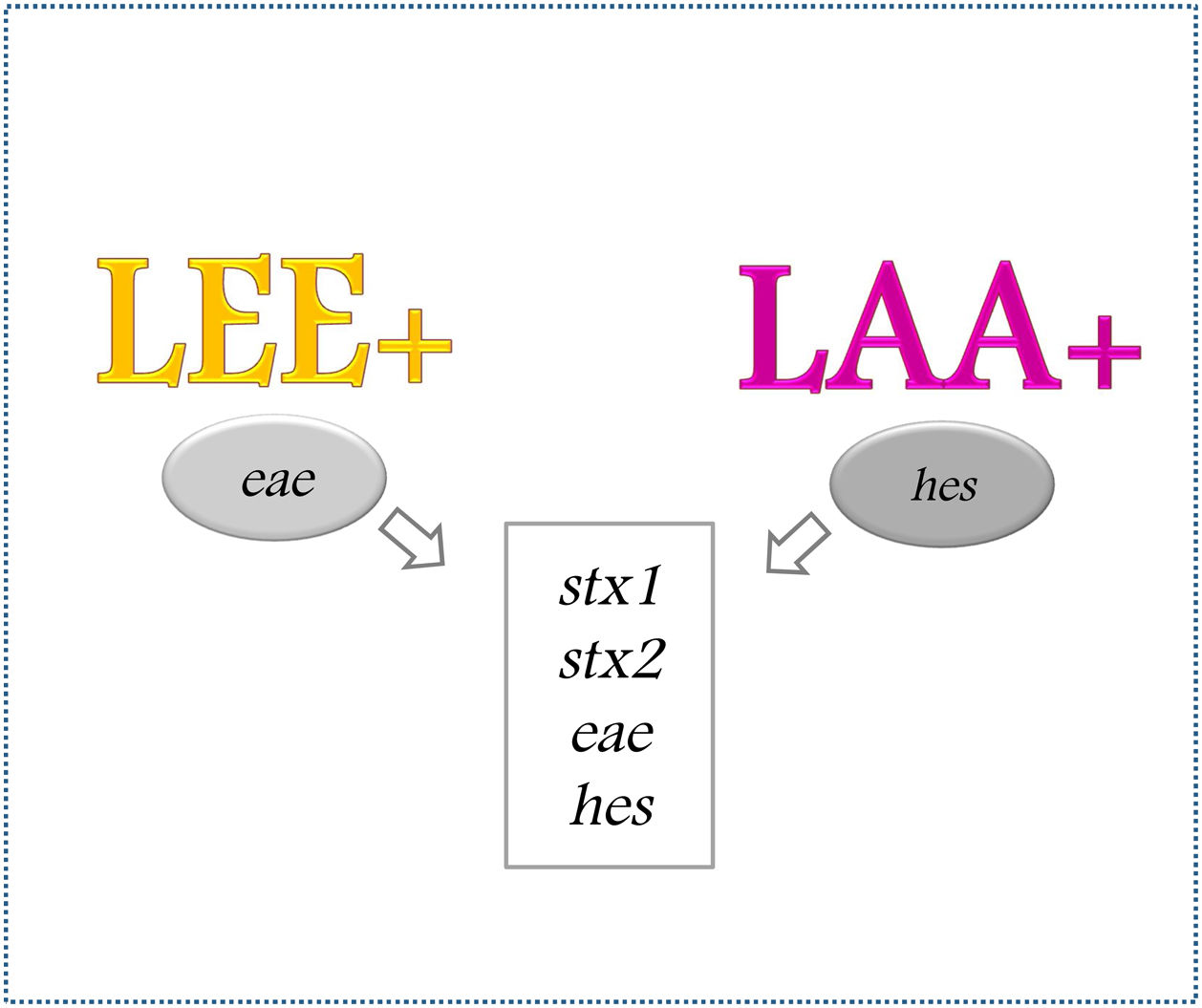
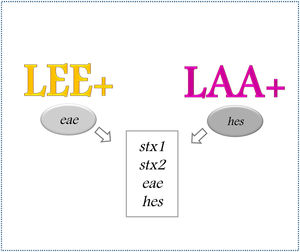
Si bien la mayoría de las cepas STEC aisladas de casos de CH y SUH portan el gen eae, existen cepas carentes de aquel (eae-negativas), con mecanismos alternativos de adherencia, como la isla de patogenicidad LAA. Por lo tanto, consideramos que la detección de genes en conjunto, como stx1, stx2, hes y eae, podría ser importante como indicador de cepas con alto potencial patogénico (fig. 1).
Muchos nombres para STECDentro de STEC existen más de 100 serotipos asociados con infecciones humanas esporádicas y epidémicas22, O157:H7 es el serotipo más estudiado en términos de investigación y marco regulatorio29,58. Sin embargo, en un estudio realizado entre los años 2000 y 2005 en 35 países, se registró un incremento global del 60,5% en casos de enfermedades producidas por STEC no-O15718. En EE. UU., el grupo llamado «Big Six»67, que incluye los serogrupos O26, O45, O103, O111, O121 y O145, fue responsable del 70% de las infecciones provocadas por STEC no-O157. Las cepas pertenecientes a los serotipos O91:H21 y O174:H21 también han sido asociadas a enfermedad grave en el humano7,28; sin embargo, no se encuentran dentro de los protocolos de detección de nuestro país, que incorporó al Código Alimentario los serotipos más prevalentes asociados a SUH10.
Aunque los serotipos son importantes en los seguimientos epidemiológicos (ya sea para evaluar la incidencia o detectar casos y brotes), no es posible atribuir la patogenicidad o la capacidad de producir enfermedad grave a cepas de STEC considerando únicamente serogrupos o serotipos22. Teniendo en cuenta la variabilidad genómica de las cepas de STEC, la detección de los factores de virulencia exclusivamente podría dificultar la asociación con la patogenicidad, debido a que dichos factores están codificados en elementos genéticos móviles que pueden a su vez ocasionar la emergencia de cepas con factores genéticos aún desconocidos11.
Un trabajo de a dosLas características genéticas de STEC favorecen, en mayor o menor medida, la infección, pero existen otros factores que influyen en la ocurrencia y gravedad de las infecciones clínicas. El huésped que recibe a este tipo de patógenos desempeña un rol importante a la hora de desarrollar la enfermedad. Se han observado asociaciones entre la edad y el riesgo a desarrollar una enfermedad; en este sentido, se ha demostrado que los pacientes menores de cinco años son especialmente propensos a desarrollar SUH8. No solo la edad es un factor importante. Un estudio realizado en humanos en Japón analizó la presencia del receptor de la toxina Shiga, globotriaosylceramida (Gb3), y demostró que existe mayor riesgo de contraer SUH en personas de sexo femenino mayores de 20 años que en personas de sexo masculino26. La genética humana y la sensibilidad individual pueden afectar el desarrollo de esta enfermedad y su gravedad22.
¿Sola o en comunidades?Los biofilms, también llamados biopelículas, son definidos como comunidades complejas de microorganismos que crecen embebidos en una matriz orgánica polimérica, producida por las propias células y adherida a una superficie viva o inerte. Estos microorganismos presentan un fenotipo alterado comparado con el de sus contrapartes planctónicas respecto de la tasa de crecimiento y la transcripción genética pueden presentar una única especie microbiana (biofilms monoespecie) o un abanico de especies diferentes (biofilms multiespecie)21.
Su formación es espontánea, simplemente en presencia de humedad y nutrientes mínimos se pueden desarrollar biofilms. Se ha comprobado que estas matrices les otorgan a las bacterias la capacidad de adaptarse a medios adversos. El mecanismo de formación de biofilms consiste en la adherencia de bacterias a una superficie, mientras que van captando nutrientes y multiplicándose, con lo que inician nuevos cambios estructurales que le brindan mayor resistencia al biofilm y sintetizan unos de sus principales componentes, el glucocálix21.
Los biofilms pueden ser uno de los mecanismos que facilitan que los patógenos lleguen al huésped, ya que se pueden formar tanto sobre los alimentos como sobre las superficies que están en contacto con estos3,60. Es por ello que se considera de suma importancia la eliminación de todos los microorganismos presentes en áreas de manipulación de alimentos, para evitar, de esta manera, su contaminación mediante biofilms68.
La formación de biofilms es una estrategia por la cual STEC puede persistir en el medioambiente49,64. Estas matrices se encuentran compuestas por microorganismos de diferentes géneros y especies, lo que implica la interacción coordinada de muchas células al unísono66. Esta expresión fenotípica se encuentra mediada por la combinación de diversos elementos genéticos y depende de las condiciones en las que se encuentren las bacterias que lo conforman.
Se ha indicado que la expresión de la fimbria curli y la síntesis de exopolisacáridos podrían estar relacionadas con una mayor capacidad de formar biofilms. A pesar de ello, no todas las cepas curli-positivas han sido asociadas a una mayor formación de biofilms3. Un estudio realizado en nuestro laboratorio comparó la expresión de la fimbria curli con la formación de biofilms a distintos tiempos (0, 6 y 20 h) entre dos cepas STEC, una O91 nativa y otra O91 mutante con la deleción de LAA (ΔLAA). Los resultados demostraron que la cepa O91 ΔLAA expresó la fimbria curli en forma sostenida, mientras que la cepa O91 nativa solo lo hizo a las seis horas del comienzo de la formación del biofilm y luego dejó de expresarla. Este ensayo sugiere que la expresión de curli podría estar relacionada con la ausencia de LAA, lo que permite observar que existe una expresión coordinada de adhesinas que interactúan en un momento determinado62. Para adaptarse a la vida del biofilm, una bacteria sufre cambios; uno de ellos es la activación de genes que codifican proteínas estructurales y enzimáticas68. Estos genes y proteínas son los que explican la fijación y la resistencia a desinfectantes y antibióticos por parte de las bacterias que conforman los biofilms55.
Dentro de STEC, la presencia de ciertos genes como sab, hes, iha, agn43 o lpf y la expresión de la fimbria curli se encuentran asociadas al proceso de patogénesis y a la capacidad de formar biofilms24,39,49,52. Brevemente, sab es un gen localizado en el megaplásmido pO113, que tiene como función promover la adherencia al epitelio intestinal y mediar la formación de biofilms32. El gen hes se encuentra en ciertas cepas STEC LEE-negativas y en todas las cepas LAA-positivas; dicho gen participa en la síntesis de factores de virulencia relacionados con la colonización, incluyendo la hemaglutinación, la adherencia y la autoagregación39. Para profundizar sobre la participación de LAA en biofilms, se realizó un ensayo en el que se comparó una cepa STEC LAA-positiva nativa, una cepa mutante con la deleción de hes y otra cepa mutante con la deleción de LAA. Los resultados demostraron que, si bien todas las cepas formaron biofilms, las cepas mutantes lo hicieron en menor grado que la cepa nativa, de lo que se puede inferir una posible participación de hes y LAA en la formación de biofilms61.
Más allá de los genesLa formación de biofilms presenta una alta variabilidad y, como se mencionó, su desarrollo no depende solo de los microorganismos que lo conforman. Factores inherentes al ambiente y a la superficie donde aquellos pueden adherirse van a influir en la expresión de biofilm de cada cepa. En nuestro laboratorio se han realizado múltiples ensayos para analizar esta variabilidad en diferentes condiciones incluyendo distintas temperaturas y pH, o presencia de desinfectantes, entre otros11,12,60. Se determinó que a temperaturas óptimas (37°C), todas las cepas fueron clasificadas como fuertes formadoras de biofilm. Sin embargo, no se detectó formación de biofilm cuando las mismas cepas fueron expuestas a temperaturas bajas (5°C) o altas (54°C), como las de conservación en heladera o de cocción de alimentos, respectivamente11.
Otro factor importante es la influencia de la superficie en la cual se forman estas matrices. Se ha analizado la capacidad de STEC de formar biofilms sobre diferentes superficies, tales como el acero inoxidable y el poliestireno, materiales comúnmente utilizados en la industria alimentaria y el ambiente doméstico. Se ha demostrado que el acero inoxidable no favorece la formación de biofilms en comparación con el poliestireno11,12,37.
La variabilidad de las cepas STEC para formar biofilms ha sido documentada en numerosos estudios. Y más allá de la poca o gran capacidad que tengan para hacerlo, lo cierto es que formar comunidades les confiere resistencia a antibióticos y sanitizantes, lo que conlleva un riesgo para la salud pública47.
Se ha estudiado la acción de diversos compuestos químicos con el fin de reducir la formación de biofilms, entre ellos, el hipoclorito de sodio, que es uno de los desinfectantes más utilizados tanto en la industria alimentaria como en los hogares. En concreto, se evaluó su actividad en los biofilms formados por cepas STEC, ensayando concentraciones de 2,5% y 5% de hipoclorito de sodio y diferentes tiempos de exposición (5, 10 y 20 min). Si bien el hipoclorito de sodio no pudo eliminar completamente los biofilms ya formados, la concentración del 5%, con 20 min de exposición, logró reducir la capacidad de las cepas de formar biofilms60. A pesar de que la concentración recomendada de este desinfectante para su uso en equipos, utensilios y superficies es del 1%, con 20 min de exposición53, este trabajo sugiere que ante biofilms ya desarrollados, esa concentración no es suficiente.
En cuanto al uso de alcohol como sanitizante y su efecto en los biofilms, Bae et al.4 analizaron su acción sobre acero inoxidable y polietileno, y encontraron una importante reducción de patógenos con el uso de alcohol. Dicho estudio sugiere que los desinfectantes a base de alcohol pueden ser una opción efectiva para reducir la contaminación microbiana y los biofilms, tanto en la industria alimentaria como a escala doméstica, independientemente de la superficie en la que se formen, pero no aseguran la eliminación completa.
La OMS ha afirmado que la resistencia bacteriana a antibióticos es una de las mayores amenazas para la salud mundial, la seguridad alimentaria y el desarrollo social44. Diversos estudios han demostrado que diferentes cepas de STEC (aisladas tanto de sus reservorios tradicionales como de los ambientes que los rodean) han desarrollado resistencia a los antibióticos14,19,36. Por esta razón, se considera que los biofilms pueden ser fuentes de cepas multirresistentes, lo cual es un peligro para la salud pública. Es así que las estrategias futuras de control de patógenos deben incluir medidas para prevenir la formación de biofilms65.
ConclusionesSi bien las toxinas Shiga son el principal factor de virulencia de las cepas STEC, su capacidad de adherirse al intestino es clave para poder desarrollar enfermedad en el humano, al igual que su capacidad de adherirse a distintas superficies y permanecer viables, lo que resultará en la contaminación de ambientes involucrados en la producción y comercialización de alimentos. Esta evidencia pone de manifiesto la necesidad de identificar estos patógenos y reducir la contaminación de alimentos y su transmisión al ser humano tras su ingesta. La Autoridad Europea de Seguridad Alimentaria (EFSA) propone la secuenciación del genoma completo para la detección de STEC22. Sin embargo, es una técnica que impide aplicarla como medida de diagnóstico y prevención, por ello remarcamos la importancia de incorporar marcadores moleculares de rápida detección que permitan identificar cepas LEE-positivas, LEE-negativas y LAA-positivas.
Existen ciertas discrepancias entre los distintos estudios que relacionan la capacidad de formar biofilms con determinados parámetros (tiempo, medio de cultivo, material). Naves et al.40 sugieren que esto puede deberse a que las cepas se podrían comportar de formas distintas in vitro debido probablemente a su composición genética, así como también a las condiciones de cada laboratorio, por lo tanto, es necesario que, a la hora de investigar este tipo de estructuras, se consideren de manera independiente la cepa bacteriana, las condiciones del ensayo y la superficie involucrada. Consideramos que el estudio en laboratorios con diferentes condiciones que pueden ser encontradas en la industria alimentaria, ya sea entorno, superficie o temperatura, resulta una herramienta útil y valiosa para conocer el comportamiento de bacterias que puedan transmitirse por alimentos y ser perjudiciales para la salud en humanos.
Esta información nos permite afirmar que al combatir problemas sanitarios generados por este tipo de patógenos, son indispensables las buenas prácticas de manufactura y el uso correcto de las temperaturas de conservación y mantenimiento. También se debe evitar la contaminación cruzada y la transferencia de STEC a alimentos desde el momento de la producción de la materia prima hasta la ingesta de cualquier alimento. Como se destaca al principio, el concepto de «una salud» implica la interrelación entre los actores de la salud pública, animal y ambiental para lograr alimentos inocuos. Asimismo, implica concientizar y difundir las medidas de prevención tendientes a evitar enfermedades de transmisión alimentaria. Consideramos que la inocuidad de los alimentos se debe cuidar desde la sanidad animal, pero también necesitamos implicarnos, como agentes de salud, en la adecuada comunicación a los consumidores, insistiendo en las medidas higiénico-sanitarias elementales como una forma de prevenir la transmisión de STEC a lo largo de toda la cadena productiva de cualquier tipo de alimento.
FinanciaciónFONCYT, PICT Proyecto 2666, 2015/Beca 79-Q29-Interna de fin de doctorado.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.