Con el objeto de caracterizar las poblaciones fúngicas, en particular las especies potencialmente micotoxigénicas, que pueden contaminar los granos de maíz almacenados en silos bolsa con un contenido de humedad superior al recomendado como seguro, se evaluaron 270 muestras extraídas al inicio, a los 90 días y al final de un período de almacenamiento de 5 meses. En dichas muestras se cuantificó e identificó la biota fúngica y se determinó la contaminación con fumonisinas y aflatoxinas. Asimismo, se evaluó el efecto de factores extrínsecos (ambiente), intrínsecos (granos) y tecnológicos (ubicación de los granos en el perfil del silo bolsa) sobre las poblaciones totales y micotoxigénicas. El pH de los granos y el nivel de O2 se redujeron significativamente a los 5 meses, mientras que la concentración de CO2 se incrementó en igual período. Los recuentos totales de la micobiota fueron significativamente mayores en los granos ubicados en el estrato superior del silo bolsa. Se identificaron especies micotoxigénicas de Fusarium, Aspergillus, Penicillium y Eurotium. La frecuencia de aislamiento de Fusarium verticillioides se redujo al final del almacenamiento y Aspergillus flavus solo se aisló en el inicio del almacenamiento. Los recuentos de Penicillium spp. y Eurotium spp. se incrementaron al final del almacenamiento. El 100% de las muestras presentaron contaminación con fumonisinas, con niveles máximos de 5,707mg/kg, mientras que las aflatoxinas contaminaron el 40% de las muestras con niveles máximos de 0,0008mg/kg. Las condiciones ambientales y de sustrato generadas durante el almacenamiento produjeron cambios en la composición de las poblaciones fúngicas y limitaron el desarrollo de hongos micotoxigénicos y la producción de micotoxinas.
In order to determine the behavior of mycotoxin-producing fungal populations linked with silobags stored corn grains with a moisture content greater at the recommended as safe, 270 samples taken in three times (beginning, 90 days, final) over a five month period of storage were evaluated. The fungal biota was quantified and identified and the contamination with fumonisin and aflatoxin was determined. Extrinsic factors (environment), intrinsic factors (grains) and technological factors (location of the grains in the profile of silobag) were taken into account to evaluate the presence and quantity of total and mycotoxigenic fungal populations. The pH of grains and O2 levels were significantly reduced after five months, while CO2 concentration increased in the same period. The total counts of mycobiota were significantly higher in grains located in the top layer of silobag. Mycotoxigenic species of Fusarium, Aspergillus, Penicillium and Eurotium were identified. The frequency of isolation of Fusarium verticillioides decreased at the end of storage and Aspergillus flavus was isolated only at the beginning of storage. The counts of the Penicillium spp. and Eurotium spp. were increased at the end of storage. Fumonisin contamination was found in all the samples (100%) with maximum levels of 5.707mg/kg whereas aflatoxin contaminated only 40% with maximum levels of 0.0008mg/kg. The environmental and substrate conditions generated during the storage limited the development of mycotoxigenic fungi and mycotoxin production.
La tecnología de silos bolsa para almacenar granos secos se ha convertido en una herramienta importante para los agricultores de la Argentina y otros países del mundo (Bartosik, comunicación personal). Los silos bolsa con mayor capacidad de almacenaje presentan dimensiones que alcanzan 100m de largo y 4,3m de diámetro, y poseen una capacidad de 500 toneladas de granos, aunque la capacidad más común es de 200 toneladas. Los silos bolsa son relativamente impermeables al agua y tienen un alto nivel de hermeticidad al oxígeno (O2) y al dióxido de carbono (CO2). La respiración de los componentes del granel (granos, insectos y hongos, entre otros) consume el O2 y genera CO225. Esto crea condiciones desfavorables para la supervivencia de los hongos y los insectos, lo que evita pérdidas de calidad de los granos36. Sin embargo, cuando los granos se almacenan con niveles de humedad por encima de los recomendados como seguros (para maíz, trigo y soja: 14%; para girasol: 11%) (http://www.cosechaypostcosecha.org, consultado en abril del 2015), existe alta probabilidad de que se desarrollen, además de los microorganismos aerobios estrictos, algunos anaerobios facultativos como bacterias y levaduras. Incluso algunas especies fúngicas, como Fusarium oxysporum, son capaces de cambiar su metabolismo y se adaptan a condiciones de ausencia de O242.
Numerosas especies de Fusarium, Aspergillus y Penicillium y de otros géneros colonizan los granos en el campo y pueden continuar su desarrollo bajo las condiciones del almacenamiento. Dado que algunas de ellas tienen la potencialidad de producir micotoxinas, además de alterar las propiedades físicas de los granos, estos agentes pueden causar inconvenientes a la salud humana y animal. Las manifestaciones de la toxicidad en los animales son tan diversas como las especies de hongos que producen estos metabolitos, aspecto que ha provocado una preocupación mundial sobre la alimentación y la seguridad alimentaria. El consumo repetido de dosis bajas de aflatoxinas, producidas por Aspergillus flavus, tiene un efecto mutagénico y cancerígeno en animales, además de ser letales a dosis altas. Las fumonisinas, producidas por especies de Fusarium, han sido relacionadas con algunas enfermedades específicas, como la leucoencefalomalacia equina y el síndrome de edema pulmonar en porcinos7. Si bien es conocido que las especies de Aspergillus y Penicillium presentan mayor competitividad durante el almacenamiento de granos secos respecto de las especies de Fusarium22,33, las especies de este género pueden crecer durante el almacenamiento cuando los granos están húmedos.
El deterioro producido por hongos en los granos almacenados depende de una serie de factores, que pueden clasificarse como extrínsecos, intrínsecos y de tipo tecnológicos40. Los factores extrínsecos se asocian a las condiciones ambientales, como la temperatura, la humedad relativa y la tensión de O2 y CO2. Los factores intrínsecos están relacionados con la composición química y las propiedades físicas de los granos, mientras que los de tipo tecnológico incluyen la ubicación de los granos en los distintos sectores de las estructuras que los contienen, en este caso particular, con referencia a los silos bolsa. Estos factores condicionarían el crecimiento de hongos, la potencial producción de micotoxinas y la calidad final del grano almacenado. Por ello, se comprende la relevancia de detectar la presencia de poblaciones fúngicas, así como la de conocer su distribución y tamaño y los factores ambientales que condicionan su desarrollo sobre los granos almacenados dentro de los silos bolsa.
La información recopilada podrá ser utilizada para diseñar estrategias y aplicar prácticas correctivas durante el cultivo o en el almacenamiento, y evitar pérdidas de calidad de los granos, principalmente por la producción de micotoxinas.
El objetivo de este estudio fue caracterizar las poblaciones de hongos, en particular las micotoxigénicas, que colonizan los granos de maíz almacenados en silos bolsa con humedades superiores a las recomendadas y también evaluar los factores extrínsecos, intrínsecos y de tipo tecnológico que podrían influir sobre dichas poblaciones.
Materiales y métodosSilos bolsaLas muestras de maíz se obtuvieron a partir de 5 silos bolsa ubicados en el sudeste de la provincia de Buenos Aires, Argentina (37° 45’ S, 58° 18’ O; 130m sobre el nivel del mar). Los silos bolsa (de polietileno de 250μm de espesor) tenían 60m de largo, 2,5m de diámetro, 1,7m de altura y una capacidad de almacenamiento de 180 toneladas de granos cada uno. El contenido de humedad de los granos registrado para cada uno de los 5 silos bolsa durante la cosecha fue superior al 14,5%. Los silos bolsa identificados como 1, 2, 3, 4 y 5 presentaron valores de humedad del 16,8%, el 16,9%, el 15,7%, el 15,4 y el 17,4%, respectivamente. La confección de los silos bolsa se realizó en julio (silos bolsa 1 y 2) y agosto (silos bolsa 3, 4 y 5) del 2010, y estos se extrajeron en diciembre del 2010 (silos bolsa 1 y 2) y enero del 2011 (silos bolsa 3, 4 y 5). En total, se analizaron 270 muestras de granos de maíz, extraídas a partir de 3 estratos del perfil vertical de los silos bolsa. El estrato superior abarcó una profundidad de 0 a 0,2m, el estrato medio de 0,2 a 0,6m y el estrato inferior de 0,6 a 1,8m. Además, a partir del punto de cierre de las bolsas, se establecieron diferentes zonas para la extracción de las muestras, ubicadas en 6 sectores equidistantes a lo largo de los silos bolsa: a los 10m (zona 1), los 20m (zona 2), los 30m (zona 3), los 40m (zona 4), los 50m (zona 5) y los 60m (zona 6). Las muestras se recogieron con un calador para granos de 1,8m de largo, en 3 tiempos del almacenamiento: al cierre de los silos bolsa (tiempo 1), luego de 90 días (tiempo 2) y antes de la apertura de los silos bolsa o final del período (tiempo 3). En cada estrato y zona se recogieron 3 muestras de aproximadamente 1,5kg para conformar una muestra compuesta de 4,5 a 5kg. Los granos recolectados se colocaron en bolsas de papel y se almacenaron a 4°C hasta su análisis.
Análisis físicos y químicosEn el interior de los silos bolsa se registró la temperatura del perfil del granel en los 3 tiempos de muestreo. Para ello se utilizó una sonda portátil de temperatura equipada con sensores en 3 puntos, que se insertó en el centro de cada silo bolsa a 30m del cierre de cada uno (entre las zonas 3 y 4). La ubicación de cada sensor coincidió con los 3 estratos del perfil vertical del silo bolsa.
La concentración de O2 y de CO2 de la atmósfera interior de los silos bolsa se determinó en los tres tiempos del almacenamiento y para las 6 zonas, aunque únicamente se consideró el estrato medio del perfil vertical, debido a que los gases difunden en forma vertical. Para esta medición se empleó un medidor de gases portátil (Check Point, PBI, Dan Sensor, Dinamarca).
El contenido de humedad de los granos se midió con un medidor de humedad (Dickey-John, GAC 2100, EE.UU.). También se registró el pH de los granos en solución acuosa, en una relación de 2:1 (20ml de agua destilada: 10g de granos molidos), con el empleo de un peachímetro digital y portátil (Oakton modelo PH11, N° serie 203852, Singapur).
Cuantificación, aislamiento e identificación de la micobiotaEl recuento de hongos filamentosos y levaduras se realizó mediante la técnica de diluciones decimales en tubo y siembra (por duplicado) en placas de Petri con agar extracto de levadura cloranfenicol glucosa (YGCA, Merck®, EE. UU.)29. Para ello, y a partir de cada muestra, se confeccionaron suspensiones con 10g de granos en 90ml de solución diluyente (0,1%) de peptona de caseína (Britania®, Argentina). Las placas se incubaron a 25°C (en oscuridad) durante 7 días y se determinó el número de unidades formadoras de colonias (UFC/g) totales, como así también de cada género o especie identificada. Los valores de UFC/g fueron transformados a log10 UFC/g para realizar los análisis estadísticos.
Para obtener los aislamientos para su identificación, cada colonia con características morfológicas diferentes se cultivó nuevamente en placas de Petri con YGCA durante 7 días a 25°C y en oscuridad. Las cepas puras se conservaron a una temperatura de –20°C en glicerol de alta pureza (Biopack®, Argentina) en una concentración al 35% v/v en agua.
Los aislamientos de las especies de Penicillium, Aspergillus, Eurotium, Eupenicillium, Wallemia, Cladosporium, Epiccocum, Acremonium y las levaduras se identificaron con claves taxonómicas29. Los aislamientos de las especies de Fusarium se identificaron a partir de claves específicas15,26,38,41. Para la denominación de las especies se consultó la última actualización de nomenclatura del International Code of Nomenclature (ICN)20,30 y el Index Fungorum (http://www.speciesfungorum.org, consultado en abril del 2015).
Las identificaciones de las especies de Fusarium y una especie de Aspergillus fueron confirmadas por análisis filogenético del factor de elongación de la transcripción 1 alfa (TEF1) con los cebadores Ef-728m/EF239, con la metodología propuesta por Chaverri y Samuels8. Las reacciones de secuenciación fueron conducidas en un equipo BigDyeTM Terminator v 3.1 (Applied Biosystems, EE. UU.), basadas en el método de Sanger y corridas con el Genetic Analyzer 3130xl en SIGYSA (Argentina). Se realizó un alineamiento con ClustalW en MEGA 4.1 de las secuencias obtenidas junto con secuencias de referencia guardadas en el GenBank. Se realizaron análisis de parsimonia en NONA con el empleo del entorno Winclada con búsqueda heurística con 10000 repeticiones y estrategia de búsqueda TBR, y el soporte de ramas se calculó sobre la base de un bootstrap de 1000 réplicas. Para dichos análisis se agregaron secuencias de especies cercanas como grupo control externo.
Determinación de micotoxinasSe conformaron muestras compuestas de granos de 5kg por cada estrato, incluyendo las 6 zonas de cada uno de los 5 silos bolsa, y se remitieron a la Fundación de Investigaciones Científicas Teresa Benedicta de la Cruz, Luján (provincia de Buenos Aires), donde fueron evaluadas. Se investigó la presencia de aflatoxinas (AFLA: B1, B2, G1, G2), zearalenona (ZEA) y deoxinivalenol (DON), de acuerdo con el método de Romer N.° MY8402s, versión 94.237, y de fumonisinas (FB1, FB2, FB3) se investigó con el protocolo de la AOAC, método oficial 995.152. Para las mencionadas cuantificaciones se empleó la técnica de cromatografía líquida de alta resolución (HPLC). El sistema HPLC utilizado fue de la serie Agilent 1100 (Alemania), que incluyó un desgasificador G1322A, un muestreador automático G1313A, un detector de fluorescencia G1321A, una bomba cuaternaria G1311A y un controlador de temperatura G1316A.
Análisis estadísticoDebido a que las observaciones realizadas dentro de un mismo silo bolsa no podrían asumirse como estadísticamente independientes, se recurrió al uso de modelos lineales mixtos que permitieron estudiar los efectos de los factores de interés y al mismo tiempo modelar la posible estructura de correlación entre las observaciones. Los modelos lineales mixtos se ajustaron con el fin de determinar el efecto fijo del estrato, la zona del silo bolsa, el tiempo del almacenamiento y sus interacciones sobre el pH, la humedad de los granos, el número total de UFC de hongos y levaduras y el número total de UFC de Fusarium spp. y de A. flavus. Estos modelos incorporaron también los efectos aleatorios del silo bolsa, el estrato, la zona y el tiempo, para incorporar una correlación positiva entre observaciones realizadas dentro del mismo nivel de cualquiera de estos factores. Por otro lado, los modelos ajustados para analizar las concentraciones de O2 y CO2 no consideraron el efecto fijo del estrato, y para la temperatura no consideraron el efecto fijo de la zona del silo bolsa. Se utilizó la función lme del paquete «nlme» del lenguaje R34. Cuando se detectó efecto significativo de los factores (p<0,05), se realizaron las comparaciones múltiples simultáneas de las medias estimadas por el modelo, utilizando la función «glht» del paquete «multcomp» del R19. Esta función utiliza la distribución t conjunta de todas las diferencias de medias estimadas a comparar, sin corregir el nivel de significación por las múltiples comparaciones, en modo similar a una prueba de diferencia mínima significativa.
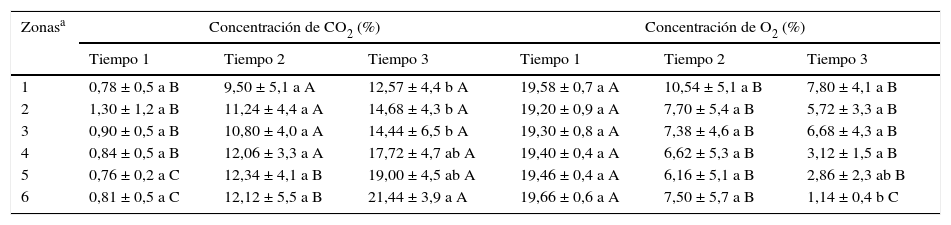
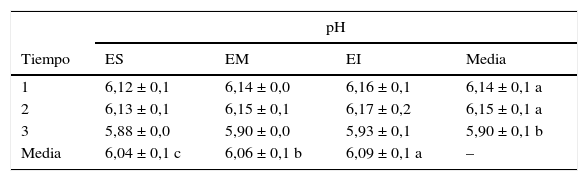
ResultadosAnálisis físicos y químicosEn el momento del embolsado de los granos, el contenido de humedad promedio considerando los 5 silos bolsa fue de 16,4 ± 0,7%, mientras que al final del período analizado los valores se incrementaron significativamente (p=0,005) a 16,7 ± 1,11% en el estrato superior. La temperatura de los granos se incrementó de 8,6°C al comienzo del almacenamiento a 22,8°C a los 5 meses de almacenamiento. En ese tiempo, la temperatura fue significativamente diferente en los 3 estratos analizados: esta fue mayor en el estrato superior respecto del estrato medio (p=0,029) e inferior (p<0,001). Las concentraciones de O2 y CO2 durante el almacenamiento pueden observarse en la tabla 1. Al comienzo del almacenamiento, los niveles de O2 oscilaron entre el 19,20 y el 19,66%, y los niveles de CO2 entre el 0,76 y el 1,30%. Al transcurrir el tiempo, los niveles de O2 se redujeron progresivamente, mientras que los de CO2 se incrementaron. Se detectó un efecto de interacción significativa entre la zona del silo bolsa y el tiempo de almacenamiento para el nivel de O2(p=0,0054) y de CO2(p=0,0226). La concentración de CO2 se incrementó hacia el tercer muestreo y fue significativamente diferente (p=0,0091) entre las zonas. La concentración de O2 disminuyó significativamente hacia el final del período analizado y también se detectaron concentraciones significativamente diferentes (p=0,0003) entre las zonas de los silos bolsa. El pH de los granos varió significativamente entre los estratos (p<0,001) y los tiempos (p=0,0036): la mayor acidez se registró en el estrato superior y hacia el final del período de almacenamiento (tabla 2).
Evolución de las concentraciones de CO2 y O2 en la atmósfera de granos de maíz almacenados en silos bolsa
| Zonasa | Concentración de CO2 (%) | Concentración de O2 (%) | ||||
|---|---|---|---|---|---|---|
| Tiempo 1 | Tiempo 2 | Tiempo 3 | Tiempo 1 | Tiempo 2 | Tiempo 3 | |
| 1 | 0,78 ± 0,5 a B | 9,50 ± 5,1 a A | 12,57 ± 4,4 b A | 19,58 ± 0,7 a A | 10,54 ± 5,1 a B | 7,80 ± 4,1 a B |
| 2 | 1,30 ± 1,2 a B | 11,24 ± 4,4 a A | 14,68 ± 4,3 b A | 19,20 ± 0,9 a A | 7,70 ± 5,4 a B | 5,72 ± 3,3 a B |
| 3 | 0,90 ± 0,5 a B | 10,80 ± 4,0 a A | 14,44 ± 6,5 b A | 19,30 ± 0,8 a A | 7,38 ± 4,6 a B | 6,68 ± 4,3 a B |
| 4 | 0,84 ± 0,5 a B | 12,06 ± 3,3 a A | 17,72 ± 4,7 ab A | 19,40 ± 0,4 a A | 6,62 ± 5,3 a B | 3,12 ± 1,5 a B |
| 5 | 0,76 ± 0,2 a C | 12,34 ± 4,1 a B | 19,00 ± 4,5 ab A | 19,46 ± 0,4 a A | 6,16 ± 5,1 a B | 2,86 ± 2,3 ab B |
| 6 | 0,81 ± 0,5 a C | 12,12 ± 5,5 a B | 21,44 ± 3,9 a A | 19,66 ± 0,6 a A | 7,50 ± 5,7 a B | 1,14 ± 0,4 b C |
Los valores corresponden a las medias ± DE de los 5 silos bolsa. Letras minúsculas distintas dentro una misma columna indican diferencias significativas (p<0,05) entre las diferentes zonas evaluadas. Letras mayúsculas diferentes dentro de una misma fila indican diferencias significativas (p<0,05) entre los distintos tiempos.
Evolución del pH de granos de maíz almacenados en silos bolsa
| pH | ||||
|---|---|---|---|---|
| Tiempo | ES | EM | EI | Media |
| 1 | 6,12 ± 0,1 | 6,14 ± 0,0 | 6,16 ± 0,1 | 6,14 ± 0,1 a |
| 2 | 6,13 ± 0,1 | 6,15 ± 0,1 | 6,17 ± 0,2 | 6,15 ± 0,1 a |
| 3 | 5,88 ± 0,0 | 5,90 ± 0,0 | 5,93 ± 0,1 | 5,90 ± 0,1 b |
| Media | 6,04 ± 0,1 c | 6,06 ± 0,1 b | 6,09 ± 0,1 a | – |
Los valores corresponden a las medias ± DE para los 5 silos bolsa.
Tiempo 1: cierre de los silos bolsa; tiempo 2: 90 días de almacenamiento; tiempo 3: cinco meses de almacenamiento.
Letras diferentes indican diferencias significativas (p<0,05) entre estratos o tiempos.
ES: estrato superior; EM: estrato medio; EI: estrato inferior.
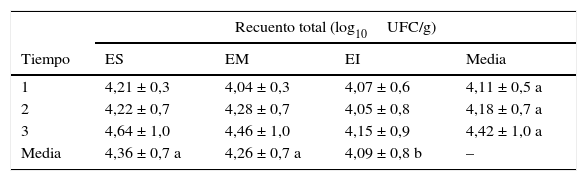
El número total de log10 UFC/g al comienzo del almacenamiento fue de 4,11 ± 0,5 y antes de la apertura de las bolsas fue de 4,42 ± 1,0) (tabla 3). Si bien no se registraron diferencias significativas en los recuentos totales entre los tiempos (p>0,05) y las zonas de los silos bolsa (p>0,05), se determinó un efecto significativo del estrato (p=0,0314), en el que el estrato superior registró mayor número de UFC/g respecto del estrato inferior.
Evolución del recuento total de la micobiota en granos de maíz almacenados en silos bolsa
| Recuento total (log10UFC/g) | ||||
|---|---|---|---|---|
| Tiempo | ES | EM | EI | Media |
| 1 | 4,21 ± 0,3 | 4,04 ± 0,3 | 4,07 ± 0,6 | 4,11 ± 0,5 a |
| 2 | 4,22 ± 0,7 | 4,28 ± 0,7 | 4,05 ± 0,8 | 4,18 ± 0,7 a |
| 3 | 4,64 ± 1,0 | 4,46 ± 1,0 | 4,15 ± 0,9 | 4,42 ± 1,0 a |
| Media | 4,36 ± 0,7 a | 4,26 ± 0,7 a | 4,09 ± 0,8 b | – |
Los valores corresponden a las medias ± DE para los 5 silos bolsa.
Tiempo 1: cierre de los silos bolsa; tiempo 2: 90 días de almacenamiento; tiempo 3: 5 meses de almacenamiento.
Letras diferentes indican diferencias significativas (p<0,05) entre estratos o tiempos.
ES: estrato superior; EM: estrato medio; EI: estrato inferior.
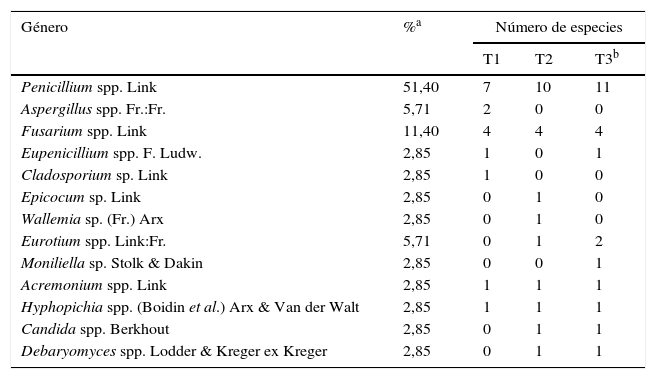
La población fúngica total hallada en las muestras de granos de maíz almacenados durante 5 meses se constituyó por 35 especies pertenecientes a 10 géneros de hongos filamentosos y 3 géneros de levaduras (tabla 4). Se identificaron 18 especies de Penicillium, clasificadas en 4 subgéneros, según se describe a continuación. Subgénero Aspergilloides: Penicillium sclerotiorum J.F.H. Beyma, Penicillium implicatum Biourge, Penicillium oxalicum (syn. P. decumbens Currie & Thom), Penicillium restrictum J.C. Gilman & EV. Abbott; subgénero Biverticillium: Talaromyces funiculosus (syn. Penicillium funiculosum Thom), Talaromyces variabilis (syn. P. variabile Sopp), Talaromyces islandicus (syn. P. islandicum Sopp), Talaromyces pinophilus (syn P. pinophilum Hedgcock); subgénero Furcatum: P. oxalicum Currie & Thom, Penicillium corylophilum Dierckx, Penicillium citrinum Thom; subgénero Penicillium: Penicillium brevicompactum Dierckx, Penicillium solitum Westling, Penicillium aurantiogriseum (syn. Penicillium viridicatum Westling), Penicillium verrocusum Dierckx, Penicillium rubens Biourge (syn. P. chrysogenum Thom), Penicillium griseofulvum Dierckx, y Penicillium olsonii Bainier & Sartory. En general, las especies de Penicillium se encontraron con alta frecuencia (51%) en el total de muestras analizadas. Sin embargo, la frecuencia de aparición (%) de cada una de estas y su recuento (log10UFC/g) fue variable durante el período analizado. T. funiculosus fue la especie predominante en los 3 tiempos de muestreo. Al comienzo del almacenamiento, el 75,5% de las muestras presentó T. funiculosus (3,37 ± 0,71 log10 UFC/g). En el tiempo 2, el porcentaje de las muestras con T. funiculosus se incrementó al 76,6% (3,25 ± 0,79 log10 UFC/g) y al final del período considerado el porcentaje se redujo al 69%, aunque sin variación en los recuentos (3,28 ± 0,71 log10 UFC/g).
Composición de las poblaciones fúngicas asociadas a granos de maíz almacenados en silos bolsa
| Género | %a | Número de especies | ||
|---|---|---|---|---|
| T1 | T2 | T3b | ||
| Penicillium spp. Link | 51,40 | 7 | 10 | 11 |
| Aspergillus spp. Fr.:Fr. | 5,71 | 2 | 0 | 0 |
| Fusarium spp. Link | 11,40 | 4 | 4 | 4 |
| Eupenicillium spp. F. Ludw. | 2,85 | 1 | 0 | 1 |
| Cladosporium sp. Link | 2,85 | 1 | 0 | 0 |
| Epicocum sp. Link | 2,85 | 0 | 1 | 0 |
| Wallemia sp. (Fr.) Arx | 2,85 | 0 | 1 | 0 |
| Eurotium spp. Link:Fr. | 5,71 | 0 | 1 | 2 |
| Moniliella sp. Stolk & Dakin | 2,85 | 0 | 0 | 1 |
| Acremonium spp. Link | 2,85 | 1 | 1 | 1 |
| Hyphopichia spp. (Boidin et al.) Arx & Van der Walt | 2,85 | 1 | 1 | 1 |
| Candida spp. Berkhout | 2,85 | 0 | 1 | 1 |
| Debaryomyces spp. Lodder & Kreger ex Kreger | 2,85 | 0 | 1 | 1 |
Las especies de Fusarium fueron aisladas en el 82,3% del total de las muestras analizadas durante los 5 meses del almacenamiento. Sobre la base de las características macroscópicas de las colonias y microscópicas de las estructuras reproductivas y el estudio filogenético con el marcador TEF1, se identificaron las siguientes especies de Fusarium: Fusarium verticillioides (Sacc.) Nirenberg, Fusarium proliferatum (Matsushima) Nirenberg, Fusarium subglutinans (Wollenw and Reinking) Nelson, Toussoun and Marasas y F. oxysporum Schlecht. EMEND. Snyd. y Hans.
Respecto de Aspergillus spp., a partir de la caracterización morfológica de los aislamientos y del estudio de las secuencias ITS se identificaron 2 especies en el primer tiempo de almacenamiento, en todos los silos bolsa. Dichas especies pertenecieron al subgénero Circumdati, Section Flavi, A. flavus Link y a la Sección Nigri, Aspergillus niger Tiegh.
La presencia de Eurotium spp. fue observada en el segundo y en el tercer muestreo en el 10% y el 37,8% de las muestras, respectivamente. La especie predominante fue Eurotium amstelodami L. Margin.
Respecto de las levaduras, el 27,8% de las muestras de maíz recolectadas al inicio del almacenamiento presentaron contaminación con este grupo microbiano, mientras que al final del período se aislaron en el 58% de las mismas. Los recuentos medios fueron de 3,3 ± 0,70 log10 UFC/g y de 4,62 (±0,74) log10 UFC/g al inicio y al final del almacenamiento, respectivamente. La especie dominante fue Hyphopichia burtonii (Boidin et al.) Arx & Van der Walt, aislada en el 91,9% de las muestras de granos. Las especies restantes fueron clasificadas como pertenecientes al género Candida.
Especies fúngicas con capacidad potencial de producir micotoxinasF. verticillioides, F. proliferatum, A. flavus, P. citrinum, P. verrucosum y E. amstelodami fueron especies aisladas de muestras de granos de todos los silos bolsa. La frecuencia de aislamiento y los recuentos de las especies de Fusarium se redujeron al final del período analizado y Aspergillus no fue encontrado en ese tiempo. A. flavus se aisló en el 11,44% de las muestras del tiempo 1, con un recuento de 2,73 ± 0,71 log10 UFC/g. El porcentaje de muestras contaminadas con especies de Fusarium se redujo a los 5 meses a un valor del 54,4%, a pesar de que los recuentos no presentaron variaciones significativas (p=0,0552) entre el primer (2,83 ± 0,92 log10 UFC/g) y el tercer tiempo de muestreo (3,18 ± 0,77 log10 UFC/g). En cambio, las especies de Penicillium y Eurotium incrementaron su frecuencia de aislamiento y abundancia hacia el final del almacenamiento. P. citrinum fue aislada en el 3,30% las muestras de granos del segundo tiempo y con un recuento de 3,53 ± 0,60 log10 UFC/g, mientras que P. verrucosum fue aislada de muestras de granos recolectados en el segundo (0,55% de las muestras y recuentos de 2,3 ± 0,00 log10 UFC/g) y en el tercer tiempo del almacenamiento (3,88% de las muestras y recuentos de 2,98 ± 1,00 log10 UFC/g). El recuento de las poblaciones de Eurotium spp. se incrementó entre el segundo y el tercer tiempo del almacenamiento, y fue de 2,08 ± 0,49 y 2,57 ± 0,49 log10 UFC/g, respectivamente.
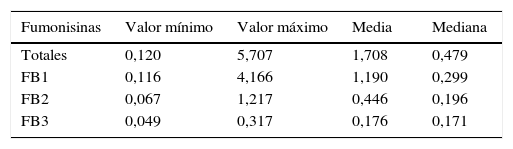
MicotoxinasEl total de las muestras analizadas presentó contaminación con fumonisinas, mientras que el 40% reveló la presencia de aflatoxinas. Se detectaron fumonisinas FB1 en el 100% de las muestras, fumonisinas FB2 en el 86% y fumonisinas FB3 en el 53%. Por otro lado, el 18,4% de las muestras presentó solamente FB1; el 18,4%, FB1+FB2, y el 47,3%, FB1+FB2+FB3 (tabla 5).
Cuando se analizaron las aflatoxinas solo se detectó la presencia de AFLA B1 en concentraciones mínimas de 0,0003mg/kg y máximas de 0,0008mg/kg.
Los valores de micotoxinas determinados al final del almacenamiento no registraron incrementos respecto de los niveles detectados a los 90 días (Cardoso, comunicación personal). Las micotoxinas ZEA y DON no fueron detectadas por las técnicas empleadas.
DiscusiónLa temperatura, la actividad agua (aw) y la humedad de los granos son factores condicionantes de la colonización fúngica y de la producción de micotoxinas durante el almacenamiento de los granos23. Sin embargo, hasta el presente no se realizaron estudios sobre la composición de gases de la atmósfera intergranaria y de la acidez de los granos, factores que podrían contribuir a explicar el comportamiento de las poblaciones fúngicas en sistemas de almacenamiento como los silos bolsa.
El incremento de la humedad registrado hacia el final del almacenamiento en el estrato superior de los silos bolsa estudiados podría ser explicado por la existencia de estratificación de la humedad de los granos ubicados en áreas de contacto con la cubierta plástica, causado posiblemente por ciclos repetidos de condensación y adsorción de agua, como consecuencia de la variación diaria de la temperatura ambiente. Casini et al.5 comunicaron estratificación de humedad en la capa superficial de granos de girasol almacenados en bolsas plásticas y la relacionaron con la disminución de la temperatura nocturna, que provocó una condensación de la superficie de los granos y de la cubierta plástica.
Los cambios en la composición de O2 y de CO2 durante el período de almacenamiento reflejaron la actividad metabólica en el interior de los silos bolsa. Es así que la respiración de los granos y de la microbiota asociada redujo el nivel de O2 e incrementó el nivel de CO2, generando una atmósfera anaerobia. Estos resultados coinciden con los reportados en Italia para el almacenamiento de granos de maíz y de trigo en silos bolsa18. Por otro lado, en la zona 1 (cierre de la bolsa) de los 5 silos bolsa al final del almacenamiento se determinó la mayor concentración de O2, lo que podría indicar un cierre inadecuado de aquellas; en consecuencia, se favorecería la producción de microambientes para el desarrollo de la micobiota aeróbica. Respecto del pH de los granos, se determinó su disminución en los granos ubicados en el estrato superior hacia el tercer tiempo del almacenamiento. Este resultado podría ser explicado a partir del registro de un mayor número de UFC/g totales en los granos dispuestos en dicho estrato, ocasionado por la mayor actividad metabólica. El comportamiento de esta variable en condiciones de almacenamiento hermético no fue estudiado hasta el presente. Por ello, el monitoreo de la acidez de los granos durante el almacenamiento puede contribuir a comprender y explicar la dinámica de las poblaciones fúngicas, y en particular la de las micotoxigénicas asociadas a ellos.
El recuento total de la micobiota que colonizó los granos de maíz no presentó variaciones a través del tiempo, coincidiendo con lo informado por otros investigadores en Argentina28. Estos resultados podrían estar determinados por el incremento de la concentración de CO2 y la acidez de los granos, y por la reducción del nivel de O2, que afectaron la actividad metabólica. Por el contrario, en Italia los reportes indicaron una reducción en el recuento de hongos totales durante el almacenamiento de maíz en silos bolsa18.
Otro aspecto relevante de este estudio determinó que los recuentos fúngicos totales fueron afectados por el estrato (posición de los granos en el perfil vertical del silo bolsa): se encontraron los mayores valores en el estrato superior y los menores en el inferior. Este hallazgo diferencial en el recuento poblacional influenciado por la ubicación de los granos nunca fue reportado; esto pudo deberse a los 3 factores extrínsecos explicados precedentemente: a) el incremento de la temperatura en la capa superior de la bolsa, en respuesta a las variaciones diarias de temperatura ambiente; b) la existencia de variación de la humedad en los granos individuales situados en el estrato superior de la bolsa, ocasionada por variaciones diurnas y nocturnas de la temperatura, lo que provoca la condensación en la superficie de los granos, y c) la influencia de un mayor intercambio de gases entre el medio ambiente y el interior de la bolsa sobre los granos ubicados en el estrato superior35. En el estrato inferior posiblemente se generaron microambientes donde la menor temperatura y humedad y el menor intercambio gaseoso influyeron negativamente en el metabolismo respiratorio, lo que pudo haber afectado la supervivencia de diferentes especies fúngicas, entre ellas las micotoxigénicas.
Respecto de la composición de las poblaciones fúngicas, se observó que la presencia de diferentes especies fue influenciada por las condiciones ambientales dinámicas que dominaron el interior del silo bolsa. En el inicio del almacenamiento, se aislaron especies de Fusarium y Aspergillus junto con otras especies asociadas a los granos. Sin embargo, la generación de un ambiente anaerobio y el incremento de la temperatura y de la acidez de los granos conforme avanzó el tiempo de almacenamiento favorecieron a una micobiota dominada por especies de Penicillium, Eurotium y levaduras. El incremento del número de muestras positivas con Eurotium hacia el final del almacenamiento pudo deberse a que este género es tolerante al estrés, sus esporas germinan a una temperatura óptima cercana a los 30°C y es capaz de adaptarse más a pH ácidos16. Asimismo, la frecuencia de aislamiento y los recuentos de las levaduras se incrementaron hacia el final del período considerado. Si bien estos resultados no coincidieron con los reportados por otros investigadores en condiciones similares28, el incremento pudo ser explicado por la dominancia de una atmósfera anaerobia.
La frecuencia de aislamiento de especies potencialmente productoras de aflatoxinas (A. flavus) y fumonisinas (F. verticillioides y F. proliferatum) se redujo hacia el final del almacenamiento. Algunos investigadores reportaron que las especies de Aspergillus estarían mejor adaptadas al crecimiento en sustratos con pH alcalino43, por lo que la reducción del pH de los granos podría haber afectado la supervivencia de tales especies. Por otro lado, podría inferirse que si bien A. flavus es considerada una especie favorecida por las condiciones del almacenamiento4, tendría probablemente inconvenientes para adaptarse a las condiciones ambientales del almacenamiento en silos bolsa, con importantes restricciones en la concentración de O2 e incremento de la acidez. La identificación de A. flavus en maíz en diferentes condiciones de almacenamiento coincidió con lo informado por otros investigadores en diferentes regiones agroecológicas de la Argentina10,17,32.
La frecuencia de aislamiento de Fusarium spp. se redujo hacia el final del almacenamiento; sin embargo, su recuento poblacional no registró variaciones. Estos resultados concuerdan con los comunicados por otros investigadores en la Argentina6,14 y otros países13,31.
A diferencia de lo que ocurrió con el recuento total de las poblaciones fúngicas, que fue afectado por el estrato granario, no se detectó efecto de la posición de los granos en el silo bolsa sobre el recuento de las especies de Fusarium. Por primera vez se comunica que la posición de los granos en el interior del silo bolsa no afectó el recuento poblacional; posiblemente esto se deba a que las especies de este género están asociadas con el sustrato maíz y son menos influenciadas por las condiciones ambientales en el interior del silo bolsa21,33.
La capacidad de especies de Fusarium y de A. flavus para producir fumonisinas y aflatoxinas en maíz fue demostrada en diferentes investigaciones realizadas en nuestro país3. Sin embargo, en la Argentina solo existe legislación para las aflatoxinas totales y esta especifica los límites máximos para maní, maíz y sus derivados, y para la aflatoxina M1 en leche fluida y en polvo (http://www.anmat.gov.ar/alimentos/codigoa, consultado en abril del 2015). Para las restantes micotoxinas, la Argentina considera los límites de tolerancia indicados por la legislación vigente en la Comunidad Europea12.
Los niveles de fumonisinas totales superaron los valores máximos permitidos de 4mg/kg11 en 3 de las muestras analizadas, correspondientes las 3 a un mismo silo bolsa (silo bolsa 3). Los granos de este silo bolsa fueron embolsados en el mes de agosto, por lo que las altas concentraciones determinadas podrían estar explicadas por una mayor permanencia de los granos en el cultivo, donde las especies de Fusarium poseen mayores ventajas adaptativas para colonizar los granos y producir la micotoxina9. Este aspecto es relevante, ya que se podría inferir que un retraso en la cosecha ocasionaría una acumulación de fumonisinas en los granos en el campo. Aquellos investigadores que analizaron fumonisinas totales en maíz en diferentes zonas productoras de la Argentina determinaron niveles que fueron desde 2,525mg/kg hasta 11,528mg/kg14 y desde 0,01mg/kg hasta 31,108mg/kg28, datos que manifiestan una marcada variabilidad.
Respecto de las aflatoxinas, los niveles registrados fueron inferiores a los límites establecidos en nuestro país para granos de maíz (0,020mg/kg), lo que podría estar relacionado con la menor adaptación de A. flavus a las condiciones ambientales descriptas para la zona de estudio. Esta especie es comúnmente aislada en maíces cultivados en las regiones central y norte de la Argentina, donde es favorecida por temperaturas superiores a 30°C24.
Entre las micotoxinas producidas por Penicillium spp. se destacan la ocratoxina A (OTA), la patulina y citrinina27. En este estudio, P. citrinum y P. verrucosum, potenciales productores de citrinina y OTA, respectivamente, se aislaron con baja frecuencia. Posiblemente, la composición de gases de la atmósfera y el incremento de la acidez no favorecieron su desarrollo.
Con referencia al incremento de E. amstelodami, en la actualidad no se conocen informes de la producción de OTA por esta especie en maíces almacenados en silos bolsa. Sin embargo, se comunicó que esta especie produjo OTA en granos de cereales en el almacenamiento1, por lo que serían necesarios estudios sobre la producción de OTA por Eurotium spp. en granos de maíz almacenados en silos bolsa dado que esta micotoxina, al igual que las ya mencionadas, representa un riesgo potencial para la salud humana y animal.
Si bien el almacenamiento de granos en silos bolsa constituye un sistema de almacenamiento sencillo y con un bajo costo de inversión para conservar granos, es necesario supervisar el estado de los granos antes de que estos sean embolsados y periódicamente en el almacenamiento, con el fin de detectar precozmente su eventual deterioro por el desarrollo de hongos. Los datos sobre la dinámica de las poblaciones micotoxigénicas y los factores que condicionan su aparición y proliferación aportados por este estudio podrían contribuir a diseñar estrategias tendientes a evitar la alteración de la calidad de los granos durante el almacenamiento. Una de ellas podría estar relacionada con el uso de diferentes mezclas de gases (con alto contenido de CO2), considerando la característica de la baja permeabilidad del plástico del silo bolsa. De esta forma, se contaría con una alternativa válida para reducir las pérdidas de calidad de los granos destinados al consumo humano y animal ocasionadas por la producción de metabolitos tóxicos, cuando aquellos son almacenados por períodos superiores a los 5 meses.
Respecto de la legislación que establece los límites de tolerancia para diferentes micotoxinas en materias primas y alimentos elaborados, sería relevante establecer valores de tolerancia máximos para las fumonisinas, ya que su presencia ha sido detectada en un alto porcentaje de muestras de granos de maíz analizadas en los últimos años en la Argentina, situación que podría constituir una problemática para la comercialización e industrialización de los granos, ya sea para consumo humano o animal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente trabajo fue financiado por la Universidad Nacional de Mar del Plata (Proyecto AGR375/12) y el Instituto Nacional de Tecnología Agropecuaria (Proyecto AEAI 274.420, Área Estratégica Agroindustria), y fue presentado por Claudia C. Castellari como requisito parcial para obtener el grado académico de Doctor en Ciencias Agrarias de la Universidad Nacional de Mar del Plata, Argentina.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Al grupo de Poscosecha de granos de la Unidad Integrada Balcarce, Estación Experimental Agropecuaria INTA Balcarce.