Candida lusitaniae es una levadura que ha sido descrita como un patógeno nosocomial emergente de baja frecuencia en infecciones profundas. La identificación oportuna de C. lusitaniae es importante porque puede desarrollar resistencia in vivo a la anfotericina B durante la terapia. Comunicamos el aislamiento de C. lusitaniae como agente etiológico de infección de tracto respiratorio inferior en un paciente masculino. Los cultivos de orina y esputo fueron negativos para bacterias y positivos para esta levadura. Los aislamientos fueron identificados por métodos fenotípicos de rutina y confirmados por secuenciación y polimorfismos de longitud de fragmentos de restricción y PCR de la región espaciadora interna del ADN ribosómico.
Candida lusitaniae is a yeast that has emerged as a low frequency nosocomial pathogen in deep infections. Although it usually shows in vitro susceptibility to all antifungal agents, in vivo resistance to amphotericin B has been observed in several clinical cases. Therefore, its early identification in the course of therapy is important. We report the isolation of C. lusitaniae as an etiologic agent of a lower respiratory tract infection in a male patient. Urine and sputum cultures were negative for bacteria and positive for this yeast. Isolates were identified by routine phenotypic methods and confirmed by sequencing and restriction fragment length polymorphism analysis of PCR internal spacer of ribosomal DNA.
Las infecciones por levaduras del género Candida son las micosis más frecuentes. Estas forman parte de la microbiota del tracto respiratorio superior, cavidad oral, tracto digestivo y piel en individuos sanos. Candida albicans es la principal especie comensal (69 % a 90 %) y, en menor frecuencia, C. parapsilosis, C. tropicalis, C. krusei y C. glabrata6,7,12. La distribución de las especies no albicans varía en función de la población y región geográfica14. En condiciones de inmunosupresión y otros procesos debilitantes, estas levaduras pueden comportarse como patógenos oportunistas y ocasionar infecciones profundas.
En las últimas décadas se ha comunicado el aumento de candidosis profundas por especies no albicans, principalmente candidemia e infecciones respiratorias asociadas a colonización de catéteres venosos centrales, ventiladores mecánicos, uso crónico de antibióticos de amplio espectro y larga estancia intrahospitalaria. El diagnóstico de estas es complicado, ya que requiere el aislamiento del agente causal y el estudio histopatológico de biopsias de tracto respiratorio, respectivamente.
A continuación, describimos un caso de infección de tracto respiratorio inferior refractario a tratamiento antimicrobiano, con aislamiento de C. lusitaniae a partir de esputo y orina y respuesta a tratamiento antimicótico.
Varón de 41 años proveniente del Estado de México, México. Trabajó en Texas colocando asfalto durante 2011 y refirió haber estado expuesto a solventes. Asimismo manifestó tener desde dos años antes hipertensión arterial, bajo tratamiento, sin antecedentes neoplásicos, autoinmunes o hematológicos. El padecimiento que motivó la consulta comenzó en agosto de 2012 con tos no productiva, disnea, dolor pleurítico, fiebre (39°C), náuseas y pérdida importante de peso (10kg).
Ingresó al Hospital Juárez de México OPD, SSA, en setiembre de 2012 con diagnóstico de neumonía adquirida en la comunidad PORT I (día 1). La radiografía de tórax indicó parénquima pulmonar con patrón macronodular radiopaco parcheado en el 100 % del hemitórax derecho, con imágenes macronodulares en parénquima izquierdo de predominio basal. A la exploración se le encontró consciente, con palidez de tegumentos, sin adenomegalias; amplexión y amplexación disminuidas en región basal izquierda, a la percusión claro pulmonar, auscultación con estertores subcrepitantes en región infraescapular bilateral de predominio izquierdo. El análisis hematológico indicó elevación de la creatinina (Cr=2,5mg/dl); el nitrógeno ureico sanguíneo (BUN=33,8mg/dl) y la relación BUN/Cr (13,5) indicaron una lesión renal aguda AKINII.
Se inició tratamiento con levofloxacina 750mg/48h. Al día 2 el paciente continuaba con picos febriles (39°C) y con dolor pleurítico. Al día 3, presentó leve mejoría con respecto a la tos, sin dificultad respiratoria, se le realizaron micronebulizaciones con solución salina para favorecer la expectoración. Se enviaron muestras de esputo y sangre para la búsqueda de bacterias y la realización de baciloscopías. Se realizó el panel viral en búsqueda de VHB, VHC y VIH; no presentó reacción. La citometría hemática mostró leucocitosis. Presentó fiebre (39°C) el día 3 y se cambió la terapia a ceftriaxona 1g/12h, claritromicina 500mg/12h y paracetamol. Al día 4 continuaban los síntomas, se mantenían la leucocitosis y los picos febriles, y se observó erupción maculopapular generalizada y rash asociado, probablemente por alergia a la claritromicina o el paracetamol, por lo que se suspendieron ambos fármacos. Cultivos bacteriológicos y baciloscopías negativos. Al día 5 se enviaron muestras de esputo para la búsqueda de hongos y muestras de sangre para cultivos bacteriológicos y baciloscopías, se mantuvo la terapia con antibiótico. El paciente continuó con picos febriles (39°C). Al día 6, se identificaron en el esputo cúmulos de blastoconidios gemantes de 4 a 6μm (+++). Se inició terapia antifúngica con fluconazol 100mg/12h y se continuó el tratamiento antibacteriano.
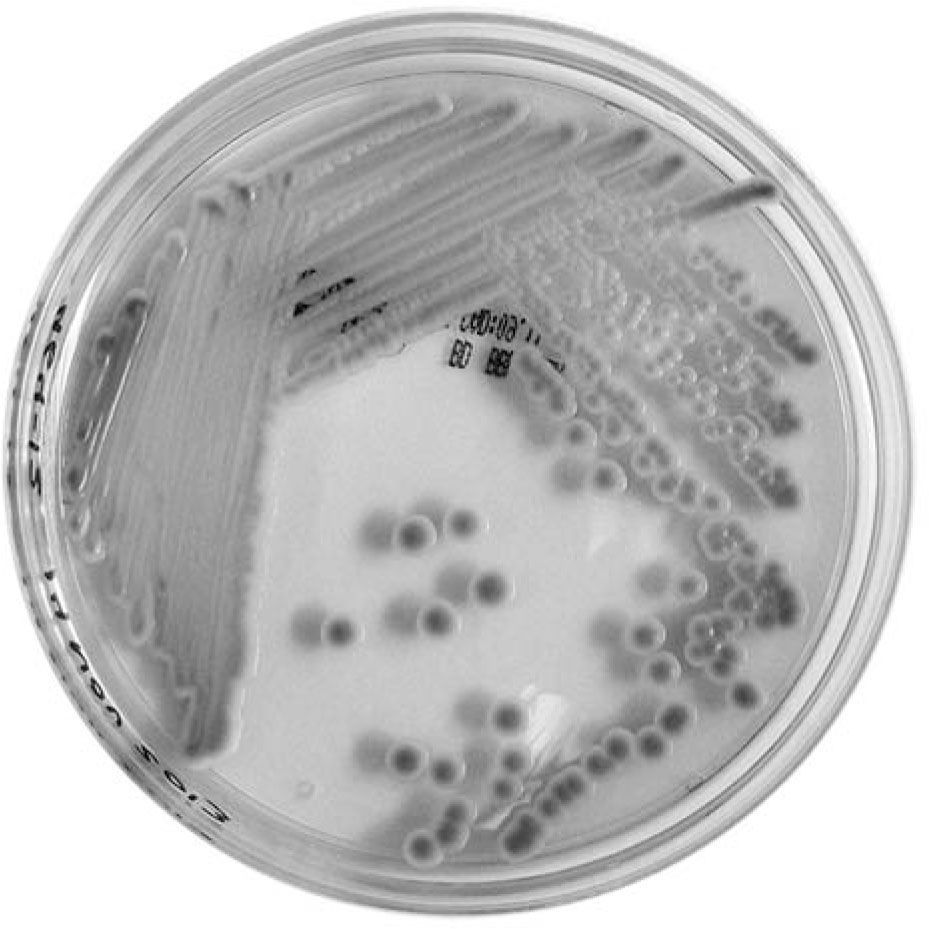
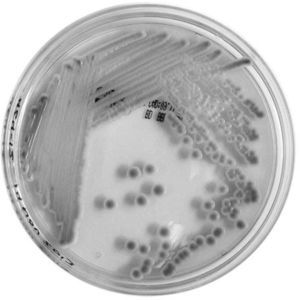
A partir del esputo, se obtuvo desarrollo en agar de Sabouraud (colonias cremosas de 3 a 4 mm, de color blanco, de bordes lisos), y en CHROMagar Candida (bioMèrieux) se obtuvieron colonias similares, pero de color rosado (fig. 1). La asimilación de carbohidratos se realizó con el sistema API 20C aux (bioMèrieux) y el perfil obtenido se comparó con los aportados por la base de datos APIweb (https://apiweb.biomerieux.com/), se identificó así al microorganismo como C. lusitaniae. Además, se determinó la sensibilidad a antifúngicos con FUNGITEST (BIORAD) y se lo clasificó como sensible a anfotericina B (CIM50 < 2μg/ml), 5-fluorocitosina (CIM50 < 2μg/ml), ketoconazol (CIM50 < 0,5μg/ml), fluconazol (CIM50 < 8μg/ml) y con resistencia intermedia a miconazol (CIM50 < 8μg/ml) e itraconazol (CIM50 < 4μg/ml), de acuerdo a las instrucciones del kit.
Ante estos resultados se continuó con fluconazol 100mg/12h. El día 7 se envió sangre y orina para búsqueda de hongos y se informó presencia de blastoconidios (+) en esta última. Del día 7 al 9 el paciente presentó mejoría en movimientos de amplexión y amplexación, sin fiebre, y el rash cutáneo estaba en remisión, con leve prurito al estímulo táctil. El día 9 se observó desarrollo solo en la muestra de orina, por tanto, se envió sangre, esputo y orina para monitorear la infección. Para el día 11 los cultivos fueron negativos y los valores hemáticos eran normales; el paciente no presentó complicaciones y se dio de alta.
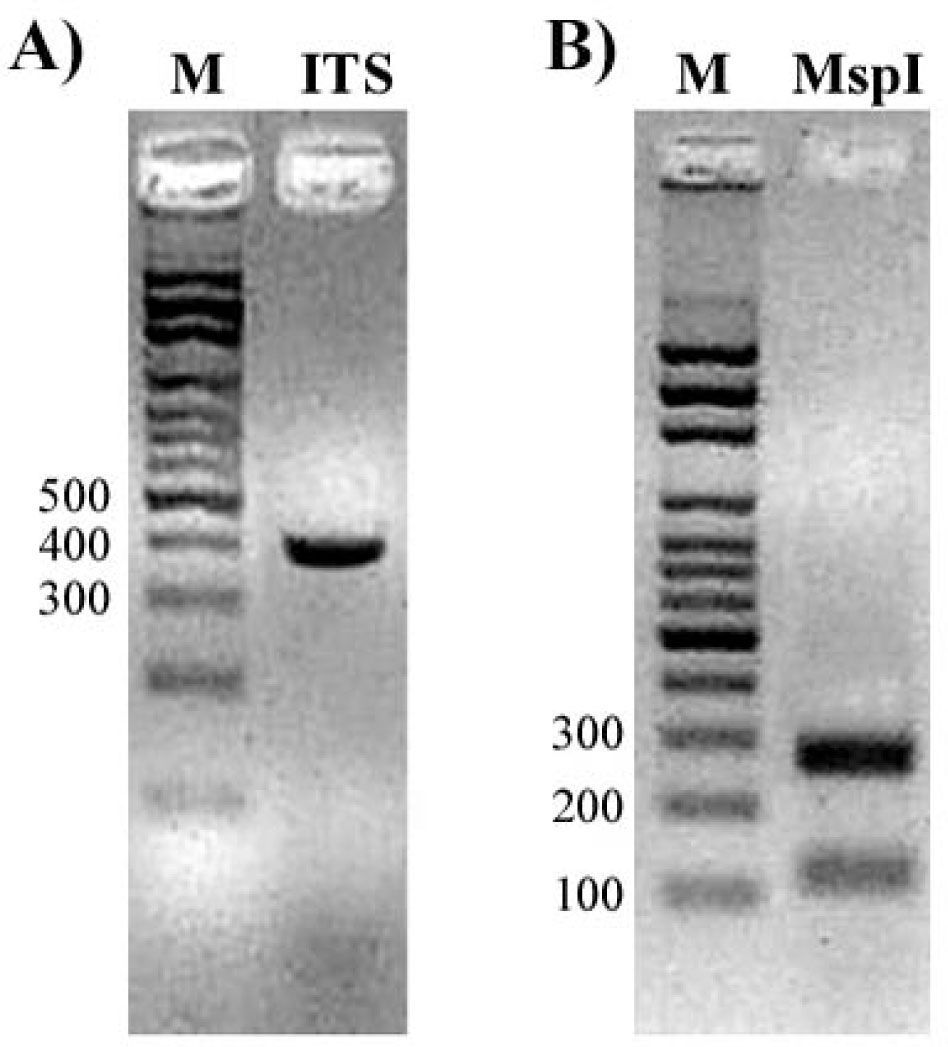
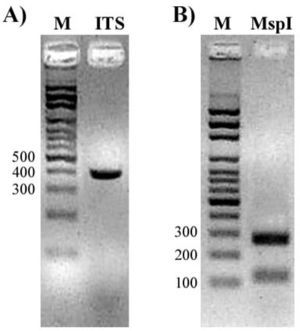
Debido a que no se han comunicado en el hospital casos de C. lusitaniae y para descartar una posible identificación errónea, se realizó el análisis molecular (PCR-RFLP y secuenciación) del fragmento ITS1, ITS2 y 5.8S ADNr. Se utilizaron los primers universales ITS1 (5’-TCC GTA GGT GAA CCT GCG G-3’) e ITS4 (5’-TCC TCC GCT TAT TGA TAT GC-3’). La PCR se realizó en un volumen final de 20μl, con 30 ng de ADN muestra, 1μM de cada primer, 100μM de dNTP, 2μl de 10X PCR buffer, 1,5 mM de MgCl2 y 2,5 U de Taq ADN polimerasa. El producto de amplificación se revisó por electroforesis en un gel de agarosa-bromuro de etidio al 2 %, se halló una banda de 382 pb (fig. 2A), que posteriormente se incubó con 10 U de MspI a 37°C. La enzima digirió el fragmento en un solo sitio y generó dos fragmentos de ADN de 118 y 264 pb (fig. 2B). La secuencia de la región ITS fue analizada utilizando BLAST de GenBank® y se encontró un 100 % de similitud con la secuencia del mismo locus de la cepa tipo C. lusitaniae CBS 10625, n.° de acceso EU149777.1.
A. Gel de agarosa que muestra el producto amplificado (ITS1-5.8S-ITS4) de C. lusitaniae. B. Fragmentos de restricción del producto de PCR obtenidos con la enzima MspI (RFLP). M: marcador de peso molecular, escalera de 100 pb.
C. lusitaniae está reconocida como patógeno oportunista nosocomial y es un organismo único por su habilidad de desarrollar rápidamente resistencia durante el tratamiento a agentes antifúngicos como anfotericina B y fluconazol3–5,10. A nivel mundial se han comunicado poco más de 50 casos de infecciones profundas en pacientes con linfomas, leucemia, cáncer y en recién nacidos1,2,8,13. En México, en los últimos 10 años solo se ha informado un caso de candidemia por C. lusitaniae11.
Nuestra comunicación sugiere un caso de neumonía por C. lusitaniae. Sin embargo, el diagnóstico definitivo requiere de la prueba histológica del tejido pulmonar con la presencia del microorganismo en asociación con la inflamación. La confirmación histopatológica no se realizó en este paciente debido a consideraciones éticas. Sin embargo, la notable mejoría clínica y de imágenes después de la iniciación del tratamiento antimicótico sistémico y el hecho de que no hay publicaciones que describan a C. lusitaniae como parte de la microbiota sugieren un diagnóstico compatible con candidosis pulmonar.
El aislamiento únicamente de colonias de C. lusitaniae a partir de la orina del paciente puede interpretarse como una probable diseminación hemática a vías urinarias (facilitada por la lesión renal aguda); sin embargo, no se pudo realizar el aislamiento a partir de sangre, ni un segundo aislamiento a partir de las otras muestras, debido a la administración del antifúngico.
Es imprescindible la identificación oportuna de especies de Candida no albicans, principalmente en micosis profundas y en pacientes con factores de riesgo, debido a que estos individuos presentan diferentes sensibilidades a los antifúngicos de primera línea. El estudio del genoma de diferentes levaduras ha contribuido al desarrollo de pruebas moleculares basadas en PCR-RFLP y secuenciación de los ITS ribosomales, que son sensibles, reproducibles y rápidas8. Estas permiten establecer el diagnóstico clínico y la selección del tratamiento adecuado en pacientes con infecciones profundas.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl presente trabajo ha sido financiado por la Dirección General de Asuntos del Personal Académico (DGAPA) DGAPA-UNAM IN214013.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.