Se presentan en este trabajo los resultados de 16 años de vigilancia epidemiológica de meningitis neumocócica llevada a cabo en el Hospital Provincial de Pediatría de Misiones (Argentina), antes de la introducción de la vacuna conjugada al calendario nacional.
En el período que va de enero de 1994 a diciembre de 2009 se diagnosticaron 167 casos de meningitis por Streptococcus pneumoniae en niños (1 mes-15 años).
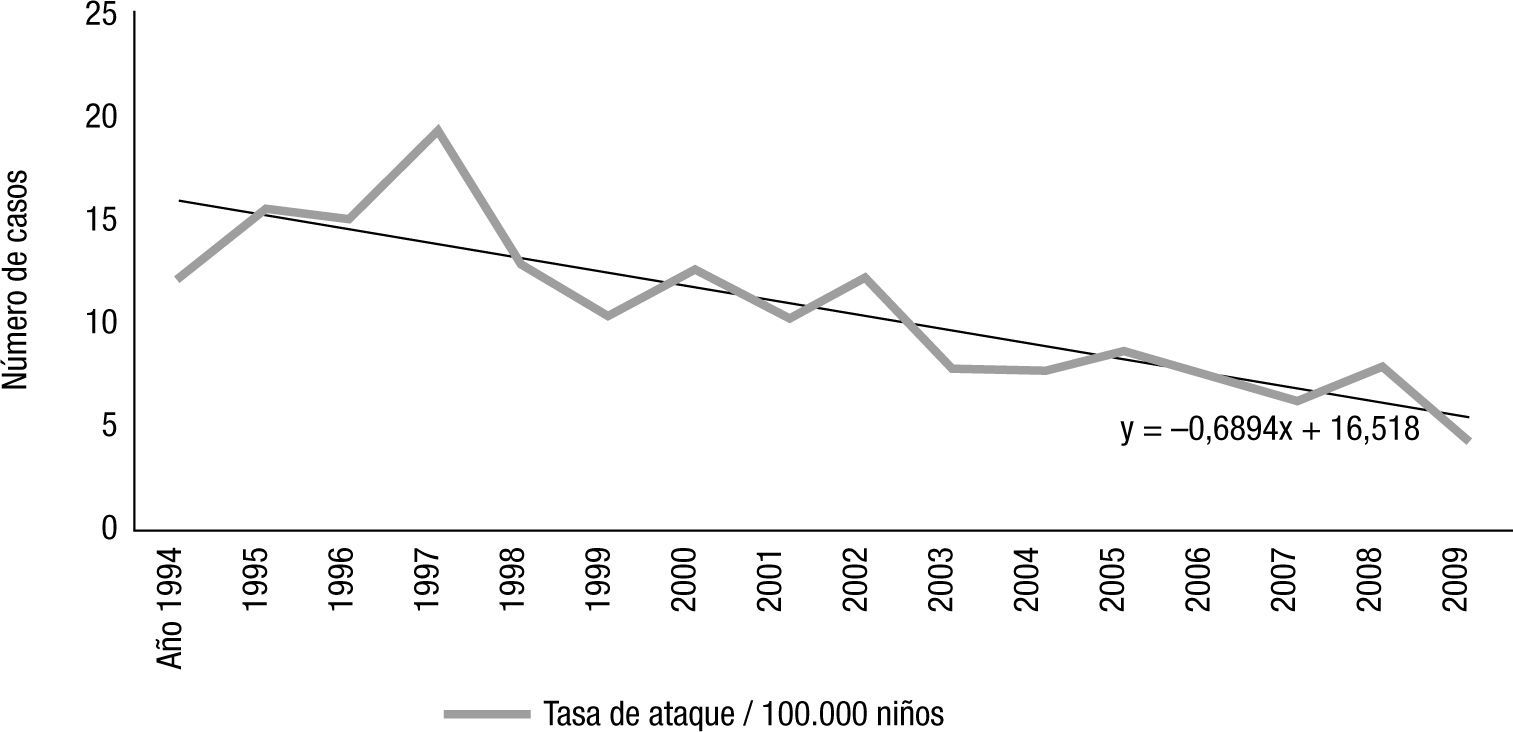
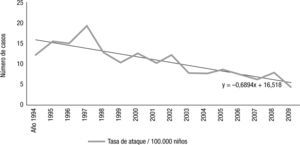
La tasa de ataque cada 100 000 niños varió entre 19,2 (1997) y 4,3 (2009), con una media de 10,6 y una tendencia en disminución (y = −0,689x + 16,52). Esto fue a expensas del grupo de niños entre 1 y 11 meses (94/167, 56 %), en el que disminuyó de 146,6 a 34,8 casos cada 100 000 niños
El 30,7 % de los aislamientos (46/150) fueron resistentes a penicilina y el 16,7 % (25/150) no sensibles a cefotaxima. La resistencia a β-lactámicos se incrementó a partir de 1997 y comenzó a disminuir en 2005.
Se detectaron 19 serotipos, predominó el 14 (32 %; 40/125). El 84,8 % de los aislamientos quedaron circunscriptos a nueve serotipos: 14, 5, 1, 7F, 18C, 6B, 9N, 9V y 4.
La cobertura teórica en los niños < 2 años y > 2 años fue de 84,1 % (74/88) y 83,8 % (31/37) con la vacuna 10-valente, y de 89,8 % (79/88) y 83,8 % (31/37) con la vacuna 13-valente, respectivamente. La resistencia a penicilina estuvo circunscripta a 8 serotipos (14, 6B, 6A, 9V, 4, 23B, 1 y 19A), y la no sensibilidad a cefotaxima a 3 serotipos (14, 9V y 1), el más importante fue en ambos casos el serotipo 14.
Este estudio permitirá evaluar el impacto de la implementación de las vacunas conjugadas en nuestra zona.
We report the results of pneumococcal meningitis surveillance conducted at the Provincial Pediatric Hospital of Posadas, Misiones (Argentina), before the conjugate vaccine was introduced into the national vaccination schedule.
Between January 1994 and December 2009, 167 cases of Streptococcus pneumoniae meningitis were diagnosed in children aged 1 month to 15 years.
The attack rate/100,000 children ranged from 19.2 (1997) to 4.3 (2009), with a mean of 10.6 and a tendency to decrease (y=−0.689x+16.52). The number of cases per 100,000 children decreased from 146.6 to 34.8 and particularly involved the group of children aged 1 to 11 months (94/167, 56%).
Thirty point seven percent (30.7%) (46/150) of the isolates were resistant to penicillin whereas 16.7% (25/150) were non-susceptible to cefotaxime. β-lactam resistance increased as from 1997 and began to decline in 2005.
Nineteen serotypes were detected; type 14 was predominant and accounted for 32% (40/125). Eighty four point eight percent (84.8%) of the isolates were circumscribed to nine serotypes: 14, 5, 1, 7F, 18C, 6B, 9N, 9V and 4.
Theoretical coverage for patients aged <2 years and >2 years was 84.1% (74/88) and 83.8% (31/37) for the 10-valent vaccine and 89.8 % (79/88) and 83.8% (31/37) for the 13-valent vaccine respectively. Penicillin resistance was restricted to 8 serotypes (14, 6B, 6A, 9V, 4, 23B, 19A1) and nonsusceptibility to cefotaxime was circumscribed to 3 serotypes (14, 9V and 1).
This study will allow to evaluate the impact of the implementation of conjugate vaccines on our area.
Streptococcus pneumoniae es una de las principales causas de meningitis, neumonía y bacteriemias, especialmente entre los niños más pequeños y los adultos mayores, por lo que constituye un problema importante de salud pública en nuestro país48 y a nivel mundial24. La incidencia global de meningitis por este agente es de 17 casos/100 000 niños menores de 5 años, la más baja se registra en Europa (5 casos/100 000) y la más alta en África (38/100 000 casos)36.
Este microorganismo presenta múltiples desafíos para su control, determinados por los diversos tipos capsulares que existen, por su diferente prevalencia según zonas geográficas y grupos etarios, y por las variaciones temporales en los serotipos causantes de enfermedad21,24,43.
Las desigualdades en la incidencia y características de la enfermedad invasiva por S. pneumoniae entre regiones pueden obedecer a diferencias epidemiológicas reales, o bien a disparidad en los sistemas de registro o en la práctica asistencial, que establece diferentes protocolos diagnósticos. Estas limitaciones diagnósticas no existen para la meningitis, enfermedad siempre sintomática y que requiere internación. Por eso, muchos autores sostienen que esta afección es la que debería usarse a efectos epidemiológicos y comparativos18,21,24.
El Programa Nacional de Control de Enfermedades Inmu-noprevenibles (ProNaCei), siguiendo las recomendaciones de la Comisión Nacional de Inmunizaciones (CONAIN) de septiembre de 2009, consideró la introducción al Calendario Nacional de Vacunación argentino de una vacuna conjugada contra neumococo. A partir de 2012 y sobre la base de estudios de costo-beneficio, se decidió incorporar al Calendario Nacional de Inmunizaciones la vacuna 13-valente48. Esta incluye 13 serotipos (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19F, 19A y 23F), con los que se prevé cubrir más del 80 % de los serotipos causantes de la enfermedad invasiva en nuestro país43.
El objetivo de este reporte es presentar los resultados de 16 años (1994 a 2009) de vigilancia epidemiológica de meningitis neumocócica realizada en el Hospital Provincial de Pediatría de Posadas (Misiones, Argentina). Esta labor ha permitido comparar en el tiempo la incidencia de enfermedad, la prevalencia de serotipos y la emergencia de resistencia a β-lactámicos, lo que a futuro contribuirá a medir el impacto de la introducción de la vacuna conjugada en la prevención de esta enfermedad en nuestra zona.
Materiales y métodosEl Hospital Provincial de Pediatría “Dr. Fernando Barreyro” constituye el único monoclínico pediátrico de la provincia de Misiones. Cuenta con 100 de las 120 camas pediátricas del departamento Capital y es responsable de aproximadamente el 95 % de las denuncias de meningitis en este departamento.
Se realizó un estudio descriptivo longitudinal. Para el presente análisis se incluyeron todos los casos de meningitis por S. pneumoniae internados en el nosocomio entre el 1 de enero de 1994 y el 31 de diciembre de 2009.
Los pacientes residían en el departamento Capital (población actual), que incluye los municipios de Posadas, Ga-rupá y Fachinal.
La población incluida en el estudio (mayores de un mes y menores de 15 años) no había sido inmunizada contra este agente y fue clasificada a los efectos de este análisis en tres franjas etarias: menores de 2 años, de 2 a 4 años y mayores de 4 años.
Los pacientes fueron definidos como sospechosos de infección meníngea (conforme con los protocolos establecidos por el Ministerio de Salud), internados en el hospital y sometidos a procedimientos diagnósticos, los que incluyeron la punción lumbar, el examen del LCR y la implementación de protocolos de laboratorio para el cultivo y aislamiento del patógeno.
Los casos fueron definidos como “confirmados” cuando se obtuvo el aislamiento de S. pneumoniae de muestras de LCR o de hemocultivos, o frente a resultados positivos para aglutinación con partículas de látex en LCR de pacientes con signos y síntomas de meningitis.
El aislamiento del microorganismo se realizó aplicando métodos convencionales de laboratorio. Los materiales clínicos fueron inoculados en placas de agar sangre de carnero al 5 %, agar chocolate y caldo infusión de cerebro y corazón (Britania, Argentina), suplementado con sangre de carnero al 5 %. La incubación se realizó en atmósfera de dióxido de carbono al 5 %, a 35°C durante 24–48h. Se evaluaron las colonias con morfología característica y se identificaron como neumococo por medio de la sensibilidad a optoquina y la solubilidad en sales biliares. Las pruebas de sensibilidad a los antimicrobianos se efectuaron por el método de macrodilución en caldo, siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI)10. Se adoptaron los puntos de corte establecidos para meningitis. Los aislamientos que presentaron un valor de CIM de penicilina > de 0,12g/ml se definieron como resistentes, y los que exhibieron una CIM de cefotaxima > 1g/ml se consideraron no sensibles.
La conservación de los microorganismos se realizó en leche descremada a −20°C, durante seis meses.
Los aislamientos se enviaron al INEI-ANLIS “Dr. Carlos G. Malbrán” para la determinación del tipo capsular. El serotipo se determinó por la técnica de Quellung, utilizando antisueros específicos producidos por el Statents Seruminstitut (Copenhage, Dinamarca).
Los cálculos de incidencia se efectuaron utilizando los datos poblacionales provistos por el INDEC (Instituto Nacional de Estadísticas y Censos) 2001 y 2010, ajustados por cálculos de crecimiento poblacional28.
Se utilizó el programa Epi-info versión 6 para la carga de datos de cada paciente, así como para evaluar los resultados obtenidos por el laboratorio.
Se aplicó el test de chi-cuadrado para el cálculo de tendencias; el test exacto de Fischer se empleó para la comparación de proporciones. Las diferencias se consideraron significativas si el valor de p fue menor que 0,05.
Para determinar la cobertura potencial de las vacunas conjugadas neumocócicas 10-valente y 13-valente, se hizo un análisis teórico que incluyó la frecuencia de aislamientos de los serotipos incluidos en cada vacuna.
El trabajo fue aprobado por el Comité de Ética del Hospital Provincial de Pediatría.
ResultadosDurante el período de estudio se internaron 1.073 niños con diagnóstico de meningitis. De ese total, 568 fueron confirmadas como bacterianas y 167 correspondieron a meningitis por S. pneumoniae.
La tasa de ataque por S. pneumoniae cada 100 000 niños del departamento Capital varió entre 19,26 (1997) y 4,37 (2009), con una media de 10,66 y una tendencia en disminución (y = −0,689x + 16,52; fig. 1). Entre los afectados observamos un predominio del género masculino, con 101 niños (60,5 %; relación V:M = 1,53:1). La mediana de edad se situó en 2 años y 7 meses. El mayor número de aislamientos se obtuvo de niños menores de 1 año (94/167; 56,3 %), sobre todo, de aquellos con edades comprendidas entre 1 y 6 meses (63/167; 37,7 %). Los niños con edades comprendidas entre 1 y 2 años y los mayores de 4 años representaron el 16,2 % (27/167) cada uno, y el grupo con edades entre 2 y 4 años el 11,3 % restante (19/167).
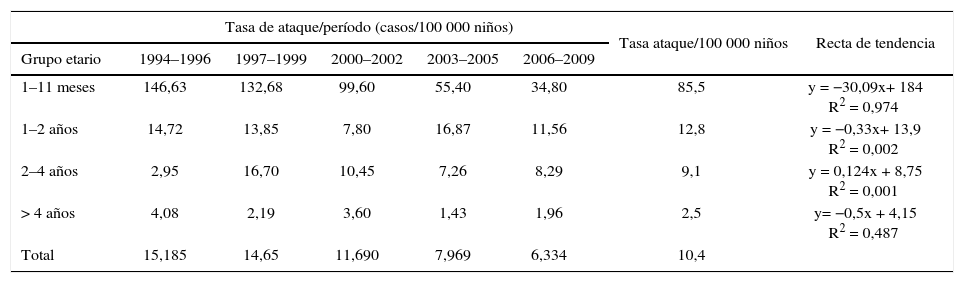
Si analizamos las tasas de ataque ajustadas por edad cada 100 000 niños, encontramos que estas fueron más elevadas en el grupo de 1-11 meses, con una marcada disminución a medida que aumentó la edad (tabla 1). Su incidencia respecto de cualquier otro grupo etario fue significativamente mayor [p (1–11 m vs. 1–2 a), p (1–11 m vs. 2–4 a) y p (1–11 m vs. > 4 a) < 0,001], esta edad constituyó un factor de riesgo para la adquisición de meningitis por este agente (OR 1–11 meses = 17,48; IC 95 %: = 12,74–24).
Meningitis por Streptococcus pneumoniae. Serie temporal. Tasa de ataque en menores de 15 años, ajustada por edad (total de casos: 167).
| Tasa de ataque/período (casos/100 000 niños) | Tasa ataque/100 000 niños | Recta de tendencia | |||||
|---|---|---|---|---|---|---|---|
| Grupo etario | 1994–1996 | 1997–1999 | 2000–2002 | 2003–2005 | 2006–2009 | ||
| 1–11 meses | 146,63 | 132,68 | 99,60 | 55,40 | 34,80 | 85,5 | y = −30,09x+ 184 R2 = 0,974 |
| 1–2 años | 14,72 | 13,85 | 7,80 | 16,87 | 11,56 | 12,8 | y = −0,33x+ 13,9 R2 = 0,002 |
| 2–4 años | 2,95 | 16,70 | 10,45 | 7,26 | 8,29 | 9,1 | y = 0,124x + 8,75 R2 = 0,001 |
| > 4 años | 4,08 | 2,19 | 3,60 | 1,43 | 1,96 | 2,5 | y= −0,5x + 4,15 R2 = 0,487 |
| Total | 15,185 | 14,65 | 11,690 | 7,969 | 6,334 | 10,4 | |
No se detectaron diferencias significativas en las tasas de ataque entre los niños de 1 -2 años y entre los de 2–4 años (p=0,05). Sin embargo, estas tasas fueron superiores y estadísticamente significativas con respecto a las observadas en el grupo etario de mayores de 4 años [p (1–2 a vs. > 4 a) = 0,007; p (2–4 a vs. > 4 a) = 0,03].
Al evaluar las variaciones de las tasas de ataque considerando los diversos grupos etarios y períodos de tiempo, observamos que, en general, el descenso fue particularmente a expensas del grupo de niños entre 1 y 11 meses, en el que la tasa de ataque corregida por edad disminuyó de 146,63 casos cada 100 000 niños a 34,80 cada 100 000 niños en el final del período evaluado (curva de tendencia: y = −30,09x + 184). No fue tan notoria la disminución en los niños de 1 a 2 años (y = −0,33x + 13,9), ni entre los mayores de 4 años (y = −0,50x + 4,15), entre los que las tasas de ataque pasaron de 14,72 a 11,56/100 000 y de 4,08 a 1,96/100 000, respectivamente.
Un comportamiento diferente observamos entre los niños con edades comprendidas entre 2 y 4 años, ya que las tasas de ataque aumentaron durante dicho período de 2,95 a 8,29, pasando por un pico de 16,7 en el periodo 1997–1999 (y = 0,124x + 8,75; tabla 1).
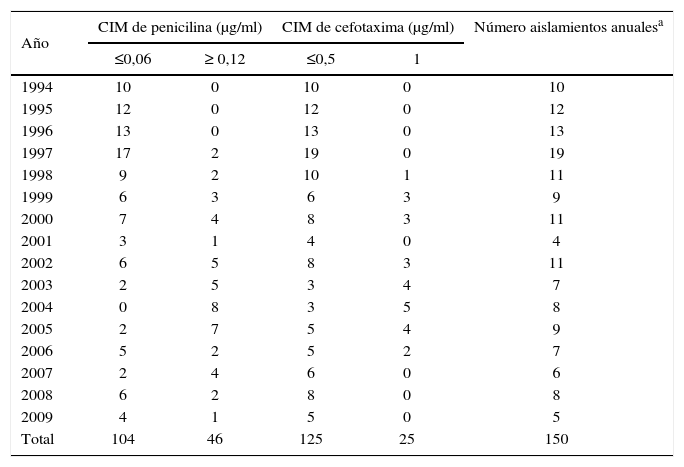
Al evaluar el comportamiento de los aislamientos frente a los antibióticos β-lactámicos, observamos que los neumococos sensibles predominaron en todo el período de estudio. Obtuvimos resultados de concentración inhibitoria mínima de penicilina (CIMpen) ≤ 0,06μg/ml en 104 aislamientos (69,3 %), CIMpen de 0,12 a 1μg /ml en 36 aislamientos (24 %), y 10 neumococos (6,7 %) con CIMpen = 2μg /ml. Ningún aislamiento tuvo CIMpen = 4μg/ml o mayor. Diecisiete cepas no estuvieron disponibles por pérdida de la viabilidad al momento del estudio de sensibilidad a los antimicrobianos, de modo que este incluyó 150 cepas.
En lo que respecta a las cefalosporinas de tercera generación, 125 aislamientos (83,3 %) presentaron CIM de cefo-taxima (CIMctx) ≤ 0,5mg/ml, por lo que fueron interpretados como sensibles, y 25 aislamientos (16,7 %) tuvieron CIMctx = 1μg/ml, y se consideraron no sensibles. Ningún aislamiento tuvo CIMctx = 2μg /ml o mayor.
Durante el período de estudio se observó un incremento de la resistencia a β-lactámicos, que se inició en 1997, llegó a los niveles máximos durante 2003–2004 y declinó a partir de 2005 llegando a un mínimo en 2009 (tabla 2).
Streptococcus pneumoniae aislados de meningitis. Distribución anual de la resistencia a penicilina y cefotaxima.
| Año | CIM de penicilina (μg/ml) | CIM de cefotaxima (μg/ml) | Número aislamientos anualesa | ||
|---|---|---|---|---|---|
| ≤0,06 | ≥ 0,12 | ≤0,5 | 1 | ||
| 1994 | 10 | 0 | 10 | 0 | 10 |
| 1995 | 12 | 0 | 12 | 0 | 12 |
| 1996 | 13 | 0 | 13 | 0 | 13 |
| 1997 | 17 | 2 | 19 | 0 | 19 |
| 1998 | 9 | 2 | 10 | 1 | 11 |
| 1999 | 6 | 3 | 6 | 3 | 9 |
| 2000 | 7 | 4 | 8 | 3 | 11 |
| 2001 | 3 | 1 | 4 | 0 | 4 |
| 2002 | 6 | 5 | 8 | 3 | 11 |
| 2003 | 2 | 5 | 3 | 4 | 7 |
| 2004 | 0 | 8 | 3 | 5 | 8 |
| 2005 | 2 | 7 | 5 | 4 | 9 |
| 2006 | 5 | 2 | 5 | 2 | 7 |
| 2007 | 2 | 4 | 6 | 0 | 6 |
| 2008 | 6 | 2 | 8 | 0 | 8 |
| 2009 | 4 | 1 | 5 | 0 | 5 |
| Total | 104 | 46 | 125 | 25 | 150 |
Durante el periodo 1994–1998, el nivel de resistencia a penicilina fue 6,1 % y el de no sensibilidad a cefotaxima, de 1,5 %. En los años 1999–2005, estos niveles aumentaron a 56 % y 37 %, respectivamente. A partir de 2006, se observó un descenso de la resistencia a ambos β-lactámicos (pasó a ser del 35 % para penicilina y del 8 % para cefotaxima).
Todos los aislamientos sensibles a penicilina lo fueron también a cefotaxima. De los 36 aislamientos con CIMpen entre 0,12 y 1μg /ml, 15 presentaron CIMctx = 1μg /ml. Los 10 aislamientos con CIMpen = 2μg /ml tuvieron CIMctx = 1μg /ml.
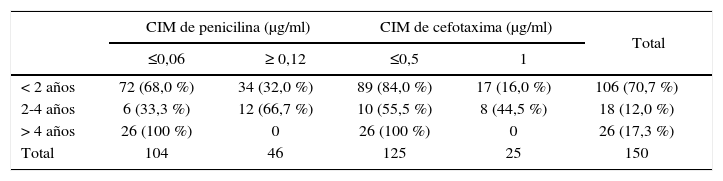
Los mayores niveles de resistencia se observaron en los niños con edades comprendidas entre 2 y 4 años (p<0,05) (tabla 3). Encontramos que en este grupo, la probabilidad de detectar aislamientos resistentes a estos antibióticos fue del 80 % con respecto a los niños menores [Pen-R: 67 % (12/18) vs. 32 % (34/106), OR Pen-R = 4,24; IC 95 %: 1,33–14,01, p=0,0049]; Ctx-NoS: 44,5 % (8/18) vs. 16 % (17/106), OR Ctx-R = 4,19; IC 95 %: 1,28–13,77, p=0,005]. Entre los niños mayores, solo se aislaron cepas sensibles a ambos β-lactámicos.
Streptococcus pneumoniae aislados de meningitis. Distribución de la CIM de penicilina y cefotaxima en los distintos grupos etarios.
| CIM de penicilina (μg/ml) | CIM de cefotaxima (μg/ml) | Total | |||
|---|---|---|---|---|---|
| ≤0,06 | ≥ 0,12 | ≤0,5 | 1 | ||
| < 2 años | 72 (68,0 %) | 34 (32,0 %) | 89 (84,0 %) | 17 (16,0 %) | 106 (70,7 %) |
| 2-4 años | 6 (33,3 %) | 12 (66,7 %) | 10 (55,5 %) | 8 (44,5 %) | 18 (12,0 %) |
| > 4 años | 26 (100 %) | 0 | 26 (100 %) | 0 | 26 (17,3 %) |
| Total | 104 | 46 | 125 | 25 | 150 |
CIMpen χ2 = 22,57; p=0,00001; CIMctx χ2 = 15,23; p=0,00049.
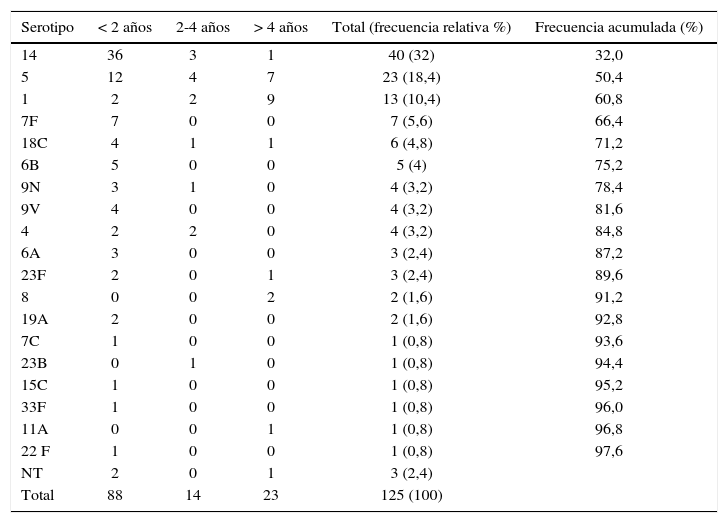
De los 167 aislamientos, 125 se enviaron a serotipificar. Se detectaron 19 serotipos diferentes. Se destaca el predominio del serotipo 14, que representó el 32 % (40/125) de las cepas estudiadas. El 84,8 % de los aislamientos quedaron circunscriptos a solo nueve serotipos: 14, 5, 1, 7F, 18C, 6B, 9N, 9V y 4 (tabla 4).
Streptococcus pneumoniae aislados de meningitis. Distribución de serotipos conforme a grupos etarios.
| Serotipo | < 2 años | 2-4 años | > 4 años | Total (frecuencia relativa %) | Frecuencia acumulada (%) |
|---|---|---|---|---|---|
| 14 | 36 | 3 | 1 | 40 (32) | 32,0 |
| 5 | 12 | 4 | 7 | 23 (18,4) | 50,4 |
| 1 | 2 | 2 | 9 | 13 (10,4) | 60,8 |
| 7F | 7 | 0 | 0 | 7 (5,6) | 66,4 |
| 18C | 4 | 1 | 1 | 6 (4,8) | 71,2 |
| 6B | 5 | 0 | 0 | 5 (4) | 75,2 |
| 9N | 3 | 1 | 0 | 4 (3,2) | 78,4 |
| 9V | 4 | 0 | 0 | 4 (3,2) | 81,6 |
| 4 | 2 | 2 | 0 | 4 (3,2) | 84,8 |
| 6A | 3 | 0 | 0 | 3 (2,4) | 87,2 |
| 23F | 2 | 0 | 1 | 3 (2,4) | 89,6 |
| 8 | 0 | 0 | 2 | 2 (1,6) | 91,2 |
| 19A | 2 | 0 | 0 | 2 (1,6) | 92,8 |
| 7C | 1 | 0 | 0 | 1 (0,8) | 93,6 |
| 23B | 0 | 1 | 0 | 1 (0,8) | 94,4 |
| 15C | 1 | 0 | 0 | 1 (0,8) | 95,2 |
| 33F | 1 | 0 | 0 | 1 (0,8) | 96,0 |
| 11A | 0 | 0 | 1 | 1 (0,8) | 96,8 |
| 22 F | 1 | 0 | 0 | 1 (0,8) | 97,6 |
| NT | 2 | 0 | 1 | 3 (2,4) | |
| Total | 88 | 14 | 23 | 125 (100) |
Observamos diferencias en la distribución de los serotipos más prevalentes (14, 5 y 1) entre los niños de los tres grupos etarios analizados (p<0,001); no así con los demás serotipos detectados (p > 0,05).
Al reagrupar a los niños entre menores y mayores de 2 años, encontramos que el serotipo 14 continuó siendo el más prevalente entre los menores de 2 años: 41,8 % (36/88) vs. 11,1 % (4/ 37), OR < 2 a vs. > 2 a=5,76; IC95 %: 1,73–21,14; p=0,002.
Por el contrario, los serotipos 1 y 5 prevalecieron en el grupo de mayores de 2 años: 30,5 % (11 /37) vs. 2,3 % (2/88), OR > 2 a vs. < 2 a = 18,48; IC95 %: 3,49–129,99; p=0,000004 para el serotipo 1; y 30,5 % (11 / 37) vs. 13,9 % (12/ 88), OR> 2 a vs. < 2 a = 2,71; IC95 %: 0,97–7,64; p=0,032 para el serotipo 5 (tabla 4).
Al comparar la frecuencia de cada uno de los serotipos hallados, observamos variaciones entre los diferentes períodos, sin diferencias significativas (p > 0,05). El serotipo 14 fue el más frecuente en todos los períodos, su frecuencia relativa varió del 34,1 % (14/41) en el período 1994–1998 al 36,5 % (15/41) en el período 1999–2003, para luego descender a 25,5 % (11/43) en el período 2004–2009. El serotipo 1 incrementó su frecuencia de un 4,8 % (2/41) en 1994–1998 a 18,6 % (8/43) en el último período. El serotipo 5 se mantuvo en porcentajes similares en el primer período (19,5 %; 8/41) y en el último (20,9 %; 9/43), y descendió a un 14,6 % (6/41) en el período 1999–2003.
Los porcentajes de tipos capsulares incluidos en las vacunas neumocócicas 10-valente y 13-valente representaron el 84 % y 88 %, respectivamente.
La cobertura prevista para los pacientes menores de 2 años y mayores de 2 años fue de 84,1 % (74/88) y 83,8 % (31/37) con la vacuna 10-valente, y de 89,8 % (79/88) y 83,8 % (31 /37) con la vacuna 13-valente, respectivamente.
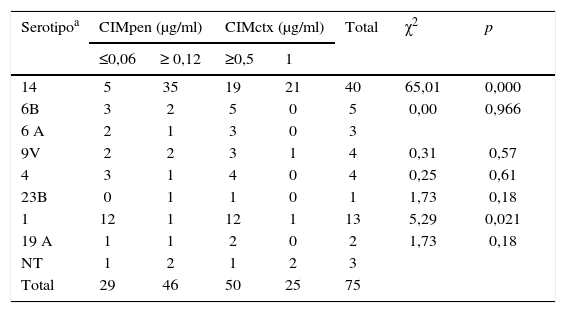
La resistencia a penicilina estuvo circunscripta a 8 serotipos (14, 6B, 6A, 9V, 4, 23B, 1 y 19A), y la no sensibilidad a cefotaxima a 3 serotipos (14, 9V y 1), el más importante en ambos casos fue el serotipo 14 (p<0,005) (tabla 5). Dos aislamientos no tipificables presentaron resistencia a penicilina y sensibilidad intermedia a cefotaxima.
Streptococcus pneumoniae aislados de meningitis. Distribución de serotipos conforme con los resultados de CIM de penicilina y de cefotaxima.
| Serotipoa | CIMpen (μg/ml) | CIMctx (μg/ml) | Total | χ2 | p | ||
|---|---|---|---|---|---|---|---|
| ≤0,06 | ≥ 0,12 | ≥0,5 | 1 | ||||
| 14 | 5 | 35 | 19 | 21 | 40 | 65,01 | 0,000 |
| 6B | 3 | 2 | 5 | 0 | 5 | 0,00 | 0,966 |
| 6 A | 2 | 1 | 3 | 0 | 3 | ||
| 9V | 2 | 2 | 3 | 1 | 4 | 0,31 | 0,57 |
| 4 | 3 | 1 | 4 | 0 | 4 | 0,25 | 0,61 |
| 23B | 0 | 1 | 1 | 0 | 1 | 1,73 | 0,18 |
| 1 | 12 | 1 | 12 | 1 | 13 | 5,29 | 0,021 |
| 19 A | 1 | 1 | 2 | 0 | 2 | 1,73 | 0,18 |
| NT | 1 | 2 | 1 | 2 | 3 | ||
| Total | 29 | 46 | 50 | 25 | 75 | ||
χ2=33,24; p=0,00005.
El 87,5 % (35/40) de las meningitis por serotipo 14 presentaron resistencia a penicilina y el 52,5 % (21 /40) fueron no sensibles a cefotaxima.
DiscusiónLas tasas de ataque de meningitis por S. pneumoniae cada 100 000 habitantes halladas en nuestro hospital son muy superiores a las anunciadas a nivel nacional, las que se mantuvieron en alrededor de 1 caso/100 000 habitantes en la serie de 16 años (1994–2009)34. Este hecho podría deberse a condiciones socioeconómicas de nuestra población2, a diferencias en las medidas de salud pública13 o a una deficiencia en el Sistema Nacional de Vigilancia Epidemiológica. Dichas tasas fueron, además, mayores que las comunicadas por investigadores europeos y americanos en estudios abordados en países industrializados, aunque no tan significativas como las denunciadas en ciertos países en vías de desarrollo. Países como Grecia, Reino Unido (Inglaterra y Gales), Eslovaquia, Alemania, Cuba, EE.UU. y Brasil denunciaron para el período valores entre 0,9 y 1,8 casos cada 100 000 niños menores de 15 años15,27,32,33,41,45,46; en cambio, en el continente africano, las cifras comunicadas superaron los 20 casos cada 100 000 niños40,44.
La incidencia de la infección neumocócica varía ampliamente en diferentes regiones del mundo y está influenciada por varios factores, como la edad y el estado de vacunación24.
Al evaluar nuestra serie observamos a lo largo de 16 años una disminución en la incidencia de meningitis, con un marcado descenso en las tasas de ataque. Estos hallazgos podrían deberse al mejoramiento en la atención primaria de salud de los niños y a la disponibilidad de la vacuna conjugada neumocócica 7-valente en la práctica privada en nuestra región, a partir de 2004. Este suceso ya fue señalado por nosotros20 y descrito en otros países latinoamericanos32. Sin embargo, este hecho no fue registrado por investigadores europeos, quienes señalaron que, a diferencia de las otras enfermedades invasivas por este agente, los valores de tasas de ataque hallados en meningitis a lo largo de 15 años no variaron notablemente41,45.
En lo que respecta a la edad de los pacientes estudiados, los porcentajes detectados fueron similares a los observados por otros autores del mundo, quienes señalan que el 70 % de los aislamientos se produjeron en los menores de 2 años, principalmente en menores de 1 año32, tanto en los países desarrollados como en aquellos en desarrollo22,50.
Las tasas detectadas durante todo el período en los menores de un año (85,5 casos/100 000 niños), en los niños de 2 a 4 años (9,1 casos/100 000 niños) y en los mayores de 4 años (2,5 casos/100 000 niños) fueron superiores a las informadas por diversos investigadores. Para los niños menores de un año, las tasas han oscilado dentro de diferentes rangos (expresadas por 100 000 niños): 8–27 en Brasil32,39, 10–24 en Cuba16 y 5–17 en Europa, dependiendo del país y del estudio33,38,45. Sin embargo, las tasas halladas en este grupo etario no fueron tan importantes como las publicadas por investigadores africanos, quienes denuncian tasas que oscilaron entre 108 y 257 casos/100 000 niños40.
En los niños con edades que van de los 2 a los 4 años y en los mayores de 4 años, las tasas halladas también superaron a las comunicadas por autores de otros países. Para el primer grupo, se han reportado tasas de 1,2 en Alemania41, 1,3 en Grecia45, 1,6 en Brasil32 y 5 casos en España18 (todas ellas, por 100 000 niños). En niños mayores de 4 años, las tasas denunciadas fueron siempre menores que 1 caso/100 000 niños: 0,3–0,8 en Brasil32, 0,7 en España18, 0,3 en Alemania41 y 0,1 en Grecia y EE.UU.45,46.
En los niños con edades entre 1 y 2 años, la tasa de ataque calculada fue 12,8 casos/100 000 niños, valor similar al publicado en Brasil32 y superior al denunciado en Europa y EE.UU.45,46.
El incremento de las tasas de resistencia a antibióticos en los últimos 20 años se ha convertido en un serio problema, con los consiguientes fracasos en el tratamiento e incrementos de los costos de asistencia sanitaria49. El conocimiento de los patrones de sensibilidad a los antimicrobianos en un área geográfica determinada es de vital importancia para establecer las pautas de manejo clínico de la infección neumocócica13.
Aunque los valores hallados en el presente trabajo son superiores a los reportados en la literatura, el aumento global de la resistencia a la penicilina de los aislamientos estudiados coincide con una tendencia mundial47. En diversos países latinoamericanos, como Argentina, Brasil, Chile, Colombia, México y Uruguay1,17,42, se observó un incremento de la resistencia a penicilina, que pasó del 22 % en 199414 a más del 30 % en los últimos años, con fluctuaciones anuales. El mismo fue menor en Brasil y Panamá, y mayor en México7,17,25.
La resistencia a cefalosporinas de tercera generación también ha aumentado en forma progresiva en diversas partes del mundo3, aunque no llega a niveles tan altos como los observados con penicilina. El porcentaje de aislamientos no sensibles a este antimicrobiano detectado en el presente trabajo (17 %) es similar al hallado en Colombia (16,8 %)1 y superior al de Argentina (13,2 %)43 y Brasil (2,5 y 1 %)32,39.
Los niveles de resistencia a penicilina (6,1 %) y de no sensibilidad a cefotaxima (1,5 %) observados durante el primer período del estudio (1994–1998) son mucho menores comparados con los publicados por el Proyecto SIREVA en niños menores de 6 años para Argentina y América Latina, que establece un 20,7 % y 28,8 % de resistencia a penicilina 25,42, y un 5 % y 12,1 % de no sensibilidad a cefotaxima, respectivamente, en cuadros meníngeos11,25.
En este período, todos los aislamientos resistentes a penicilina fueron sensibles a cefotaxima, lo que indica que el uso de cefalosporinas de tercera generación constituía una alternativa válida de tratamiento empírico inicial en casos sospechosos de meningitis bacterianas por este agente.
Durante el periodo 1999–2005, los niveles de resistencia a penicilina (56 %) resultan superiores a los informados a nivel nacional y para la región37, donde se señala una tendencia a la estabilización cercana al 20 %32,42. Este dato no supera lo informado en México, donde fue del 68 %13.
El nivel de no sensibilidad a cefotaxima hallado (37 %) fue superior al publicado en Argentina37 y Brasil32, por lo que debe considerarse el uso de esta droga a altas dosis o asociada a vancomicina como tratamiento empírico en estos cuadros, hasta que las pruebas de sensibilidad estén disponibles29.
La disminución en los niveles de resistencia a β-lactámicos en meningitis y enfermedades invasivas por S. pneumoniae observada en nuestra región a partir del año 2006, que ya fue informada por nuestro grupo20, también fue denunciada por otros autores de la Argentina y de otros países de la región37,43. Una excepción la constituye Brasil, que acusa un aumento de los niveles de resistencia a penicilina del 25 % en 2006 al 50 % en 2009, sin observar inicialmente variaciones en los niveles de no sensibilidad a cefotaxima, los que permanecieron en 2007 menores que el 10 %32,36,37 y posteriormente ascendieron hacia 2009 a porcentajes cercanos al 20 %32,37.
Diversos autores discuten la importancia de los factores socioeconómicos y el uso de antibióticos en el desarrollo de la resistencia de S. pneumoniae12, y destacan la necesidad del uso prudente y racional de antibióticos en niños, fundamentalmente en el ámbito ambulatorio, en donde los antibióticos β-lactámicos son frecuentemente usados.
Mientras que algunos trabajos no han encontrado que la edad fuera un factor de riesgo para la adquisición de infecciones por cepas penR3, otros, al igual que el presente estudio, señalan una fuerte asociación entre estas variables35,42, considerándola un riesgo que favorece este tipo de infecciones.
En nuestro estudio, los 9 serotipos prevalentes representan el 84,8 % de los aislamientos, y de estos, más del 60 % corresponden a los serotipos 14, 5 y 1. Estos resultados difieren de lo encontrado por el grupo SIREVA-Argentina para este tipo de cuadros clínicos, en donde los 13 serotipos prevalentes representaron el 81 % de los aislamientos, y los serotipos 14, 5 y 1, el 44 %31,43.
Se ha sugerido que algunos tipos capsulares tienen una fuerte asociación con ciertas patologías23,43. La prevalencia de los serotipos 14, 6A, 6B, 5, 1, 18C, 19F y 23F como causantes de meningitis, comunicada por SIREVA para América Latina9, coincide parcialmente con nuestros resultados, ya que no hemos observado en nuestra zona circulación del serotipo 19F, sí reportado en estos cuadros en América Latina1,9,32.
Detectamos una frecuencia similar de aislamientos del serotipo 7F a la reportada para Argentina43, y más elevada que la observada en Brasil32,37.
En concordancia con lo descrito31 y puesto de manifiesto previamente19, hemos logrado documentar diferencias entre los serotipos encontrados entre los niños menores o mayores de 2 años. El serotipo 14 predominó en el primer grupo, mientras que los serotipos 1 y 5 prevalecieron en el segundo7,42.
Al igual que a nivel nacional, no observamos variaciones en la circulación del serotipo 5, pero sí hemos detectado una disminución del serotipo 14 y un aumento en la circulación del serotipo 143. Esta variación no fue observada en Brasil5,32.
La relativa estabilidad en cuanto a los serotipos circulantes durante los últimos años observada en el país y en la región podría explicarse por el limitado uso de vacunas conjugadas en nuestra población, lo que reduce la posibilidad de cambios en las cepas aisladas, tanto de portadores nasofaríngeos como de procesos invasivos4,32,43.
Para nuestro país, la cobertura estimada para cada una de las fórmulas vacunales 10-valente y 13-valente en casos de meningitis sería del 76,1 % y 81,9 %, respectivamente43, la cual resulta superior a la publicada para estos cuadros en Brasil4,32 y Estados Unidos26, aunque un poco más baja que las coberturas teóricas hallada para este período en el presente estudio (84 % y 88 %, respectivamente).
La mayoría de los casos de resistencia a antimicrobianos clínicamente importantes se limita a unos pocos serotipos dominantes, denominados “serotipos pediátricos”: 6A, 6B, 9V, 14, 19A, 19F y 23F30. Tal como ha sido informado en otros estudios realizados en Latinoamérica8,32, cinco de estos serotipos han sido detectados en el presente estudio, en relación con la resistencia a β-lactámicos.
Se señala que los países con mayores índices de resistencia a penicilina son aquellos en los que no se detectan los serotipos 1 y 5 (o en donde han sido detectado a muy bajo nivel)22, ya que estos son generalmente sensibles a los antimicrobianos6,22. En este estudio se obtuvieron resultados similares, ya que los aislamientos del serotipo 5 fueron sensibles a ambos β-lactámicos y solo observamos un aislamiento del serotipo 1 resistente a penicilina.
Nuestros hallazgos refuerzan la idea de que dada las considerables diferencias geográficas que prevalecen en nuestro país, sería importante que cada región tuviera su propia información a través de la vigilancia continua42.
Se cumplieron los objetivos principales al lograr información sobre las tasas de incidencia de meningitis por S. pneumoniae, sus variaciones por edad, los serotipos relacionados con la enfermedad, su sensibilidad a β-lactámicos y los cambios temporales. Consideramos que esto posibilitará a futuro evaluar el impacto de las vacunas conjugadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.