La toxoplasmosis es una infección oportunista causada por el parásito Toxoplasma gondii; su infección es grave y de difícil diagnóstico en pacientes que reciben un trasplante alogénico de células progenitoras hematopoyéticas (TCPH). En el Hospital de Pediatría S.A.M.I.C. “Profesor Dr. Juan P. Garrahan” se realizó la vigilancia postrasplante de 12 pacientes receptores de TCPH mediante la técnica de PCR cualitativa. La necesidad de seguimiento de estos pacientes fue definida por el antecedente de serología positiva para toxoplasmosis en el donante o receptor y ante la imposibilidad de iniciar el uso profiláctico de trimetoprima-sulfametoxazol a causa de la condición hematológica. Dos pacientes presentaron signos de enfermedad por T. gondii con resultado de PCR positivo y recibieron tratamiento con pirimetamina-clindamicina. En otros dos, la toxoplasmosis fue causa de muerte y hallazgo de autopsia, con resultado de PCR negativo. Cuatro pacientes recibieron tratamiento contra toxoplasmosis por la detección de una PCR positiva, sin manifestaciones clínicas. En los cuatro pacientes restantes no se detectaron signos de enfermedad por toxoplasmosis, con resultados de PCR negativos durante el seguimiento. La técnica de PCR cualitativa demostró ser útil para detectar la reactivación de la toxoplasmosis en receptores de TCPH, pero tiene limitaciones para el seguimiento y la toma de decisiones clínicas en pacientes con PCR positiva que persiste en el tiempo y manifestaciones de toxicidad por el tratamiento.
Toxoplasmosis is an opportunistic infection caused by the parasite Toxoplasma gondii. The infection is severe and difficult to diagnose in patients receiving allogeneic hematopoietic stem cell transplantation (HSCT). Twelve patients receiving HSCT were monitored post-transplant, by qualitative PCR at the Children's Hospital S.A.M.I.C. “Prof. Dr. Juan P. Garrahan”. The monitoring of these patients was defined by a history of positive serology for toxoplasmosis in the donor or recipient and because their hematologic condition did not allow the use of trimethoprim-sulfamethoxazole for prophylaxis. During the patients’ monitoring, two of them with positive PCR results showed signs of illness by T. gondii and were treated with pyrimethamine-clindamycin. In two other patients, toxoplasmosis was the cause of death and an autopsy finding, showing negative PCR results. Four patients without clinical manifestations received treatment for toxoplasmosis because of positive PCR detection. In four patients there were no signs of toxoplasmosis disease and negative PCR results during follow-up. The qualitative PCR technique proved useful for the detection of toxoplasmosis reactivation in HSCT recipients, but has limitations in monitoring and making clinical decisions due to the persistence of positive PCR over time and manifestations of toxicity caused by the treatment.
Toxoplasma gondii es un parásito protozoario intracelular obligado que infecta una amplia variedad de aves y mamíferos, incluyendo seres humanos. La transmisión al huésped humano puede ocurrir por vía transplacentaria, por la ingestión de carne cruda o poco cocida, que contenga quistes tisulares, o por la exposición a los ooquistes en los suelos contaminados con heces de gato, el cual es huésped definitivo del parásito6.
La infección adquirida rara vez es sintomática en individuos sanos y su detección generalmente se realiza mediante técnicas serológicas. La probabilidad de haber sido infectado aumenta con la edad y varía entre las zonas geográficas, desde un 5 % hasta el 90 % de los adultos sanos2.
La infección clínicamente sintomática puede presentarse de diferentes maneras. La más común es la forma linfática leve, semejante a la mononucleosis infecciosa. También puede presentarse como toxoplasmosis crónica, en forma de coriorretinitis; como una infección diseminada, que puede ser fulminante; o bien como una reactivación localizada que ocurre frecuentemente en cerebro y causa encefalitis. Las dos últimas formas por lo general se observan en los individuos altamente inmunocomprometidos, en los que la mayoría de estas infecciones suele ser el resultado de la reactivación de parásitos tisulares latentes en individuos seropositivos13.
Toxoplasma se ha descrito como un importante patógeno infeccioso oportunista que afecta a los receptores de trasplante de órganos sólidos, trasplante alogénico de células madre hematopoyéticas y a pacientes infectados con el virus de la inmunodeficiencia humana (HIV)1,5.
En el trasplante alogénico de células madre hematopoyéticas (HSCT), la toxoplasmosis sigue siendo una causa de infección grave que se asocia con una alta tasa de mortalidad13. Diversos estudios han estimado el riesgo de toxoplasmosis en valores de 0,3 % a 5,0 % después de HSCT alogénicos, en función de la prevalencia de T. gondii en la población7,12,17. Estudios multicéntricos retrospectivos recientes y de un solo centro12 han sugerido que la enfermedad invasiva puede ser más común de lo que se conocía anteriormente, con una incidencia entre receptores de trasplante alogénico T. gondii seropositivos de hasta un 4 %, y una tasa de mortalidad estimada de 60–90 %7,12.
Las presentaciones clínicas son inespecíficas y las manifestaciones pleomórficas de la toxoplasmosis hacen dificultoso obtener un diagnóstico definido antes de la muerte9. Los diferentes trabajos reflejan la necesidad de contar con pruebas diagnósticas rápidas, más sensibles y eficaces, para mejorar los resultados obtenidos en las infecciones oportunistas17.
La asociación de trimetoprima-sulfametoxazol (TMS), utilizada habitualmente en el HSCT para la prevención de la infección por Pneumocystis jirovecii, previene también parcialmente la reactivación de T. gondii y es mejor tolerada que drogas más eficaces, pero con mayor mielotoxicidad4,15. Sin embargo, es frecuente que en algunos pacientes, por intolerancia o mielotoxicidad, el TMS sea reemplazado por la pentamidina, droga que carece de efecto sobre T. gondii. Por este motivo, actualmente se recomienda que aquellos pacientes seropositivos que no reciben profilaxis con TMS o que tienen alto riesgo de reactivación de T. gondii, que son receptores de sangre de cordón umbilical (SCU) o que se encuentran en tratamiento de enfermedad de injerto contra huésped (EICH), realicen en forma periódica pruebas de PCR cuantitativa para T. gondii en sangre, de forma de poder detectar precozmente la reactivación del parásito e iniciar una terapia temprana que evite la progresión de la enfermedad8. Al no contar en nuestro medio con una técnica cuantitativa para este fin, se decidió utilizar como alternativa una técnica de amplificación génica (PCR) cualitativa. Esta técnica se utilizó también para otras muestras biológicas en los casos de sospecha de enfermedad. El objetivo del estudio fue describir las ventajas y limitaciones de la técnica de PCR.
Materiales y métodosPoblación en estudioEn el Hospital de Pediatría S.A.M.I.C. “Profesor Dr. Juan P. Garrahan” se realizan un promedio anual de 40 TCPH, en niños y adolescentes provenientes de distintos lugares de Argentina. De ellos, entre un 20 y 25 % tienen resultados de serología positivos para toxoplasmosis antes del trasplante. Entre junio de 2011 y mayo de 2013 se remitieron al Departamento de Parasitología del Instituto Nacional de Enfermedades Infecciosas “Dr. Carlos G. Malbrán” muestras de 12 pacientes seropositivos, los que se consideraron en situación de alto riesgo a causa de alguna de las siguientes condiciones: probabilidad de reactivación de T gondii (por intensificación del tratamiento inmunosupresor para tratamiento de EICH); por presentar manifestaciones clínicas sospechosas de toxoplasmosis; por imposibilidad de recibir profilaxis con TMS.
Todos los pacientes evaluados recibieron antes del trasplante regímenes de acondicionamiento mieloablativos. Las profilaxis antimicrobianas incluyeron aciclovir los primeros 30 días postrasplante, ciprofloxacina y fluconazol hasta la recuperación de la neutropenia, y TMS antes del trasplante y desde el día 21 hasta los 6 meses posteriores. En caso de intolerancia a la TMS o mielotoxicidad, esta fue reemplazada por pentamidina inhalatoria. Los pacientes afectados por EICH crónica recibieron amoxicilina profiláctica y TMS o pentamidina hasta 6 meses después de suspendida la inmunosupresión.
Dentro del período de 100 días postrasplante se recibieron muestras biológicas de cada paciente, que fueron codifi cadas para preservar la identidad de los pacientes y garantizar su trazabilidad en todo momento desde su ingreso hasta su procesamiento.
Las muestras de sangre se enviaron semanalmente durante el tiempo en que se consideró al paciente en riesgo de reactivación de toxoplasmosis (por ejemplo, mientras su situación hematológica contraindicaba la administración de TMS). La mediana del número de muestras enviadas por paciente fue 12 (rango: 3–39). Se enviaron también muestras de lavado broncoalveolar (BAL) de 3 pacientes, a los que se les efectuó una endoscopía respiratoria por presentar enfermedad pulmonar.
Técnica serológicaLas muestras de suero del receptor y del donante fueron procesadas en el Hospital de Pediatría S.A.M.I.C. “Profesor Dr. Juan P. Garrahan” mediante la técnica de MEIA (Abbott) y ELFA (bioMèrieux), según las recomendaciones de los fabricantes (datos no publicados). Estos son sistemas automatizados para la realización de inmunoensayos en el laboratorio, que permiten la cuantificación de las IgG anti-Toxoplasma en suero o plasma humano. La técnica de ELFA asocia el método inmumoenzimático sándwich en dos etapas a una detección final por fluorescencia. La técnica de MEIA se basa en el enzimoinmunoanálisis de micropartículas.
Purificación de taquizoítosLos taquizoítos fueron recolectados del exudado peritoneal de ratones de la cepa CF1, previamente infectados con T. gondii cepa RH, para su posterior purificación. Los taquizoítos fueron contados directamente en una cámara de Neubauer. El cálculo se realizó de la siguiente manera:
De los taquizoítos se extrajo ADN genómico para poder contar con controles positivos para las PCR cualitativas.
Extracción de ADN de T. gondii y de muestras de sangreEl ADN de las muestras de sangre entera fue obtenido utilizando el kit FlexiGene DNA (Qiagen). Para las muestras de BAL y para contar con el ADN de los taquizoítos totales se utilizó el kit DNeasy Blood & Tissue (Qiagen).
Técnica de PCR cualitativaLa detección de ADN de T. gondii en las muestras biológicas se basó en la amplificación del gen B1, que está repetido 35 veces en el genoma del parásito, lo cual confiere mayor sensibilidad a la técnica. Las secuencias de los oligonucleótidos fueron B1 N1: 5’ GGA ACT GCA TCC GTT CAT GAG 3’; B1 C1: 5’ TCT TTA AAG CGT TCG TGG TC 3’, en una concentración final de 1μmol/50 Ul. La mezcla de reacción se realizó en un volumen final de 50μl con 2,5 U de Taq ADN polimerasa (Invitrogen), con 1X del buffer, 2mM de MgCl2, 0,1mM de cada dNTP y 0,1μl de cada oligonucleotido. Las muestras fueron amplificadas por 40 ciclos de 60 s a 94°C; 45 s a 56°C y 45 s a 72°C, con un paso inicial de 4min a 94°C y un paso final de 10min a 72°C.
Los productos de amplificación fueron visualizados en un gel de agarosa al 2 % con bromuro de etidio. El tamaño del fragmento amplificado para el gen B1 fue de 190 pb.
Ensayo de inhibiciónSe amplificó el gen de la β-actina en todas las muestras de ADN de sangre y BAL con el fin de validar la precisión del test, lo que permitiría distinguir resultados negativos verdaderos de falsos resultados negativos causados por un mal funcionamiento de la PCR debido a inhibidores o deterioro de los reactivos. La secuencia de los oligonucleótidos utilizados fueron β-actina F: 5’ CGG AAC CGC TCA TTG CC 3’; β-actina R: 5’ ACC CAC ACT GTG CCC ATC 3’, en una concentración final de 1μmol en un volumen final de 50μl, con 2,5 U de Taq ADN polimerasa (Invitrogen) 1X del buffer; 2,5mM de MgCl2; 0,1mM de cada dNTP y 0,1μl de cada oligonucleotido. Las muestras fueron amplificadas por 35 ciclos de 60 s a 94°C; 45 s a 54°C y 90 s a 72°C, con un paso inicial de 4min a 94°C y uno final de 10min a 72°C.
Los productos de amplificación fueron visualizados en un gel de agarosa al 2 % con bromuro de etidio. El tamaño del fragmento amplificado para el gen de la β-actina fue de 289 pb.
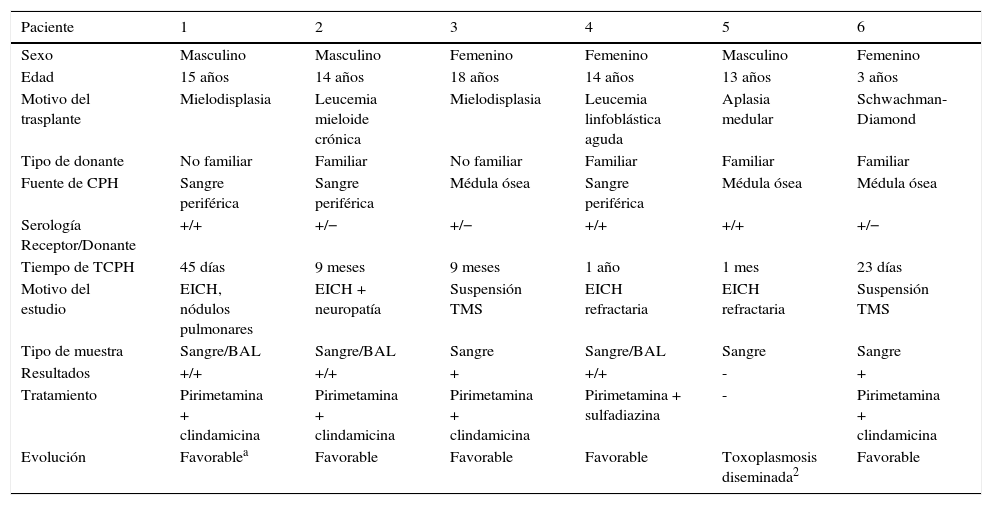
ResultadosEn la tabla 1 se resumen las características y evolución de los pacientes evaluados. Los pacientes 1, 2, 5 y 8 presentaron enfermedad por T. gondii, y en los dos últimos fue causa de muerte y hallazgo de autopsia. En el caso del paciente n.° 5, se trataba de un adolescente que recibió un segundo trasplante luego de sufrir la pérdida del injerto del primer TCPH. Tuvo estudios de PCR en sangre negativos hasta 15 días antes de su muerte, la que se produjo en terapia intensiva, en donde ingresó por EICH aguda refractaria a corticoides y neumonía por Cytomegalovirus (CMV). Se produce el deceso de este paciente por falla hemodinámica refractaria a inotrópicos, y su autopsia mostró toxoplasmosis diseminada con un severo compromiso miocárdico. El paciente n.° 8 presentó una insuficiencia multiorgánica asociada a un cuadro séptico, sin documentación de germen en el contexto de una EICH aguda refractaria. Cinco días antes de su muerte se realizó el último estudio de PCR en sangre, cuyo resultado fue negativo. El estudio de la misma muestra por una técnica cuantitativa aún en fase de desarrollo mostró la presencia de 4 taquizoítos (datos no mostrados).
Características y evolución de los pacientes estudiados (1 al 6).
| Paciente | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Sexo | Masculino | Masculino | Femenino | Femenino | Masculino | Femenino |
| Edad | 15 años | 14 años | 18 años | 14 años | 13 años | 3 años |
| Motivo del trasplante | Mielodisplasia | Leucemia mieloide crónica | Mielodisplasia | Leucemia linfoblástica aguda | Aplasia medular | Schwachman-Diamond |
| Tipo de donante | No familiar | Familiar | No familiar | Familiar | Familiar | Familiar |
| Fuente de CPH | Sangre periférica | Sangre periférica | Médula ósea | Sangre periférica | Médula ósea | Médula ósea |
| Serología Receptor/Donante | +/+ | +/− | +/− | +/+ | +/+ | +/− |
| Tiempo de TCPH | 45 días | 9 meses | 9 meses | 1 año | 1 mes | 23 días |
| Motivo del estudio | EICH, nódulos pulmonares | EICH + neuropatía | Suspensión TMS | EICH refractaria | EICH refractaria | Suspensión TMS |
| Tipo de muestra | Sangre/BAL | Sangre/BAL | Sangre | Sangre/BAL | Sangre | Sangre |
| Resultados | +/+ | +/+ | + | +/+ | - | + |
| Tratamiento | Pirimetamina + clindamicina | Pirimetamina + clindamicina | Pirimetamina + clindamicina | Pirimetamina + sulfadiazina | - | Pirimetamina + clindamicina |
| Evolución | Favorablea | Favorable | Favorable | Favorable | Toxoplasmosis diseminada2 | Favorable |
| Características y evolución de los pacientes estudiados (7 al 12) | ||||||
|---|---|---|---|---|---|---|
| Paciente | 7 | 8 | 9 | 10 | 11 | 12 |
| Sexo | Femenino | Femenino | Masculino | Masculino | Masculino | Femenino |
| Edad | 4 años | 13 años | 12 años | 10 años | 3 años | s10 años |
| Motivo del trasplante | Eritroblastopenia | Mielodisplasia | Adrenoleucodist rofi a | Mielodisplasia | LMMJ | Leucemia linfoblástica |
| Tipo de donante | Familiar | Familiar | No familiar | No familiar | Familiar | Familiar |
| Fuente de CPH | Médula ósea | Médula ósea | Médula ósea | Sangre periférica | Médula ósea | Sangre periférica |
| Serología Receptor/Donante | +/− | +/− | +/− | +/− | −/+ | |
| Tiempo de TCPH | 7–100 días | 13 mes | 2 meses | 3 meses | 4 meses | s3 meses |
| Motivo del estudio | IgM y PCR + pretrasplante (sangre) | EICH refractaria | EICH | Suspensión TMS | Suspensión TMS | Suspensión TMS |
| Tipo de muestra | Sangre | Sangre | Sangre | Sangre | Sangre | Sangre |
| Resultados | - | - | - | + | - | - |
| Tratamiento | - | - | - | Pirimetamina + clindamicina | - | - |
| Evolución | Favorable | Toxoplasmosis diseminadab | Fallecidoc | Favorable | Favorable | Favorable |
LMMJ: leucemia mielomonocítica juvenil.
Los pacientes 1 y 2 presentaron enfermedad respiratoria aguda, con resultados positivos para T. gondii en los estudios de PCR en sangre y BAL. Estos pacientes mejoraron luego de recibir tratamiento con pirimetamina-clindamicina. En el primer caso se aisló también Fusarium en los hemocultivos, lo que también pudo haber sido causa de las imágenes nodulares observadas. Estos dos pacientes presentaron luego, mientras continuaban con el tratamiento inmunosupresor de su EICH, resultados positivos de PCR en sangre, por lo cual repitieron nuevos ciclos de tratamientos de cuatro semanas con pirimetamina-clindamicina o pirimetamina-sulfadiazina. En algunos episodios la PCR persistió positiva, a pesar de lo cual se suspendió el tratamiento por mielotoxicidad sin observarse manifestaciones de enfermedad.
En los pacientes 3, 4, 6 y 10 se detectó durante su seguimiento PCR positiva en sangre, y esta resultó negativa luego de haber recibido tratamiento, mientras que en los pacientes número 7, 9, 11 y 12 los estudios de PCR realizados fueron siempre negativos.
DiscusiónLa serie de pacientes estudiada reafirma la importancia de T. gondii como causa de enfermedad severa en los receptores de TCPH seropositivos. La inclusión de algunos pacientes con características especiales, como el haber recibido un segundo TCPH, o presentar EICH refractaria o coinfecciones severas, sumado a la falta de profilaxis con TMS, pudo haber incidido en la frecuencia de 33 % de enfermedad, registrada en el grupo estudiado. Otro aspecto que cabe destacar es la importancia de realizar autopsia en los pacientes fallecidos luego de un TCPH, a fin de conocer la prevalencia real de una enfermedad cuyo diagnóstico premortem es difícil.
Debido a la dificultad de detectar la sensibilidad diagnóstica de la técnica dado que un resultado negativo no descarta la presencia de T. gondii, la variabilidad de la prevalencia de toxoplasmosis en las distintas regiones y la falta de drogas que combinen eficacia y seguridad, hacen que no haya en cuanto a su manejo un consenso similar al de la prevención de otras infecciones.
Sin embargo, las recomendaciones de expertos coinciden en que los pacientes seropositivos que no reciben TMS y aquellos con mayor riesgo, como quienes reciben sangre de cordón umbilical como fuente de su TCPH, al igual que los pacientes en los que se intensifica el tratamiento inmunosupresor, deberían ser seguidos con estudios de biología molecular, a fin de permitir un diagnóstico temprano de la reactivación de la infección.
La amplificación de ácidos nucleicos de T. gondii se ha convertido en una herramienta fundamental para el diagnóstico de la toxoplasmosis. El ensayo de PCR es una técnica molecular que se ha utilizado en diferentes tipos de muestras biológicas, como líquido amniótico, humor acuoso, medula ósea, líquido cefalorraquídeo, lavado broncoalveolar, biopsia y sangre1,3,5,10,12,14,16,19. Diferentes laboratorios utilizan la técnica de PCR in house debido a la falta de kits comerciales disponibles que detecten ácidos nucleicos de T. gondii mediante la técnica PCR11.
La técnica cualitativa utilizada en este trabajo facilitó el diagnóstico de toxoplasmosis en algunos de los pacientes en estudio y la terapia temprana de otros enfermos con reactivación, pero sin signos de enfermedad. Sin embargo, tanto los resultados negativos obtenidos en otros casos en individuos con enfermedad, así como la persistencia de resultados positivos en pacientes con tratamiento prolongado, señalan sus limitaciones y la necesidad de contar con métodos de biología molecular cuantitativos para una mejor atención de los receptores de TCPH seropositivos.
En consecuencia, varios centros que realizan HSCT vigilan rigurosamente a los pacientes durante varios meses usando la técnica de PCR cuantitativa para la detección de ADN de T. gondii en muestras de sangre, ya que es crucial la pronta iniciación de la terapia para pacientes con inmunodefi ciencia profunda18. Debido a esta necesidad, el laboratorio de toxoplasmosis del Instituto Malbrán ha desarrollado una técnica de PCR en tiempo real in house, que se encuentra en proceso de validación.
NotaEste trabajo ha sido realizado bajo las condiciones académicas y éticas determinadas en el marco regulatorio (resolución CA 630/07) para el desarrollo de investigaciones clínicas del Hospital Garrahan.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Tec. Jorge Barreiro, por proveer el antígeno de Toxoplasma gondii.
Lic. Nadia Bueno, por su colaboración en la redacción del Abstract.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.