La presencia de bacterias patógenas, como Escherichia coli, afecta la calidad e inocuidad de las hortalizas que se consumen en fresco y se relaciona con graves problemas de salud. El objetivo de este trabajo fue determinar si 3 cepas diferentes de E. coli tienen la capacidad de penetrar y permanecer en plantas y frutos de tomate. Se siguió un diseño experimental completamente al azar, para lo cual se estableció un cultivo de tomate (variedad «Cid») en condiciones de invernadero y se evaluaron 3 tratamientos, T1 (E. coli O157:H7), T2 (E. coli de cultivo de tomate [EcT] O157:H16), T3 (E. coli de cultivo de espinaca [EcH] EcH O105ab) y un testigo T4, con 100 plantas cada uno y 4 formas de inoculación: en el sustrato, en el tallo, en el pecíolo y en el pedúnculo. Se realizaron muestreos en etapa vegetativa, floración, fructificación y madurez fisiológica para cuantificar en placa las UFC/g y saber si las bacterias lograban moverse y recuperarse en la raíz, el tallo, la flor y el fruto. Los grupos filogenéticos a los que correspondieron las bacterias recuperadas fueron confirmados mediante pruebas bioquímicas, serotipificación y PCR. A los 120 días la recuperación de bacterias en la planta fue del 23% (E. coli O157:H7), 28% (EcT O157:H16) y 55% (EcH O105ab) con la inoculación al sustrato, mientras que con la inoculación por punción la recuperación fue (en igual orden) del 5%, 3% y 4% a los 30 días; del 37%, 35% y 30% a los 90 días; y del 42%, 39% y 13% a los 65 días. Las cepas utilizadas mostraron la capacidad de entrar en la planta de tomate y de permanecer en ella y transportarse hasta llegar al fruto, sin producir síntomas que indiquen su presencia.
The presence of pathogenic bacteria, such as Escherichia coli affects the quality and safety of vegetables that are consumed fresh and is associated with serious health problems. The objective of this study was to determine if three different strains of E. coli can penetrate and remain in plants and tomato fruits. A completely randomized experimental design was followed for which a tomato crop (“Cid” variety) was established under greenhouse conditions and three treatments were evaluated, T1 (E. coli O157:H7), T2 (E. coli from tomato cultivation [EcT] O157:H16), T3 (E. coli from spinach cultivation [EcH] O105ab) and a T4 control, with 100 plants each and four forms of inoculation: in the substrate, steam, petiole and the peduncle. Samples were carried out in vegetative stage, flowering, fruiting and physiological maturity to quantify in petri dish CFU/g and know if the bacteria managed to move around and recover in root, stem, flower and fruit. The phylogenetic groups that corresponded to the bacteria recovered were confirmed by biochemical tests, serotyping and PCR. At 120 days the recovery of bacteria in the plant was 23% (E. coli O157:H7), 28% (EcT O157:H16) and 55% (EcH O105ab) whit inoculation to the substrate while the inoculation by puncture the recovery was (in the same order) of 5%, 3%, and 4% at 30 days; 37%, 35% and 30% at 90 days; and 42%, 39% and 13% at 65 days. The strains submit the ability to enter the tomato plant and to stay in it and transported to the fruit, without producing that indicate their presence.
El tomate (Solanum lycopersicum L.) es una de las hortalizas de mayor consumo a nivel mundial por su alto aporte nutrimental y versatilidad; es rico en vitaminas A y C y en flavonoides. Son muy reconocidas sus propiedades antioxidantes y contiene licopeno, responsable del color rojo característico del fruto. Algunos de estos compuestos se relacionan con la prevención de enfermedades como el cáncer, la inflamación del colon y el síndrome de degeneración macular, principal causa de ceguera en gente mayor de 65 años23.
Por consumirse en fresco, el tomate ha pasado a ser una fuente importante de enfermedades transmitidas por alimentos (ETA)13. Se han documentado brotes relacionados con el consumo de productos en fresco, como es el caso de la espinaca, la lechuga, el tomate, los germinados y los rábanos, contaminados con E. coli O157:H7, Salmonella Typhimurium y Salmonella Newport17. La contaminación se puede dar a lo largo de la cadena de producción; se reportan como principales fuentes el uso de agua de riego contaminada47, los abonos a base de estiércol no tratado adecuadamente15, el empleo de semillas contaminadas y los diferentes vectores, como animales, insectos y seres humanos34.
Uno de los principales microorganismos reportados causantes de enfermedades transmitidas por alimentos es Escherichia coli14, que forma parte de la microbiota intestinal de seres humanos, animales de sangre caliente y aves. Se distinguen 2 grupos según el tipo de infección que provocan: uno está constituido por cepas responsables de infecciones extraintestinales (tracto urinario, sepsis y meningitis); el segundo grupo está compuesto por cepas patógenas intestinales, responsables de un elevado número de infecciones gastrointestinales. Dichas infecciones pueden manifestarse con distinto nivel de gravedad, desde una diarrea leve hasta una sintomatología similar a la del cólera, que puede desencadenar complicaciones como el síndrome urémico hemolítico12,16. El consumo de tomate, al igual que el de otras hortalizas, ha presentado diferentes alertas por la presencia de E. coli O157:H722. Esa cepa ha mostrado capacidad de mantenerse por tiempo prolongado fuera de su hábitat natural, adaptándose a condiciones adversas. Algunas investigaciones demuestran que estos microorganismos tienen la capacidad de internalizarse en el producto, protegiéndose de los sanitizantes17. Existe un limitado conocimiento sobre el mecanismo por el cual las bacterias patógenas de humanos colonizan y sobreviven en estos productos7. El conocimiento de las vías de contaminación y la asociación entre patógenos transmitidos por alimentos y tejidos vegetales es importante para intervenir y garantizar la seguridad de los productos que se consumen en fresco. El objetivo de la presente investigación fue evaluar la capacidad de 3 cepas diferentes de Escherichia coli para penetrar y permanecer en plantas y frutos de tomate (Solanum lycopersicum L).
Materiales y métodosEl estudio se realizó en el ciclo agrícola de mayo a septiembre de 2015, en condiciones de invernadero, en el municipio de Toluca de Lerdo, cuyas coordenadas geográficas corresponden a 19°17′32″ Norte, 99°39′14″ Oeste, con una altitud entre de 2.600 y 2.625ms.n.m.20,21.
Los análisis fueron procesados en el Laboratorio de Calidad de Productos Agropecuarios perteneciente a la Facultad de Ciencias Agrícolas de la Universidad Autónoma del Estado de México, Laboratorio de Patogenicidad Bacteriana del Hospital Infantil de México Federico Gómez, Universidad Nacional Autónoma de México (UNAM) y Laboratorio de Serotipificación, Unidad de Investigación, Facultad de Medicina (UNAM).
Material vegetal y cepas bacterianasSe utilizaron plántulas variedad «Cid» tomate tipo saladette, que se obtuvieron en bandejas de germinación; estas fueron trasplantadas en macetas de 35×35cm. Para la siembra se utilizó una mezcla de sustrato (40% suelo de campo, 40% lombricomposta y 20% tepojal), esterilizada previamente por medio de un método químico38. El riego se realizó diariamente con agua de pozo. Las plantas se conservaron en condiciones de invernadero durante todo el ciclo de producción. Antes de comenzar los ensayos se realizaron análisis microbiológicos de las plántulas, la mezcla de sustrato y el agua de riego (con evaluación periódica durante el desarrollo del cultivo) para descartar la presencia de organismos coliformes termotolerantes y de E. coli.
De las 3 cepas utilizadas 2 de ellas fueron de serogrupos desconocidos y se obtuvieron de cultivos de tomate de la región de Texcaltitlán33 y de espinaca de la zona de Calimaya (EcH); la tercera fue una cepa del serogrupo O157:H7 (STEC) donada por el Laboratorio de Patogenicidad Bacteriana del Hospital Infantil de México Federico Gómez. Las cepas fueron almacenadas en una solución agua-glicerol (50:50) a –20°C. La elección de la cepa del serotipo O157:H7 obedeció a que dicha cepa estuvo relacionada con diferentes brotes de enfermedades transmitidas por alimentos mínimamente procesados y logra crecer en ambientes no propicios. Las otras 2 cepas se eligieron por haberse recuperado con anterioridad de cultivo de tomate y hortalizas, dando así continuidad a un trabajo previo33.
Caracterización fenogenotípicaAntes del establecimiento del experimento en invernadero las bacterias se reactivaron en caldo soya tripticaseína, se hicieron crecer en medios selectivos agar MacConkey (DIBICO), eosina azul de metileno (DIBICO) y agar cromogénico E. coli O157:H7 (DIBICO).
Para la confirmación de la identidad de las cepas bacterianas se realizó una serotipificación y reacción en cadena de la polimerasa (PCR). Para la serotipificación se siguió el método propuesto por Orskov et al.36 y recientemente actualizado por Scheutz et al.41. Se usaron 181 antisueros somáticos y 56 antiflagelares, que corresponden al esquema antigénico de E. coli24,46. Para la determinación del grupo filogenético se realizó la PCR descrita por Clermont et al.11, en función de la combinación de 3 marcadores de ADN (chuA, yjaA y el fragmento de ADN TspE.4C2), que clasifica a los aislados de E. coli dentro de uno de los 4 grupos filogenéticos establecidos: A, B1, B2 y D.
Para determinar la presencia de genes relacionados con cepas diarreogénicas (E. coli enterotoxigénica: lt y st; E. coli enterohemorrágica: stx1 y stx2; E. coli enteropatogénica: bfpA y eaeA) se realizó la PCR múltiplex descrita por López et al.25.
InoculaciónPara la inoculación en el sustrato se emplearon 100 macetas por tratamiento con un volumen de 300ml de suspensión bacteriana para cada cepa, con un promedio de 2,5×103UFC/ml en agua peptonada bufferada (BPA) 0,1%. La solución se infiltró en el sustrato sin salpicar la planta. Este tratamiento (INC1) se realizó a los 7 días después del trasplante, con el objetivo de observar si las 3 cepas podían entrar y transportarse a las diferentes partes de la planta. A partir de esta inoculación se monitorizó durante los 120 días que duró el cultivo, incluyendo la etapa vegetativa, la floración, la fructificación y la madurez fisiológica.
En otros grupos de plantas se realizó la inoculación por medio de una punción en la etapa vegetativa en el tallo (INC2) o en la floración, en el pecíolo (INC3) o en la fructificación en el pedúnculo (INC4). Eso se hizo con la finalidad de determinar la capacidad de las 3 cepas de E. coli de perdurar en los tejidos internos del tomate, tras su ingreso a través de algún tipo de herida. Para realizar las punciones los cultivos se hicieron crecer en agar MacConkey (DIBICO), y con palillos previamente esterilizados se tomó aproximadamente 1,8×103 UFC de masa bacteriana (dicho valor se obtuvo mediante recuento en placa).
Toma de muestraSe colectaron muestras de raíz (R), tallo (T) flor (Fl) y fruto (Fr) a los 30, 55, 90 y 120 días después del trasplante (ddt). Todo el material fue colectado y transportado de acuerdo con lo indicado por la Norma Oficial Mexicana NOM-109-SSA1-199431.
Para la preparación de las muestras se utilizó el método microbiológico indicado por la Norma Oficial Mexicana NOM-110-SSA1-199432. A 10g de tejido se le adicionaron 90ml de BPA 0,1% y se homogeneizó en una licuadora marca Osterizer. De la suspensión obtenida se tomó 1ml para hacer siembra directa por duplicado en placas con agar bilis rojo violeta (BIOXON), las cuales se incubaron a una temperatura de 45±2°C. Después de 24h de incubación se realizó el recuento de colonias lactosa positivas, las cuales se estriaron en agar MacConkey (BIOXON), agar cromogénico O157:H7 (DIBICO) y agar de eosina y azul de metileno (BIOXON). Estas placas se incubaron a 35°C por 24±2h. Para confirmar la presencia de E. coli se tomó como referencia el crecimiento característico para cada medio selectivo y diferencial empleado28,49, así como los resultados de las pruebas IMViC (producción de indol, movilidad, prueba de rojo de metilo, Voges-Proskauer y citrato de Simmons), complementadas con producción de ureasa y de ácido sulfhídrico y con descarboxilación de ornitina48. Dichos análisis se realizaron en las cepas antes de la inoculación y a las colonias recuperadas durante el experimento.
Diseño experimentalSe siguió un diseño experimental completamente al azar, para lo cual se estableció un cultivo de tomate (variedad «Cid») en condiciones de invernadero, en el que se establecieron 3 tratamientos: T1 (E. coli O157:H7), T2 (EcT O157:H16), T3 (EcH O105ab), más el testigo T4, con 100 plantas por tratamiento. Se emplearon 4 diferentes formas de inoculación: al sustrato, al tallo, al pecíolo y al pedúnculo. El muestreo implicó la colecta de 20 plantas en cada etapa fenológica para cuantificar en placa las UFC/g, y así para saber si las bacterias lograban moverse hacia la raíz, el tallo, la flor y el fruto.
Los resultados fueron evaluados por un ANDEVA bifactorial (p<0,05) para recuento en la raíz, el tallo, la flor y el fruto por cepa, forma de inoculación e interacción entre estas variables. Frente al hallazgo de diferencias significativas se aplicó una prueba de Tukey al 5% para identificar la cepa, la vía de inoculación y la interacción que llevaron a los mayores recuentos. Para ello se empleó el programa estadístico SAS (SAS, 2002)39.
ResultadosCaracterización bioquímica, serotipificación y PCRLas pruebas bioquímicas confirmaron la recuperación de las cepas bacterianas inoculadas durante todas las etapas fenológicas (anexo 1 en material suplementario).
La serotipificación agrupó a las cepas bacterianas en O157:H7, O157:H16 (EcT) y O105ab (EcH), todas flagelares.
Las reacciones de PCR para identificar los grupos filogenéticos amplificaron bandas de 279, 211 y 152pb, lo que clasificó a las cepas O157:H7 y EcT (O157:H16) en el grupo filogenético D, perteneciente a las cepas diarreogénicas, mientras que la cepa EcH (O105ab) se ubicó en el grupo A, de las no diarreogénicas. Con la PCR múltiplex se observaron bandas de 150pb (stx1), 255pb (stx2) y 384pb (eaeA), de acuerdo con lo esperado para las cepas O157:H7.
Estos análisis fenogenotípicos tuvieron la finalidad de confirmar que las bacterias recuperadas eran las mismas que las inoculadas.
No se encontraron microorganismos coliformes termotolerantes ni E. coli en las plántulas de tomate ni en el sustrato antes del experimento, tampoco en el agua de riego durante todo el desarrollo del cultivo.
Se encontraron diferencias significativas (p<0,05) para todas las variables analizadas: cepa, método de inoculación e interacción. Por eso se aplicó la prueba de comparación múltiple de medias, de acuerdo con el criterio de Tukey.
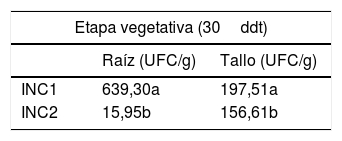
De las 4 formas de inoculación evaluadas la que llevó a la mayor tasa de recuperación fue la realizada en el sustrato, donde los valores más elevados se registraron en R y T. Para las punciones, en cambio, las tasas de recuperación más altas se observaron cuando el inóculo se aplicó en el pecíolo y en el pedúnculo (tabla 1).
Recuento de Escherichia coli en distintas etapas del cultivo de tomate
| Etapa vegetativa (30ddt) | ||
|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | |
| INC1 | 639,30a | 197,51a |
| INC2 | 15,95b | 156,61b |
| Etapa floración (55ddt) | |||
|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | |
| INC1 | 1183,48a | 483,86a | 49,90b |
| INC2 | 41,66b | 56,13c | 29,63c |
| INC3 | 12,06c | 81,01b | 123,40a |
| Etapa fructificación (90ddt) | ||||
|---|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | Fruto (UFC/g) | |
| INC1 | 888,51a | 184,13a | 42,91b | 14,53b |
| INC2 | 30,31b | 56,61b | 22,58c | 18,31a |
| INC3 | 24,31c | 52,23c | 87,35a | 11,90c |
| INC4 | 13,36d | 23,16d | 3,55d | 6,65d |
| Etapa madurez fisiológica (120ddt) | ||||
|---|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | Fruto (UFC/g) | |
| INC1 | 700,01a | 146,83a | 35,66b | 10,60b |
| INC2 | 31,63b | 43,95c | 18,416c | 10,166b |
| INC3 | 9,567c | 105,25b | 60,15a | 20,90a |
| INC4 | 9,28c | 15,31d | 4,81d | 2,01c |
Medias seguidas de las mismas letras señalan ausencia de diferencias significativas por test de Tukey (p<0,05).
INC1: inoculación al sustrato; INC2: inoculación por punción al tallo; INC3: inoculación por punción al pecíolo; INC4: inoculación por punción al pedúnculo; ddt: días después del trasplante.
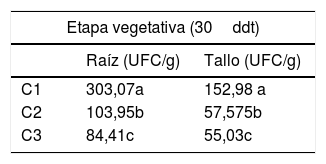
Las 3 cepas de E. coli inoculadas se recuperaron durante todo el ciclo, con diferencias según el órgano de la planta inoculado (tabla 2). Para el grupo testigo en todos los casos no existió presencia de bacterias.
Recuento de 3 cepas de Escherichia coli en distintas etapas del cultivo de tomate. Datos por cepa
| Etapa vegetativa (30ddt) | ||
|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | |
| C1 | 303,07a | 152,98 a |
| C2 | 103,95b | 57,575b |
| C3 | 84,41c | 55,03c |
| Etapa floración (55ddt) | |||
|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | |
| C1 | 270,35b | 149,11b | 32,06b |
| C2 | 257,56c | 197,37a | 95,17a |
| C3 | 400,00a | 119,27c | 24,96c |
| Etapa fructificación (90ddt) | ||||
|---|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | Fruto (UFC/g) | |
| C1 | 213,85b | 62,28c | 38,60b | 17,35a |
| C2 | 187,85c | 75,01b | 63,11a | 15,12b |
| C3 | 315,68a | 99,81a | 15,58c | 6,07c |
| Etapa madurez fisiológica (120ddt) | ||||
|---|---|---|---|---|
| Raíz (UFC/g) | Tallo (UFC/g) | Flor (UFC/g) | Fruto (UFC/g) | |
| C1 | 136,225b | 61,6750c | 40,3625a | 19,7750a |
| C2 | 136,963b | 84,6375b | 39,3625a | 8,5250b |
| C3 | 289,688a | 87,20a | 9,5625b | 4,4625c |
Medias seguidas de las mismas letras señalan ausencia de diferencias significativas por test de Tukey (p<0,05).
C1: E. coli O157:H7; C2: E. coli O157:H16; C3: E. coli O105ab; ddt: días después del trasplante.
La inoculación de E. coli O157:H7 en el sustrato permitió la recuperación de dicha cepa de R, T, Fl y Fr y la respuesta fue similar en cada etapa fenológica (vegetativa, floración, fructificación y madurez fisiológica). Se observó una disminución de las UFC recuperadas con respecto a la cantidad inoculada en el sustrato. Las bacterias permanecieron detectables y cultivables sin necesitar enriquecimiento hasta el último muestreo. E. coli O157:H7 logró permanecer en los diferentes tejidos de la planta hasta 120 días, con una disminución de la densidad a lo largo del ciclo.
La cepa EcT (E. coli de cultivo de tomate) se recuperó de R y T a los 30ddt; sin embargo, a los 55ddt se observó un notorio incremento y se recuperó de R, T y Fl, a ello siguió un decremento hacia los 90ddt. En las determinaciones subsiguientes se recuperaron de Fl y Fr; a los 120ddt existió recuperación de Fr, lo que demuestra que la bacteria inoculada al sustrato logró internalizar y permanecer en la planta y en el fruto.
La cepa EcH (E. coli de cultivo de espinaca), aparentemente, se movilizó y mostró un incremento a los 55ddt. Por otro lado, a los 90ddt se registró un decremento de la población bacteriana.
Persistencia y recuento de E. coli a partir de la inoculación por punción en el talloCon las 3 cepas de E. coli inoculadas al tallo se observó en la parte aérea de la planta mayor población en la etapa vegetativa y menor en cosecha. De forma contraria, en la R hubo mayor carga bacteriana en cosecha. Cuando las cepas fueron inoculadas durante la etapa vegetativa permanecieron en mayor cantidad en el tejido inoculado, y por las UFC recuperadas se puede observar que el movimiento fue basípeto y acrópeto, con una sobrevivencia de 90 días.
Persistencia y recuento de E. coli a partir de la inoculación por punción en el pecíoloSe detectó incremento en el número de E. coli O157:H7 en Fl y Fr, no así en T y R. Asimismo, existió mayor recuperación de EcT en las flores. La población bacteriana se redujo en Fr y T, mientras que en R y Fl los valores fueron diversos.
Se notó una menor recuperación de EcH (E. O105ab) en Fl, R y T. De las 3 cepas existió mayor recuperación de colonias en Fl, mientras que para Fr los valores fueron similares entre etapas fenológicas.
Persistencia y recuento de E. coli a partir de inoculación por punción en el pedúnculoDe la etapa de fructificación a la cosecha los recuentos de E. coli O157:H7 se incrementaron en Fl y Fr, mientras que en R y T disminuyeron. La mayor recuperación de UFC se obtuvo del T. La recuperación de EcT de una etapa a otra disminuyó en R, T y Fr. Únicamente en la Fl existió poco incremento, mientras que la mayor recuperación se obtuvo del T. En relación con las plantas inoculadas con EcH se notó una disminución en la recuperación de la bacteria en R, T y Fr; solo en la Fl se mantuvo la cantidad de UFC recuperadas.
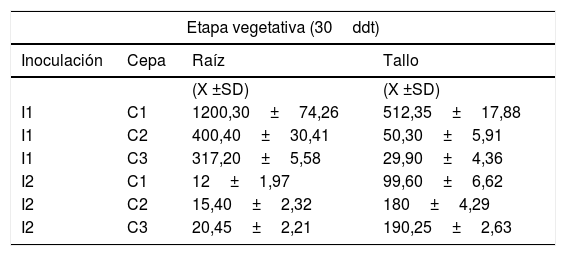
Respuesta de cepas por método de inoculaciónEn la etapa vegetativa del tomate fue la inoculación al sustrato con la cepa O157:H7 la que llevó a la mayor recuperación de UFC, mientras que fue la inoculación por medio de punción en el tallo con las cepas de los serotipos O105ab y O157:H7 las que llevaron a los recuentos más altos en R y T, respectivamente (tabla 3).
ANDEVA multifactorial (X ±SD) de los recuentos de Escherichia coli en diferentes estados fenológicos y distintas partes de la planta (cepa×método de inoculación)
| Etapa vegetativa (30ddt) | |||
|---|---|---|---|
| Inoculación | Cepa | Raíz | Tallo |
| (X ±SD) | (X ±SD) | ||
| I1 | C1 | 1200,30±74,26 | 512,35±17,88 |
| I1 | C2 | 400,40±30,41 | 50,30±5,91 |
| I1 | C3 | 317,20±5,58 | 29,90±4,36 |
| I2 | C1 | 12±1,97 | 99,60±6,62 |
| I2 | C2 | 15,40±2,32 | 180±4,29 |
| I2 | C3 | 20,45±2,21 | 190,25±2,63 |
| Etapa floración (55ddt) | ||||
|---|---|---|---|---|
| Inoculación | Cepa | Raíz (UFC) | Tallo | Flor |
| (X ±SD) | (X ±SD) | (X ±SD) | ||
| I1 | C1 | 1050,35±34,66 | 450,45±24,09 | 30,40±5,11 |
| I1 | C2 | 1000,2±12,28 | 600,25±14,28 | 100,45±6,77 |
| I1 | C3 | 1499,90±21,49 | 400,9±6,80 | 18,85±1,98 |
| I2 | C1 | 15,00±2,63 | 48±4,11 | 19,95±2,16 |
| I2 | C2 | 19,9±5,05 | 90,25±3,89 | 49,95±2,99 |
| I2 | C3 | 90,10±3,80 | 30,15±3,13 | 19±1,89 |
| I3 | C1 | 16,05±2,28 | 98±4,38 | 77,90±3,58 |
| I3 | C2 | 10,15±1,95 | 99±4,06 | 230,30±3,70 |
| I3 | C3 | 10±2,51 | 46,05±2,66 | 62±2,97 |
| Madurez fisiológica (120 ddt) | |||||
|---|---|---|---|---|---|
| Inoculación | Cepa | Raíz (UFC) | Tallo | Flor | Fruto |
| (X ±SD) | (X ±SD) | (X ±SD) | (X ±SD) | ||
| I1 | C1 | 500,05±56,50 | 50,45±5,37 | 21,95±4,26 | 14,95±2,58 |
| I1 | C2 | 500±43,92 | 120,05±6,93 | 75,05±7,04 | 11,85±2,39 |
| I1 | C3 | 1100±46,83 | 270±13,21 | 10±3,56 | 5,0±1,97 |
| I2 | C1 | 21,8±4,50 | 17,1±2,42 | 7,30±1,30 | 10±2,22 |
| I2 | C2 | 30,05±3,39 | 74,55±3,83 | 34,95±3,39 | 12±2,29 |
| I2 | C3 | 43,05±4,11 | 40,20±4,66 | 13±1,80 | 8,50±2,16 |
| I3 | C1 | 13±3,19 | 167,15±9,68 | 122±3,85 | 50,10±3,91 |
| I3 | C2 | 7,70±1,92 | 129,90±5,56 | 45,15±3,52 | 10,25±2,84 |
| I3 | C3 | 8±1,97 | 18,70±2,57 | 13,30±2,53 | 2,35±2,27 |
| I4 | C1 | 10,05±2,52 | 12±2,73 | 10,20±2,37 | 4,05±2,43 |
| I4 | C2 | 10,10±3,21 | 14,05±3,03 | 2,30±1,38 | 0 |
| I4 | C3 | 7,70±2,81 | 19,90±3,74 | 1,95±1,27 | 2±1,45 |
I1: inoculación al sustrato; I2, I3 e I4: punción al tallo, al pecíolo y al pedúnculo, respectivamente; ddt: días después del trasplante.
Para el muestreo realizado en la etapa de floración la cepa que se recuperó en mayor número con la inoculación al sustrato y por punción en el tallo fue la O105ab y de la R, mientras que del T y la Fl fue la cepa O157:H16. Con la inoculación por punción en el pecíolo el serotipo con mayor recuperación en la R fue el O157:H7, y en el T y la Fl fue el O157:H16 (tabla 3).
Hacia el muestreo realizado a los 90 días, con la inoculación al sustrato la mayor recuperación de UFC a partir de R y T se obtuvo con la cepa O105ab, en Fl con la cepa O157:H16 y en Fr con la cepa O157:H7. Por otra parte, tras la inoculación por punción al tallo la cepa O105ab fue la que se recuperó en mayor número en la R, mientras que la O157:H16 arrojó los recuentos más altos en las demás partes de la planta. La cepa que se asoció con recuentos más altos en R, T y Fr en la inoculación al pecíolo fue la O157:H7, mientras que, en la Fl, el valor más alto fue para la cepa O105ab. Cuando la inoculación se hizo por punción en el pedúnculo la cepa O157:H7 tuvo mayor recuperación en R, Fl y Fr, y en el T tuvo mayor recuperación la O105ab (tabla 3).
Hacia los 120 días los recuentos más altos en R y T correspondieron a la cepa O105ab, mientras que los más altos en Fl y Fr fueron los de la O157:H7. Tras la inoculación al tallo, en R el valor de UFC más marcado lo mostró la cepa O105ab, pero en T, Fl y Fr la O157:H16. Con la inoculación al pecíolo la cepa que arrojó recuentos mayores fue la O157:H7. Con la inoculación al pedúnculo, la cepa hallada en mayor número en R fue la O157:H16, en T fue la O105ab y en Fl y Fr fue la O157:H7 (tabla 3).
DiscusiónLa recuperación de las 3 cepas de E. coli indica la capacidad de estas para ingresar, permanecer y moverse a través de los órganos de la planta y sobrevivir a lo largo de las etapas fenológicas del cultivo. Como factible punto de entrada de esta bacteria en las plantas se identifica a la raíz, que es la principal vía de absorción de alimentos y agua29. Existen reportes que señalan que en las raíces las bacterias enteropatógenas pueden tener mayor acceso a los nutrientes que en otros sitios, puesto que las uniones de la raíz son sitios que liberan exudados y absorben nutrientes, lo que las convierte en puertas de entrada para que las bacterias inicien el proceso de internalización26. Otros trabajos señalan que el ingreso de estas bacterias a la planta puede obedecer a la presencia de heridas18 o a procesos de endobiosis5,10,45.
Los resultados del presente estudio muestran que E. coli logró sobrevivir en el sustrato y entrar a la planta. A través del interior de esta y en las diferentes etapas fenológicas pudo transportarse hasta llegar al fruto. Se ha informado que la transmisión de E. coli O157:H7 puede ocurrir por suelo contaminado con estiércol (fertilizante) y a través del agua de irrigación en plantas de lechuga44. Además, algunos autores resaltan que la carga microbiana presente en un vegetal depende de la probabilidad de que el producto esté en contacto con la fuente de contaminación durante el cultivo: suelo, fertilizantes orgánicos y agua de irrigación3,17.
Uno de los factores que puede afectar la persistencia en el suelo de bacterias enteropatógenas, como es el caso de E. coli O157:H7, es la presencia de carbono, es decir, al existir baja concentración de este y presencia de microbiota natural la bacteria puede presentar alta mortalidad48.
Las bacterias presentaron similar comportamiento al ser inoculadas por punción en el vegetal o agregadas al sustrato: en ambos casos se movieron en el interior de la planta. La cepa de E. coli que se recuperó en más alto número fue la aislada de cultivo de tomate (EcT), que corresponde al serotipo O157:H16. Esto se relaciona con la adaptación al tomate que pudo haber desarrollado con anterioridad, al estar ya presente en este cultivo27,33. Estos resultados muestran que E. coli tiene la capacidad de persistir en el tejido interno de las plantas de tomate, donde la mayor recuperación se obtuvo en la inoculación realizada en la etapa vegetativa y en la floración. Esto nos indica que en las primeras etapas fenológicas del cultivo existe mayor posibilidad de contaminación. Este resultado coincide con lo reportado en hojas de espinaca de 3 semanas, que fueron más susceptibles de ser colonizadas por E. coli O157:H7 en comparación con las hojas de 5 semanas37. En contraste, también se han informado similares tamaños de población de bacterias patógenas en tejido joven de lechuga y en tejidos ya cortados4. Esto resalta que la supervivencia de la bacteria depende de la condición fisiológica en cada etapa fenológica, así como del órgano de la planta donde persiste.
Las 3 cepas inoculadas de diferentes formas presentaron la capacidad de moverse en toda la planta de forma ascendente por el xilema y descendente por el floema, sin mostrar ningún tipo de respuesta o síntoma. Otros autores, sin embargo, demostraron que las enterobacterias pueden activar el sistema inmunitario activando la respuesta en el tejido de plantas de Arabidopsis thaliana, las que presentaron clorosis y marchitez42. Asimismo, algunos estudios señalan que estas bacterias pueden inducir respuesta de defensa de la planta e incluso tienen la capacidad de suprimirla9,19. Por otra parte, en este estudio las plantas de tomate no reconocieron a la bacteria patógena para humanos O157:H7 como peligrosa para ellas y no iniciaron ninguna respuesta de defensa2.
Resultados similares fueron obtenidos en un estudio realizado sobre calidad y seguridad microbiológica de productos consumidos en fresco, donde encontraron que la segregación de enzimas por microorganismos endófitos como pectinasas, celulasas y proteasas favorece la disponibilidad de nutrientes y propicia el desarrollo de poblaciones microbianas40. Esto nos habla de la adaptación al medio que ha desarrollado E. coli por un proceso conocido como quorum sensing, donde la exposición a condiciones de estrés permite a las bacterias sobrevivir bajo estas condiciones, e incluso mejorar su tolerancia6. Este comportamiento es destacado en una investigación en la que se observaron diferencias entre cepas de E. coli recuperadas de diversos cultivos y otras de origen intestinal (de mamíferos): las primeras utilizaron en mayor grado glucosa y azúcares derivados de la planta, por lo que se asume que podrían adaptarse a las condiciones que le pueden brindar los vegetales30. Otros estudios señalan que diferentes especies de enterobacterias pueden encontrar el ambiente adecuado al estar en contacto con el fruto y así poder sobrevivir en este ambiente35,43.
Conocer el comportamiento de E. coli y los procesos involucrados en su internalización y supervivencia en plantas cuyas partes comestibles se consumen en fresco es de gran importancia, ya que los desinfectantes solo previenen la contaminación superficial y no tienen acceso a tejidos internos1,8,44. Esto representa un riesgo latente para el consumidor, si desde etapas tempranas el cultivo se contamina.
A través del presente estudio se aporta información relevante vinculada con la adaptación, la persistencia y la sobrevivencia de un importante patógeno en plantas de tomate, y queda en evidencia lo importante que es prevenir la contaminación de los cultivos por bacterias enteropatógenas.
ConclusionesTres cepas de E. coli (O157:H7, O157:H16 y O105ab) presentaron la capacidad de penetrar en plantas y frutos de tomate y lograron permanecer durante el desarrollo del cultivo hasta 120 días. En todos los casos se pudieron transportar a las diferentes partes de la planta hasta llegar al fruto, sin mostrar ningún síntoma que pudiera advertir de su presencia. La persistencia dependió de la etapa fenológica en que se hizo la inoculación, así como del serotipo al que pertenecían las cepas. E. coli en contacto con plantas de tomate representa un peligro latente, ya que al presentar la capacidad de internalizar y llegar al fruto limita la acción de los métodos de desinfección utilizados normalmente.
FinanciaciónPublicación financiada con recursos PFCE2017.
Conflicto de interesesNo existe conflicto de intereses por parte de los autores.
Los autores agradecen el apoyo recibido al Consejo Nacional de Ciencia y Tecnología por la beca otorgada a la primera autora durante sus estudios de posgrado, al financiamiento del trabajo con clave PROMEP FEO57/12 y al Hospital infantil de México Federico Gómez UNAM por el apoyo para los análisis realizados.