Las amebas de vida libre (AVL) del género Acanthamoeba son protozoos ubicuos y anfizoicos que colonizan hábitats acuáticos y terrestres, pudiendo actuar de reservorio de otros microorganismos. Son econosis que producen patologías graves y poco frecuentes. Dada la escasa información epidemiológica acerca de este protozoo, el objetivo de este estudio fue investigar la presencia de Acanthamoeba spp. en humedales costeros del sudeste bonaerense y su asociación con variables bacteriológicas y ambientales. Desde febrero de 2021 hasta julio de 2022 se recolectaron 22 muestras de agua de mar en diferentes puntos de la costa de Mar del Plata (Buenos Aires, Argentina). Se determinaron parámetros ambientales y se realizaron estudios fisicoquímicos, bacteriológicos, cultivos y tipificaciones morfológicas y moleculares. Independientemente de las variables ambientales y bacteriológicas, en el 54,54% de las muestras se confirmó la presencia de Acanthamoeba spp. por un método molecular. Se documenta por primera vez la presencia de estos protozoos en agua de mar en Argentina.
Free-living amoebae (FLA) of the genus Acanthamoeba are ubiquitous and amphizoic protozoa that colonize aquatic and terrestrial habitats and can serve as reservoirs for other microorganisms. They are considered econoses that can cause severe and rare pathologies. Due to limited epidemiological data available, the objective of this study was to investigate the presence of Acanthamoeba in coastal wetlands of the southeast of Buenos Aires province and evaluate their association with bacteriological and environmental variables. From February 2021 to July 2022, 22 seawater samples were collected at different points along the coast of the city of Mar del Plata (Buenos Aires, Argentina). Environmental parameters were determined and physicochemical and bacteriological studies, morphological identification, cultures and molecular typification were conducted. Regardless of the environmental and bacteriological variables, the presence of Acanthamoeba spp. was molecularly confirmed in 54.54% of the samples, being the first report of these protozoa in seawater in Argentina.
Las amebas de vida libre (AVL) son protozoos ubicuos y cosmopolitas, que se caracterizan por presentar, en su gran mayoría, dos estados evolutivos o biotipos: trofozoítos y quistes. Los trofozoítos son formas vegetativas que se alimentan y reproducen; los quistes son formas de latencia, infectantes y de resistencia15. Las AVL se encuentran ampliamente distribuidas en la naturaleza colonizando hábitats acuáticos y terrestres, tanto naturales como artificiales, así como otros ambientes no convencionales (estuches para lentes de contacto, equipos de aire acondicionado, unidades de diálisis y de tratamiento dental, piscinas de uso recreativo, bachas e incubadoras hospitalarias)9,12,14. Existen cuatro géneros de AVL de patogenicidad demostrada para el ser humano y los animales: Acanthamoeba, Balamuthia y Sappinia, pertenecientes al supergrupo Amoebozoa, y Naegleria, perteneciente a Excavata. De los cuatro géneros, Acanthamoeba es el más frecuentemente aislado4,10,15.
Las especies de Acanthamoeba provocan lesiones cutáneas e infecciones en los senos nasales, queratitis, encefalitis granulomatosa amebiana y, en ciertas ocasiones, neumonía. Afectan frecuentemente a individuos inmunodeprimidos o expuestos a factores de riesgo (usuarios de lentes de contacto, condiciones de vida higiénico-sanitarias deficientes, etc.). Estos organismos se comportan como patógenos oportunistas y, en general, las infecciones que producen se asocian al uso de agua de escasa calidad sanitaria2,5,15.
Por su carácter de depredador bacteriano en el ambiente, Acanthamoeba spp. desempeñan un rol importante en el control de las comunidades microbianas. El consumo de bacterias como parte de su proceso de alimentación impacta significativamente en la abundancia y la diversidad de las poblaciones microbianas de su entorno5. Sin embargo, como estrategia de supervivencia, ciertos microorganismos han desarrollado habilidades para evitar la digestión por parte de Acanthamoeba spp., estableciendo con ella relaciones endosimbióticas. Estas relaciones tienen implicancias tanto en la ecología microbiana como en la salud pública8. Las especies endosimbióticas pueden alterar la capacidad de las amebas para depredar a otros microorganismos, modificando así la estructura y la función de las comunidades en el ambiente.
Dado que Acanthamoeba spp. son protozoos ubicuos que se encuentran predominantemente en ambientes acuáticos compartiendo un mismo nicho ecológico con diferentes microorganismos, hace que las mismas puedan ser reservorio de agentes potencialmente patógenos y zoonóticos. Su presencia en humedales continentales y costeros usados para riego, consumo o recreación representa un potencial riesgo para la salud pública5,8,12. Este comportamiento los convierte en verdaderos «caballos de Troya»2.
Si bien en la literatura existen numerosos estudios que reportan aislamientos de Acanthamoeba spp. en humedales continentales, hay escasa información acerca de su presencia en agua de mar7,13. En Argentina se ha descrito la presencia de quistes y trofozoítos de Acanthamoeba spp. en ecosistemas dulceacuícolas superficiales y profundos, en aguas de piscinas de uso recreacional, en aguas de consumo animal y en salas cerradas de un hospital provincial4,9,10,14. Sin embargo, no existen a la fecha trabajos que reporten aislamientos en humedales costeros.
En este contexto, y dada la escasez de información epidemiológica acerca de la presencia de AVL en la región del sudeste bonaerense, el objetivo del presente trabajo fue buscar y tipificar AVL, con énfasis en Acanthamoeba spp., en agua de mar de diferentes áreas costeras de la ciudad de Mar del Plata, tratando de asociar la presencia de este protozoo a parámetros ambientales, fisicoquímicos y bacteriológicos.
El estudio se realizó con fuentes obtenidas por dos de los autores en sus respectivas instituciones (ver apartado de financiación), entre febrero de 2021 y julio de 2022 en la costa de la ciudad de Mar del Plata (provincia de Buenos Aires, Argentina) a lo largo de una transecta que involucró 5playas: E1, Playa Félix U. Camet; E2, Playa Sun Rider; E3, Playa Constitución; E4, Playa del Puerto, y E5, Playa Waikiki. Todas las playas muestreadas son de acceso público para los bañistas. E1 y E2 están próximas a la Estación Depuradora de Aguas Residuales (EDAR, Obras Sanitarias Sociedad de Estado), E3 y E4 están vinculadas a descargas de efluentes pluviales (de mayores dimensiones en E3) y E5 no recibe descarga directa significativa de ningún tipo. Para evaluar el posible impacto de la navegación en un área de acceso prohibido para bañistas, también se muestreó la zona de aparcamiento de embarcaciones del puerto de la ciudad (E6, área Marinas) (fig. 1).
Se recolectaron un total de 22 muestras de agua de mar, que se clasificaron según el sitio de muestreo y la estacionalidad (verano/invierno). Para investigar la presencia de AVL se recolectaron las muestras de forma subsuperficial en recipientes estériles de 300ml. Una vez en el laboratorio, cada muestra se dejó reposar por 24horas. Transcurrido este tiempo, se descartaron 260ml del sobrenadante y el volumen restante se concentró por centrifugación a 1.500rpm durante 10min, reservando el pellet en 2ml de solución de Page, para su posterior siembra14.
Para el cultivo, se prepararon placas de Petri con agar no nutritivo (Britania, Argentina) al 1,5%, sobre las que se colocaron por extensión en superficie 500μl de una suspensión de Escherichia coli ATCC 25922 en solución de Page. Luego se sembró una alícuota de 100μl de pellet de cada muestra. Estas siembras se hicieron por duplicado a fin de incubar en paralelo a dos temperaturas: 37°C (temperatura óptima para el desarrollo de Acanthamoeba spp.) y 42°C (para optimizar el aislamiento de especies termófilas). Para cada temperatura se utilizó como control una placa inoculada únicamente con E.coli en solución de Page. En todos los casos la incubación se realizó durante 30días, con visualizaciones periódicas a partir de las 48horas de incubación.
En las placas en las que se detectó crecimiento amebiano se procedió a la caracterización morfológica de quistes y trofozoítos. Se observó el material en fresco entre porta y cubreobjetos al microscopio óptico; se realizaron análisis morfológicos y se midieron con ocular micrométrico los diámetros de los trofozoítos y quistes. En el caso de los trofozoítos, se evaluaron el tamaño, la presencia de acantópodos y pseudópodos, las características del núcleo y la presencia de vacuola pulsátil. En el caso de los quistes, se evaluaron la forma y el tamaño. Los biotipos se identificaron y clasificaron morfológicamente empleando un microscopio Leica DM500 (Leica Microsystems GmbH, Wetzlar, Alemania); las fotografías se tomaron con una cámara Leica ICC50HD (Leica Microsystems GmbH, Wetzlar, Alemania) y para las mediciones se empleó el software Leica LASEZ (v.3.2.1).
Las muestras que presentaron aislamientos morfológicamente compatibles con AVL se reservaron para posteriores estudios moleculares de tipificación2,4. Estos aislamientos se repicaron en el medio líquido MYAS (extracto de maltosa 0,01% y extracto de levadura 0,01% en solución de Page) y se incubaron por 24-48horas a 37°C. Para concentrar los trofozoítos o quistes, se tomaron alícuotas (5ml) de cada cultivo; estas se centrifugaron 5veces a 3.000rpm por 15min y se sometieron a un pasaje a través de agujas 25G. Los pellets así obtenidos se emplearon para la extracción de ADN utilizando el kit comercial Quick-DNA™ MiniPrep (Zymo Research). La amplificación del ADN por PCR se basó en el protocolo de Booton et al.1. Se utilizó el par de primers JDP1/JDP2, específico para el género Acanthamoeba, y el par Nae1/Nae2, específico para el género Naegleria4,10. Las cepas aisladas fueron conservadas para realizar posteriormente secuenciación y genotipificación, a fin incorporarlas a la base de datos GenBank.
La temperatura ambiental y del agua de mar (en °C) en el momento de tomar las muestras se registró utilizando un termómetro de alcohol Biocare (Chile). Mediante la aplicación para celular AccuWeather, se registró el índice de luz ultravioleta y la velocidad y dirección del viento predominante. El pH de las muestras se determinó utilizando el kit medidor de pH digital con calibración +EC/Tds Temp Hidroponia comercializado por e-LABShop, Argentina (rango de medición de pH: 0,0 a 14,0; resolución: 0,1). El número total de bañistas en cada sitio muestreado se estimó mediante el recuento visual del número de personas presentes en la arena y en el mar de cada lugar.
En forma complementaria, en cada sitio y ocasión de muestreo se tomaron muestras de agua de mar para el análisis bacteriológico siguiendo procedimientos estandarizados11; esto incluyó el recuento de bacterias aerobias mesófilas (BAM), de coliformes totales (CT) y coliformes termotolerantes (CTt), de Escherichia coli y de Enterococcus faecalis (EF). Se realizaron test estadísticos para comparar los valores del recuento entre las distintas playas muestreadas y las tomas de invierno y verano utilizando el paquete estadísticoR, con la finalidad de rastrear diferencias relacionadas con el efecto antrópico o las estaciones climáticas.
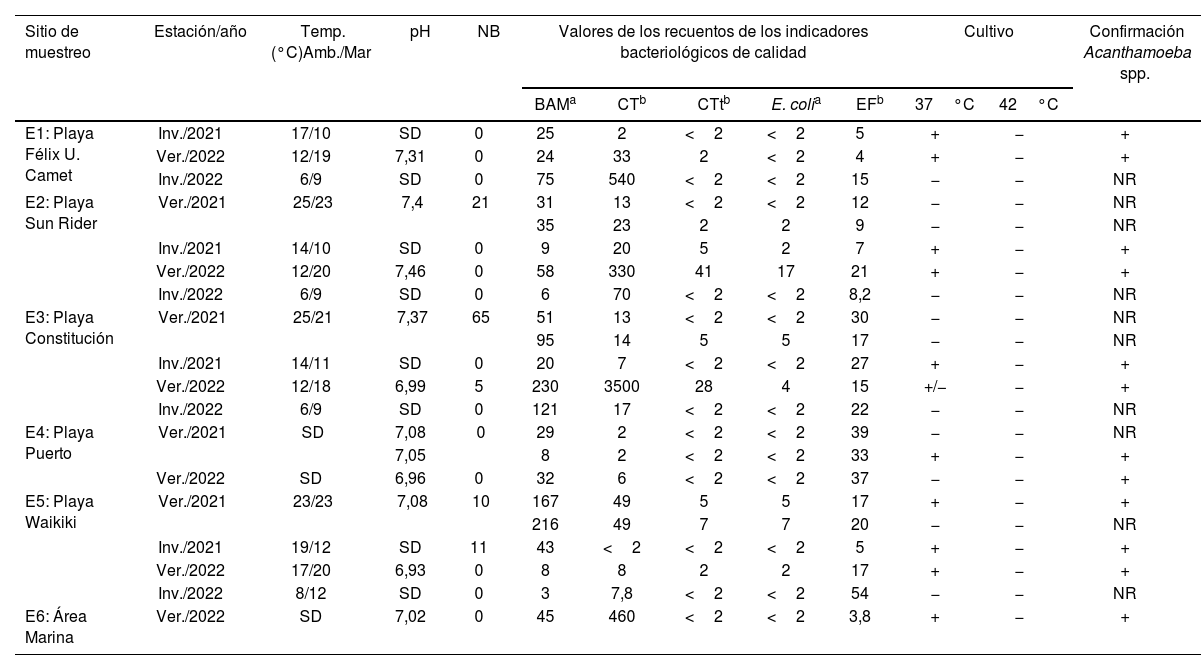
En la tabla 1 se observan los resultados de las determinaciones descritas, incluyendo el hallazgo de aislamientos morfológicamente compatibles con Acanthamoeba spp. a dos temperaturas distintas y su confirmación por PCR.
Resumen de los resultados obtenidos en cada sitio y ocasión de muestreo
| Sitio de muestreo | Estación/año | Temp. (°C)Amb./Mar | pH | NB | Valores de los recuentos de los indicadores bacteriológicos de calidad | Cultivo | Confirmación Acanthamoeba spp. | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| BAMa | CTb | CTtb | E. colia | EFb | 37°C | 42°C | ||||||
| E1: Playa Félix U. Camet | Inv./2021 | 17/10 | SD | 0 | 25 | 2 | <2 | <2 | 5 | + | − | + |
| Ver./2022 | 12/19 | 7,31 | 0 | 24 | 33 | 2 | <2 | 4 | + | − | + | |
| Inv./2022 | 6/9 | SD | 0 | 75 | 540 | <2 | <2 | 15 | − | − | NR | |
| E2: Playa Sun Rider | Ver./2021 | 25/23 | 7,4 | 21 | 31 | 13 | <2 | <2 | 12 | − | − | NR |
| 35 | 23 | 2 | 2 | 9 | − | − | NR | |||||
| Inv./2021 | 14/10 | SD | 0 | 9 | 20 | 5 | 2 | 7 | + | − | + | |
| Ver./2022 | 12/20 | 7,46 | 0 | 58 | 330 | 41 | 17 | 21 | + | − | + | |
| Inv./2022 | 6/9 | SD | 0 | 6 | 70 | <2 | <2 | 8,2 | − | − | NR | |
| E3: Playa Constitución | Ver./2021 | 25/21 | 7,37 | 65 | 51 | 13 | <2 | <2 | 30 | − | − | NR |
| 95 | 14 | 5 | 5 | 17 | − | − | NR | |||||
| Inv./2021 | 14/11 | SD | 0 | 20 | 7 | <2 | <2 | 27 | + | − | + | |
| Ver./2022 | 12/18 | 6,99 | 5 | 230 | 3500 | 28 | 4 | 15 | +/− | − | + | |
| Inv./2022 | 6/9 | SD | 0 | 121 | 17 | <2 | <2 | 22 | − | − | NR | |
| E4: Playa Puerto | Ver./2021 | SD | 7,08 | 0 | 29 | 2 | <2 | <2 | 39 | − | − | NR |
| 7,05 | 8 | 2 | <2 | <2 | 33 | + | − | + | ||||
| Ver./2022 | SD | 6,96 | 0 | 32 | 6 | <2 | <2 | 37 | − | − | + | |
| E5: Playa Waikiki | Ver./2021 | 23/23 | 7,08 | 10 | 167 | 49 | 5 | 5 | 17 | + | − | + |
| 216 | 49 | 7 | 7 | 20 | − | − | NR | |||||
| Inv./2021 | 19/12 | SD | 11 | 43 | <2 | <2 | <2 | 5 | + | − | + | |
| Ver./2022 | 17/20 | 6,93 | 0 | 8 | 8 | 2 | 2 | 17 | + | − | + | |
| Inv./2022 | 8/12 | SD | 0 | 3 | 7,8 | <2 | <2 | 54 | − | − | NR | |
| E6: Área Marina | Ver./2022 | SD | 7,02 | 0 | 45 | 460 | <2 | <2 | 3,8 | + | − | + |
Amb.: temperatura ambiental; NB: número de bañistas; BAM: bacterias aerobias mesófilas; CT: coliformes totales; CTt: coliformes termotolerantes; EF: Enterococcus faecalis; SD: sin datos; + y −: aislamiento morfológicamente compatible con Acanthamoeba spp. positivo o negativo, respectivamente; NR: no realizada.
El 54,54% (12/22) de las muestras de agua de mar fueron positivas para AVL, con aislamientos morfológicamente compatibles con Acanthamoeba spp. (fig. 2). Todas las muestras incubadas a 42°C resultaron negativas, lo que descartó la presencia de Naegleria spp. en los cultivos.
Los aislamientos morfológicamente compatibles con Acanthamoeba spp. fueron confirmados mediante PCR, con un 100% de tipificación positiva para este género de AVL (tabla 1). En forma complementaria y con el objetivo de corroborar la eficacia de la incubación a 42°C para el aislamiento de AVL termófilas, los cultivos positivos obtenidos a 37°C fueron sometidos a análisis moleculares de cribado para Naegleria spp., donde en todos los casos los resultados fueron negativos.
Respecto de los parámetros fisicoquímicos, la temperatura del mar varió entre 9 y 23°C y el pH entre 6,93 y 7,4. En relación con los indicadores bacterianos evaluados, no se observaron diferencias significativas entre las diferentes playas (BAM: F=1,11; p=0,39; CT: F=0,53; p=0,74; CTt: F=0,48; p=0,78, y E.coli: F=0,54; p=0,74), con excepción del recuento de E.faecalis (F=3,47: p=0,025), que arrojó valores significativamente superiores en E4. Tampoco se observaron diferencias estadísticamente relevantes entre los indicadores bacterianos durante el invierno y el verano (BAM: t=−1,57; p=0,08; CT: t=−0,9; p=0,2; CTt: t=−1,66; p=0,07; E.coli: t=−1,49: p=0,09 y E. faecalis: t=−0,54; p=0,3). No se logró relacionar la presencia de Acanthamoeba spp. con cambios en la estacionalidad climática (verano/invierno), ni con la temperatura ambiental o del agua, el pH, el número de bañistas o los recuentos bacterianos evaluados.
Las temperaturas registradas, tanto ambientales como del agua de mar, abarcaron un amplio espectro durante el período de muestreo (20,5°C de temperatura media) debido a que la zona presenta una gran variabilidad térmica entre las estaciones de invierno y verano. Asimismo, se observó una tendencia hacia la alcalinidad del agua de mar en las playas muestreadas (con valores de pH de entre 7 y 9). Estos datos coinciden con lo informado en otros reportes y estarían asociados a una mayor supervivencia microbiana tanto de bacterias como de AVL12.
En relación con la calidad del agua, las playas seleccionadas para este estudio difieren en el disturbio antrópico al cual están sometidas, incluyendo la cercanía a la Estación Depuradora de Aguas Residuales (E1 y E2), la presencia de pluviales (E3 y E4) y de bañistas (sobre todo en E3) y el aparcamiento de embarcaciones (E6). Solo E5 posee una situación ambiental más controlada, sin disturbios antrópicos evidentes. A pesar de esto, los recuentos de los indicadores bacterianos analizados no muestran diferencias significativas entre playas ni entre estaciones climáticas, en contraposición con lo reportado por Esquius et al.3 para los mismos sitios. Cabe aclarar que ese estudio fue realizado antes de la pandemia del SARS-CoV-2 y que las diferencias en los resultados bacteriológicos de dicha investigación, comparados con los de esta, podrían relacionarse con el confinamiento social y los cambios de hábitos de la población.
Esta investigación pone en evidencia que la presencia del ser humano en el ambiente (áreas con bañistas versus áreas sin bañistas) no predispone a la presencia de AVL, ya que se obtuvieron aislamientos positivos de Acanthamoeba spp. en todas las playas muestreadas.
Si bien la cantidad de muestras analizadas en este trabajo fue baja (n=22), el porcentaje de muestras positivas para Acanthamoeba spp. en las playas de la costa marplatense (54,54%, 12/22 muestras totales) fue mayor que el reportado por Lorenzo-Morales et al.6,7, tanto si se compara con las costas de Tenerife (40% de muestras positivas) como con las de Jamaica (49,6% de muestras positivas).
Este estudio constituye el primer registro de aislamientos de Acanthamoeba spp. en agua de mar del sudeste bonaerense argentino y contribuye de manera significativa al conocimiento acerca de la presencia y la distribución de este parásito en la región.
Los resultados obtenidos ponen de manifiesto la preocupante versatilidad y adaptabilidad de Acanthamoeba spp. para sobrevivir en distintos ambientes y condiciones. Asimismo, su presencia resulta de interés para investigar posibles reservorios de microorganismos patógenos para el ser humano en cuerpos de agua de la región («caballo de Troya»)2.
Acanthamoeba spp. representa un riesgo potencial para la salud pública no solo por la patogenicidad y el oportunismo, sino por su capacidad de establecer relaciones endosimbióticas. La profundización en el tema proporcionará una herramienta fundamental para la vigilancia epidemiológica y el control sanitario del área de influencia de este trabajo.
FinanciaciónEste trabajo forma parte de la tesis doctoral de Loriana Tomassini y fue financiado con los fondos recibidos por la SECyT-UNS para el Proyecto de Grupo de Investigación PGI 24/B273 «Zoonosis y Econosis en el Sudoeste Bonaerense» bajo la dirección de la Dra. V. R. Randazzo, por el subsidio otorgado por la Universidad Nacional de Mar del Plata (a través del EXA N.° 1073/22) a la Dra. K. S. Esquius y el proyecto PUE 2016 «Ecosistemas costeros: estructura, funcionamiento, dinámica y estrategias de manejo», cuyo director es el Dr. Isacch (IIMyC, FCEyN, CONICET).
Conflicto de interesesLos autores no acreditan conflicto de intereses.
A la Dra. Alicia H. Escalante por una lectura criteriosa y sus valiosos comentarios y sugerencias.